Похожие презентации:
Соли, их классификация и свойства
1. Презентация по химии «СОЛИ»
Презентация по химии«
СОЛИ»
2. Соли – сложные вещества, состоящие из атомов металла, соединённых c кислотным остатком.
Общая формула класса:MenAm
3.
СолиCaCO3(мел)
CuSO4
KMnO4
FeCl3
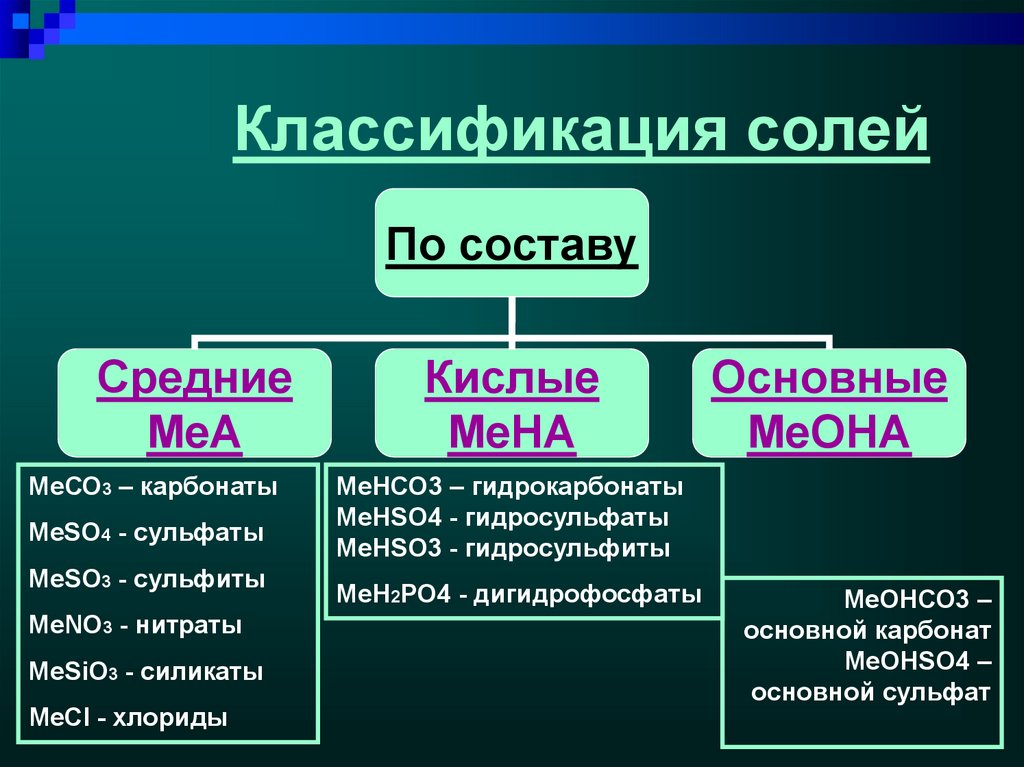
4. Классификация солей
По составуСредние
МеA
МеСО3 – карбонаты
МеSO4 - сульфаты
MeSO3 - сульфиты
MeNO3 - нитраты
MeSiO3 - силикаты
MeCl - хлориды
Кислые
MeHA
Основные
МеОНА
МеНСО3 – гидрокарбонаты
МеНSO4 - гидросульфаты
MeНSO3 - гидросульфиты
МеН2РО4 - дигидрофосфаты
МеОНСО3 –
основной карбонат
МеОНSO4 –
основной сульфат
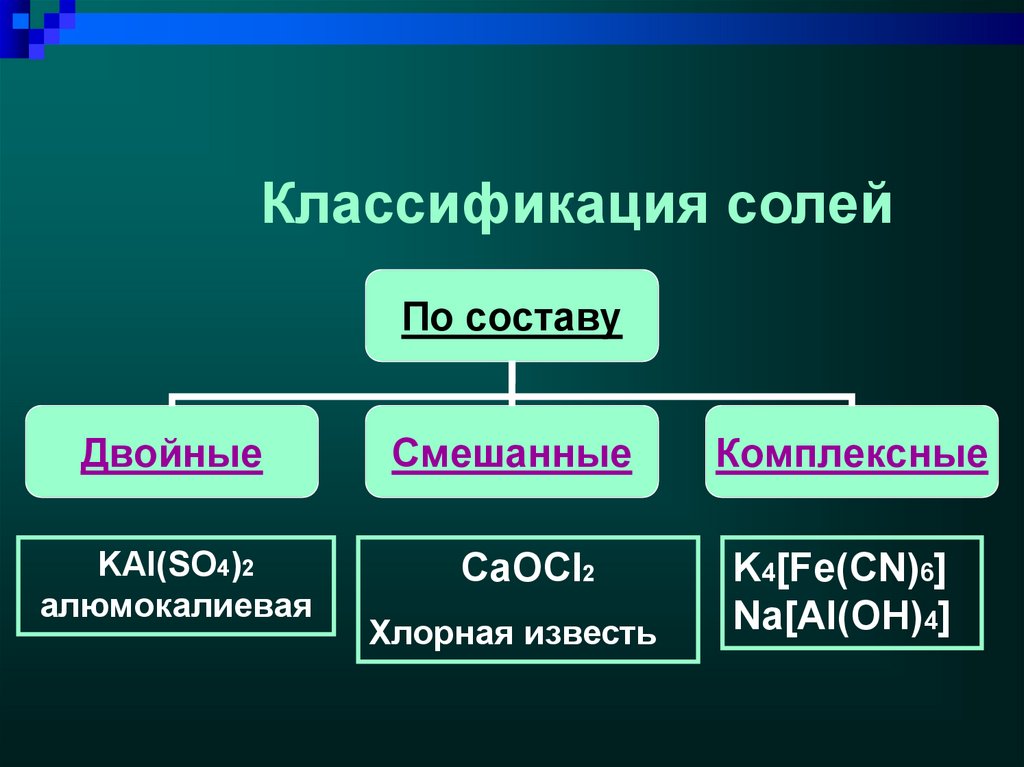
5. Классификация солей
По составуДвойные
KAl(SO4)2
алюмокалиевая
Смешанные
CaOCl2
Хлорная известь
Комплексные
K4[Fe(CN)6]
Na[Al(OH)4]
6. Выбрать формулы солей:
KNO3NaHCO3 P2O5 PbCl2 ZnOHCl
Mg(OH)2 H3PO4 Na2SO4 CaH2PO4 CO2
7. Назвать:
NaCl BaI2 FeSO4 AlPO4Ca(NO3)2 CuCO3 Cr2S3
CuHCO3
CuOHCO3
8. Составить формулы солей:
а) силикат натрияб) фторид алюминия
в) сульфат меди(II)
г) нитрит железа (III)
д) хлорид магния
9. Получение солей
1. Реакциянейтрализации:
Ca(OH)2 + H2SO3 =
= CaSO3 + 2H2O
сульфит кальция
10. Получение солей
2. Взаимодействиеметаллов с
неметаллами:
2Al + 3S = Al2S3
сульфид алюминия
11. Получение солей
3. Взаимодействиеметаллов с
кислотами:
Zn + 2HCl = ZnCl2 + H2
хлорид цинка
12. Получение солей
4. Взаимодействие основных оксидов скислотными оксидами.
CaO + SiO2 = CaSiO3
силикат кальция
5. Взаимодействие оснований с кислотными
оксидами.
Ca(OH)2 + CO2 = CaCO3 + H2O
карбонат кальция
13. Физические свойства солей
Соли, за небольшимисключением, являются
твёрдыми кристаллическими веществами
различного цвета. По
растворимости в воде
их делят на:
растворимые
малорастворимые
нерастворимые
14. Химические свойства солей
1)2)
Соли взаимодействуют:
C простыми веществами –
металлами и неметаллами.
со сложными – кислотами,
основаниями и солями.
15. Химические свойства солей
1. С металлами:CuSO4 + Fe = FeSO4 + Cu
сульфат меди (II) сульфат
железа (II)
2. С неметаллами:
2KI + Br2 = 2KBr + I2
иодид калия
бромид калия
16. Химические свойства солей
3. С кислотами:2NaCl + H2SO4 =
хлорид натрия
= Na2SO4 + 2HCl
сульфат натрия
17. Химические свойства солей
4. С щелочами:FeCl2 + 2NaOH =
хлорид железа (II)
=Fe(OH)2 + 2NaCl
хлорид натрия
18. Химические свойства солей
5. С солями:AgNO3 + KCl =
нитрат серебра
=AgCl + KNO3
хлорид серебра
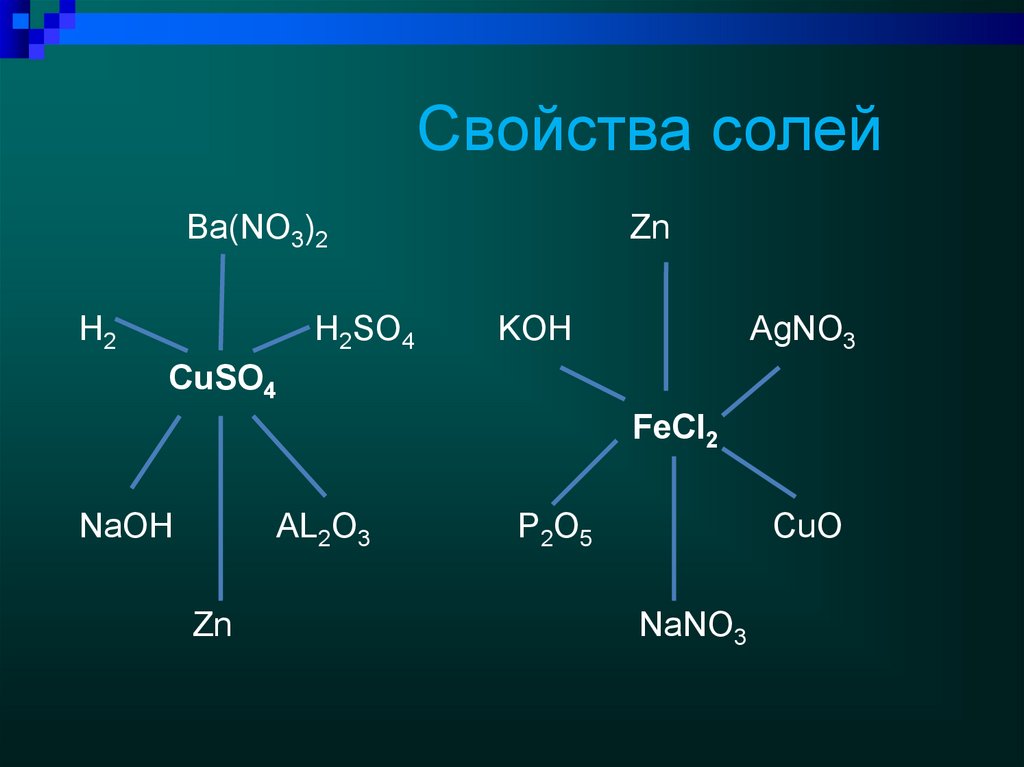
19. Свойства солей
Ba(NO3)2H2
H2SO4
Zn
KOH
AgNO3
CuSO4
FeCl2
NaOH
AL2O3
Zn
P2O5
CuO
NaNO3
20. Применение солей
Многие солиприменяют в быту
(поваренная соль,
сода), в качестве
минеральных
удобрений, при
производстве
стекла, моющих
средств,
взрывчатых
веществ.




















 Химия
Химия








