Похожие презентации:
Контроль качества лекарственных средств
1.
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХСРЕДСТВ
Фармацевтическая химия как наука. Современные проблемы и
перспективы развития фармацевтического анализа.
2.
ВВЕДЕНИЕДля провизора , фармацевта необходимы знания с помощью
которых можно контролировать качество лекарственных
веществ (форм) , определять их подлинность , условия
хранения ,сведения о способах получения новых лекарств
из природных ресурсов. Краткий курс лекций по данной
дисциплине раскрывает основные способы получения ,
строения , физико-химические свойства и классификацию
лекарственных веществ , методы контроля качества
лекарств неорганической и органической природы
,биологически активных веществ и изменения ,
происходящие в них при хранении , а также основные
документы , регламентирующие фармацевтическую
продукцию
3.
ПРЕДМЕТ И СОДЕРЖАНИЕФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
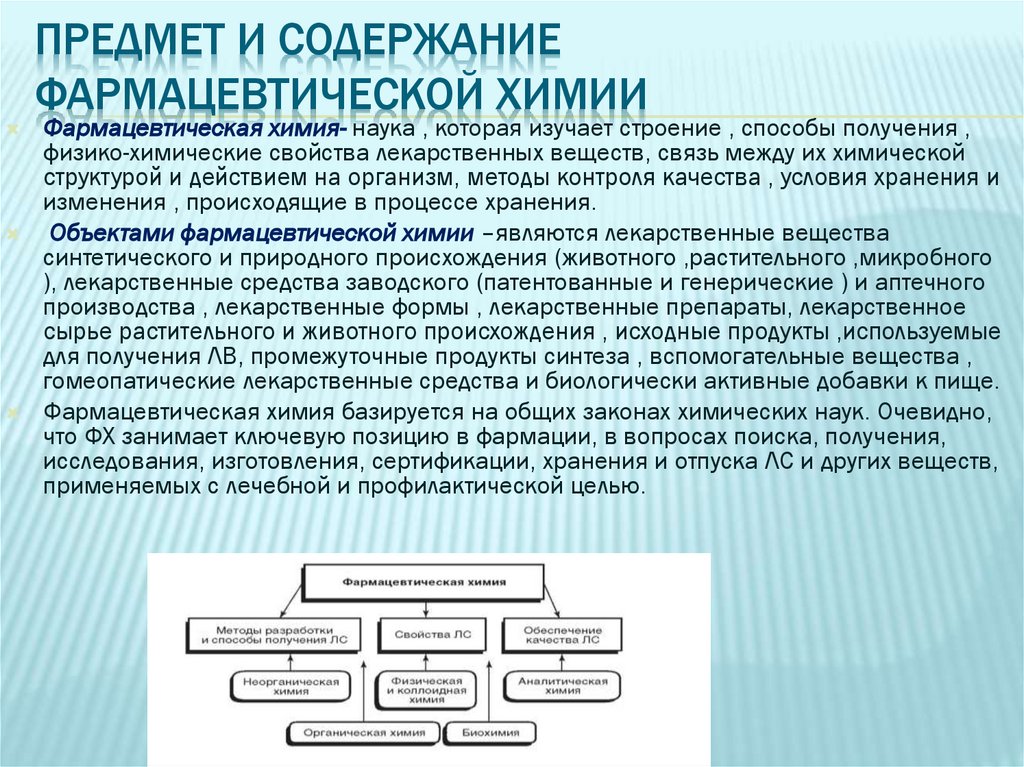
Фармацевтическая химия- наука , которая изучает строение , способы получения ,
физико-химические свойства лекарственных веществ, связь между их химической
структурой и действием на организм, методы контроля качества , условия хранения и
изменения , происходящие в процессе хранения.
Объектами фармацевтической химии –являются лекарственные вещества
синтетического и природного происхождения (животного ,растительного ,микробного
), лекарственные средства заводского (патентованные и генерические ) и аптечного
производства , лекарственные формы , лекарственные препараты, лекарственное
сырье растительного и животного происхождения , исходные продукты ,используемые
для получения ЛВ, промежуточные продукты синтеза , вспомогательные вещества ,
гомеопатические лекарственные средства и биологически активные добавки к пище.
Фармацевтическая химия базируется на общих законах химических наук. Очевидно,
что ФХ занимает ключевую позицию в фармации, в вопросах поиска, получения,
исследования, изготовления, сертификации, хранения и отпуска ЛС и других веществ,
применяемых с лечебной и профилактической целью.
4.
К лекарственным веществам (субстанциям) относятся веществарастительного ,животного и синтетического происхождения , обладающие
биологической активностью и предназначенные для производства и
изготовления лекарственных средств.
Фармацевтическая химия занимает центральное место среди других
специальных фармацевтических дисциплин – фармакологии
,фармацевтической технологии , фармакогнозии , управления и экономики
фармации ,токсикологической химии и является связующим звеном между
ними.
Так , фармакогнозия - наука ,исследующая лекарственное растительное
сырье и возможности создания из него новых лекарственных веществ .
Тесно взаимосвязана фармацевтическая химия с фармацевтической
технологией , изучающей методы приготовления лекарственных средств ,
которые являются объектами для разработки способов фармацевтического
анализа . Токсикологическая химия базируется на применении тех же
методов исследования , что и фармацевтическая химия. В изучении проблем
хранения лекарственных средств , а также организации
контрольноаналитической службы тесно связаны с фармацевтической
химией организация и экономика фармации . В области исследования
взаимосвязи между структурой молекул лекарственных веществ и их
действием на организм фармацевтическая химия близко примыкает к
фармакологии.
5.
Вместе с тем фармацевтическая химия занимает промежуточноеположение между комплексом медико-биологических и
химических наук. Являясь прикладной наукой ,
фармацевтическая химия базируется на теории и законах таких
наук , как неорганическая , органическая , аналитическая ,
физическая и коллоидная химия. Поскольку действие
лекарственных веществ на организм зависит как от химической
структуры , так и от физико-химических свойств ,
фармацевтическая химия использует законы физической химии.
При разработке способов контроля качества лекарственных
веществ и лекарственных форм в фармацевтической химии
применяются методы аналитической химии .
Однако фармацевтический анализ имеет свои специфические
особенности и включает три обязательных этапа : установление
подлинности , контроль чистоты (определение допустимых
приделов примесей) и количественное определение
лекарственных веществ. Фармацевтическая химия связана с
другими естественнонаучными и медикобиологическими
дисциплинами. Фармацевтические исследования не возможны
без анализа растительного и других видов природного сырья..
Организация фармации использует информацию
фармацевтической химии для совершенствования системы
стандартизации и контроля качества ЛС.
6.
СОВРЕМЕННЫЕ ПРОБЛЕМЫФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
Основными проблемами фармацевтической химии являются:
- создание и исследование новых лекарственных средств;
- разработка способов фармацевтического и биофармацевтического
анализа.
Создание и исследование новых ЛС. Несмотря на огромный арсенал
имеющихся ЛС, проблема изыскания новых высокоэффективных ЛВ
остается актуальной.
Роль ЛС непрерывно растет в современной медицине. Это вызвано
целым рядом причин, главными из которых являются:
- ряд тяжелых заболеваний еще не излечивается ЛС;
- длительное применение ряда ЛС формирует толерантные патологии, для
борьбы с которыми необходимы новые ЛС с иным механизмом
действия;
- процессы эволюции микроорганизмов приводят к возникновению
новых заболеваний, для лечения которых нужны эффективные ЛС;
некоторые из применяемых ЛВ вызывают побочные эффекты, в связи с
чем необходимо создавать более безопасные ЛС.
7.
Будущее фармацевтической химии связано с запросами медицины и дальнейшим прогрессомисследований во всех указанных направлениях. Это создаст предпосылки для открытия новых
направлений фармакотерапии, получения более физиологичных, безвредных ЛС как с помощью
химического или микробиологического синтеза, так и путем выделения БАВ из растительного или
животного сырья. Приоритетны разработки в области получения инсулина, гормонов роста,
препаратов для лечения СПИДа, алкоголизма, получения моноклональных тел. Активные
исследования ведутся в области создания новых сердечно-сосудистых, противовоспалительных,
диуретических, нейролептических, антиаллергических средств, им- муномодуляторов, а также
полусинтетических антибиотиков, цефалоспоринов и гибридных антибиотиков. Наиболее
перспективно создание ЛВ на основе исследования природных пептидов, полимеров, полисахаридов,
гормонов, ферментов и других БАВ. Чрезвычайно важны выявление новых фармакофоров и
целенаправленный синтез поколений ЛВ на основе еще не исследованных ароматических и
гетероциклических соединений, родственных биологическим системам организма.
В последние годы изменился подход к процессу создания и исследования синтетических ЛВ. От чисто
эмпирического метода «проб и ошибок» исследователи все больше переходят к использованию
математических методов планирования обработки результатов экспериментов, применению
современных физико-химических методов. Такой подход открывает широкие возможности
прогнозирования вероятных видов биологической активности синтезированных веществ,
составления сроков создания новых ЛС. В перспективе все большее значение будет приобретать
создание и накопление лунных для ЭВМ, а также использование ЭВМ для установления зависимости
между химическим строением и фармацевтическим действием синтезируемых веществ. В конечном
счете эти работы должны привести к созданию общей теории направленного конструирования
эффективных ЛВ, родственных системам организма человека.
8.
Немаловажное значение имеют также изучение новых источников полученияЛВ, широкое использование для их производства отходов химической,
пищевой, деревообрабатывающей и других отраслей промышленности. Это
направление имеет непосредственную связь с экономикой химикофармацевтической промышленности и будет способствовать снижению
стоимости ЛС. Особенно перспективно использование для создания ЛВ
современных методов биотехнологии и генной инженерии, которые находят
все более широкое применение в химико-фармацевтической
промышленности.
За последние годы существенно изменилась структура заболеваний и
эпидемиологическая обстановка, в высокоразвитых странах увеличилась
средняя продолжительность жизни населения, повысился уровень
заболеваемости среди людей пожилого возраста. Указанные факторы
определили новые направления поиска ЛС. Возникла необходимость
расширения номенклатуры ЛП для лечения различных видов
психоневрологических заболеваний (паркинсонизм, депрессия, расстройство
сна), сердечно-сосудистых (атеросклероз, артериальная гипертензия, ИБС,
нарушения сердечного ритма), болезней опорно-двигательного аппарата
(артриты, заболевания позвоночника), заболеваний легких (бронхиты,
бронхиальная астма). Эффективные ЛС для лечения указанных болезней
могут существенно повлиять на качество жизни и значительно продлить
активный период жизни людей, в т.ч. пожилого возраста. Причем основным
подходом в этом направлении является поиск мягкодействующих ЛС, не
вызывающих резких изменений основных функций организма, проявляющих
лечебный эффект за счет влияния на метаболические звенья патогенеза
болезни.
9.
ОСНОВНЫМИ НАПРАВЛЕНИЯМИ ПОИСКАНОВЫХ И МОДЕРНИЗАЦИИ ИМЕЮЩИХСЯ
ЖИЗНЕННО НЕОБХОДИМЫХ ЛС ЯВЛЯЮТСЯ:
- синтез биорегуляторов и метаболитов энергетического и
пластического обмена;
- выявление потенциальных Л В в ходе скрининга новых продуктов
химического синтеза;
- синтез соединений с программируемыми свойствами
(модифицирование структуры в известных рядах ЛВ, ресинтез
природных фитосубстанций, компьютерный поиск БАВ);
- стереоселективный синтез эутомеров и наиболее активных
конформаций социально значимых ЛВ.
Таким образом, основу методологии фармацевтической химии
составляет комплекс физических, химических, физико-химических,
биологических и биофармацевтических методов. Они
используются при решении современных проблем
фармацевтической химии.
10.
ОСНОВНЫЕ ПОЛОЖЕНИЯ И ДОКУМЕНТЫ , РЕГЛАМЕНТИРУЮЩИЕФАРМАЦЕВТИЧЕСКИЙ АНАЛИЗ.
11.
ГОСУДАРСТВЕННАЯ ФАРМАКОПЕЯТермин «фармакопея» происходит от двух греческих слов «
фармакон- pharmacon»- (лекарство) и «пейо -poeio» (делаю) т. е. в
буквальном смысле оно может быть расшифровано как –
(руководство по приготовлению лекарств ). Государственная
Фармакопея - это свод, сборник обязательных
общегосударственных стандартов и положений , нормирующих
качество наиболее важных лекарственных средств и
лекарственных форм Применяемых современной медициной .
СТАНДАРТ –слово английского происхождения и означает
«образец» , «норма» . Стандартизация ЛС –разработка и
применение унифицированных требований и методов
исследования лекарственных форм – стандартов . Стандарт
качества ЛС –это нормативный документ содержащий перечень
нормируемых показателей и методов контроля качества ЛС
утвержденный МЗ РФ.
12.
СТАНДАРТЫ КАЧЕСТВА ЛС ПОДРАЗДЕЛЯЮТ НАДВЕ КАТЕГОРИИ :
Стандарты качества ЛС подразделяют на две категории :
1. Государственные стандарты качества ЛС
–общая фармакопейная статья ОФС ,ФС
2. Фармакопейная статья предприятия (ФСП) На всех этапах
создания и использования ЛС контроль его качества осуществляют
отдел технического контроля предприятия –изготовителя ОТК ,
заводские лаборатории, контрольно-аналитические лаборатории ,
центры контроля качества , в АПТЕКЕ – провизоры—аналитики.
Государственная Фармакопея – XIVиздания введена Приказом
МЗРФ №749 от31 октября 2018 года в четырех ГФ состоит из
общих фармакопейных статей ОФС и фармакопейных статей ФС .
13.
Общая фармакопейная статья –это Государственный стандарт ЛС , содержащий основныетребования к лекарственной форме и описание стандартных методов контроля качества ЛС –
включает перечень нормируемых показателей или методов испытания для конкретной
лекарственной формы , описание физических , физико-химических , микробиологических
методов анализа ЛС , требование к используемым реактивам , титрованным растворам ,
индикаторам.
Фармакопейная статья – это Государственный стандарт качества под международным
непатентованным названием (МНН) , которое дает Всемирная организация здравоохранения
(ВОЗ) Для однокомпонентных ЛС , содержащий обязательный перечень показателей и методов
контроля качества ( с учетом его лекарственной формы), соответствующих требованиям ведущих
зарубежных фармакопей. Общие фармакопейные статьи и фармакопейные статьи должны
пересматриваться Научным центром экспертизы и Государственного контроля ЛС МЗ РФ не реже
чем через 5 лет.
Фармакопейная статья предприятия – это стандарт качества лекарственного средства под
торговым названием , содержащий перечень показателей и методов контроля качества ЛС
производства конкретного предприятия , учитывающий конкретную технологию данного
предприятия и прошедший экспертизу и регистрацию в установленном порядке.
Фармакопея имеет законодательный характер и ее предписания совершенно обязательны для
всех учреждений и предприятий всех ведомств , изготавливающих , хранящих , контролирующих
и применяющих лекарственные средства . Иначе говоря фармакопея является единой , отсюда и
название Государственная фармакопея. Работа по пересмотру фармакопеи и уточнению ее
стандартов проводится ФАРМАКОПЕЙНЫМ КОМИТЕТОМ МЗ РФ. На сегодняшний день мы
пользуемся ГФ -10 ,ГФ-11 , ГФ-12 , ГФ-13, ГФ-14
14.
ГОСУДАРСТВЕННЫЙ КОНТРОЛЬ КАЧЕСТВА ПРИОБРАЩЕНИИ ЛС.
Статья №9 ( ФЗ №61)
1.Государственному контролю подлежат все лекарственные
средства , произведенные на территории РФ и ввозимые на
территорию РФ.
2.Государственный контроль при обращении ЛС осуществляется
уполномоченными федеральными органами исполнительной
власти и органами исполнительной власти субъектов РФ в
соответствии с их полномочиями.
3.Государственный контроль при обращении лекарственных
средств включает в себя контроль за доклиническими
исследованиями ЛС , клиническими исследованиями ЛП ,
качеством ,производством ЛС , изготовлением ЛП, хранением
,перевозкой, ввозом на территорию РФ , рекламой , отпуском
,реализацией ,уничтожением ЛС ,применением ЛП.
15.
Государственный контроль качества .После регистрации ЛС проходит государственный
контроль качества. Контроль качества ЛСустановление соответствия качества ЛС
утвержденным нормативным документам.
Государственная система контроля качества ЛС
устанавливает нормы качества лекарственных и
вспомогательных веществ используемых в
производстве лекарственных препаратов , которые
включаются в нормативно-техническую документацию
– фармакопейная статья , фармакопейная статья
предприятия ,ГФ ,ГОСТы.
Государственный контроль качества ЛС может
осуществляться в форме предварительного а также в
виде последующего выборочного и арбитражного
контроля. П Сертификация . Декларирование.
16.
НТД по контролю : ГФ , ФЗ-61 ОТ 12.04.2010 года,приказ МЗ РФ № 751н от 25.10.2015 года , ГОСТ
«Правила организации производства и контроля
качества лекарственных средств, GMP»
Постановление Главного государственного врача РФ
от 24.12.2020 года № 44 «Об утверждении
санитарных правил СП2.1.3678-20
«Санитарноэпидемиологические требования к
эксплуатации помещений , зданий, сооружений,
оборудования и транспорта , а также условиям
деятельности хозяйствующих субъектов,
осуществляющих продажу товаров , выполнение работ
или оказания услуг» Пятый раздел данного
постановления посвящен аптечным организациям и
называется «Санитарно-эпидемиологические
требования при предоставлении услуг аптечными
организациями» ( вместо приказа №309)
17.
ГОСУДАРСТВЕННЫЕ СТАНДАРТЫ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ.ПРОБЛЕМЫ ФАЛЬСИФИКАЦИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ.
Кроме фармакопейных стандартов существуют и другие
государственные стандарты качества :
К основным задачам стандартизации ГОСТ относит : установление
требований к качеству готовой продукции на основе комплексной
стандартизации качественных характеристик данной продукции , а
также сырья , материалов , полуфабрикатов и комплектующих
изделий , необходимых для ее изготовления с высокими
показателями качества и эффективной эксплуатации ;
определение единой системы показателей качества продукции ,
иетодов и средств ее испытания и контроля , а также
необходимого уровня надежности и долговечности в зависимости
от назначения изделий и условий их эксплуатации.
18.
Стандарты подразделяются на ГОСТы - Государственные стандарты (утверждаются комитетом стандартов ) .
ОСТЫ- отраслевые стандарты. Подавляющее большинство лекарственных
средств промышленного производства являются отраслевой продукцией
,выпускаемой и применяемой для медицинских целей. Поэтому вся
нормативно-техническая документация НТД на лекарственные препараты
является отраслевой .
Технические условия –ТУ
В отношении многих препаратов , сырьевых объектов и прописей
лекарственных форм , не включенных в ГФ ,Фармакопейным Комитетом
была принята другая форма нормирования их качества - форма
технических условий, ТУ составляются по той же схеме , что и
фармакопейные статьи , их разработке предшествуют такие же
исследования , как и на фармакопейные объекты.
Станормативный документ, содержащий перечень нормируемых
показателей и методов контроля качества лекарственных средств,
утверждаемый Минздравом России. Стандартные образцы (СО),
применяемые для контроля качества лекарственных средств, - это
вещества, с которыми проводят сравнение испытуемых лекарственных
средств при проведении их анализа с использованием физико-химических
и биологических методовндарт качества лекарственного средства---
19.
НОРМАТИВНАЯ ДОКУМЕНТАЦИЯ, РЕГЛАМЕНТИРУЮЩАЯ ПРОИЗВОДСТВОИ КАЧЕСТВО ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Стандарты организаций
Национальный орган по стандартизации
Национальные стандарты и общероссийские классификаторы техникоэкономической и социальной информации,
в том числе правила их разработки и применения, представляют собой национальную систему стандартизации.
Национальные стандарты утверждаются национальным органом по стандартизации.
Национальный орган по стандартизации утверждает и опубликовывает перечень национальных стандартов,
которые могут применяться для соблюдения технических регламентов.
Таким образом, Федеральный закон “О техническом регулировании” в главе 3 (статьи 12, 13, 14, 15 и 16)
обосновывает создание национальных стандартов и их связь со специальным техническим регламентом.
Стандарт – нормативный документ, в котором установлены для общего и многократного использования правила,
требования, общие принципы или характеристики, касающиеся разных видов деятельности или их результатов для
достижения оптимальной степени упорядочения в определенной области.
Государственный и отраслевой стандарты (ГОСТ, ОСТ)устанавливаются на дополнительные технические
требования и групповые характеристики, необходимые для изготовления и поставки лекарственных препаратов
(технические термины и обозначения, общетехническая документация, технологические нормы и т.д.).
Некоторые виды сырья, вспомогательные вещества, тара и упаковка нормируются техническими условиями (ТУ)
или временными техническими условиями (ВТУ). Подобно статьям в фармакопее, ТУ и ВТУ носят характер
государственного стандарта.
Технические условия – нормативный документ, устанавливающий требования к конкретной продукции, услугам и
регулирующий отношения между поставщиком и потребителем продукции.
20.
Стандарты организаций и рекомендательные документы федеральныхорганов исполнительной власти - III уровень.
В соответствии со статьей 17 Федерального закона “О техническом
регулировании” проект стандарта организации может представляться
разработчиком в технический комитет по стандартизации, который
организует проведение экспертизы данного проекта.
На основании результатов экспертизы данного проекта Технический
комитет по стандартизации готовит заключение, которое направляется
разработчику стандарта.
Порядок разработки, утверждения, учета, изменения и отмены
стандартов организаций устанавливается ими самостоятельно с учетом
положений статьи 12 упомянутого Закона.
Промышленное производство лекарств регламентируется
соответствующей нормативно-технической документацией (НТД),
утвержденной в установленном порядке.
НТД должна обеспечивать повышение качества и эффективности
лекарственных препаратов, постоянно совершенствоваться на основе
достижений науки и техники и своевременно пересматриваться с целью
замены устаревших показателей в соответствии с потребностями
здравоохранения населения.
21.
Нормативная документация – это документы, устанавливающие правила, общиепринципы или характеристики, касающиеся разных видов деятельности или их
результатов.
НТД на лекарственные препараты, лекарственное растительное сырье и изделия
медицинской техники подразделяются на следующие категории:
1. Технологические регламенты.
2. Государственная фармакопея (ГФ).
3. Фармакопейные статьи (ФС).
4. Временные фармакопейные статьи (ВФС).
5. Государственные стандарты (ГОСТ).
6. Отраслевые стандарты (ОСТ).
7. Технические условия (ТУ).
8. Руководящий нормативный документ (РД) – инструкции, методические
указания и т. д.
9. Производственные и технологические инструкции.
22.
Технологический регламент – это нормативный документ, в котором изложены технологическиеметоды, технические средства, нормы и нормативы изготовления лекарственного средства.
Требования данных регламентов гарантируют качество выпускаемой продукции, рациональное
безопасное проведение технических процессов, сохранение оборудования, исключение
возможности возникновения аварий и загрязнения окружающей среды.
Технологический регламент, независимо от его типа, должен содержать следующие разделы:
1. Характеристика готовой продукции.
2. Химическая схема производства.
3. Технологическая схема производства.
4. Аппаратурная схема производства и спецификация оборудования.
5. Характеристика сырья, материалов и полупродуктов.
6. Описание стадий технологического процесса.
7. Технико-экономический баланс.
8. Контроль производства.
9. Техника безопасности.
10. Охрана окружающей среды.
11. Приложения:
– перечень технологических инструкций изготовления;
– перечень форм протоколов. Соблюдение всех требований технологического регламента
обязательно.
Регламент является законом производства, и отступление от него недопустимо.
23.
ПРОБЛЕМА ФАЛЬСИФИКАЦИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ И ПУТИ ЕЕРЕШЕНИЯ
Наиболее значимая проблема современного фармацевтического
рынка - присутствие контрафактных (фальсифицированных)
лекарственных препаратов.
Мировой оборот фальсифицированных ЛС оценивается в несколько
миллиардов долларов в год. Примерно десятая доля всей
фальсифицированной продукции приходится на российский рынок.
Проблема подделки ЛС имеет давнюю историю. Уже в середине XIX
в. были описаны случаи, когда производители лекарственных
препаратов уменьшали содержание или полностью заменяли
дорогостоящий компонент растительного или животного
происхождения, не отличающийся внешне и менее дорогой.
Например, в зарубежные лимонное и бергамотовое масла
добавляли скипидар; вместо рыбьего жира в продажу поступали
суррогаты, полученные настаиванием на минеральном или
кунжутном масле отходов рыбного производства, а мятные капли
вместо фармакопейной прописи готовили из настойки крапивы,
смешивая ее с эфирным маслом перечной мяты.
24.
По определению Всемирной организации здравоохранения (ВОЗ),«фальсифицированным (контрафактным) ЛС является продукт,
преднамеренно и противоправно снабженный этикеткой, неверно
указывающей подлинность препарата и/или изготовителя». В большинстве
случаев эти ЛС неэквивалентны оригинальным препаратам по критериям
эффективности и безопасности.
Первые данные о фактах фальсификации ЛС поступили в ВОЗ в 1982 г. В
РФ первый случай фальсификации ЛС (реополиглюкина) был
зафиксирован в 1997 г. Однако в последующие годы число
фальсифицированных ЛС на российском фармацевтическом рынке резко
возросло. Так, за период с 1997 по октябрь 2001 г. задокументировано
218 случаев фальсификации лекарств.
Согласно ВОЗ, основными причинами существования контрафактной
продукции являются: недостаточная эффективность законодательной базы
и отсутствие национального органа по регламентации ЛС или
недостаточность его полномочий, финансовых и кадровых ресурсов;
неадекватность мер наказания за нарушение законодательства в сфере
обращения ЛС; чрезмерная сложность системы продвижения ЛС на
фармацевтическом рынке, наличие большого числа посредников;
неоправданно высокие цены на ЛС; неэффективное сотрудничество между
национальным органом регламентации ЛС, таможенной службой,
правоохранительными и судебными органами; возможность
совершенствования нелегального производства лекарств (доступность
современного оборудования, в том числе полиграфического).
25.
Анализ сообщений о фальсифицированных (контрафактных)продуктах, проведенный ВОЗ, показал, что около 60% фальсификатов
вообще не содержит действующего вещества, 19% содержит
действующие вещества в количествах, не соответствующих
стандартам, в 16% случаев в них находятся действующие вещества,
которые не соответствуют указанным на маркировке.
Кроме активных ингредиентов подделывают лекарственные формы,
инструкции по применению препаратов, названия производителей,
номера серий, даты срока годности и документацию по контролю
качества.
В России самым распространенным видом лекарственного
фальсификата является так называемая копия, т.е. подделка,
содержащая истинное действующее вещество в нужном количестве
и имеющая такую же упаковку, как и оригинальное ЛС. В 67%
случаев подделывают проверенные временем отечественные и
популярные зарубежные препараты, выпускаемые авторитетными
фармацевтическими компаниями. Однако встречаются
фальсификаты, имитирующие и не столь распространенные
препараты не самых известных производителей.
26.
Фальсификация распространяется как на оригинальные, так и навоспроизведенные ЛС (дженерики). По фармакотерапевтическим группам
наиболее часто подделывают: антибактериальные средства - 47%; гормональные
средства - 11; средства, влияющие на тканевый обмен, - 7; противогрибковые - 7;
средства, влияющие на ЖКТ, - 7; анальгетики - 7; прочие средства - 14%.
Расхождение по показателям качества фальсифицированных ЛС: «описание и
маркировка» - 52%, «подлинность» - 40, «количественное содержание» - 6, другие
показатели - 2%.
Случаи подделок регистрируют контрольно-аналитические лаборатории, центры
сертификации ЛС, а также сами производители оригинальных препаратов.
Часто выбор препаратов для подделки объясняется их широким применением
и/или высокой стоимостью. Например, в России к часто подделываемым
препаратам относят спазмолитики, антибиотики, гастроэнтерологические средства,
антигистаминные средства (см. выше).
Подделка антибактериальных препаратов опасна не только для конкретного
больного, но и общества в целом, поскольку помимо неэффективности
фальсифицированные антимикробные средства являются фактором риска
возникновения резистентности.
Серьезную угрозу здоровью населения представляют фальсифицированные
противотуберкулезные средства. Их применение не только приводит к летальным
исходам вследствие неэффективности лечения, но и способствует возникновению
и распространению мультирезистентных форм туберкулеза, плохо поддающихся
лечению.
27.
В настоящее время создают национальные и международные сети для определенияфальсифицированной фармацевтической продукции и борьбы с ней.
В их задачи входит:
- обмен информацией по препаратам ненадлежащего качества;
- обучение инспекторов на национальном или региональном уровне;
- тестирование образцов продукции, уже поступившей на рынок;
- создание региональных контрольных лабораторий;
- создание системы оповещений о фальсифицированных препаратах.
В Европе 15 фармацевтических компаний входят в состав Института фармацевтической
безопасности. В институте проводится ежедневный анализ сведений, поступающих из сотен
электронных баз, публикаций в медицинской, юридической и коммерческой периодике, что
позволяет отслеживать продукцию, производимую компаниями-участницами, и предупреждать
аптеки о проблемных препаратах.
В связи с ростом производства и продаж биологически активных добавок (БАД) как
отечественного, так и зарубежного производства актуальным вопросом стала оценка степени
эффективности и безопасности их применения. В соответствии с СанПиН 2.3.2.129003
«Гигиенические требования к организации производства и оборота БАД к пище», БАД могут
использоваться: в качестве дополнительного источника пищевых и биологически активных
веществ, для оптимизации обмена (белкового, жирового, углеводного и др.), для нормализации
и/или улучшения функционального состояния органов и систем организма человека, для снижения
риска развития заболеваний, для нормализации микрофлоры ЖКТ, в качестве энтеросорбентов.
Как следует из определения, БАД не должны оказывать терапевтического эффекта. Степень их
эффективности исследуют в Клинике лечебного питания ГУ НИИ РАМН и по окончании составляют
протоколы оценки эффективности БАД. В то же время контроль качества БАД, идентичный
контролю ЛС, не осуществляют. В связи с этим к применению БАД следует относиться с большой
осторожностью.
28.
В качестве «первой линии обороны» для выявленияконтрафактной продукции было рекомендовано измерение
количества активного компонента в жидких ЛС. С этой
целью может быть использован переносной рефрактометр.
Предложено также вводить электромагнитную маркировку
между пластиковым слоем и фольгой в блистерной
упаковке или в крышку флаконов. К другим предлагаемым
средствам защиты относят невидимые чернила,
голограммы с маркировкой лекарства, нанесение скрытых
знаков (маркеров) на продукцию.
Немецкие специалисты, обнаружив незаявленные
кортикостероиды в спрее для лечения угревой сыпи,
разработали простые тесты для выявления
фальсифицированных препаратов. Созданная минилаборатория умещается в небольшом чемодане-дипломате
и рассчитана на проведение 3 тыс. цветных реакций на
подлинность лекарств и 1 тыс. тестов хроматографии в
тонком слое сорбента.
29.
В РФ в последнее время внедряют новый метод контроляконтрафактной продукции - ИК-спектрометрию в ближнем диапазоне
(БИК-метод). Он позволяет обнаружить различия не только между
продукцией отдельных производителей, но даже между отдельными
сериями препаратов одного производителя. При создании библиотек
спектров метод может быть использован для выявления
контрафактной продукции без вскрытия упаковки, что позволяет
применять его для контроля качества в условиях аптечных складов и
аптек.
В связи с наличием на аптечном рынке широкого ассортимента
питьевых, лечебных и лечебно-столовых минеральных вод
отечественного и импортного производства, а также жидких водных
ЛС стало актуальным экспрессопределение их подлинности для
установления контрафактной продукции. С этой целью
разрабатывают портативные приборы, в основе действия которых
лежит интерференция лазерного света.
Таким образом, проблема фальсификации ЛС - одна из наиболее
актуальных проблем здравоохранения во всем мире.




























 Медицина
Медицина








