Похожие презентации:
Предмет органической химии
1.
Для работы на уроке-учебник;
-две тетради в клетку 48 листов : одна
для конспектов, другая – для решения
задач);
-ручка, карандаш, ластик, маркеры,
линейка;
-непрограммируемый калькулятор.
2. Дополнительные источники информации https://orgchem.ru/
3.
ИНСТРУКТАЖ по ТБ4.
Введение в органическую химиюв тезисах,
аргументах и
фактах
5.
Метод научного познания1.Излагается мысль, требующая
доказательства или опровержения
– тезис.
2.Приводятся доводы, суждения, мысли,
обоснования, доказывающие или
опровергающие ранее высказанную мысль
– аргументы.
3. Формулируем вывод об истинности
или ложности тезиса.
6.
ТезисИзучать
органическую
химию
очень сложно.
Но жутко интересно!
7.
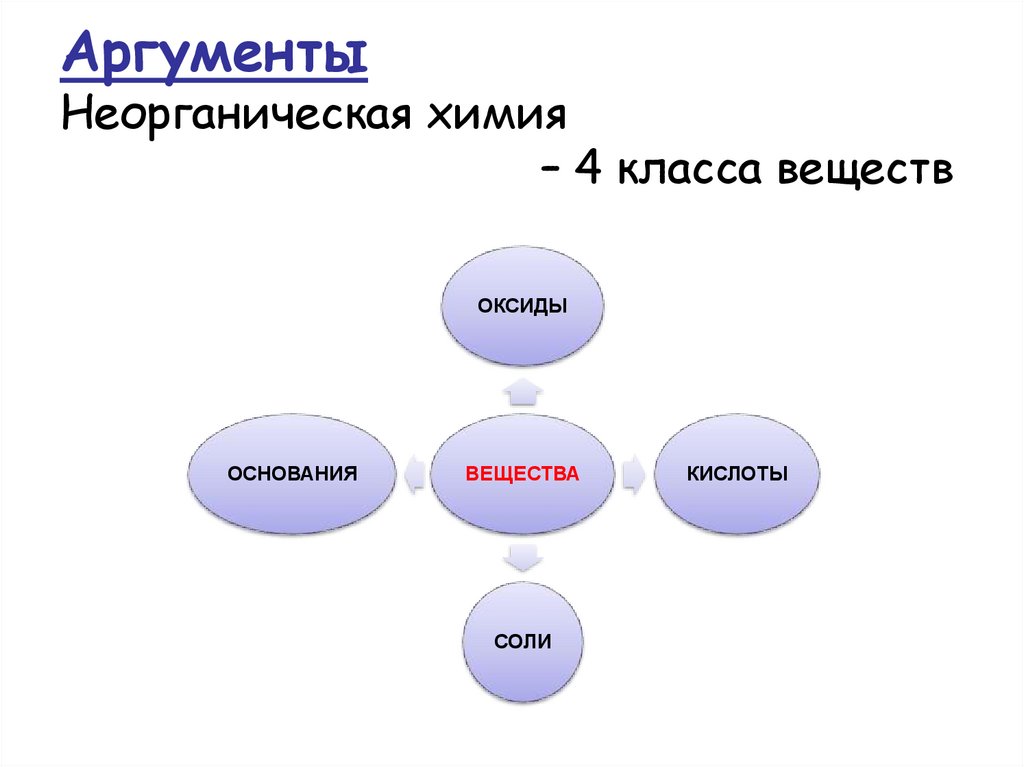
АргументыНеорганическая химия
– 4 класса веществ
ОКСИДЫ
ОСНОВАНИЯ
ВЕЩЕСТВА
СОЛИ
КИСЛОТЫ
8.
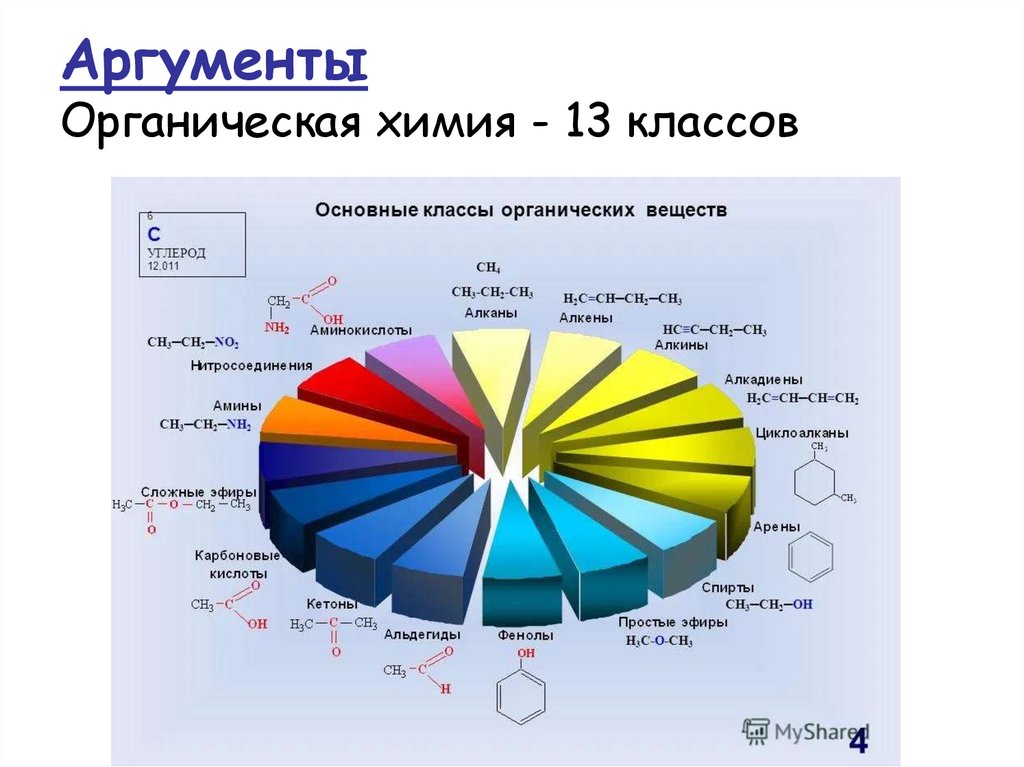
АргументыОрганическая химия - 13 классов
9.
АргументыКомплексные соединения:
ДНК бактериофага:
K[Al(OH)4]
С5750Н7227N2215O4131S590
10.
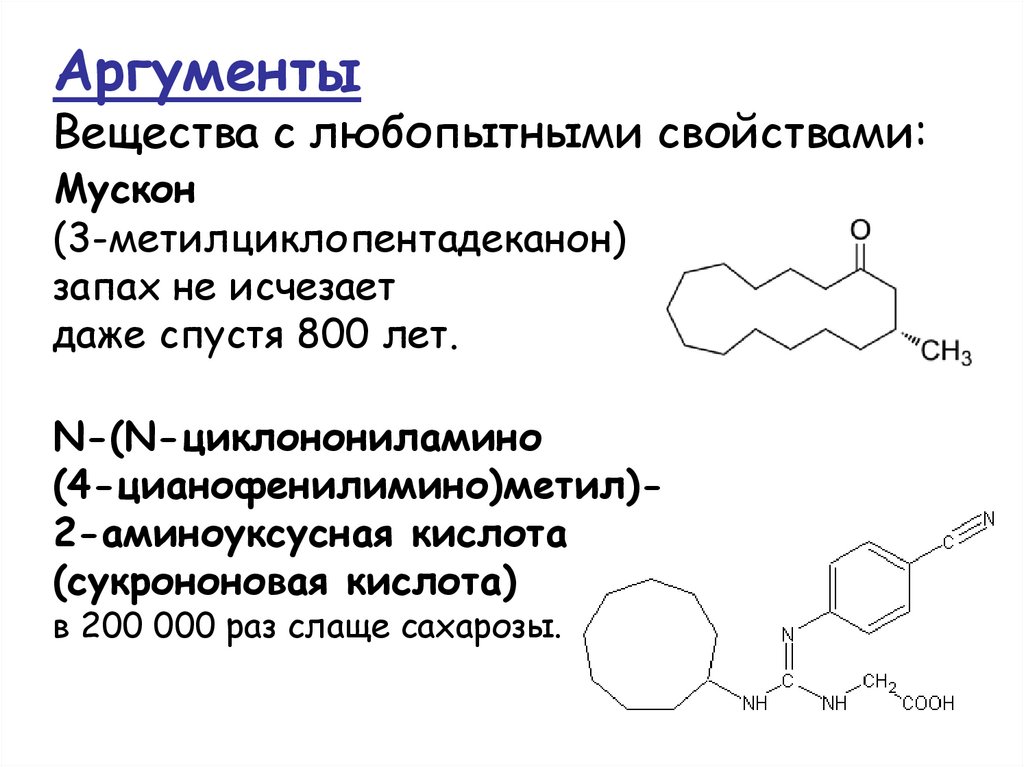
АргументыВещества с любопытными свойствами:
Мускон
(3-метилциклопентадеканон)
запах не исчезает
даже спустя 800 лет.
N-(N-циклонониламино
(4-цианофенилимино)метил)2-аминоуксусная кислота
(сукрононовая кислота)
в 200 000 раз слаще сахарозы.
11.
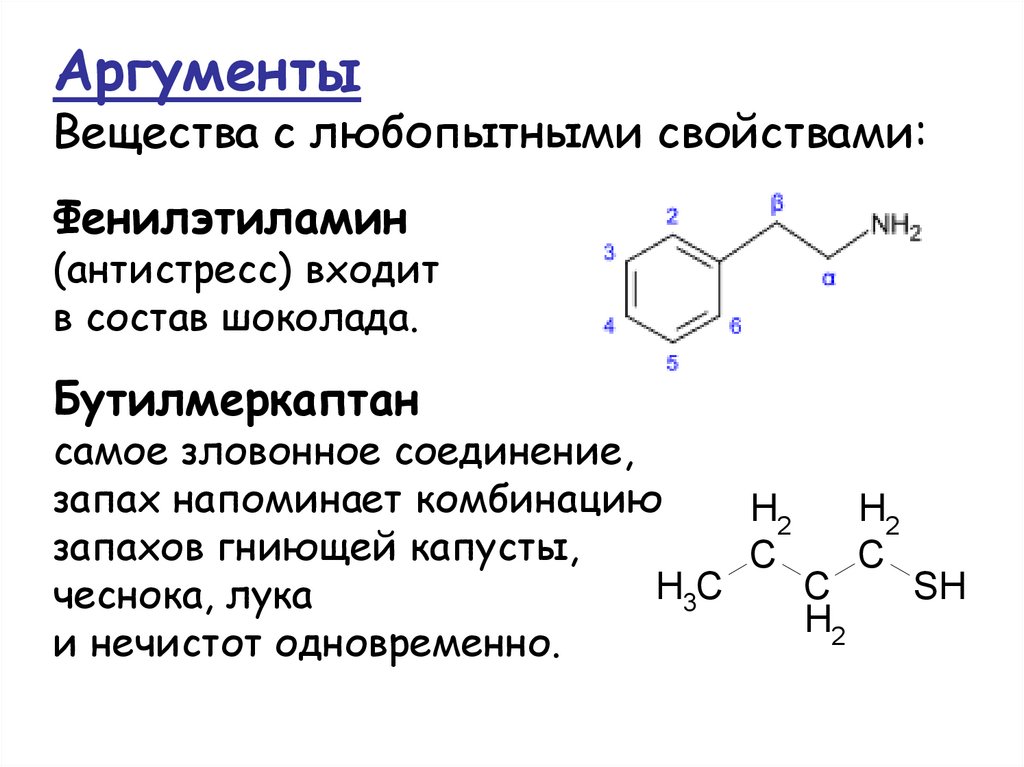
АргументыВещества с любопытными свойствами:
Фенилэтиламин
(антистресс) входит
в состав шоколада.
Бутилмеркаптан
самое зловонное соединение,
запах напоминает комбинацию
H2
H2
запахов гниющей капусты,
C
C
C
SH
H3C
чеснока, лука
H2
и нечистот одновременно.
12.
Аргументы:Цепочки превращений:
целлюлоза древесины →
искусственный шелк
бензин низкого качества →
высокооктановый бензин
13.
АргументыХимия – одна из
быстроразвивающихся наук.
Химики создают новые вещества,
которые помогают
усовершенствовать технику,
делают удобной нашу одежду,
помогают бороться со
смертельными болезнями.
14.
АргументыНайдем ответы на вопросы:
• Почему пища, приготовленная во
фритюре вредна?
• Как правильно варить мясо, если вы
хотите получить вкусный бульон?
• Как отличить натуральную кожу от
искусственной ?
15.
ВыводДорогу осилит идущий!
Химия важна!
Химические знания помогают
в решении многих
жизненно важных проблем.
16.
КОНСПЕКТ1Предмет
органической химии
17.
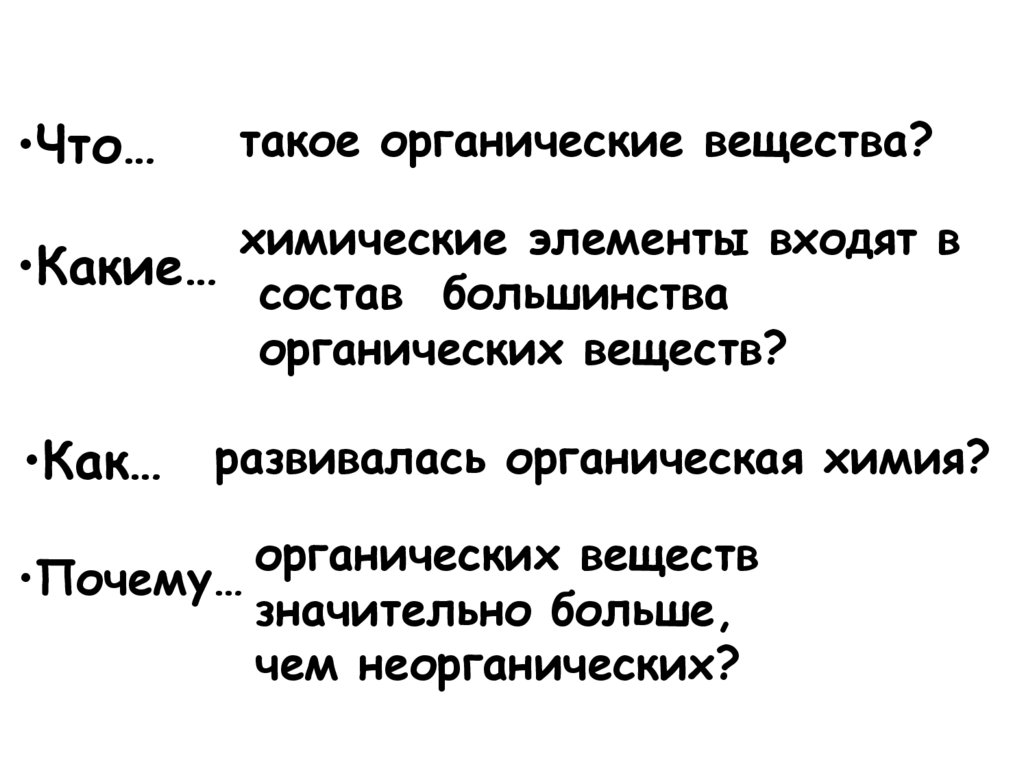
•Что…такое органические вещества?
химические элементы входят в
•Какие… состав большинства
органических веществ?
•Как… развивалась органическая химия?
органических веществ
•Почему…
значительно больше,
чем неорганических?
18.
Немного из историиСпособы получения
различных органических веществ были
известны ещё с древности.
Египтяне и римляне использовали
красители индиго и ализарин,
содержащиеся в растительных веществах.
Многие народы знали секреты
производства спиртных напитков
и уксуса из сахар- и крахмалсодержащего
сырья.
19.
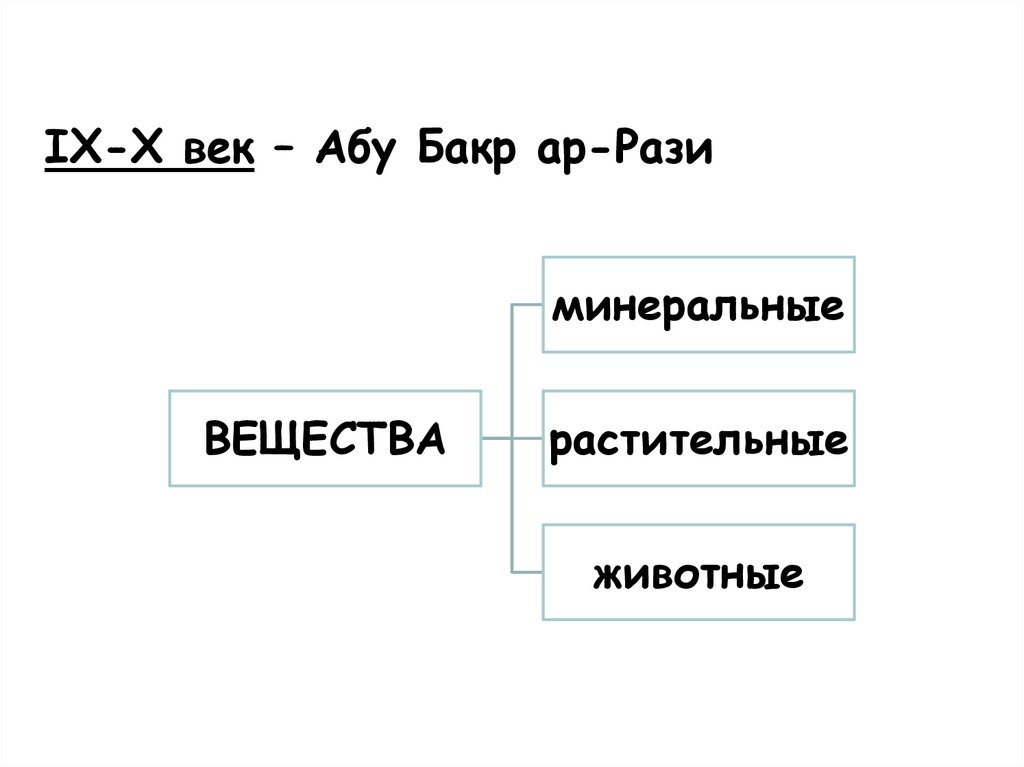
IX-X век – Абу Бакр ар-Разиминеральные
ВЕЩЕСТВА
растительные
животные
20.
Во времена средневековья к этимзнаниям мало что прибавилось.
Некоторый прогресс начался
только в XVI—XVII вв:
были получены некоторые
вещества, в основном путём
перегонки определённых
растительных продуктов.
В 1769—1785 г. Шееле выделил
несколько органических кислот:
яблочная, винная, лимонная,
молочная и щавелевая.
В 1773 г. Руэль выделил из
человеческой мочи мочевину.
21.
В начале XIX века– Йёнс Якоб Берцелиус
неорганические
ВЕЩЕСТВА
органические
учение о витализме
- органические вещества могут
образовываться только в живых
организмах под действием некой
“жизненной силы”.
22.
23. Живое – из неживого?
1828 г.Ф.Велер
синтезирует
мочевину
1854 г.
М.Бертло
синтезирует
жиры
1845 г.
А.Кольбе
синтезирует
уксусную
кислоту
1861 г.
А.Бутлеров
синтезирует
сахаристое
вещество
24.
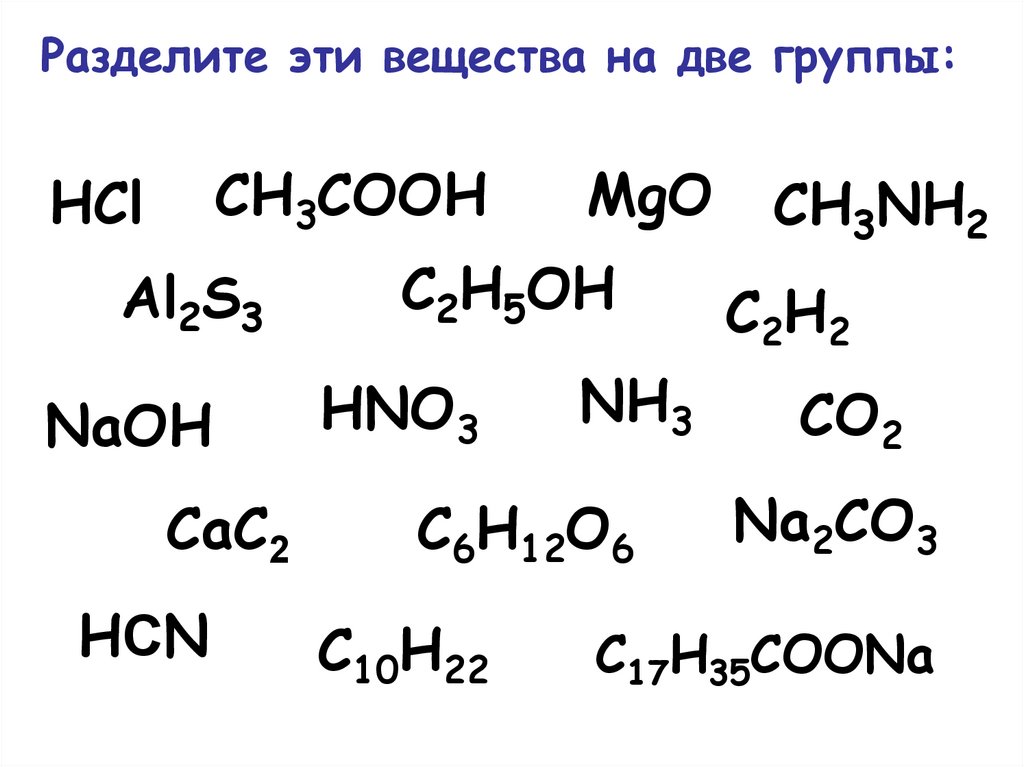
Разделите эти вещества на две группы:CH3COOH
HCl
Al2S3
NaOH
CaC2
HСN
MgO
C2H5OH
HNO3
NH3
C6H12O6
C10H22
CH3NH2
C2H2
CO2
Na2CO3
C17H35COONa
25.
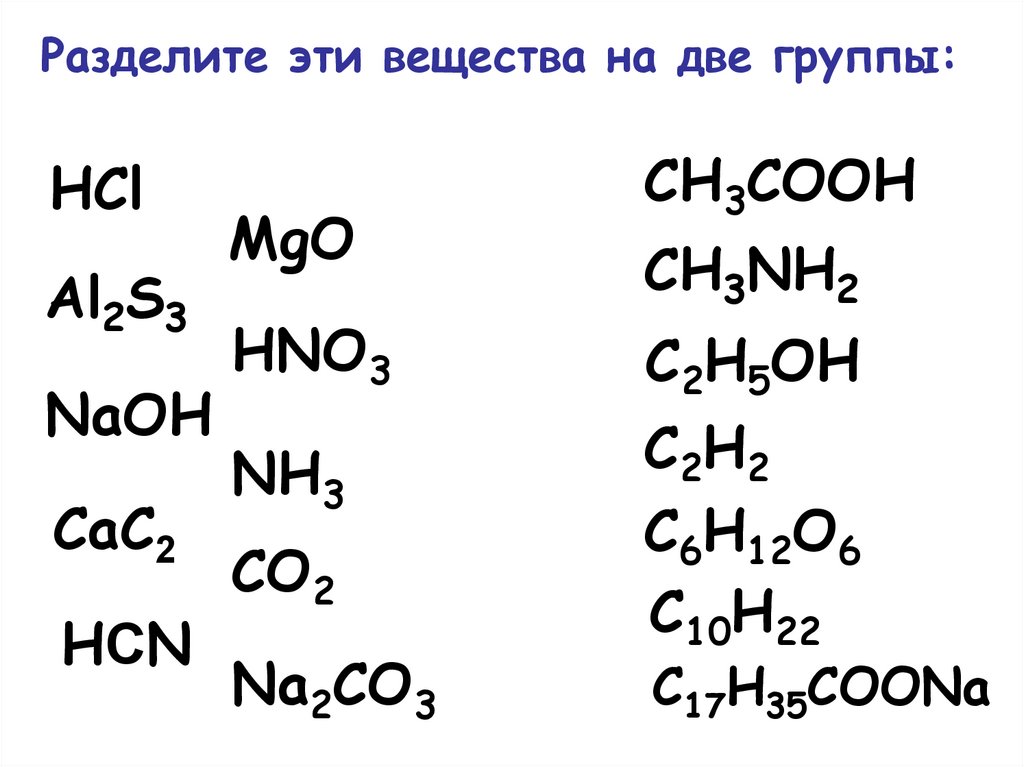
Разделите эти вещества на две группы:HCl
Al2S3
NaOH
CaC2
HСN
MgO
HNO3
NH3
CO2
Na2CO3
CH3COOH
CH3NH2
C2H5OH
C2H2
C6H12O6
C10H22
C17H35COONa
26.
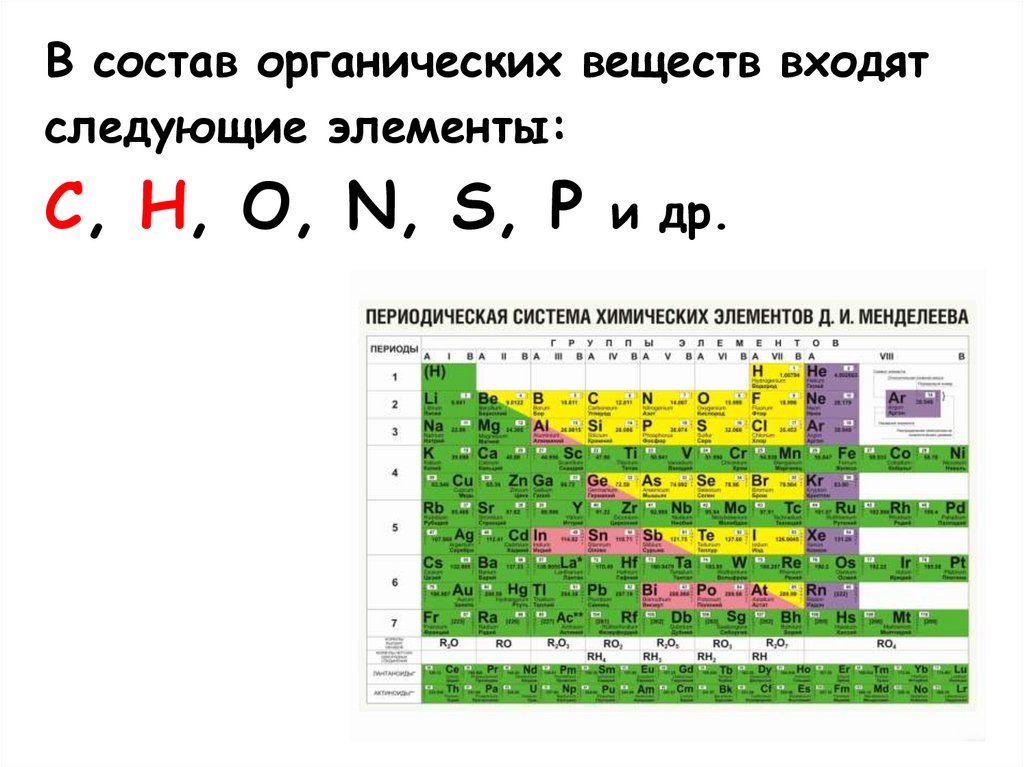
В состав органических веществ входятследующие элементы:
C, H, O, N, S, P и др.
27.
КОНСПЕКТ1Органическими веществами называют
соединения С, за исключением:
CO – оксид углерода (II)
CO2 – оксид углерода (IV)
H2CO3 – угольная кислота и её соли:
-гидрокарбонаты NaHCO3,
-карбонаты Na2CO3
HCN – синильная кислота и её соли:
-цианиды KCN
CaC2, Al4C3 – карбиды металлов
28.
1889 г. Карл Шорлеммер КОНСПЕКТ1Органическая химия (ОХ) - это химия
углеводородов и их производных.
Углеводороды (УВ) – простейшие
органические вещества, молекулы
которых состоят из атомов С и Н.
Общая формула УВ: CxHy
Примеры: CH4, C2H6, C6H6
29.
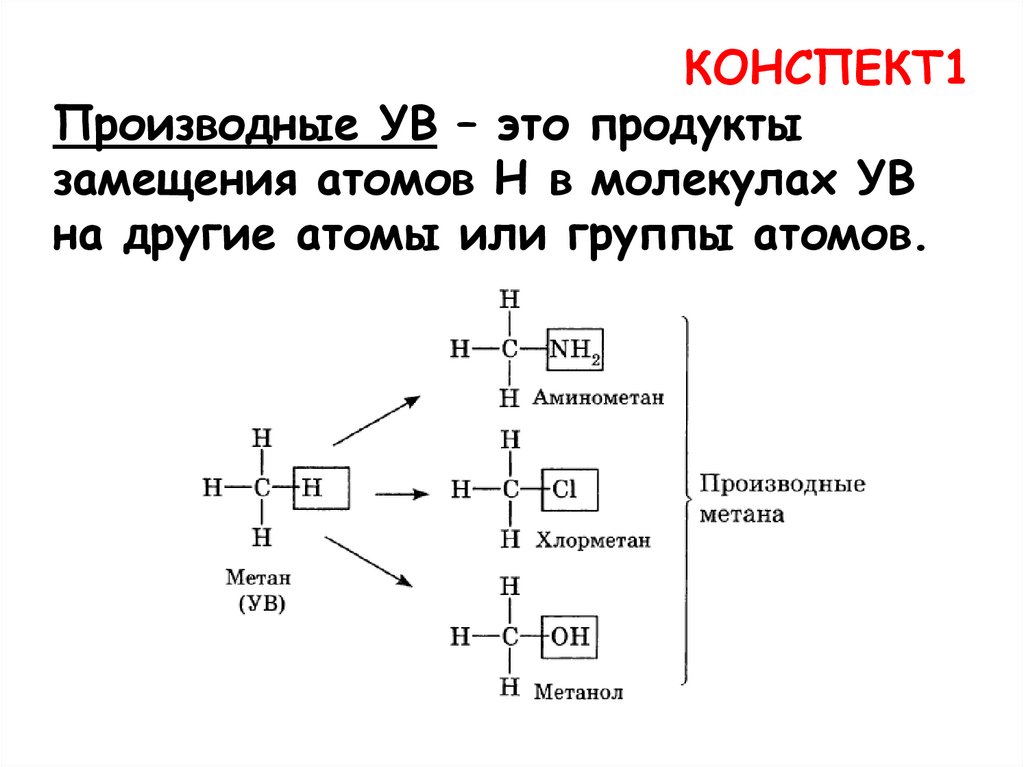
КОНСПЕКТ1Производные УВ – это продукты
замещения атомов Н в молекулах УВ
на другие атомы или группы атомов.
30.
Причина многообразия ОВ:Углерод – особый элемент.
Ни один другой химический элемент не
может образовывать такое
многообразие соединений.
31.
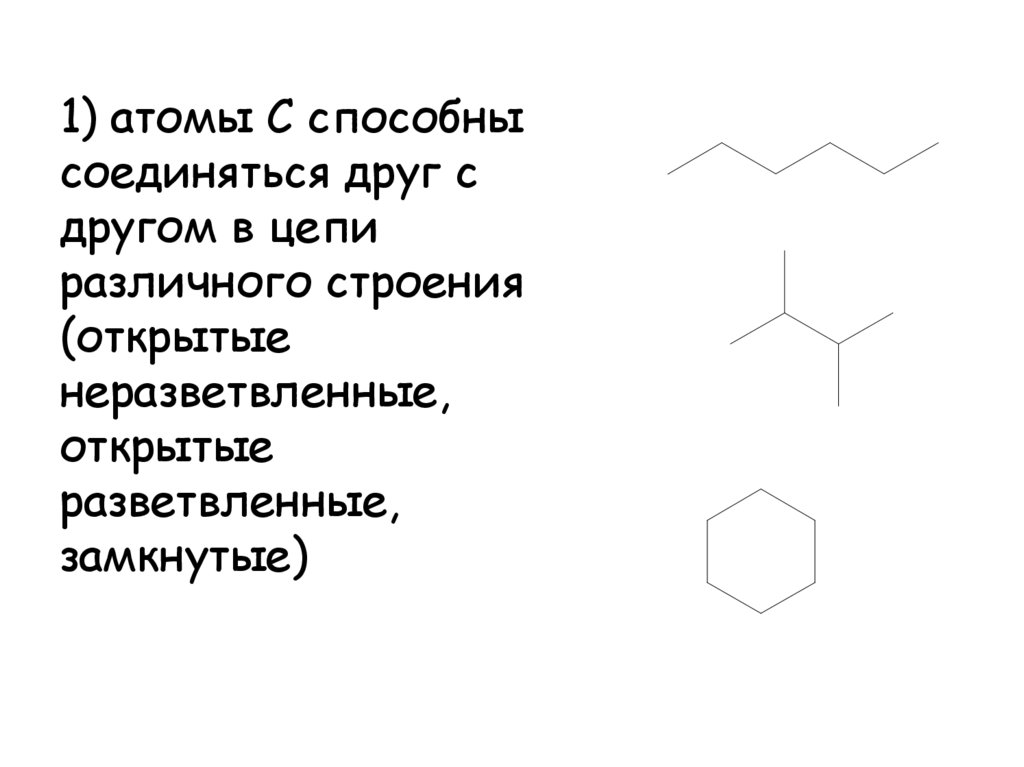
1) атомы С способнысоединяться друг с
другом в цепи
различного строения
(открытые
неразветвленные,
открытые
разветвленные,
замкнутые)
32.
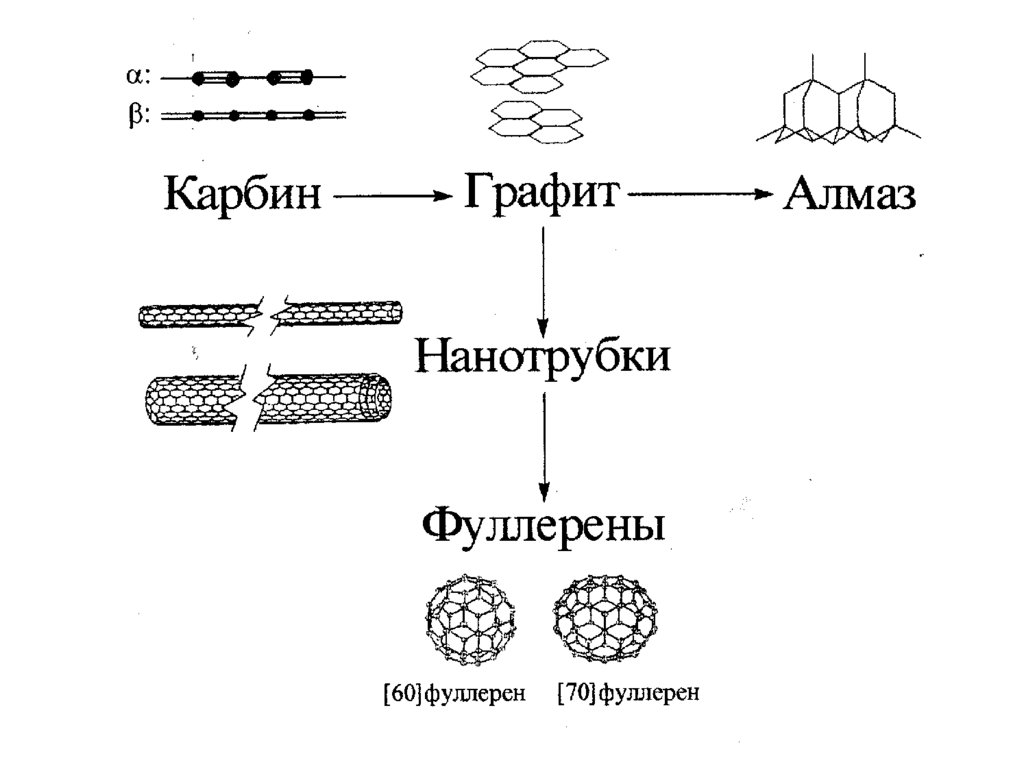
и разной длины– от 2х атомов С (этан, этилен,
ацетилен) до 100 тысяч (полиэтилен,
полипропилен, полистирол, другие
карбоцепные полимеры),
а также создавать разнообразные
наноструктуры (фуллерены,
нанотрубки, наноконусы и т.п);
33.
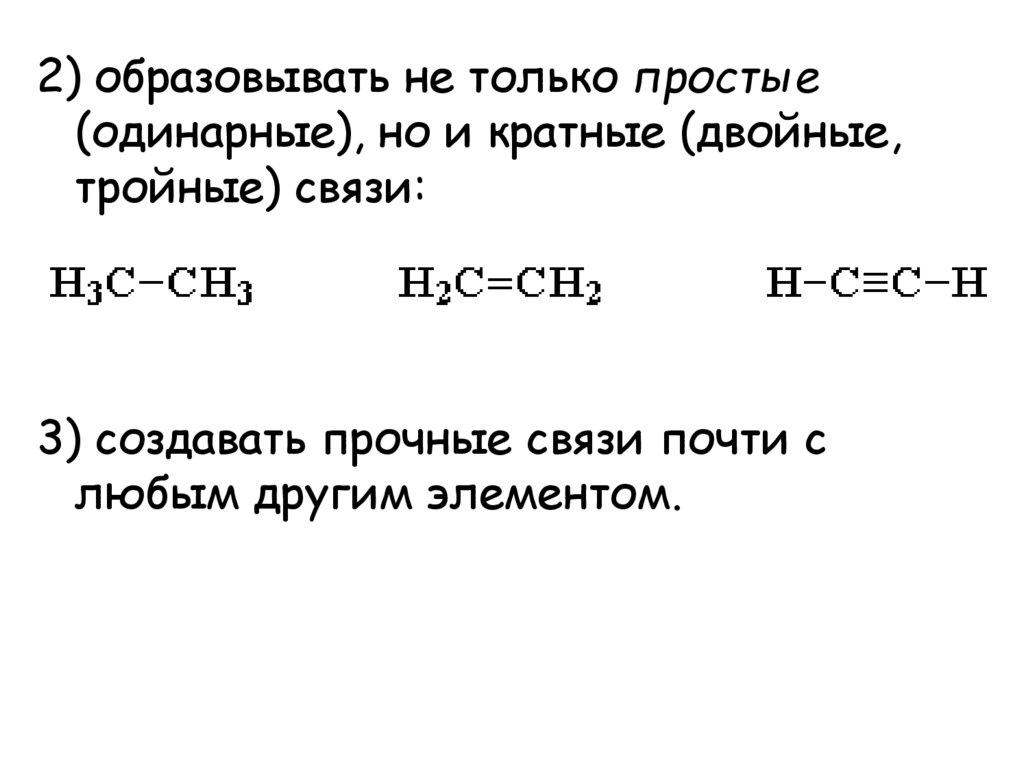
34.
2) образовывать не только простые(одинарные), но и кратные (двойные,
тройные) связи:
3) создавать прочные связи почти с
любым другим элементом.
35.
Особенности ОС, которые отличают ихот неОС:
1.Многочисленность + круговорот С в
природе.
На 8 апреля 2018 года в реестре Химической реферативной
службы США зарегистрировано 141 млн. химических веществ.
2.Т.к. в состав ОС входят С и Н,
большинство из них горючи → CO2 +
H2O
3.ОС построены более сложно и имеют
огромную ММ → белки, жиры,
углеводы, нуклеиновые кислоты…
36.
4.Гомологический ряд – ряд веществ,расположенных в порядке возрастания их
относительных ММ, сходных по
строению и химическим свойствам, где
каждый член отличается от предыдущего
на гомологическую разность СН2.
5.Для ОС характерно явление изомерии.
Изомерия – это явление существования
веществ с одинаковым качественным и
количественным составом (т.е.
одинаковой молекулярной формулой), но
разным строением и свойствами.
37.
КОНСПЕКТ2Вычисление массовой доли
химического элемента в веществе
производится по его химической
формуле с использованием атомных
масс элементов, входящих в состав
молекулы вещества.
38.
КОНСПЕКТ2ω (Э) – массовая доля
химического элемента в
веществе, %
n – количество атомов
химического элемента в
веществе;
Ar(Э) – относительная
атомная масса элемента;
Mr – относительная
молекулярная масса вещества.
39. Задача №1 Определите в общем виде массовые доли углерода и водорода для вещества СxНy.
Дано:СxHy
ω(С) -?
ω(Н) -?
40. Задача №1 Определите в общем виде массовые доли углерода и водорода для вещества СxНy.
Дано:СxHy
ω(С) -?
ω(Н) -?
41. Задача №2 Рассчитайте массовые доли углерода и водорода для вещества С6Н12
Дано:С6H12
ω(С) -?
ω(Н) -?
42. Задача №2 Рассчитайте массовые доли углерода и водорода для вещества С6Н12
Дано:С6H12
ω(С) -?
ω(Н) -?
43. Уч. стр.10 №2 Решение задачи
44.
Определение молекулярной формулывещества по массовым долям
элементов
Молекулярная (истинная) формула — формула,
в которой отражается реальное число атомов
каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула —
показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н =
1:1, т.е. простейшая формула бензола — СН.
45.
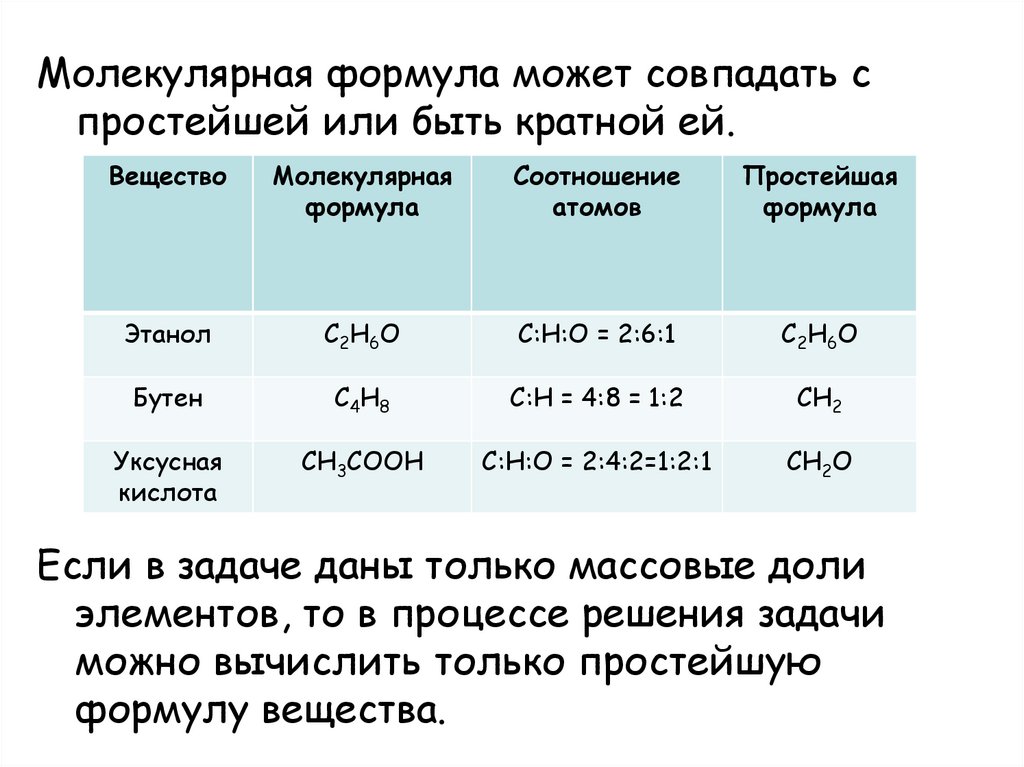
Молекулярная формула может совпадать спростейшей или быть кратной ей.
Вещество
Молекулярная
формула
Соотношение
атомов
Простейшая
формула
Этанол
C2H6O
C:Н:О = 2:6:1
C2H6O
Бутен
C4H8
С:Н = 4:8 = 1:2
СН2
Уксусная
кислота
CH3COOH
С:Н:О = 2:4:2=1:2:1
СН2О
Если в задаче даны только массовые доли
элементов, то в процессе решения задачи
можно вычислить только простейшую
формулу вещества.
46.
Для получения истинной формулы взадаче обычно даются дополнительные
данные:
- молярная масса;
- относительная или абсолютная
плотность вещества;
- или др.
47.
48.
49.
50. Задача №2 Найдите молекулярную формулу углеводорода, в составе которого массовая доля углерода составляет 82,7%, водорода-
Задача №2Найдите молекулярную формулу
углеводорода, в составе которого массовая
доля углерода составляет 82,7%, водорода17,3%, а плотность по воздуху равна 2.
Дано:
ω(С) =82,7%
ω(Н) =17,3%
Dв(CxHy) =2
CxHy - ?
Решение:
51. Уч. стр.10 №5 Решение задачи
52.
53.
Домашнее задание• 1)уч. параграф 1 читать, определения учить (отсутствующие делают
конспект по параграфу и учат определения);
• 2) В тетради 1(конспект) письменно: Все многообразие
органических веществ по их происхождению условно делят
на три группы: природные, искусственные и синтетические.
Дайте определение каждой группе и приведите примеры для каждой
группы.
• 3) В тетради 2(решение задач) письменно: Рассчитать массовую долю
С в веществах CH4, C2H6, C6H6 . На основании расчетов сделать вывод
при горении какого из веществ пламя будет более коптящим? Почему?
• 4) В тетради 2(решение задач) письменно: Органическое вещество А
используют в технике в качестве охлаждающего реагента систем
охлаждения двигателей. Определите молекулярную формулу
органического соединения А, которое содержит 38,71% углерода,
9,68% водорода и 51,61% кислорода по массе, если известно, что
плотность его паров по азоту составляет 2,2143.







































 Химия
Химия








