Похожие презентации:
ПЗ и ПС Д.И. Менделеева в свете квантовомеханической теории строения атома. Современные представления химической связи
1.
ПЗ и ПС Д.И. Менделеевав свете квантовомеханической теории
строения атома.
Современные представления
о природе химической
связи и строении молекул.
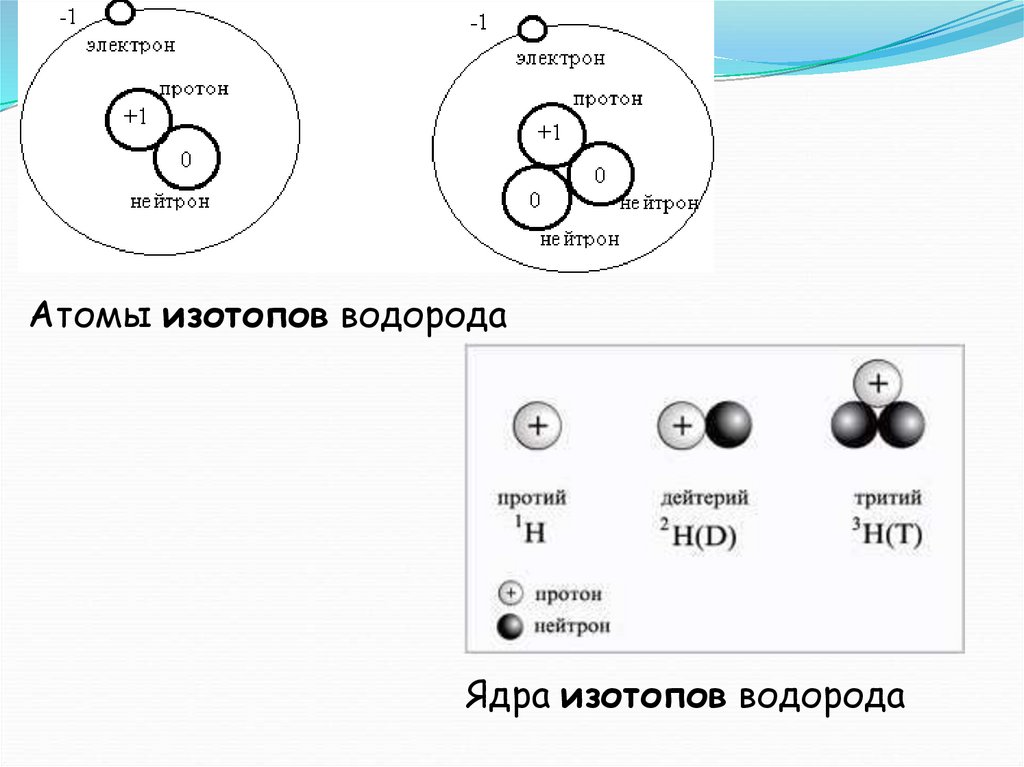
2. Изотопы.
Так называются атомы, имеющиеодинаковый заряд ядра , но различную
массу. Все изотопы одного и того же
элемента обладают одинаковыми
химическими свойствами , но могут
отличаться радиоактивностью.
Например, 12Н- дейтерий и 13Н- тритий
являются изотопами водорода (тритий
радиоактивен)
3.
Атомы изотопов водородаЯдра изотопов водорода
4.
В 1924 г французский учёный Луи де Бройльвысказал предположение о двойственной природе
материальных частиц, в частности электрона.
В 1926 г Э. Шредингер
теорию движения микрочастиц –
квантовая (волновую) механику
создание современной квантовомеханической модели строения атома.
Эта модель не наглядная !
( очень условное изображение)
λ=10-8 см
5.
1. Электрон в атоме можно рассматриватькак частицу, которая при движении
проявляет волновые свойства. Т.е.
нельзя описать движение электрона в
атоме
определенной
траекторией
(орбитой).
2. Электрон в атоме может находиться в
любой точке пространства вокруг ядра,
однако вероятность его пребывания в
разных местах атомного пространства
различна.
6.
…электронным облаком.… атомной орбиталью (АО)
(или электронной плотностью).
Термин "орбита" (из модели Бора) в волновой
модели теперь полностью уступил место
термину "орбиталь". Орбиталь имеет чисто
вероятностный смысл и её просят не путать
с орбитой, т.е. траекторией движения
электрона.
«Неужели действительно были такие
идиоты, которые думали, что электрон
вращается по орбите?»
Н. Бор
7.
Важным следствием теории квантовой механикиявляется то, что вся совокупность сложных
движений электрона в атоме описывается
четырьмя квантовыми числами.
8. Атом хлора
+17 Cl )2 )8 )7 схема строения атома.1s2 2s2 2p6 3s2 3p5 это электронная
формула.
Атом располагается в III периоде, и
имеет три энергетических уровня.
Атом располагается в VII группе, главной
подгруппе - на внешнем энергетическом
уровне 7 электронов.
8
9.
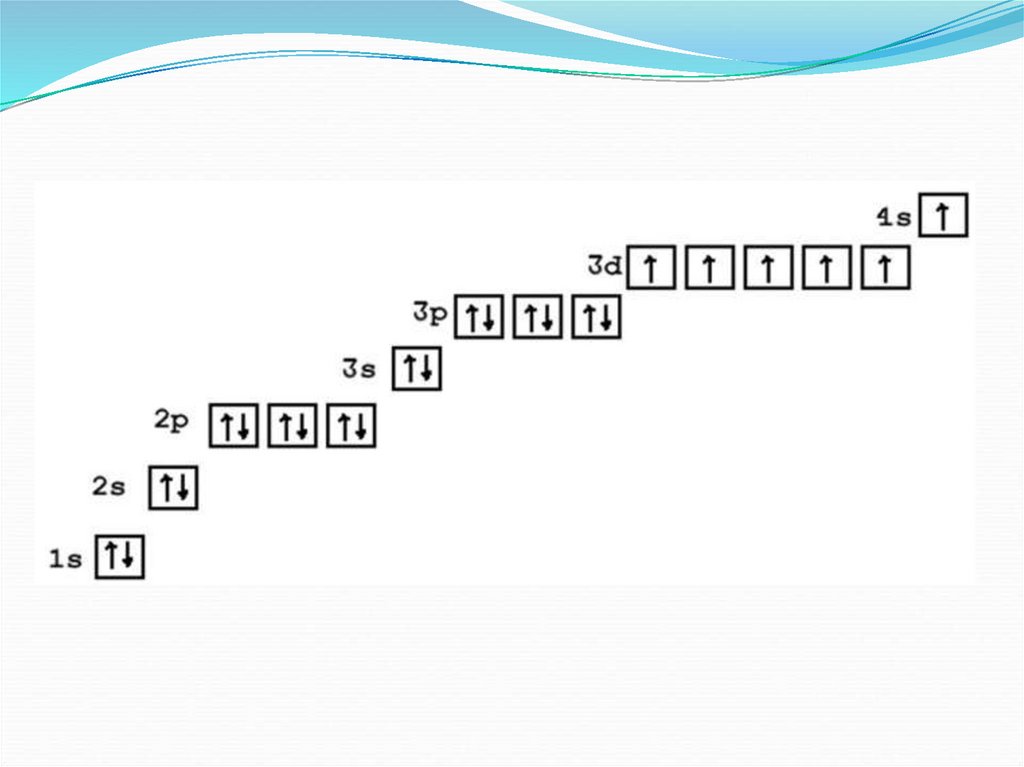
«Проскок» электронаИсходя из правила сначала заполняется 4s-подуровень и только потом 3dподуровень.
Опираясь на это, давайте построим теоретическую (!) электронную
конфигурацию меди:
1s² 2s² 2p⁶ 3s²3p⁶ 4s² 3d⁹.
Теперь мы видим, что 3d уровень меди теоретически содержит в себе 9
электронов при том что максимально на нем их может находиться 10.
Итак, мы подошли к самой причине возникновения проскока электрона:
10.
Элементам гораздо выгоднее энергетически заполнить dподуровень либо до конца (10 электронов) либо наполовину (5электронов)
Соответственно, медь будет стремиться получить на своем 3dподуровне не 9, а 10 электронов.
Откуда же возьмется этот недостающий электрон? Ответ —
прямиком с 4s-подуровня.
Итак, реальная (не теоретическая) электронная
конфигурация меди будет выглядеть следующим образом:
1s²2s²2p⁶ 3s²3p⁶ 4s¹3d¹⁰
Теперь у меди до конца заполнен 3d-подуровень, что очень
энергетически выгодно для нее. Графически это выглядит
следующим образом:
11.
Также можно уточнить, что самым отдаленным от ядраявляется s-электрон.
12.
Проскок электрона наблюдается только у пятиследующих элементов, которые необходимо выучить:
•медь
•серебро
•золото
•хром
•молибден
И если у серебра и золота абсолютно идентичная
ситуация с медью, то хром и молибден стремятся
заполнить d-подуровень не до конца, а наполовину (5
электронов). Графически это выглядит следующим
образом:
13.
14.
«Проскок» электронаУстановлено, что у d-орбиталей особо
устойчивыми конфигурациями являются d5 и d10 ,
а у f-орбиталей f7 и f14. Всвязи с этим в основном
состоянии атома наблюдается проскок электрона
с ns-подуровня на (n-1)d-подуровень:
Сr : ….3d44s2 – неправильно
Сr : ….3d54s1 – правильно
15.
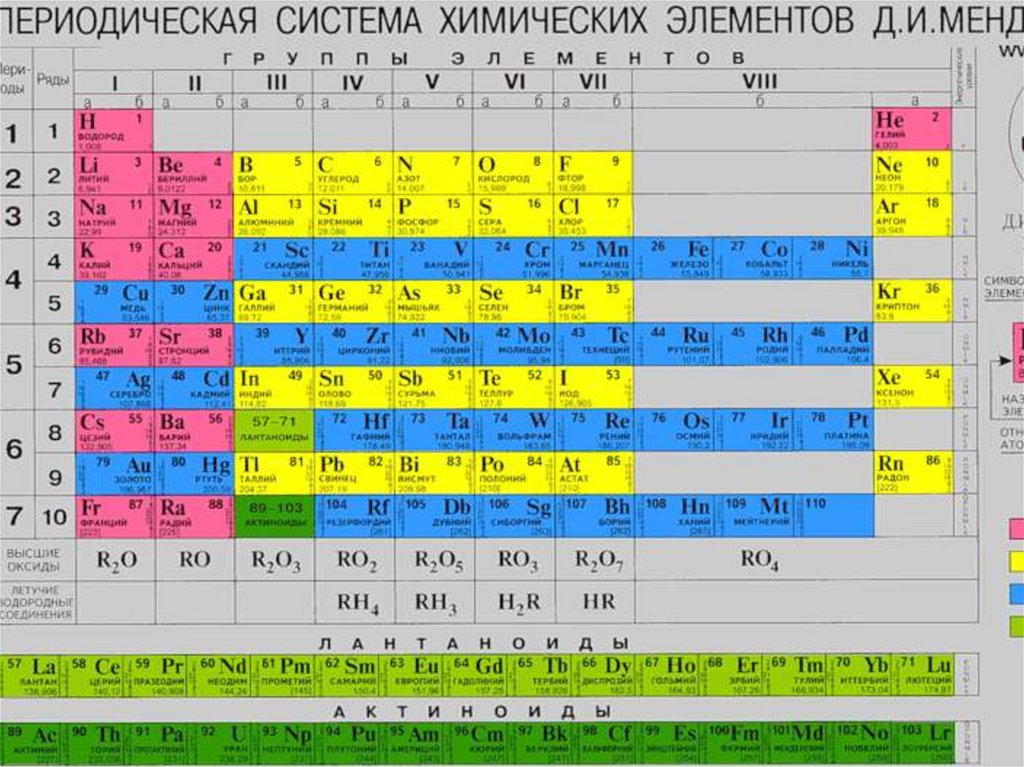
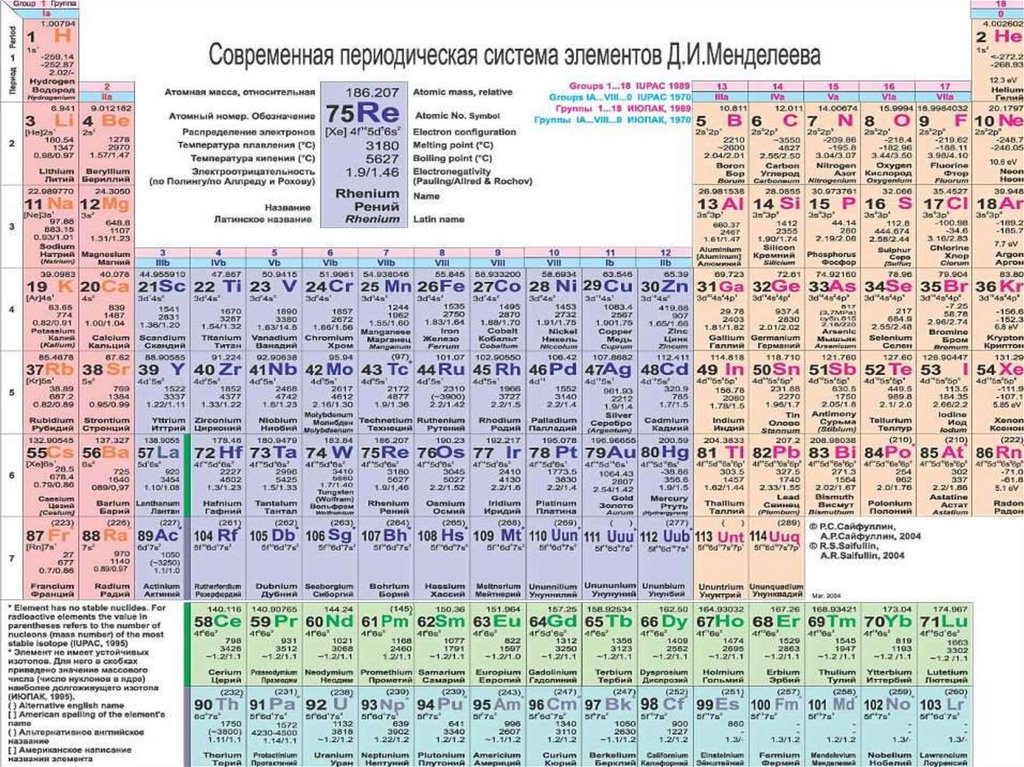
Периодический закон Д.И. Менделеева.Открыт в 1869 г. великим русским ученым Д.М. Менделеевым.
“Свойства элементов и свойства образуемых ими
простых и сложных соединений стоят в периодической
зависимости от их атомного веса”.
Это определение немного ошибочно.
Современная формулировка ПЗ гласит:
Свойства химических элементов, а также формы и
свойства их соединений находятся в периодической
зависимости от величины заряда атомных ядер в
результате периодического повторения электронных
конфигураций внешнего энергетического уровня.
16.
Первым вариантомсистемы элементов,
предложенным Д. И.
Менделеевым 1
марта 1869 г., был
так называемый
вариант длинной
формы, В этом
варианте периоды
располагались одной
строкой. В декабре
1870 г. он
опубликовал второй
вариант
периодической
системы — так
называемую
короткую форму. В
этом варианте
периоды
разбиваются на ряды,
а группы — на
подгруппы (главную
и побочную).
17.
18.
19.
Периодом в ПС называется – горизонтальный рядэлементов, в пределах которого свойства
элементов изменяются последовательно.
В вертикальных колонках, называемых группами,
объединены элементы, имеющие сходное
электронное строение.
Элементы –аналоги, т.е. расположенные в
одной подгруппе ПС, имеют одинаковое
строение внешних электронных оболочек
атомов при различных значениях n и поэтому
проявляют сходные химические свойства.
20.
Периодически меняющиеся свойства атомов1. Атомные и ионные радиусы
2. Энергия ионизации
3. Сродство к электрону
4. Электроотрицательность
21.
Атомные радиусы – характеристика атома,позволяющая приближенно оценивать
межатомные (межъядерные) расстояния в
молекулах и кристалла
Эффективный атомный радиус – радиус
сферы действия атома или иона
увеличение
уменьшение
при этом в группах А
такое увеличение
происходит в большей
степени, чем в группах
В.
22.
2. Энергия ионизации (Еион)[кДж/моль] или [эВ/атом] (1эВ/атом= 100 кДж/моль. )
– минимальная энергия, необходимая для
отрыва наиболее слабосвязанного электрона от
невозбужденного атома
Э ион Э е
Характер изменения в периодах одинаков:
23.
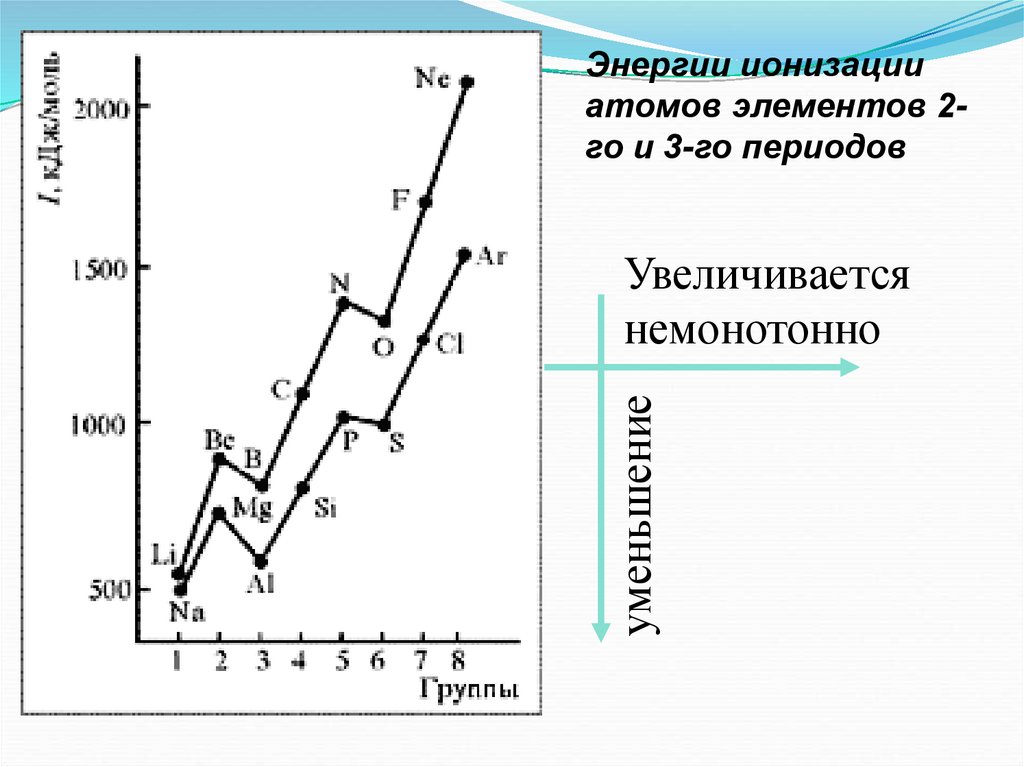
Энергии ионизацииатомов элементов 2го и 3-го периодов
уменьшение
Увеличивается
немонотонно
24.
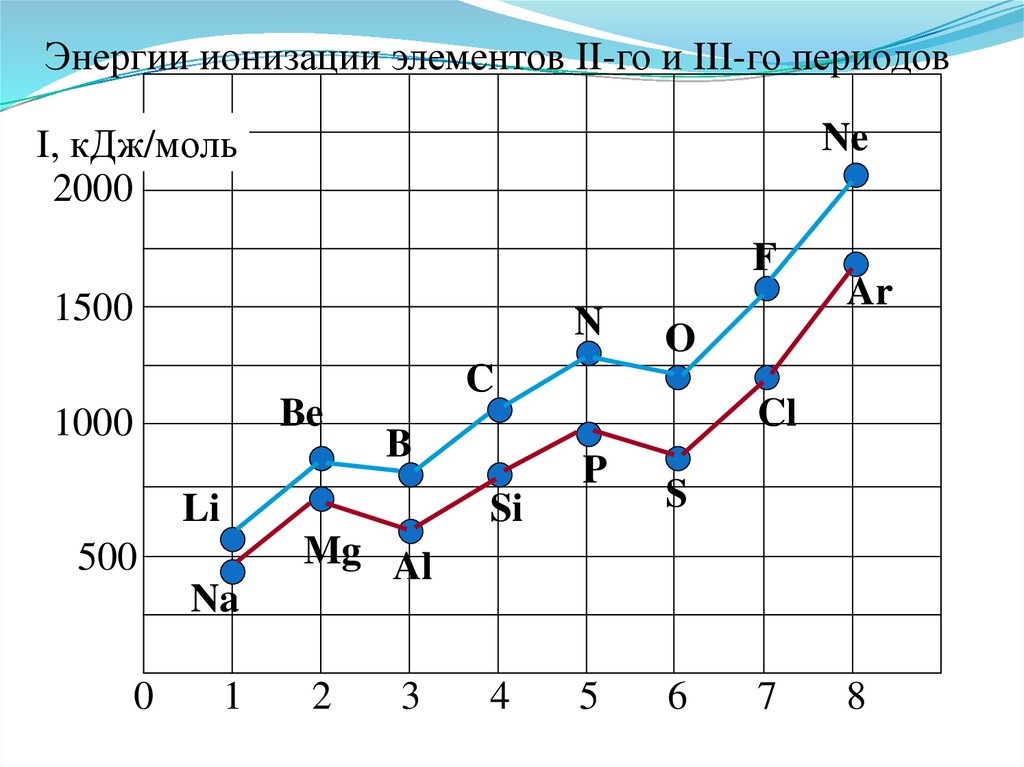
Энергии ионизации элементов II-го и III-го периодовI, кДж/моль
2000
Ne
F
1500
N
Be
1000
Li
Na
0
Cl
P
Si
500
1
O
C
B
Ar
S
Mg Al
2
3
4
5
6
7
8
25.
Анализ изменения Еион позволяет сделатьнекоторые выводы:
1. В периодах Еион ↑, что вызвано сжатием
электронной оболочки вследствие увеличения эфф.
заряда ядра.
2. Атомы щелочных Ме (ns1) имеют самые
низкие Еион
3. Атомы благородных газов (ns2np6) имеют
max Еион
26.
2. Сродство к электрону (Еср.)[кДж/моль] или [эВ/атом] - энергетический
эффект присоединения электрона к
нейтральному атому
Э е Э ср.
Характер изменения в периодах одинаков:
27.
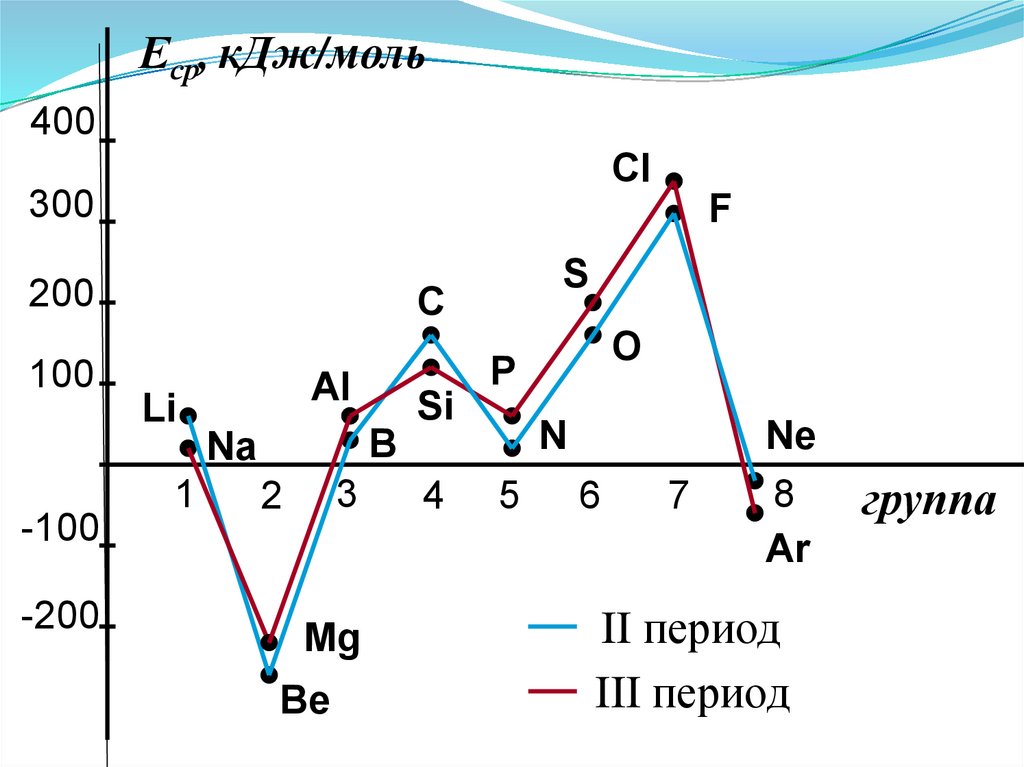
Еср, кДж/моль400
Cl
300
F
200
100
C
Al
Li
-200
1
Si
3
2
Mg
Be
4
O
P
N
B
Na
-100
S
5
6
7
Ne
8
Ar
II период
III период
группа
28.
Анализ изменения СЭ позволяет сделатьнекоторые выводы:
1. Min (отрицательное) СЭ наблюдается у
атомов, имеющих завершенные ns2 и ns2np6
подуровни.
2. Незначительно СЭ у атомов с конфигурацией
np3 (устойчивый наполовину заполненный
подуровень)
3. Мах СЭ обладают атомы 7(А) группы – ns2np5
29.
3. Электроотрицательность ( )[кДж/моль] или [эВ/атом] – характеризует
способность атома в химическом соединении
притягивать к себе электроны.
30.
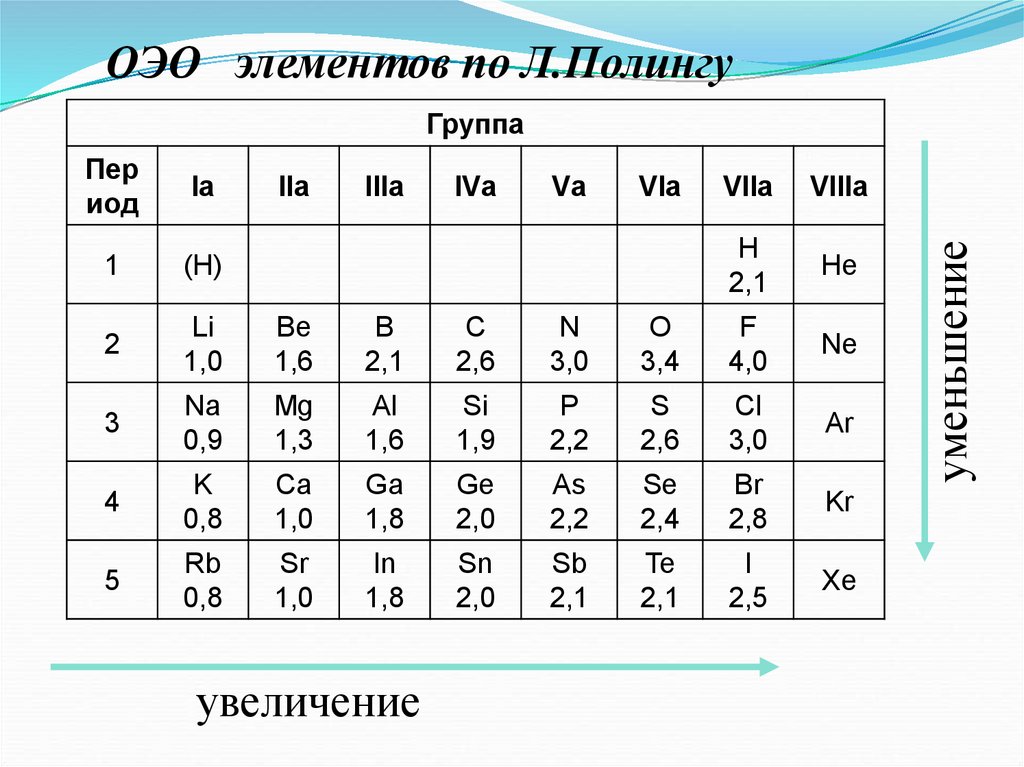
ОЭО элементов по Л.ПолингуПер
иод
Iа
1
(H)
2
Li
1,0
Be
1,6
B
2,1
С
2,6
N
3,0
3
Na
0,9
Mg
1,3
Al
1,6
Si
1,9
4
K
0,8
Ca
1,0
Ga
1,8
5
Rb
0,8
Sr
1,0
In
1,8
IIа
IIIа
увеличение
IVа
Vа
VIа
VIIа
VIIIа
H
2,1
He
O
3,4
F
4,0
Ne
P
2,2
S
2,6
Cl
3,0
Ar
Ge
2,0
As
2,2
Se
2,4
Br
2,8
Kr
Sn
2,0
Sb
2,1
Te
2,1
I
2,5
Xe
уменьшение
Группа























 Химия
Химия








