Похожие презентации:
Источники азота для синтеза аминокислот у человека и других организмов. Токсичность форм азота для человека. Аминокислоты
1.
Лекция 2Аминокислоты (продолжение)
Источники азота для синтеза аминокислот у
человека и других организмов
Токсичность форм азота для человека
2.
АМИНОКИСЛОТЫ3.
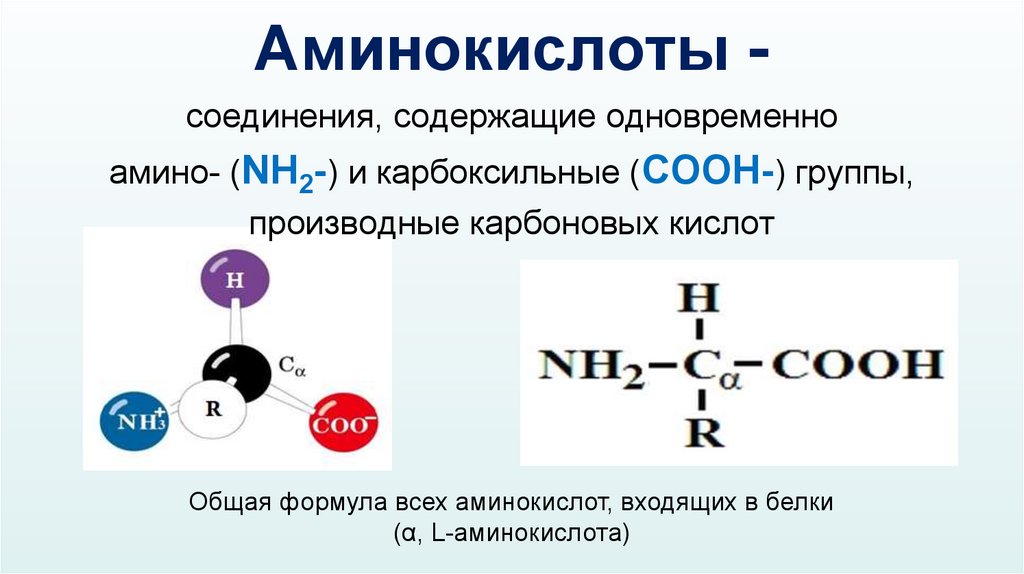
Аминокислоты соединения, содержащие одновременноамино- (NH2-) и карбоксильные (COOH-) группы,
производные карбоновых кислот
Общая формула всех аминокислот, входящих в белки
(α, L-аминокислота)
4.
Обозначения аминокислот• трехбуквенный код (на русском или английском)
аргинин – aрг (arg)
• однобуквенный код
аргинин – R
5.
Классификация аминокислот:1)
По химизму бокового радикала (алифатические, ароматические,
серусодержащие, гетероциклические …)
2)
По количеству СООН- (моноаминодикарбоновые) и NH2-групп
(диаминомонокарбоновые)
3)
По способности (или неспособности) к диссоциации бокового радикала
аминокислот (заряженные и не заряженные)
4)
По типу изомерии: α, ß и т.д. (по взаиморасположению СООН- и NH2групп); структурная изомерия (лей – илей), L- и D-изомеры
(энантиомеры)
5)
Белковые (протеиногенные) и небелковые
6)
Заменимые – незаменимые
6.
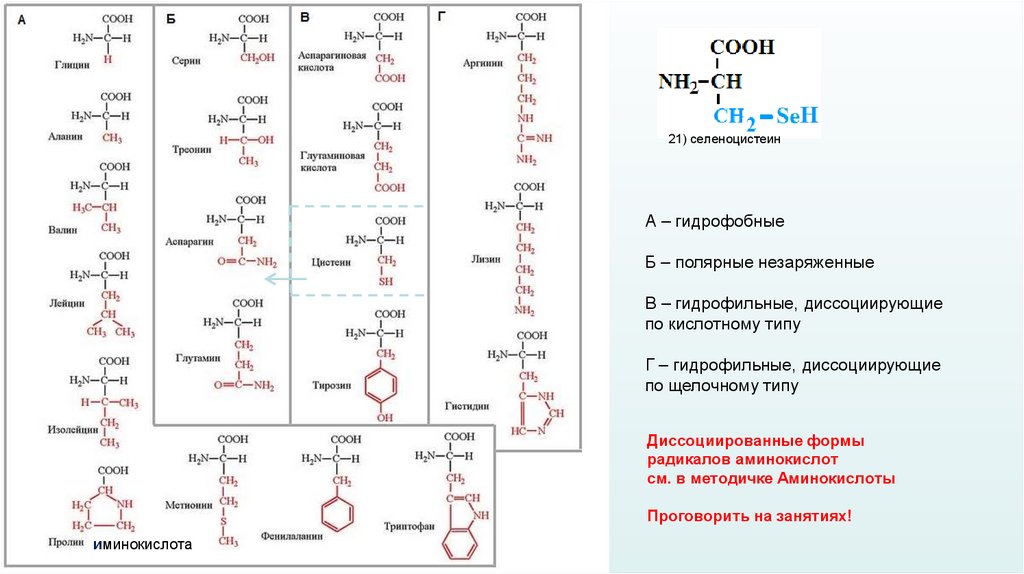
21) селеноцистеинА – гидрофобные
Б – полярные незаряженные
В – гидрофильные, диссоциирующие
по кислотному типу
Г – гидрофильные, диссоциирующие
по щелочному типу
Диссоциированные формы
радикалов аминокислот
см. в методичке Аминокислоты
Проговорить на занятиях!
иминокислота
7.
Диссоциация аминокислот в кислой и щелочной средеКислая среда
Щелочная среда
Заряды радикалов аминокислот важны для поддержания структуры белка
8.
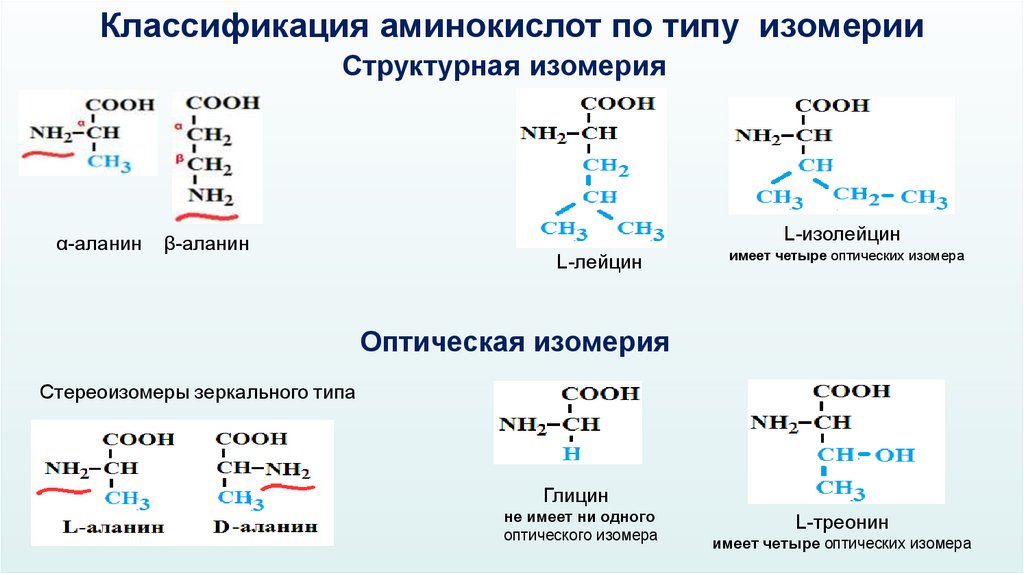
Классификация аминокислот по типу изомерииСтруктурная изомерия
α-аланин
β-аланин
L-изолейцин
L-лейцин
имеет четыре оптических изомера
Оптическая изомерия
Стереоизомеры зеркального типа
Глицин
не имеет ни одного
оптического изомера
L-треонин
имеет четыре оптических изомера
9.
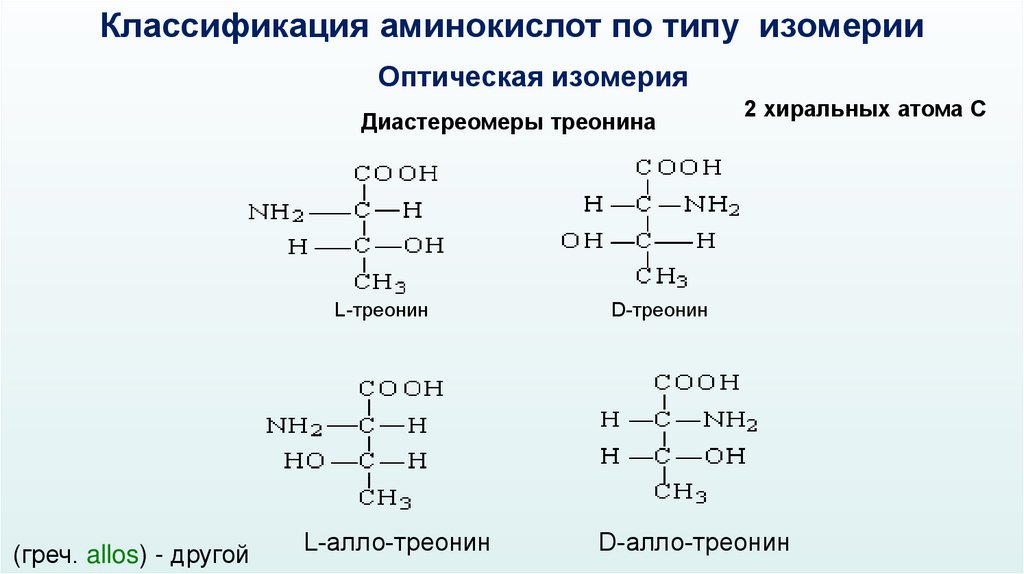
Классификация аминокислот по типу изомерииОптическая изомерия
Диастереомеры треонина
L-треонин
(греч. allos) - другой
L-алло-треонин
2 хиральных атома С
D-треонин
D-алло-треонин
10.
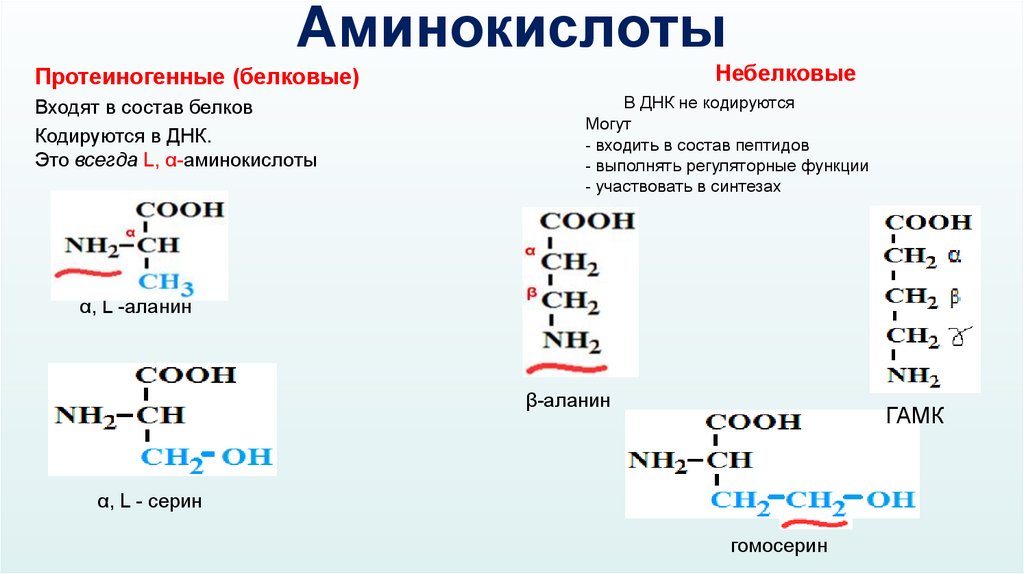
АминокислотыНебелковые
Протеиногенные (белковые)
Входят в состав белков
Кодируются в ДНК.
Это всегда L, α-аминокислоты
В ДНК не кодируются
Могут
- входить в состав пептидов
- выполнять регуляторные функции
- участвовать в синтезах
α, L -аланин
β-аланин
ГАМК
α, L - серин
гомосерин
11.
Небелковые аминокислотыОрнитин (похож на лизин)
Цитруллин (похож на аргинин)
D-фенилаланин и орнитин в пептидном
антибиотике грамицидине S, выделяемом
Bacilus brevis
12.
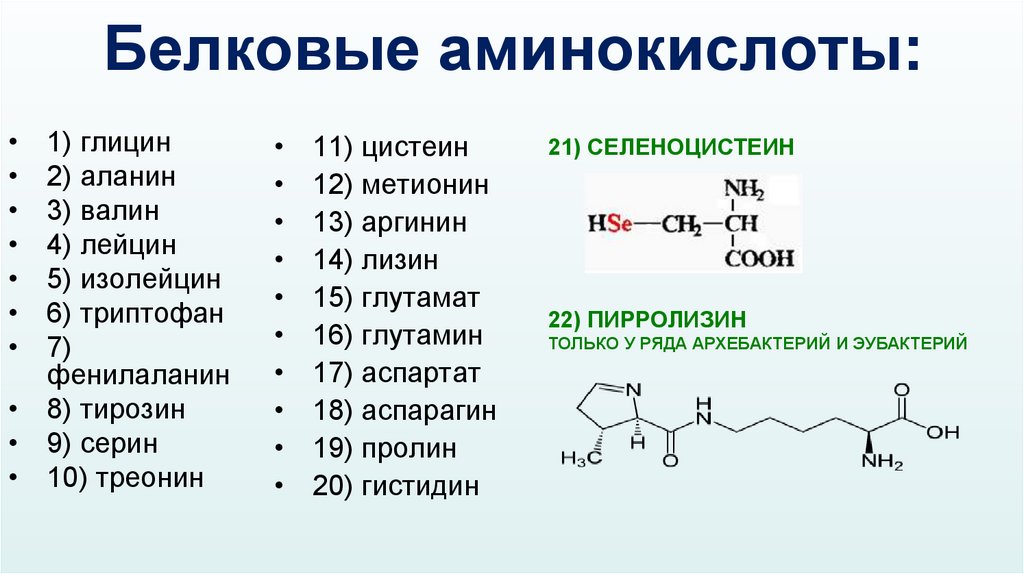
Белковые аминокислоты:1) глицин
2) аланин
3) валин
4) лейцин
5) изолейцин
6) триптофан
7)
фенилаланин
• 8) тирозин
• 9) серин
• 10) треонин
11) цистеин
12) метионин
13) аргинин
14) лизин
15) глутамат
16) глутамин
17) аспартат
18) аспарагин
19) пролин
20) гистидин
21) СЕЛЕНОЦИСТЕИН
22) ПИРРОЛИЗИН
ТОЛЬКО У РЯДА АРХЕБАКТЕРИЙ И ЭУБАКТЕРИЙ
13.
Зачем нужен селеноцистеин?Обеспечение функционирования
белков-селенопротеинов:
йодотиронин-йодиназа (монодейодиназа) – превращение гормона тироксина в
трийодтиронин
тиоредоксинредуктаза – антиоксидантная активность: восстанавливает глутатион
глутатионпероксидаза – антиоксидантная активность: защита против Н2О2 и других
пероксидов
14.
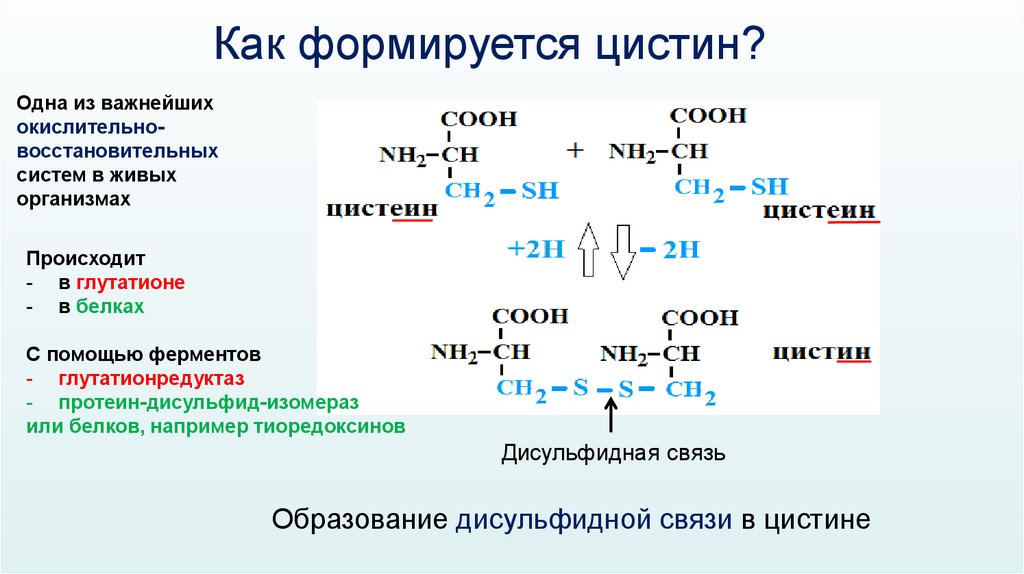
Как формируется цистин?Одна из важнейших
окислительновосстановительных
систем в живых
организмах
Происходит
- в глутатионе
- в белках
С помощью ферментов
- глутатионредуктаз
- протеин-дисульфид-изомераз
или белков, например тиоредоксинов
Дисульфидная связь
Образование дисульфидной связи в цистине
15.
Ферменты протеин-дисульфид-изомеразы,образуют цистин у эукариот в ЭПР
Тоже самое происходит при химической завивке волос
(разрушение и восстановление дисульфидных связей)
16.
Заменимые и незаменимые аминокислотыдля человека
Взрослый
организм
не нуждается
Селеноцистеин
Человек может синтезировать сам
Есть необходимые ферменты
Человек НЕ может синтезировать сам
Нет ферментов
Должен поглощать с пищей
НО: для птиц незаменим глицин…
17.
Суточная минимальная потребность в незаменимыхаминокислотах для человека
Дополнительная информация
18.
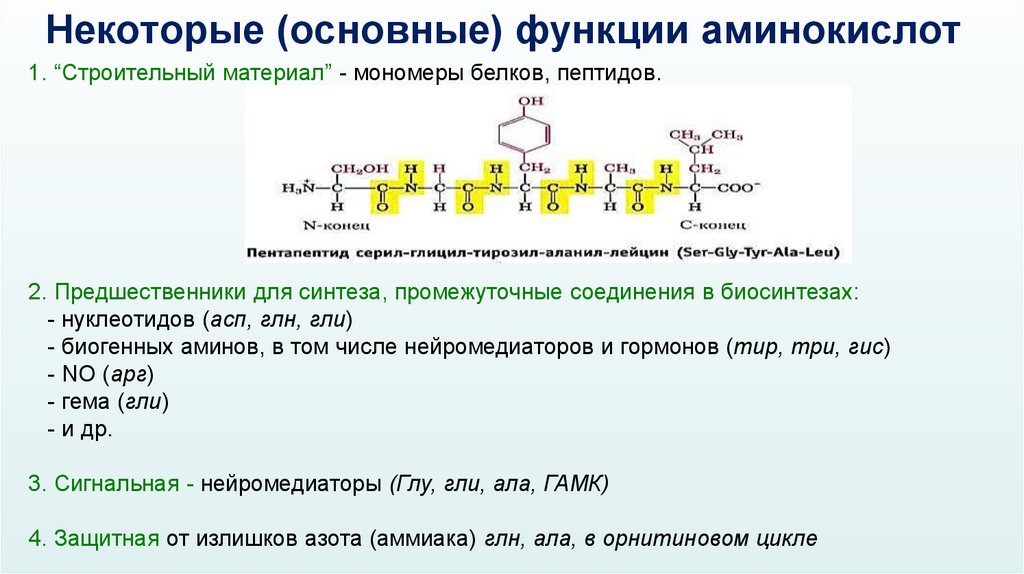
Некоторые (основные) функции аминокислот1. “Строительный материал” - мономеры белков, пептидов.
2. Предшественники для синтеза, промежуточные соединения в биосинтезах:
- нуклеотидов (асп, глн, гли)
- биогенных аминов, в том числе нейромедиаторов и гормонов (тир, три, гис)
- NO (арг)
- гема (гли)
- и др.
3. Сигнальная - нейромедиаторы (Глу, гли, ала, ГАМК)
4. Защитная от излишков азота (аммиака) глн, ала, в орнитиновом цикле
19.
Вопросы для подготовки к контрольной работе 1 “Аминокислоты”1. Формулы 21 белковой (протеиногенной) аминокислоты, включая селеноцистеин (пирролизин
можно не заучивать). См. методичку!!! Уметь указать свойства их боковых радикалов. Знать
формулы цистина и небелковых аминокислот β-аланина, орнитина, цитруллина, оксипролина,
гомосерина (см. методичку).
2. Физико-химические свойства аминокислот: способность к оптической изомерии, характер
диссоциации боковых радикалов и связанная с ним классификация аминокислот. Уметь определять
по заданной формуле, к D- или L-ряду принадлежит аминокислота. Знать оптически неактивную
аминокислоту.
3. Незаменимые аминокислоты (понятие, уметь перечислить незаменимые для человека
аминокислоты).
4. Качественные реакции на аминокислоты и белки, химизм и алгоритм действий: биуретовая,
ксантопротеиновая, нингидриновая реакции; реакция обнаружения серы в белках, реакции
осаждения (лабораторное занятие 1).
5. Первичная структура белков и пептидов. Уметь написать трипептид из предложенных
аминокислот и указать пептидные связи (лабораторное занятие 1).
20.
Зачем нам азот?Азот входит в
-
аминокислоты и белки
-
нуклеотиды и нуклеиновые кислоты
-
аминированные сахара (гексозоаминогликаны, мономеры строительных полисахаридов
(гиалуроновая кислота, кератан-, хондроитинсульфаты, гепарин и др.)
-
аминоспирты (сфингозин)
Азот во все эти молекулы приходит из аминокислот
Синтез аминокислот у всех живых организмов начинается с реакции
прямого восстановительного аминирования
α-кетоглутаровой кислоты
21.
Распределение азота в биосфере (млн тонн)N2 в атмосфере 78%
В живых организмах
азот в основном находится в
связанном виде в
+ ОЧЕНЬ небольшое
количество свободного
аммиака
Животные получают азот уже
в виде готовых органических
соединений с пищей
из растений или других
животных
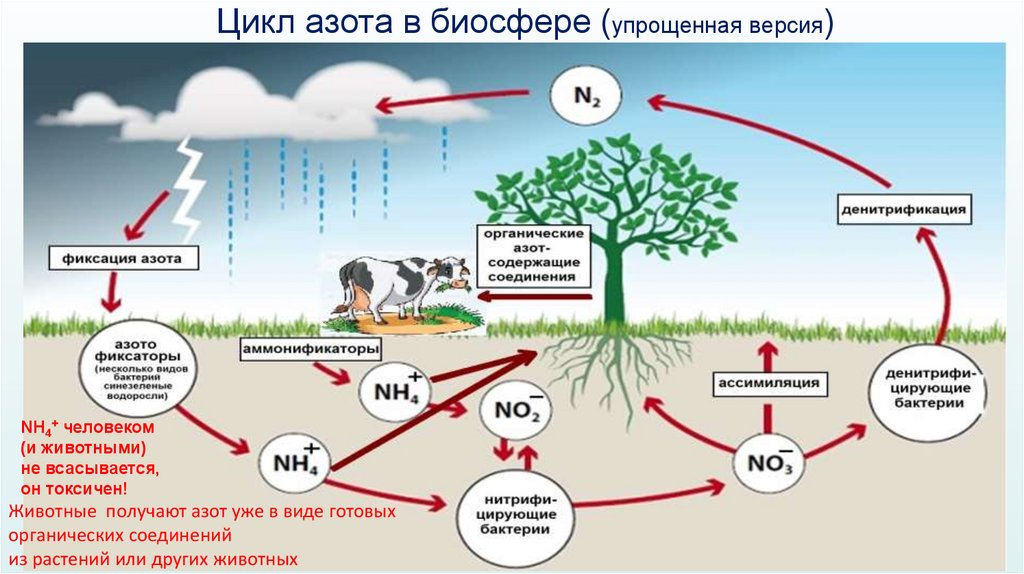
22.
Цикл азота в биосфере (упрощенная версия)NH4+ человеком
(и животными)
не всасывается,
он токсичен!
Животные получают азот уже в виде готовых
органических соединений
из растений или других животных
23.
Биологическая фиксация молекулярного азота воздухаАзотофиксирующие организмы
БАКТЕРИИ - диазотрофы:
- свободноживущие
рр. Azotobacter, Clostridium,
все фотосинтезирующие,
ряд архебактерий
Azotobacter
- в симбиозе или ассоциации с растениями
рр. Rhizobium, Azospirillum и др.
- в кишечнике животных
р. Кlebsiella
60% N в теле термита – продукт азотфиксации
бактерий пищеварительного тракта
Rhizobium на люпине
24.
Промышленное получение аммиакаФриц Габер в 1918, Карл Бош в 1931
получили нобелевские премии и за создание
технологии промышленного получения аммиака
+5000С, 300-350 атм.
25.
26.
Животные получают азот уже в виде готовых органическихсоединений с пищей из растений или других животных
Синтез аминокислот у всех живых организмов начинается с реакции
прямого восстановительного аминирования
α-кетоглутаровой кислоты
Далее синтезируются:
аминокислоты и белки, нуклеотиды и нуклеиновые кислоты, аминированные сахара, аминоспирты
Животные и человек аминогруппы получает в этих соединениях с пищей
27.
Растения могутполучать NH3 из нитратов
Нитратредуктаза
восстанавливает нитраты до нитритов
Нитритредуктаза
восстанавливает нитриты до аммиака
ферредоксин
28.
Опасность нитратов и нитритов для человекаТОКСИЧНОСТЬ
Первичная - самого нитрат-иона;
Вторичная - нитрит-иона,
Третичная – действие нитрозаминов, образовавшихся из нитритов.
Кроме того, при метаболизме нитратов в организме возникает NO,
обладающий сигнальным действием.
Источники нитратов и нитритов:
- Пищевые красители (розовая колбаса)
- Загрязнение окружающей среды
- Овощи и фрукты
29.
Уровень накопления нитратов в овощахCодержание
нитратов
Виды овощных культур
Низкое
Горох, томаты, сладкий стручковый перец, чеснок, картофель, репчатый лук,
поздняя морковь
10-150 мг/кг
Среднее
150-700 мг/кг
Высокое
700-1500 мг/кг
Максимальное
1500-4000 мг/кг
Огурцы, поздняя белокочанная капуста, зеленый лук в открытом грунте,
тыква, кабачки, патиссоны, лук-порей, щавель, ранняя морковь,
корнеплоды петрушки, лук-батун, цветная капуста (осенью)
Ранняя цветная и белокочанная капуста, столовая свекла, капуста брокколи,
корневой сельдерей, брюква, кольраби, ревень, репа, хрен, редис и
редька в открытом грунте, зеленый лук в защищенном грунте.
Салат, пекинская капуста, мангольд (листовая свекла), шпинат, укроп, редис в
защищенном грунте, листья столовой свеклы и петрушки, листовой
сельдерей.
30.
Действие нитратовДля взрослых острое отравление наступает при попадании в организм 1-4 г нитратов
(из 1 кг зелени),
Смертельно 8-14 г нитратов
1. Способствуют развитию патогенной кишечной микрофлоры
2. Снижают содержание витаминов в пище
3. У беременных женщин возникают выкидыши
4. При длительном поступлении в организм уменьшается количество йода, что
приводит к увеличению щитовидной железы
31.
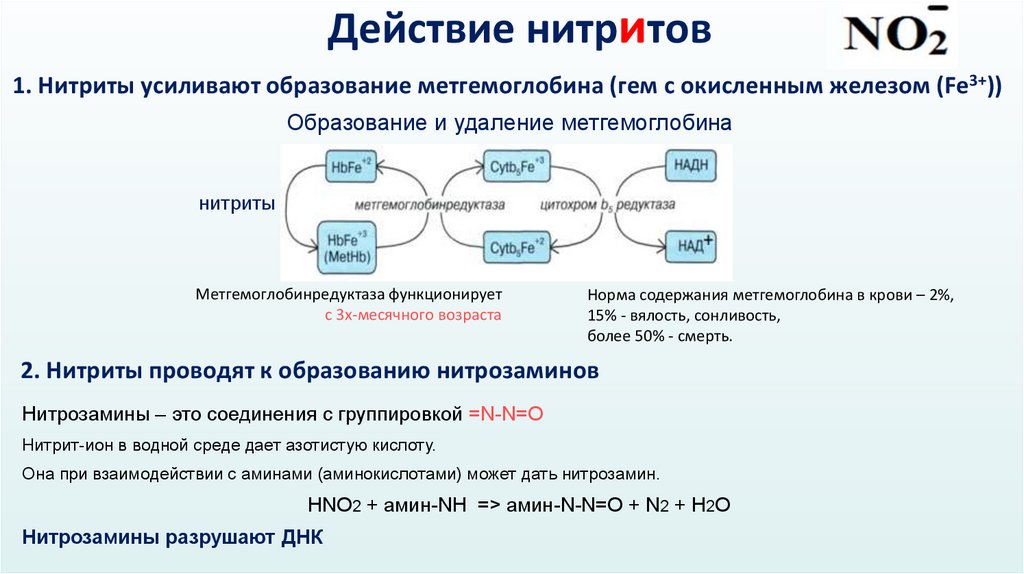
Действие нитритов1. Нитриты усиливают образование метгемоглобина (гем с окисленным железом (Fe3+))
Образование и удаление метгемоглобина
нитриты
Метгемоглобинредуктаза функционирует
с 3х-месячного возраста
Норма содержания метгемоглобина в крови – 2%,
15% - вялость, сонливость,
более 50% - смерть.
2. Нитриты проводят к образованию нитрозаминов
Нитрозамины – это соединения с группировкой =N-N=O
Нитрит-ион в водной среде дает азотистую кислоту.
Она при взаимодействии с аминами (аминокислотами) может дать нитрозамин.
НNO2 + амин-NH => амин-N-N=O + N2 + H2O
Нитрозамины разрушают ДНК
32.
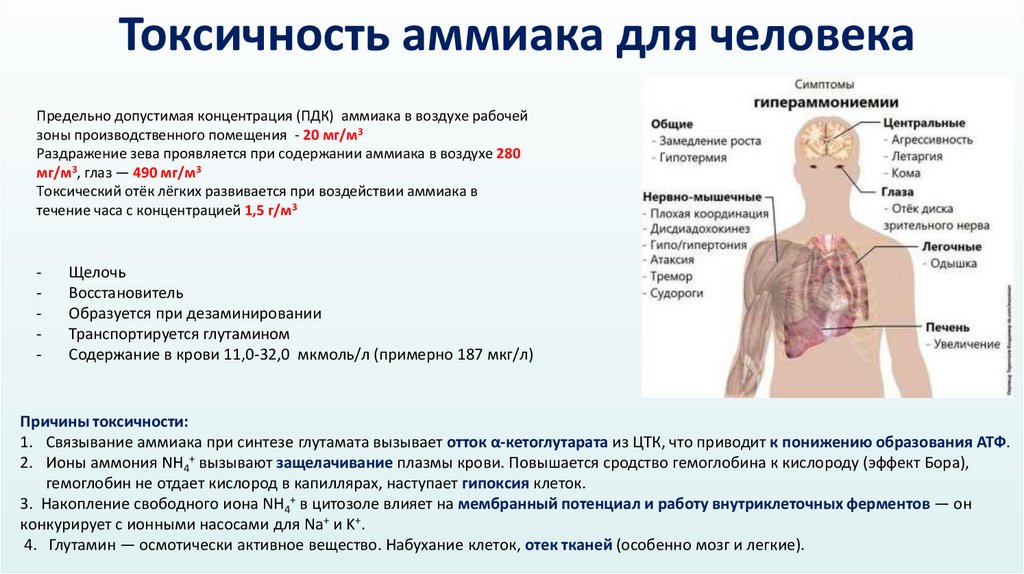
Токсичность аммиака для человекаПредельно допустимая концентрация (ПДК) аммиака в воздухе рабочей
зоны производственного помещения - 20 мг/м3
Раздражение зева проявляется при содержании аммиака в воздухе 280
мг/м3, глаз — 490 мг/м3
Токсический отёк лёгких развивается при воздействии аммиака в
течение часа с концентрацией 1,5 г/м3
-
Щелочь
Восстановитель
Образуется при дезаминировании
Транспортируется глутамином
Содержание в крови 11,0-32,0 мкмоль/л (примерно 187 мкг/л)
Причины токсичности:
1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из ЦТК, что приводит к понижению образования АТФ.
2. Ионы аммония NH4+ вызывают защелачивание плазмы крови. Повышается сродство гемоглобина к кислороду (эффект Бора),
гемоглобин не отдает кислород в капиллярах, наступает гипоксия клеток.
3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов — он
конкурирует с ионными насосами для Na+ и K+.
4. Глутамин — осмотически активное вещество. Набухание клеток, отек тканей (особенно мозг и легкие).
33.
Подготовка с семинарскомузанятию
1. Физико-химические свойства аминокислот
(проговорить D и L изомерию, диссоциацию, уметь писать для разных
аминокислот)
2. Уметь составлять пептид из нескольких аминокислот
3.
Токсичность форм азота для человека. Типы токсичности.
Источники в организме человека (внутренние и внешние).
34.
Дополнительные материалы35.
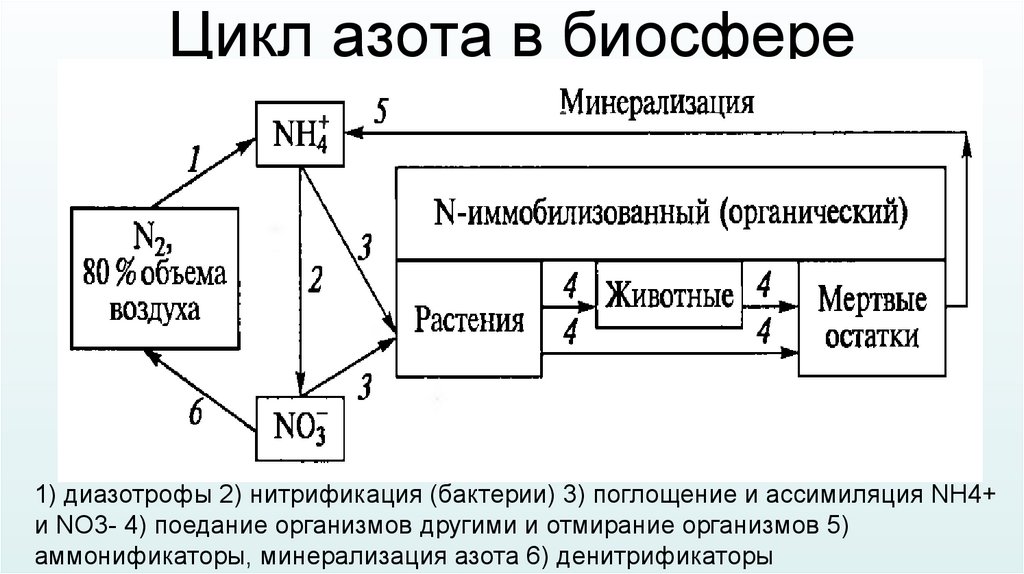
Цикл азота в биосфере1) диазотрофы 2) нитрификация (бактерии) 3) поглощение и ассимиляция NH4+
и NO3- 4) поедание организмов другими и отмирание организмов 5)
аммонификаторы, минерализация азота 6) денитрификаторы
36.
37.
Нитрозамины нарушают ДНК38.
Опасность нитратов и нитритов длячеловека
Рекомендации ВОЗ - в сутки не более 3,7 мг нитратов
на 1 кг массы тела, нитритов – 0,2 мг на кг (именно по
аниону),
250 мг нитратов, безопасных для условного едока
массой в 70 кг = 350 мг NaNO3
Нормы в Германии 50-100 мг в сутки,
в большинстве стран СНГ – 300-320 мг
в США – 400-500 мг.
39.
Проблема нитратов в пищеУправление Роспотребнадзора по
Нижегородской области, 2018:
превышение по нитратам из 2000
взятых проб – в 12 . Снято с
реализации несколько партий
плодоовощной продукции объемом
свыше 3 тонн.
Следует приобретать плодоовощную продукцию только в специально оборудованных и отведенных для этих целей органами
местного самоуправления местах уличной торговли (при этом на вывеске должно быть указано наименование предприятия, его
юридический адрес, ФИО индивидуального предпринимателя, продавец должен находиться в чистой санитарной одежде и
иметь при себе бейджик с указанием ФИО и личную медицинскую книжку), а также на организованных рынках, ярмарках и в
стационарной торговой сети.
40.
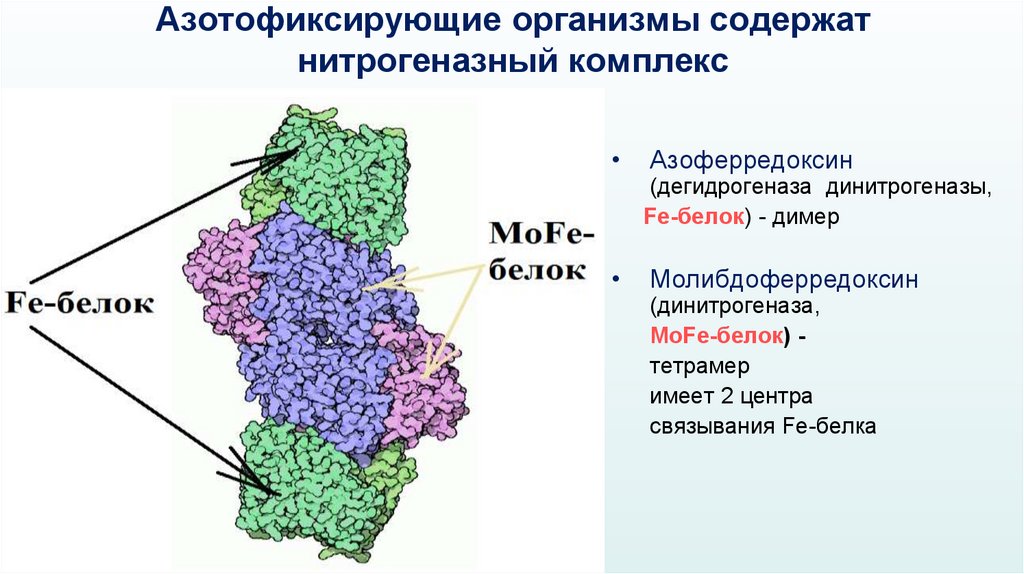
Азотофиксирующие организмы содержатнитрогеназный комплекс
Азоферредоксин
(дегидрогеназа динитрогеназы,
Fe-белок) - димер
Молибдоферредоксин
(динитрогеназа,
MoFe-белок) тетрамер
имеет 2 центра
связывания Fe-белка
41.
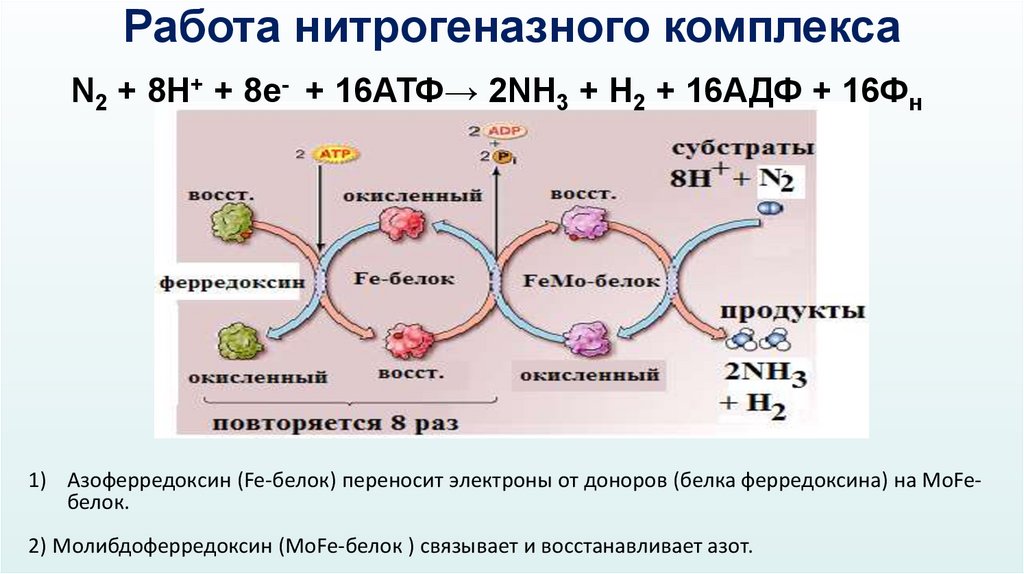
Работа нитрогеназного комплексаN2 + 8H+ + 8e- + 16АТФ→ 2NH3 + H2 + 16АДФ + 16Фн
1) Азоферредоксин (Fe-белок) переносит электроны от доноров (белка ферредоксина) на MoFeбелок.
2) Молибдоферредоксин (MoFe-белок ) связывает и восстанавливает азот.
42.
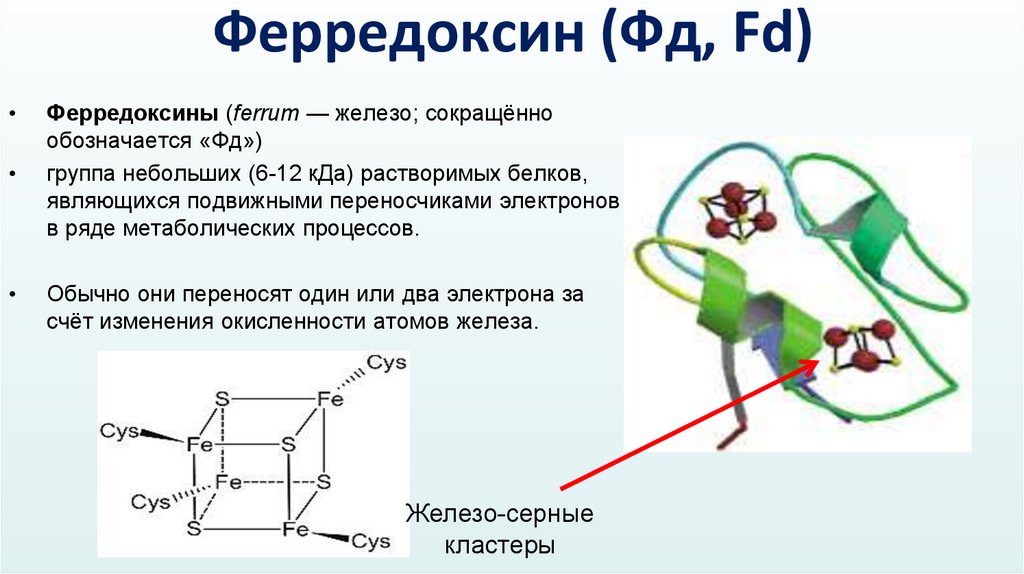
Ферредоксин (Фд, Fd)Ферредоксины (ferrum — железо; сокращённо
обозначается «Фд»)
группа небольших (6-12 кДа) растворимых белков,
являющихся подвижными переносчиками электронов
в ряде метаболических процессов.
Обычно они переносят один или два электрона за
счёт изменения окисленности атомов железа.
Железо-серные
кластеры


























 Биология
Биология








