Похожие презентации:
Типы химической связи. Урок химии в 11 классе
1. \ Типы химической связи.
Урок химии в 11 классе\
Типы химической связи.
Учитель МАОУ СОШ № 11:
Чугайнова В.С.
2. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы
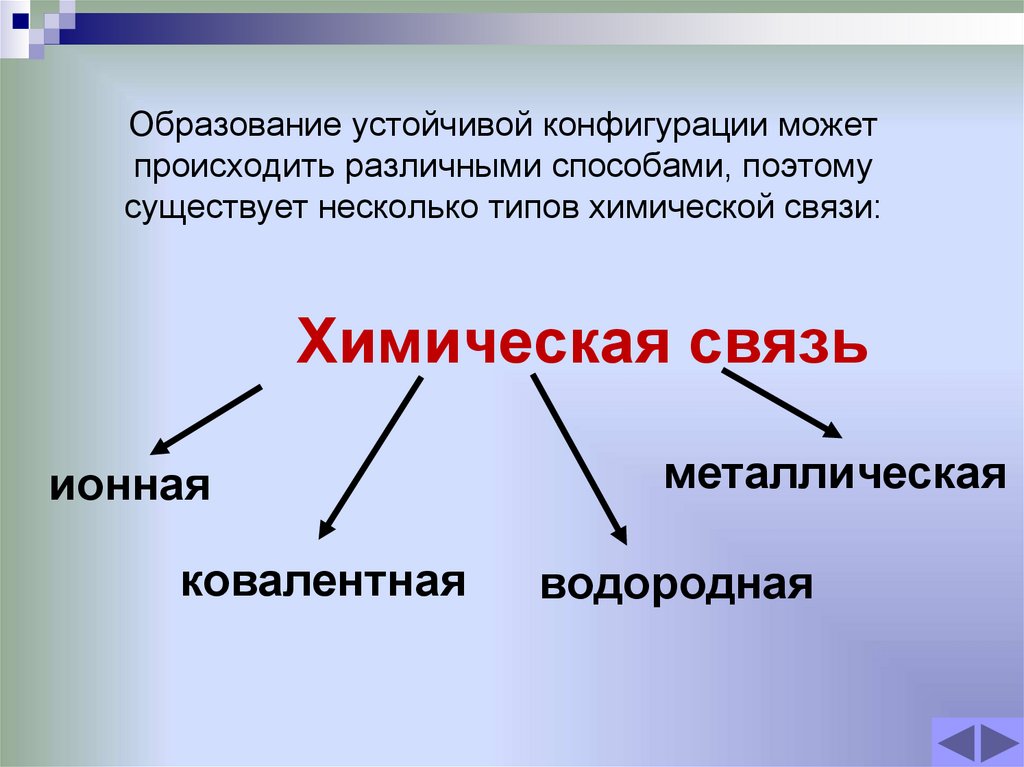
3. Образование устойчивой конфигурации может происходить различными способами, поэтому существует несколько типов химической
связи:Химическая связь
ионная
ковалентная
металлическая
водородная
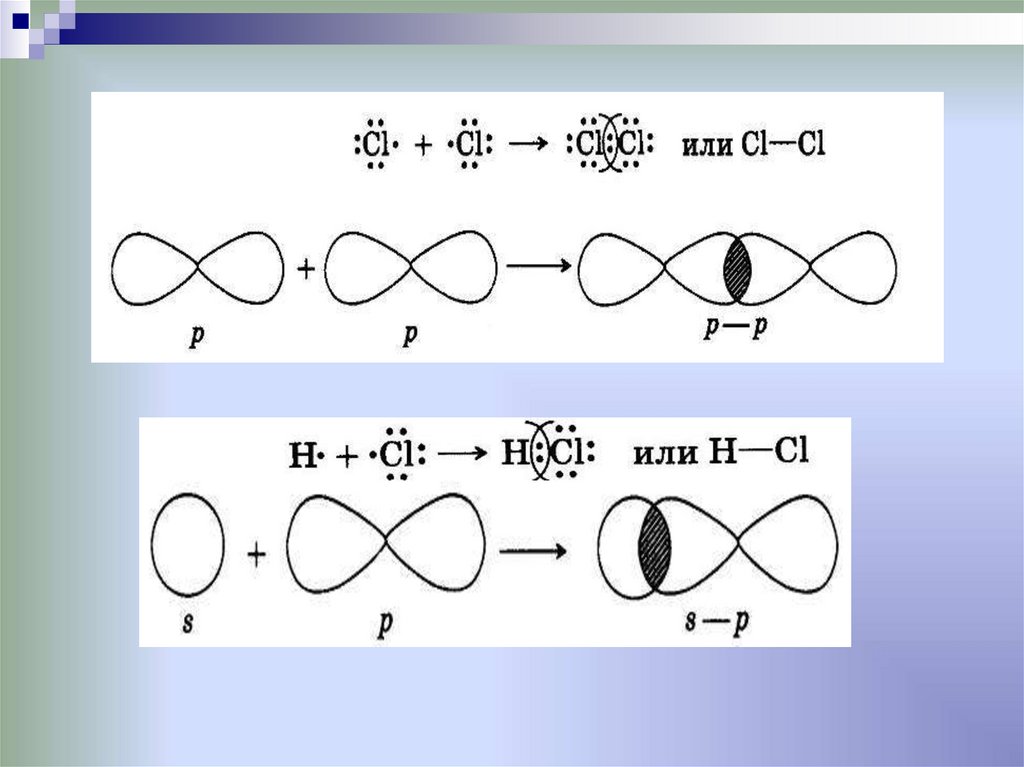
4. Ковалентная химическая связь
это связь, возникающая между атомами за счетобразования общих электронных пар
Механизм образования связи:
• Обменный
•Донорно-акцепторный
5.
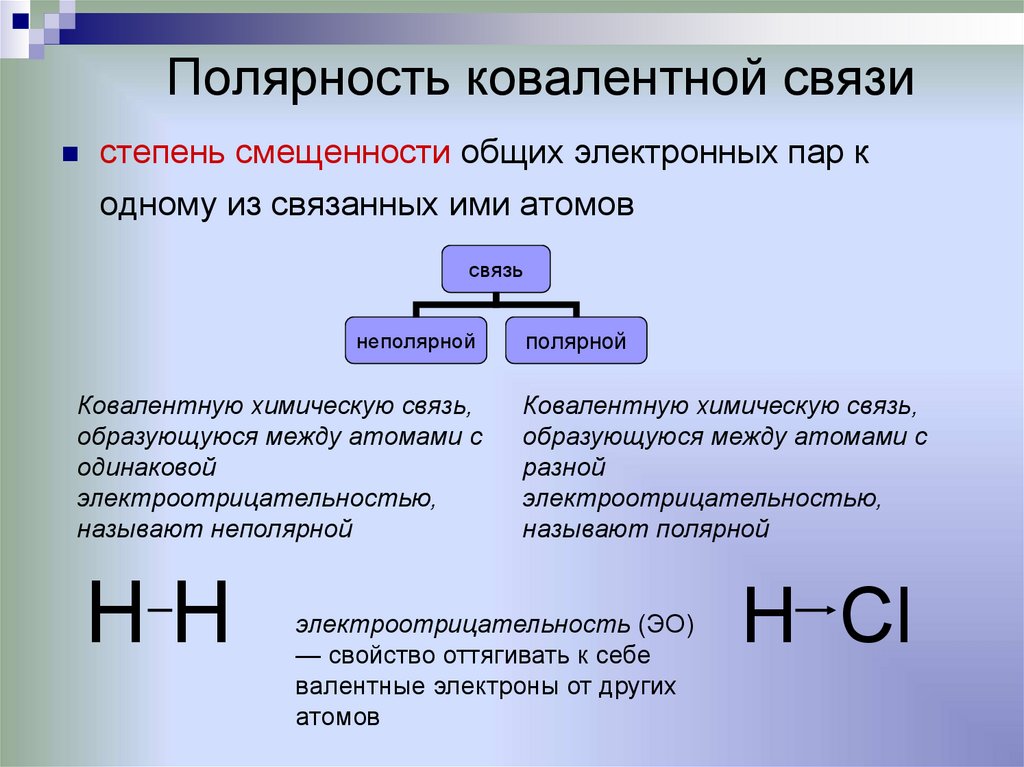
6. Полярность ковалентной связи
степень смещенности общих электронных пар кодному из связанных ими атомов
связь
неполярной
Ковалентную химическую связь,
образующуюся между атомами с
одинаковой
электроотрицательностью,
называют неполярной
HH
полярной
Ковалентную химическую связь,
образующуюся между атомами с
разной
электроотрицательностью,
называют полярной
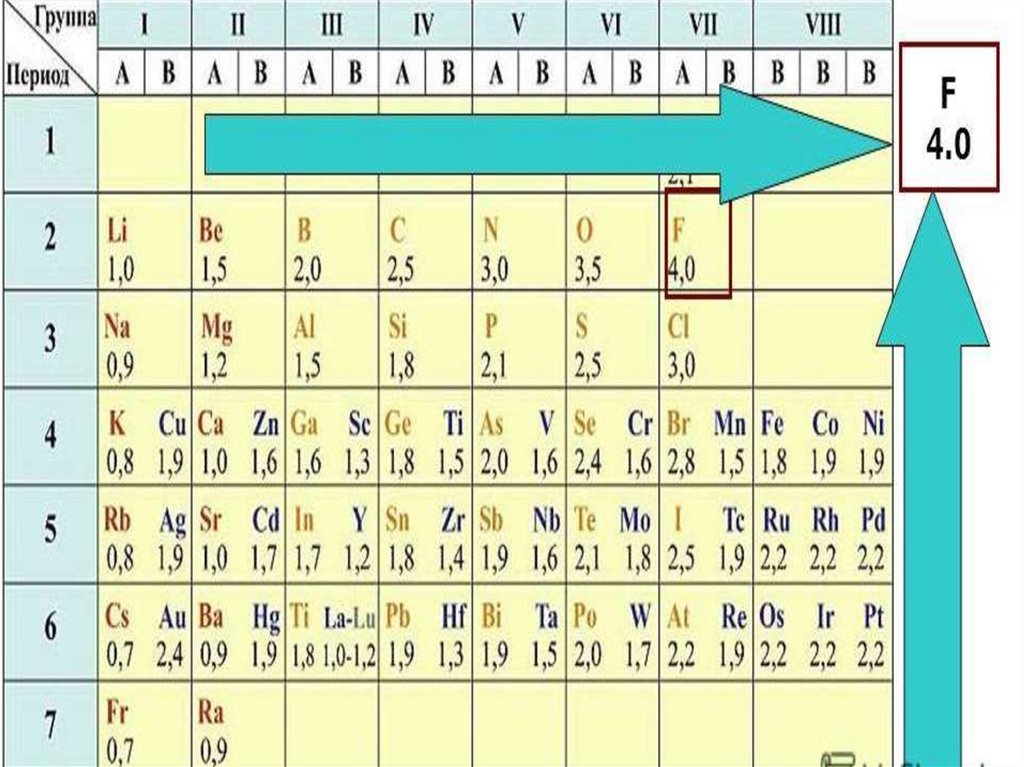
электроотрицательность (ЭО)
— свойство оттягивать к себе
валентные электроны от других
атомов
H Сl
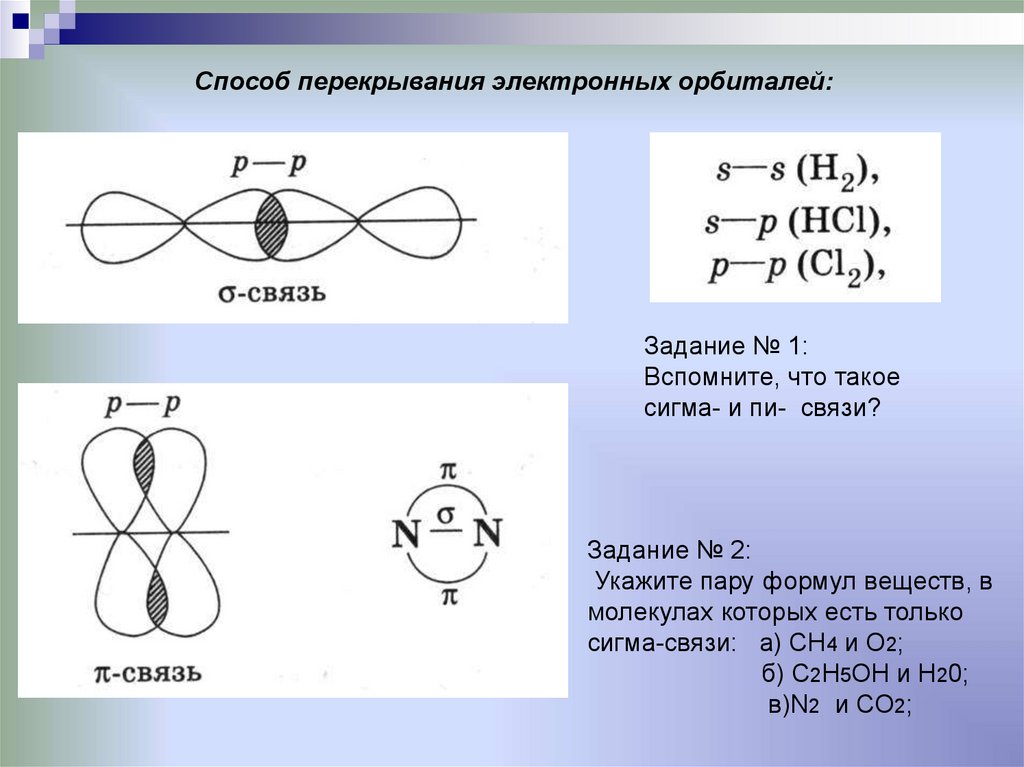
7. Способ перекрывания электронных орбиталей:
Задание № 1:Вспомните, что такое
сигма- и пи- связи?
Задание № 2:
Укажите пару формул веществ, в
молекулах которых есть только
сигма-связи: а) СН4 и О2;
б) С2Н5ОН и Н20;
в)N2 и CO2;
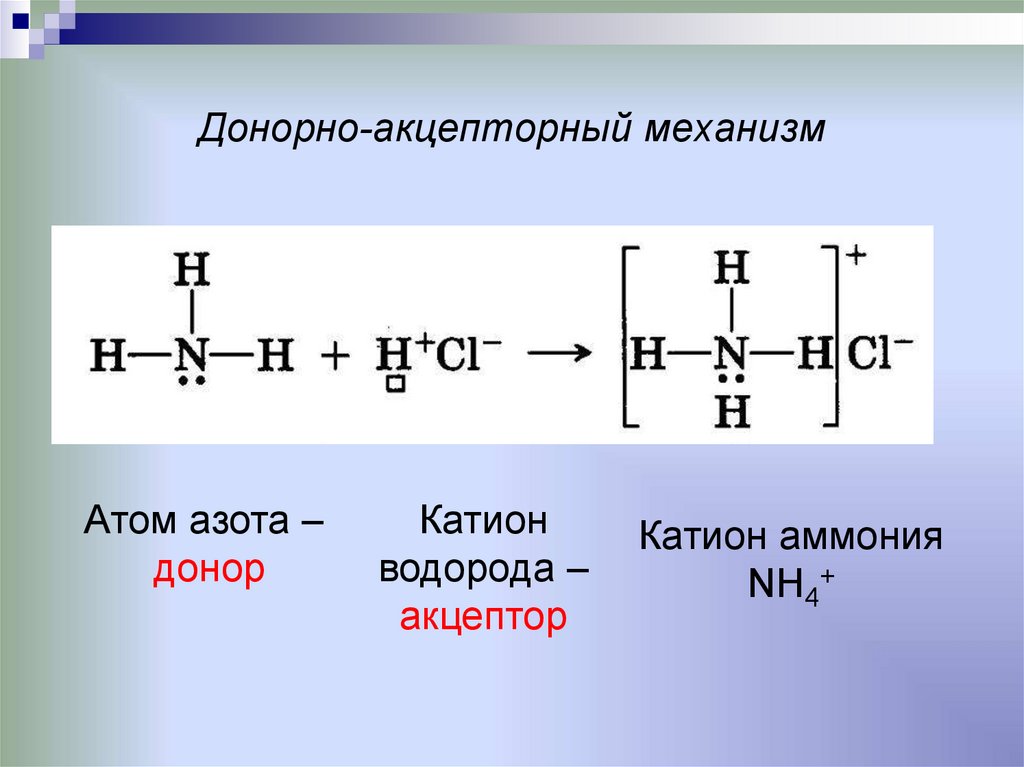
8. Донорно-акцепторный механизм
Атом азота –донор
Катион
водорода –
акцептор
Катион аммония
NH4+
9. Характеристики ковалентной связи
1.Длина связи (нм)2.Энергия связи (кДж/моль)
3.Полярность связи
4.Поляризуемость связи
5.Направленность
6. Насыщаемость
7. Кратность.
10.
Длина связимежъядерное расстояние (нм)Энергия связиколичество энергии, которое необходимо
для разрыва связи (кДж/моль)
11.
Насыщенность связиСпособность атомов образовыватьограниченное число ковалентных связей
Направленность связиОбуславливает пространственную структуру
молекул, т.е. их геометрию.
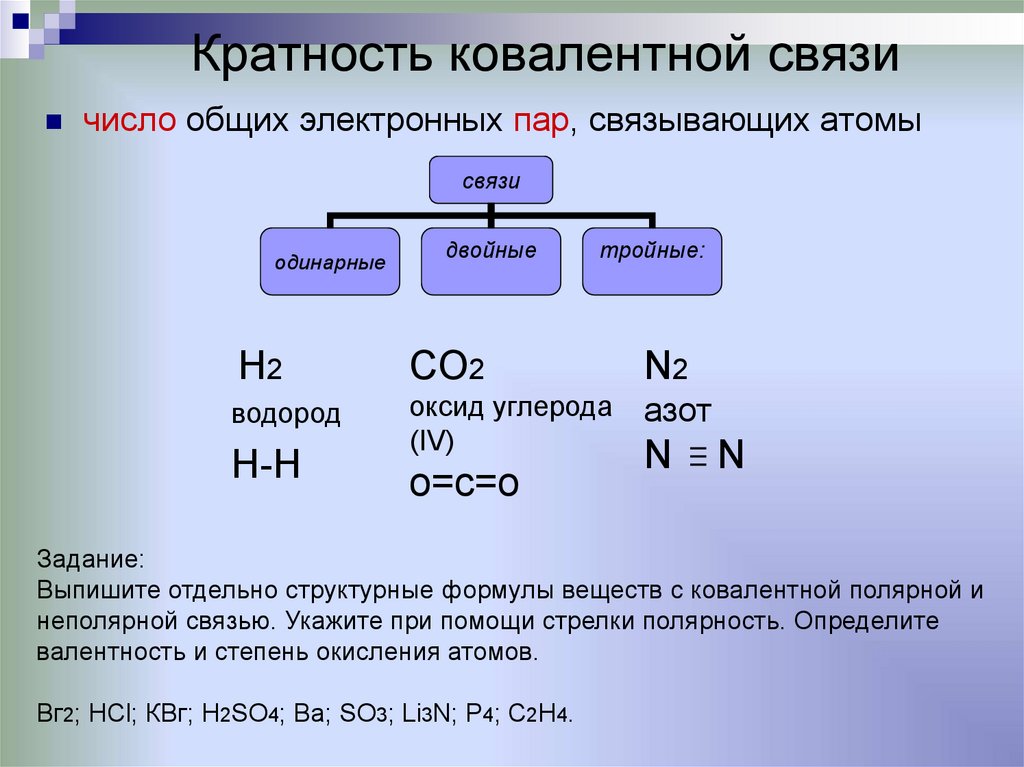
12. Кратность ковалентной связи
число общих электронных пар, связывающих атомысвязи
одинарные
двойные
тройные:
H2
CO2
N2
водород
оксид углерода
(IV)
азот
H-H
о=с=о
N
N
Задание:
Выпишите отдельно структурные формулы веществ с ковалентной полярной и
неполярной связью. Укажите при помощи стрелки полярность. Определите
валентность и степень окисления атомов.
Вг2; НСl; КВг; H2SO4; Ba; SO3; Li3N; P4; C2H4.
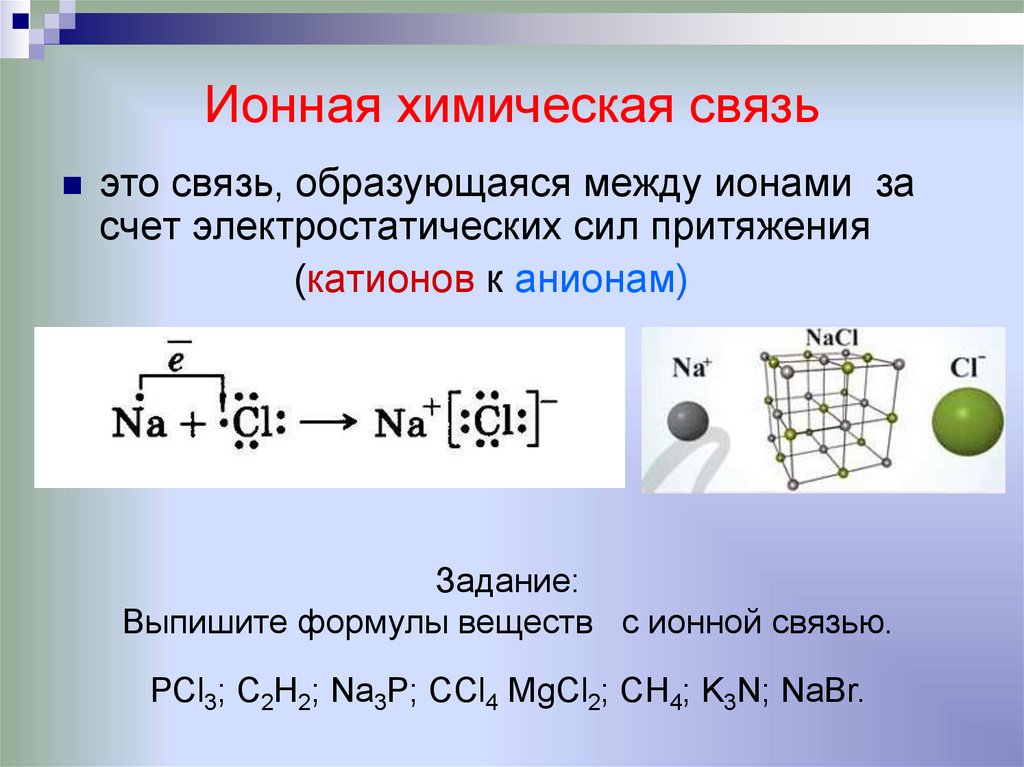
13. Ионная химическая связь
это связь, образующаяся между ионамисчет электростатических сил притяжения
(катионов к анионам)
за
Задание:
Выпишите формулы веществ с ионной связью.
РСl3; С2Н2; Na3P; ССl4 MgCl2; СН4; K3N; NaBr.
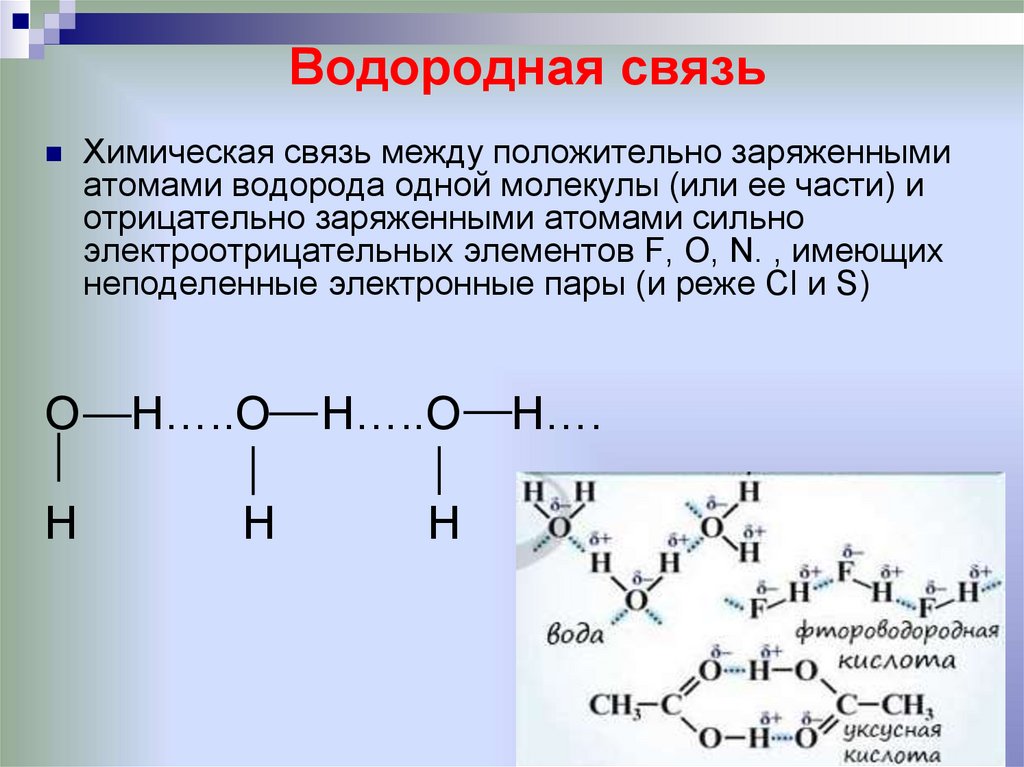
14. Водородная связь
Химическая связь между положительно заряженнымиатомами водорода одной молекулы (или ее части) и
отрицательно заряженными атомами сильно
электроотрицательных элементов F, О, N. , имеющих
неподеленные электронные пары (и реже Сl и S)
O
H…..O
H…..O
H
H
H
H….
15. Металлическая связь
связь в металлах и сплавах, которуювыполняют относительно свободные
электроны между ионами металлов в
металлической кристаллической решетке
Схема образования металлической связи:
о
М — пе
п+
М
Задание:
Выпишите формулы веществ, в которых присутствует металлическая и
водородная связи
Na, KF, NH3, C2H2, CH3-COOH, H2S, Al, NaCl.
16. Самостоятельная работа
Определите типы химических связеймежду атомами в веществах.
CaВг2; НСl; К; H2SO3; BaO;
SO2; LiNО3; S2; C2H2; Na; HCОOК.
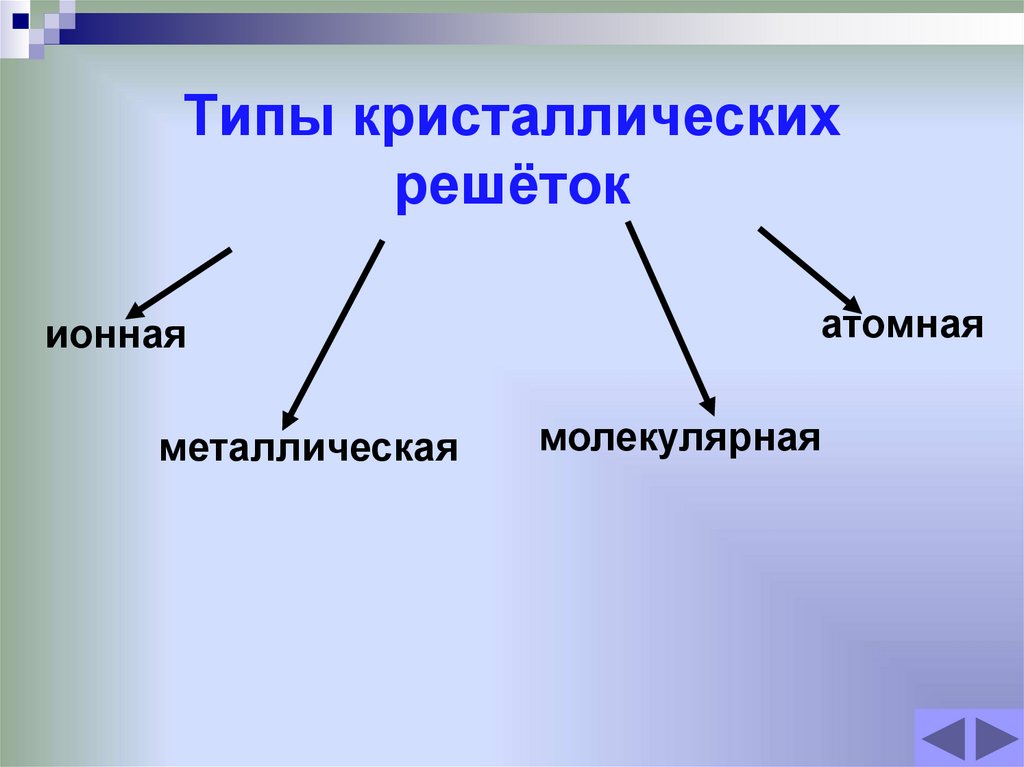
17. Типы кристаллических решёток
ионнаяметаллическая
атомная
молекулярная
18. Атомная кристаллическая решётка.
В её узлах находятся атомы.Характерна для веществ с ковалентной связью( алмаз,
графит, бор, кристаллический кремний, карборунд,
кварц, некоторые оксиды, карбиды, силициды.)
Вещества с атомной кристаллической решёткой
твёрдые, тугоплавкие, нелетучие, нерастворимы в воде.
19. Ионная кристаллическая решётка
В её узлах находятся ионы.Характерна для веществ с ионной связью
(щёлочи, соли, некоторые оксиды, гидриды
активных металлов.)
Вещества с ионной кристаллической решёткой
тугоплавкие, нелетучие, твёрдые, но хрупкие,
многие растворимы, в расплавах и растворах
проводят электрический ток.
+
-
+
-
+
-
+
-
+
20. Металлическая кристаллическая решётка.
В её узлах находятся отдельные атомы и положительныеионы , между которыми существует металлическая связь за
счёт обобществлённых электронов.
Характерна для всех металлов и сплавов (кроме Hg )
Вещества с металлической кристаллической решёткой
обладают физическими свойствами: металлический блеск,
тепло- и электропроводность, ковкость и пластичность,
высокая прочность, плотность, температура плавления и
кипения.
+
+
+
+
+
21. Молекулярная кристаллическая решётка.
В её узлах находятся молекулы.Характерна для веществ с ковалентной полярной и
неполярной связью( большинство неметаллов, а также
органические и неорганические вещества в твёрдом
состоянии.)
Вещества с молекулярной кристаллической решёткой
обладают: летучестью, хрупкостью в кристаллическом
виде, низкие температуры плавления и кипения,
растворимость в воде и электропроводность растворов
зависит от полярности связей.
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
22. Решение упражнений:
Даны вещества: CH3COOH, C2H2, NF3, S8, C2H4NH4Cl, NaNO3 , СО, Н2O2 , H2О, SO2 SO3, BeCl2 Р4,
CH3COONa, O3 , C6H6 N2 Cu, CO2 NH3,
С (алмаз), BaO2, бутадиен-1,3, [CH3NH3]Cl, Р(красн).
1. Какие виды химической связи присутствуют в веществах?
2. Определите вещества, в которых присутствуют π-связи.
3. В каких веществах присутствуют по 2 π-связи.
4.В каких веществах ковалентная связь образована по
донорно-акцепторному механизму?
5. В каких веществах молекулы связаны водородными
связями?
6. Определите тип кристаллической решетки.
23. Характеристики ковалентной связи
1. Наибольшей полярностью характеризуется связь междуатомами
1) S-Cl
2) Na -Cl
3) С-Cl
4) Cl-Cl
2. Наибольшая длина связи между атомами:
1) С - H
2) N - H
3) Br - H
4) O - H
3. Наибольшей полярностью обладает связь между атомами
1) Si-H
2) P - H
3) S - H
4) Cl - H
4. Акцептором электронной пары является частица:
1) F2) H+
3) S24) NH3
5. Донором электронной пары является частица:
1) F2) H+
3) S24) NH3
6. В какой молекуле связь характеризуется наибольшей энергией:
1) C2H4
2) C2H2
3) C2H6
4) CH4















 Химия
Химия








