Похожие презентации:
Химические реакции: их виды
1.
ХИМИЧЕСКИЕ РЕАКЦИИ:ИХ ВИДЫ
Исаева О.С.
2.
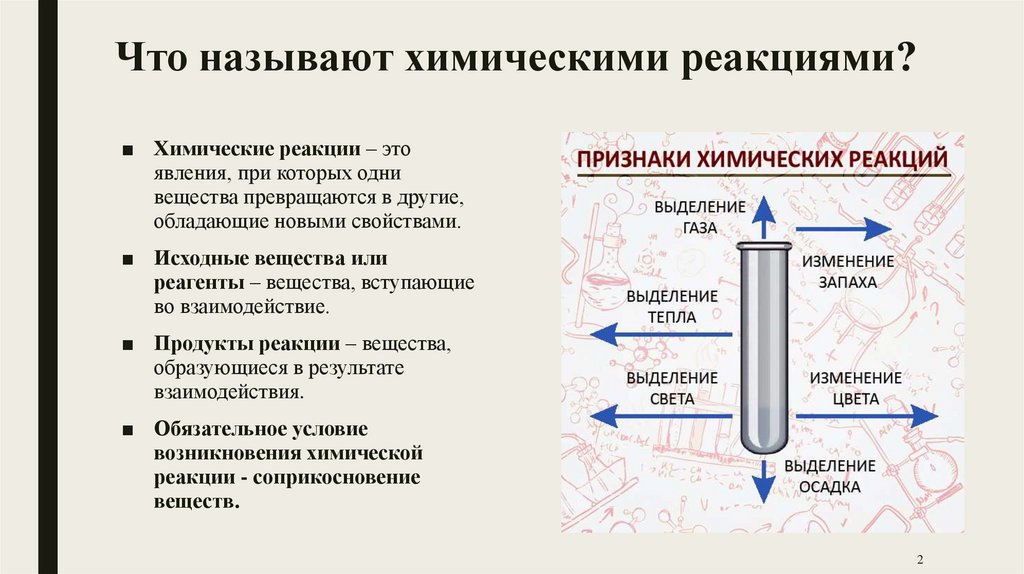
Что называют химическими реакциями?■ Химические реакции – это
явления, при которых одни
вещества превращаются в другие,
обладающие новыми свойствами.
■ Исходные вещества или
реагенты – вещества, вступающие
во взаимодействие.
■ Продукты реакции – вещества,
образующиеся в результате
взаимодействия.
■ Обязательное условие
возникновения химической
реакции - соприкосновение
веществ.
2
3.
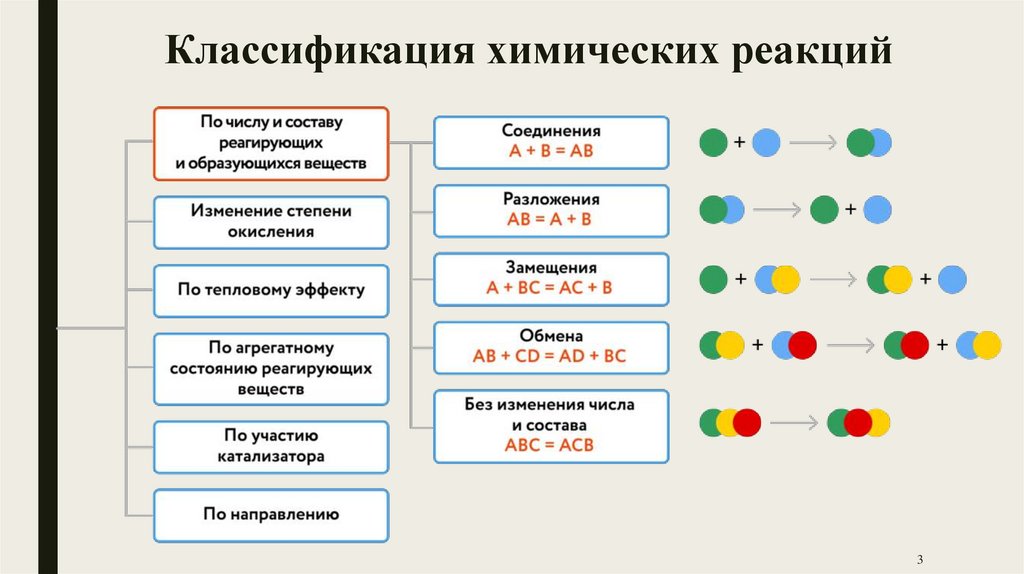
Классификация химических реакций3
4.
К какому типу относятся данныереакции?
Пример
Признак реакции
2Cu + O2 = 2CuO
Образование чёрного налёта на
поверхности меди
(CuOH)2CO3 = 2CuO + H2O + CO2
(реакция протекает при
нагревании)
Почернение зелёного малахита
CuSO4 + Fe = FeSO4 + Cu
Изменение цвета раствора с
голубого на бледно-зелёный и
образование красного налёта на
поверхности железа
K2S + 2HCl = 2KCl + H2S
Выделение газа с характерным
запахом тухлых яиц
4
5.
В зависимости от агрегатного состоянияреагирующих веществ различают:
Гомогенные хим. реакции
Гетерогенные хим. реакции
Каталитическое окисление газообразного
аммиака порошком оксида хрома (III) 5
6.
В зависимости от теплового эффектахим. реакции различают:
Экзотермические хим.
реакции
Эндотермические хим.
реакции
6
7.
В зависимости от теплового эффектахим. реакции различают:
Экзотермические хим.
реакции
Эндотермические хим.
реакции
■ Самые типичные
экзотермические
реакции — это реакции
горения:
■ Примерами
эндотермических
реакций являются
реакции разложения,
протекание которых
происходит при
нагревании:
CaCO3 = CaO + CO2 - Q
СН4 + 2O2 = CO2 + 2H2O + Q
7
8.
Термохимическое уравнение■ Если в уравнении указан тепловой эффект реакции, т. е. количество выделяемой
или поглощаемой в результате реакции теплоты, то такое уравнение
называется термохимическим.
■ В термохимических уравнениях обязательно указывают агрегатные состояния
веществ (жидкое, твёрдое или газообразное), так как разные агрегатные
состояния одного и того же вещества имеют разную внутреннюю энергию.
Коэффициенты в термохимическом уравнении равны количеству веществ (в
молях), вступивших в реакцию.
■ Например, термохимическое уравнение 2H2(г) + O2(г) = 2H2O(г) + 484 кДж
означает, что 484 кДж выделяются при сгорании двух молей водорода в одном
моле кислорода. Тепловой эффект реакции прямо пропорционален количеству
вещества. Так, если в реакцию сгорания вступит в 2 раза меньше водорода, чем в
термохимическом уравнении, т. е. моль, то и тепловой эффект будет в 2 раза
меньше, т. е. 484 кДж / 2 = 242 кДж.
■ Выделение или поглощение энергии в результате химической реакции
объясняется тем, что любая химическая реакция протекает с разрывом старых
химических связей и образованием новых. При этом изменяется электронное
состояние атомов, их взаиморасположение, а потому и внутренняя энергия
продуктов реакции отличается от внутренней энергии реагентов.
8
9.
В зависимости от теплового эффектахим. реакции различают:
Экзотермические хим.
реакции
Эндотермические хим.
реакции
■ E реагентов > E продуктов,
■
■ исходя из закона сохранения
энергии, избыточная энергия
выделяется в окружающую
среду, чаще всего в виде тепла
или света.
■ для протекания реакции
необходима дополнительная
энергия, которая может быть
получена извне в виде
дополнительного нагревания,
УФ-облучения или в других
формах.
E реагентов < E продуктов,
9
10.
Окислительно-восстановительныереакции
■ Окислительно-восстановительные реакции - реакции, в которых
изменяются степени окисления некоторых элементов.
■ Окисление - процесс потери электронов, сопровождающийся
увеличением степени окисления.
■ Восстановление - процесс присоединения электронов,
сопровождающийся уменьшением степени окисления.
■ Окислитель - элемент, принимающий электроны.
■ Восстановитель - элемент, отдающий электроны.
10
11.
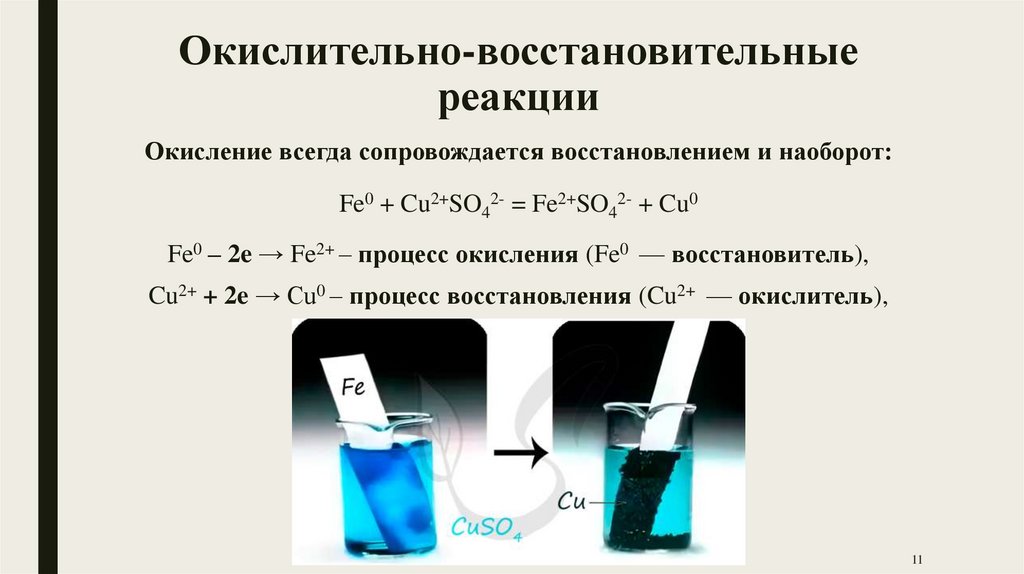
Окислительно-восстановительныереакции
Окисление всегда сопровождается восстановлением и наоборот:
Fe0 + Cu2+SO42- = Fe2+SO42- + Cu0
Fe0 – 2e → Fe2+ – процесс окисления (Fe0 — восстановитель),
Cu2+ + 2e → Cu0 – процесс восстановления (Cu2+ — окислитель),
11
12.
По наличию или отсутствиюкатализатора
■ Различают каталитические и некаталитические реакции.
■ Катализатор - вещество, участвующее в реакции и изменяющее её
скорость, но остающееся неизменным после того, как химическая
реакция закончилась.
12
13.
По признаку обратимостиразличают
Обратимые реакции
■ Реакции, одновременно
протекающие в двух
противоположных направлениях.
Необратимые реакции
■ Реакции, протекающие только в
одном направлении.
13
14.
Коротко о главном:■ Следует отметить, что единой классификации химических реакций не
существует. Многие реакции, например реакцию горения метана, нельзя
причислить ни к реакциям соединения, ни к реакциям разложения, обмена или
замещения.
■ Химические реакции можно классифицировать по различным признакам: по
числу и составу исходных веществ и продуктов реакции; по агрегатному
состоянию; по тепловому эффекту; по изменению степени окисления; по наличию
или отсутствию катализатора; по признаку обратимости.
14
15.
Вопросы для самоконтроля:■ Назовите признаки сравнения, в соответствии с которыми можно проводить
классификацию химических реакций.
■ Охарактеризуйте следующие реакции по различным классификационным
признакам:
15












 Химия
Химия








