Похожие презентации:
Виды химических реакций
1.
Выполнено: Федотовой Антониной ВалериевнойГОУ школа 336 Невского района
2. Классификация химических реакций.
По числу и составу исходных веществи продуктов реакций.
3. Реакции соединения
Это такие реакции, в которых изнескольких простых или сложных
веществ образуется одно сложное
вещество:
2H2+O2
H2+Cl2
2H2O
2HCl
4. Реакции разложения
Это реакции, в которых изодного сложного вещества
получается несколько простых или
сложных веществ:
2KClO3
2KCl+3O2
5. Реакция замещения
Это реакция между простым иcложным веществом, приводящая
к образованию другого простого и
сложного вещества:
Zn+2HCl
ZnCl2+H2
6. Реакция обмена
Это реакция между двумя сложнымивеществами, приводящая к образованию
других сложных веществ.
Реакция обмена возможна только при
условии образования в продуктах
реакции нерастворимого вещества, газа
или малодиссоциируемого вещества,
например, воды:
AgNO3+HCl
AgCl +HNO3
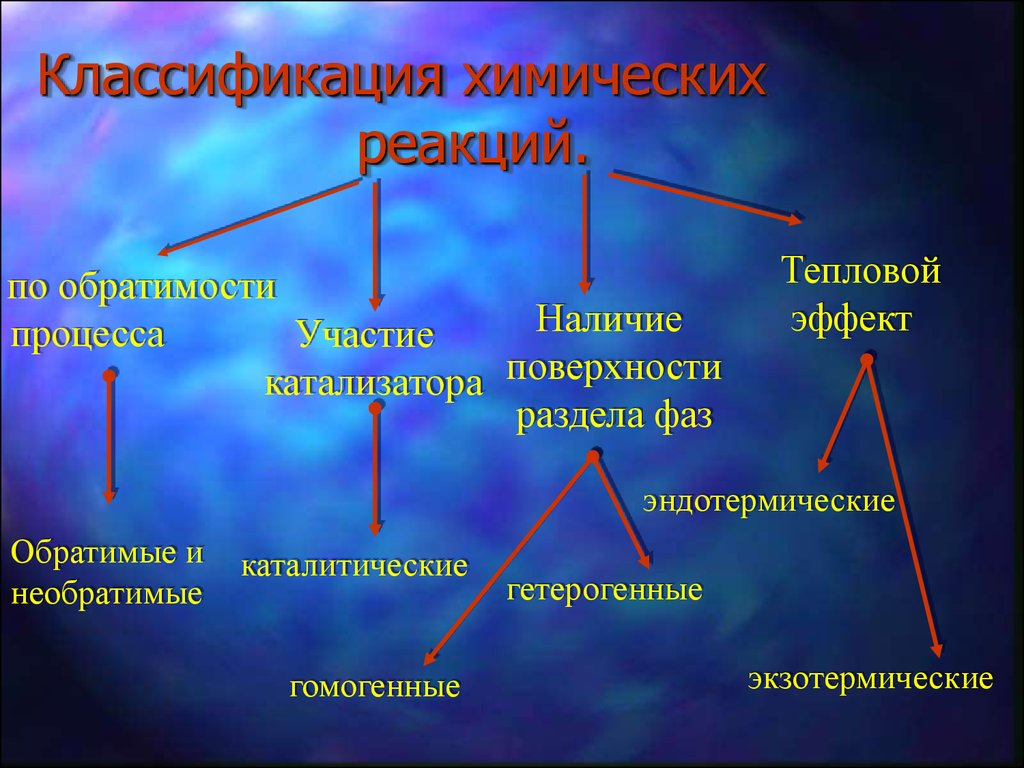
7. Классификация химических реакций.
по обратимостиНаличие
процесса
Участие
катализатора поверхности
раздела фаз
Тепловой
эффект
эндотермические
Обратимые и
необратимые
каталитические
гомогенные
гетерогенные
экзотермические
8. Обратимые и необратимые реакции.
Обратимые реакции -протекают во взаимнопротивоположных направлениях:
N2 + 3H2 2NH3
Необратимые реакции –протекают при одних
и
тех же условиях только в одном направлении:
BaCl2+2AgNO3 Ba(NO3)2+2AgCl
9. Каталитические реакции.
Каталитические реакции- протекаютв присутствии катализатора:
C2H4+H2O
H2SO4
C2H5OH
10. Гомогенные и гетерогенные реакции.
Гомогенные- протекают между веществаминаходящимися в одном агрегатном
состоянии:
NaOH+HCl
NaCl+H2Oж
Ж
Ж
Гетерогенные- протекают между
веществами находящимися в разном
агрегатном состоянии:
Mg+2HCl
MgCl2+H2
ТВ
Ж
11. Экзотермические и эндотермические реакции.
Эндотермические- протекают свыделением тепла:
N2+3H2
2NH3+Q
Эндотермические- протекают с
поглощением тепла:
N2+O2
2NO-Q
12. Окислительно-восстановительные реакции.
Окислительновосстановительные реакции.В ходе окислительно-восстановительных
реакций изменяются степени окисления
элементов:
2Fe0 +3Сu+2Cl2-2
2Fe+3Cl3-1+3Cu0
Fe0-3e
Fe+3 восстановитель (окисление)
Cu+2+2e
Cu0 окислитель (восстановление)












 Химия
Химия








