Похожие презентации:
Общая химия. Основные закономерности химических процессов (лекция 4)
1.
ОБЩАЯ ХИМИЯ(лекция 4)
2.
д.х.н.,профессор
кафедры
общей химии
Конюхов
Валерий
Юрьевич
VK
id2476227
3.
ЛитератураКоровин Н.В. Общая химия. М.: Высшая школа. 2002, 2013
Ахметов, Н.С. Общая и неорганическая химия/Н.С. Ахметов. – М.:ВШ, 2007
Химия: учебник для вузов. Гуров А.А., Бадаев Ф.З., Овчаренко Л.П., Шаповал
В.Н. М.: Изд-во МГТУ им. Н.Э. Баумана, 2004.
Третьяков Ю.Д. Неорганическая химия. В 3 томах, 2004,2007 г (электронное)
Сергиевский В.В., Ананьева Е.А., Жукова Т.В и др. Неорганическая
химия((электронное): учебное пособие для внеаудиторной работы / М.:
МИФИ. 2007
Ананьева Е.А., Звончевская М.Ф. Кучук Ж.С., Сорока И.В. Закономерности
протекания химических реакций (химическая термодинамика, кинетика,
равновесие). М.: МИФИ. 2015
Сергиевский В.В., Ананьева Е.А., Звончевская М.Ф. и др. Химия растворов.
М.: МИФИ. 2005
Ананьева Е.А., Звончевская М.Ф., Глаголева М.А., Сергиевский В.В.,
Электрохимия: Учебное пособие. М.: МИФИ. 2006.
Общая химия. Лабораторный практикум. Ред. Ананьева Е.А.: МИФИ. 2024.
• Ананьева Е.А., Безрукова Н.Ю., Глаголева М.А. и др. Сборник задач и
тестов по курсу химии: учебное пособие. М.: МИФИ. 2024
4.
Из программы курса:Основные закономерности
химических процессов
• Термохимия. Первый закон термодинамики. Функции состояния и
функции процесса в уравнении первого закона термодинамики.
Теплота процесса, тепловой эффект процесса. Законы термохимии.
Закон Гесса и основные следствия из него. Энтальпия образования
химических соединений. Стандартное состояние. Расчет теплового
эффекта реакции.
Направление химических процессов. Второй закон термодинамики.
Обратимые и необратимые процессы в термодинамике. Определение
энтропии по Клаузиусу и по Больцману. Уравнение Больцмана.
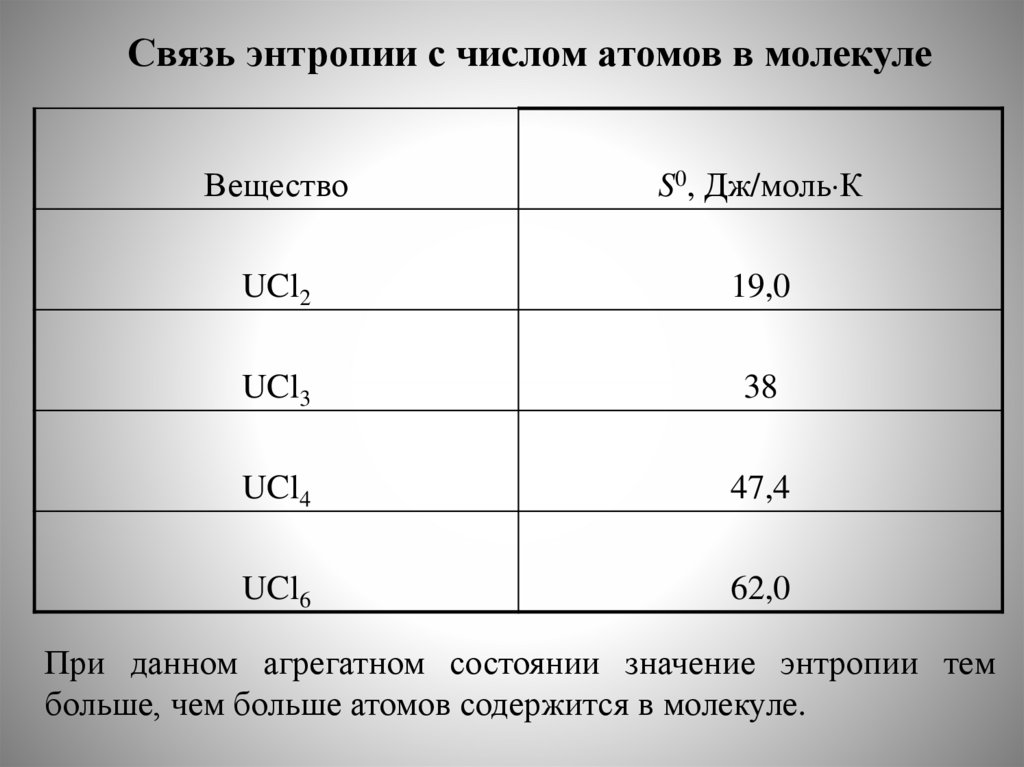
Факторы, влияющие на энтропию. Энтропия и природа вещества.
Определение абсолютного значения энтропии. Постулат Планка.
Критерий возможности процесса в изолированной системе.
Объединенное уравнение 1-го и 2-го законов термодинамики. Энергия
Гиббса. Критерии возможности самопроизвольного протекания
процесса в изобарно-изотермической системе при стандартной и
нестандартных температурах и нестандартных условиях. Расчет
термодинамических функций химических реакций по справочным
данным. Оценка реакционной способности и устойчивости веществ.
5.
Тема 17. КОНТРОЛЬНЫЕ ВОПРОСЫПО КУРСУ ХИМИИ
• Энергетика химических процессов.
Тепловой эффект и энтальпия реакции.
Законы термохимии. Энтальпия
образования химических соединений.
Энтропия. Энергия Гиббса реакции, ее
связь с направлением химических
процессов. Расчет термодинамических
функций химических реакций по
справочным данным. Оценка
реакционной способности и
устойчивости веществ.
6.
7.
Функции состояния8.
• Функции состояния – это свойствасистемы (внутренняя энергия U,
энтальпия H, энтропия S и т.д.), они
характеризуют данное состояние
системы (содержаться в системе).
• Их изменения в ходе процесса не зависят
от его пути и определяются только
начальным и конечным состояниями
системы.
9.
Функции процесса (перехода)10.
• Функции процесса (теплота Q,работа W) – они не являются
свойствами системы (их нет в
системе), они возникают в ходе
процесса, в котором участвует
система.
• Т.е они связаны с процессом, а не
с состоянием системы.
11.
Если теплоты и работы нет всистеме, то бессмысленно
говорить об их изменении, речь
может идти только об их
количестве Q или W в том или
ином процессе.
• Их количества зависят от пути
осуществления процесса.
• Бесконечно малые количества
обозначают Q, W.
12.
Энергия, теплота и работа13.
• Известно множество различныхвидов энергии: механическая,
электрическая, химическая и т.п.,
но от системы к системе энергия
может переходить лишь в двух
формах: в форме теплоты или
работы.
14.
• Теплота (Q) – форма передачиэнергии от системы к системе за
счёт хаотического движения
частиц (молекул, атомов, ионов и
т.п.) контактирующих систем.
15.
• В термодинамике теплота,подведённая к системе, принимается
положительной (например, теплота
эндотермической реакции), а
теплота, отведённая от системы –
отрицательной (теплота
экзотермической реакции).
• В термохимии всё наоборот.
16.
• Работа – форма передачиэнергии от системы к системе за
счёт направленного движения
микро- или макротел.
• В литературе работу обозначают
либо W (от англ. “work”), либо A
(от нем. «arbait”).
17.
• первый закон (начало)термодинамики:
• U = Q – W
• В дифференциальной форме (для
бесконечно малой части
процесса):
• dU = Q W
18.
• Здесь Q и W – бесконечно малыеколичества теплоты и работы
процесса.
• dU – полный дифференциал U
(бесконечно малое изменение
внутренней энергии).
• Обычно выражение записывают в
форме:
• Q = U + W
19.
Формулировка 1-го закона ТД• «Теплота, подведённая к
системе, идёт на увеличение
внутренней энергии системы
и совершение системой
работы».
20.
Теплота изохорного и изобарногопроцессов. Закон Гесса
21.
• В общем случае теплота Q - есть функцияпроцесса, т.е. её количество зависит от
пути протекания процесса, но в двух
важных для практики случаях теплота
приобретает свойства функции
состояния, т.е. величина Q перестаёт
зависеть от пути процесса, а
определяется только начальным и
конечным состояниями системы.
22.
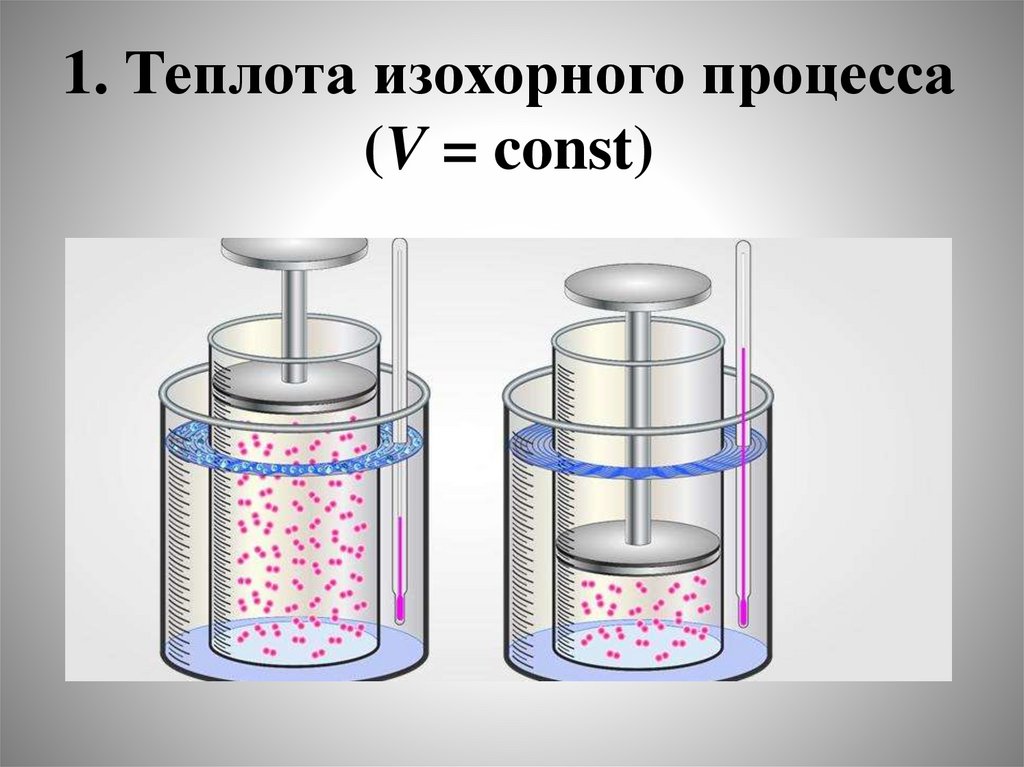
1. Теплота изохорного процесса(V = const)
23.
• Будем считать, что в ходе процессаможет совершаться только работа
против сил внешнего давления, а
полезная работа W = 0:
• Q = dU + P dV,
• а так как V = const, то P dV = 0:
QV = dU
• или в интегральной форме:
• QV = U = Uк – Uн
24.
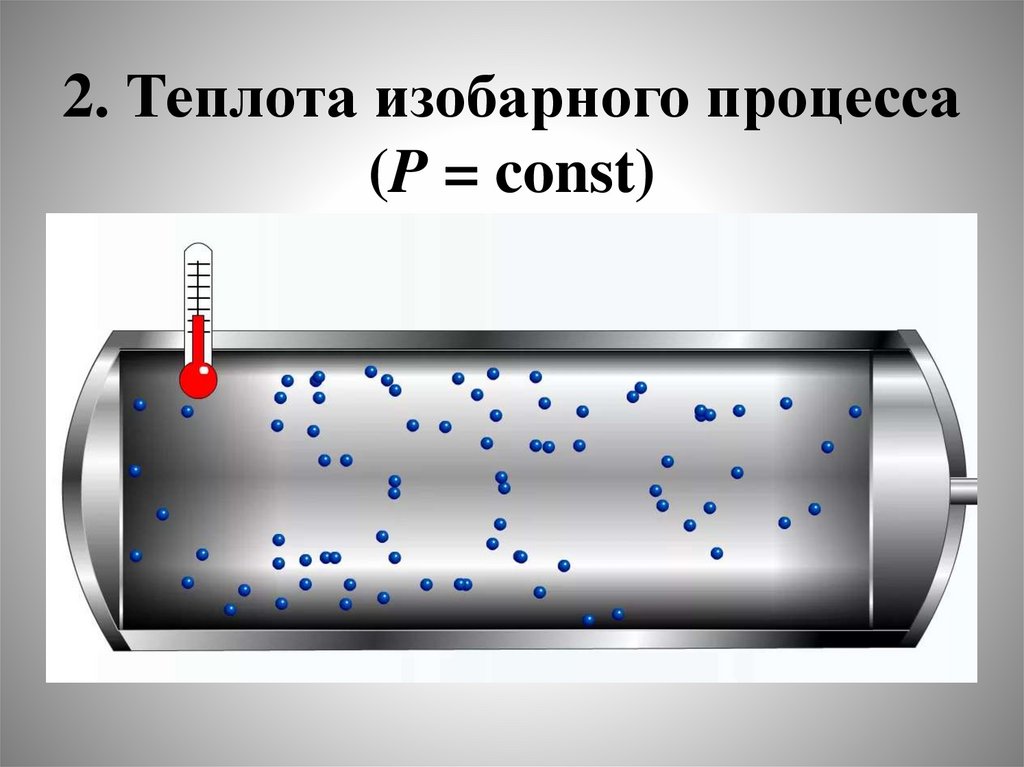
2. Теплота изобарного процесса(P = const)
25.
• Снова будем считать, что полезнаяработа W = 0, тогда:
Q = dU + P dV,
• Так как Р = const, то можно записать:
QР = dU + d(РV),
QР = d(U + P V).
Обозначим:
Н U + P V (энтальпия)
• QР = dH или:
• QP = H = Hк – Hн
26.
• Таким образом, тепловой эффектхимической реакции приобретает
свойства функцией состояния (его
величина не зависит от пути процесса)
• при P = const:
• QP = H;
• при V = const:
• QV = U.
27.
• Так как химические реакции и физикохимические процессы чаще осуществляют припостоянном давления (на открытом воздухе, т.е.
при Р = const = 1 атм), то на практике для
расчётов чаще используют понятие энтальпии, а
не внутренней энергии.
• Иногда слово «теплота» процесса заменяют без
дополнительных объяснений «энтальпией», и
наоборот.
• Например, говорят «теплота образования», а
пишут fН.
28.
Но если интересующий нас процесс протекает при V= const (в автоклаве), то следует использовать
выражение:
QV = U.
29.
Связь rН и rU30.
• Продифференцируем выражение:• Н = U + P V
• dH = dU + PdV + VdP,
• при постоянном давлении V dP = 0
и
• dH = dU + P dV
• В интегральной форме:
• Н = U + Р V
31.
• Для идеального газа справедливо уравнениеКлапейрона-Менделеева:
• Р V = R T,
• где – число моль газа, R 8,314Дж/моль К
– универсальная газовая постоянная.
• Тогда (при Т = const) P V = R T.
Окончательно имеем:
• Н = U + R T
• – изменение числа моль газообразных
веществ в ходе реакции.
32.
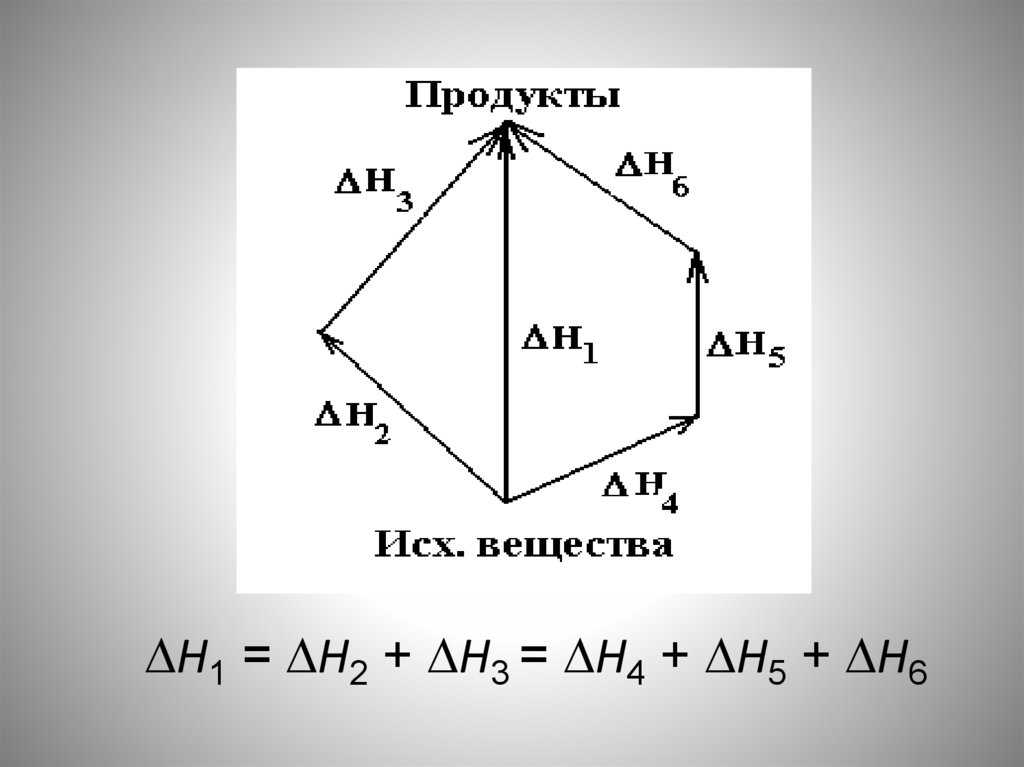
И тут Г.И. Гесса осенило:33.
• Факт постоянства QV или QP, задолго дооформления химической термодинамики
как науки, опытным путем установил
Г.И.Гесс (закон постоянства сумм тепла
или закон Гесса):
• Тепловой эффект химической реакции
зависит от вида и состояния исходных
веществ и продуктов реакции и не
зависит от пути их превращения друг в
друга.
34.
Н1 = Н2 + Н3 = Н4 + Н5 + Н635.
Теплоты (энтальпии) образования36.
• Теплота (энтальпия) образования –тепловой эффект образования 1 моль данного
вещества из простых веществ: fH.
• Простыми называют вещества, состоящие из
атомов одного вида. Это, например, азот N2,
кислород О2, графит С и т.п.
• Если у данного элемента простых веществ
несколько, то рассматривают наиболее
устойчивое при условиях табулирования:
• О2, но не О3.
37.
• Из определения следует, чтотеплота (энтальпия) образования
воды равна по величине тепловому
эффекту реакции:
• Н2 + 1/2О2 = Н2О QP = fН
38.
• Если все вещества, участвующие вреакции, взяты в стандартном состоянии,
т.е. при давлении Р = 1 атм, то теплоту
образования fНo называют стандартной
теплотой образования (здесь воды).
• Обычно величины fНo табулированы
при 298 К.
• Обозначают: fНo298(Н2О).
39.
Стандартные теплотыобразования некоторых веществ
Вещество
С6Н6(г)
fHo298,
кДж/моль
82,93
С6Н6(ж)
49,04
С6Н12(г)
Н2
-123,10
0
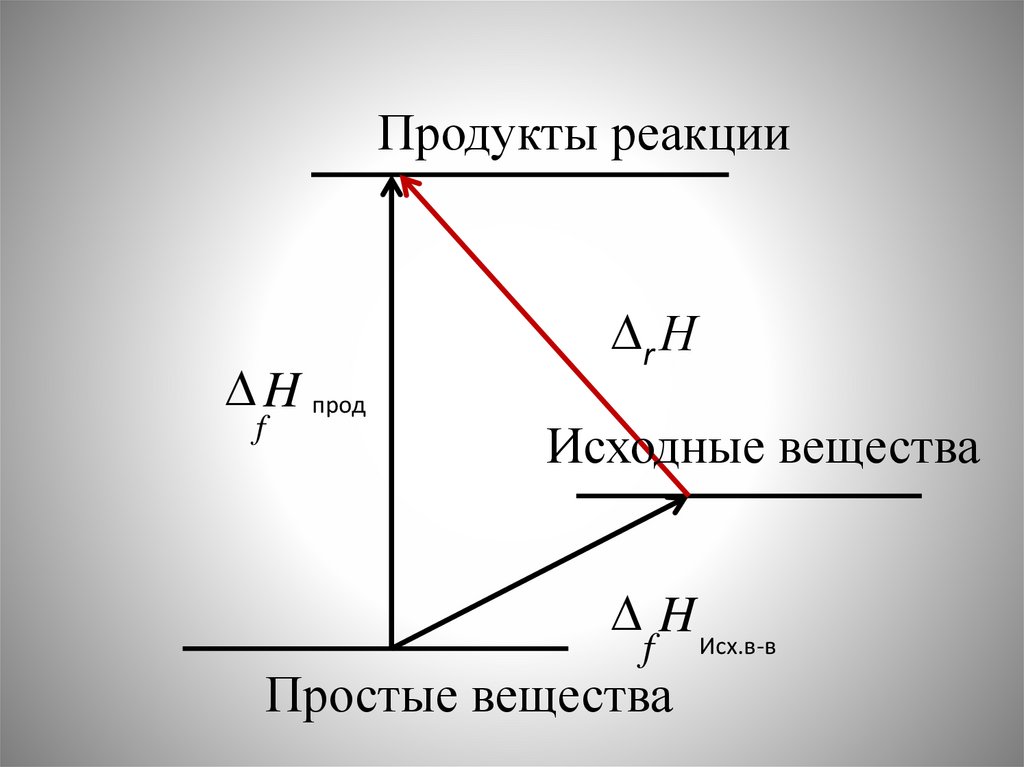
40.
Продукты реакцииH прод
f
r Н
Исходные вещества
H Исх.в-в
f
Простые вещества
41.
Первое следствие из закона Гесса• Тепловой эффект химической реакции:
• 1A1 + 2A2 + = 1А 1 + 2А 2 +
• равен сумме теплот образования
продуктов реакции за вычетом суммы
теплот образования исходных веществ (с
учётом стехиометрических
коэффициентов i и j):
r H
0
298
J f H ( А j ) i f H ( Ai )
0
298
j
0
298
i
42.
• Пример 1: Вычислить тепловойэффект реакции гидрирования паров
бензола (эту реакцию осуществляют на
поверхности гетерогенных
катализаторов – платиновых
металлов):
• С6Н6 + 3Н2 = С6Н12
• при 298 К и Р = 1 атм:
0
0
0
rH 298 j fH 298 ( А j ) i fH 298 ( Ai )
43.
ВеществоС6Н6(г)
fHo298,
кДж/моль
82,93
С6Н6(ж)
49,04
С6Н12(г)
Н2
-123,10
0
rН0298 = -123,10 – (82,93 +3 0) =-206,03
кДж
rН0298 = -123,10–(49,04 + 3 0) =-72,14
кДж
испН0 = 82,93 – 49,04 = +33,89 кДж/моль
44.
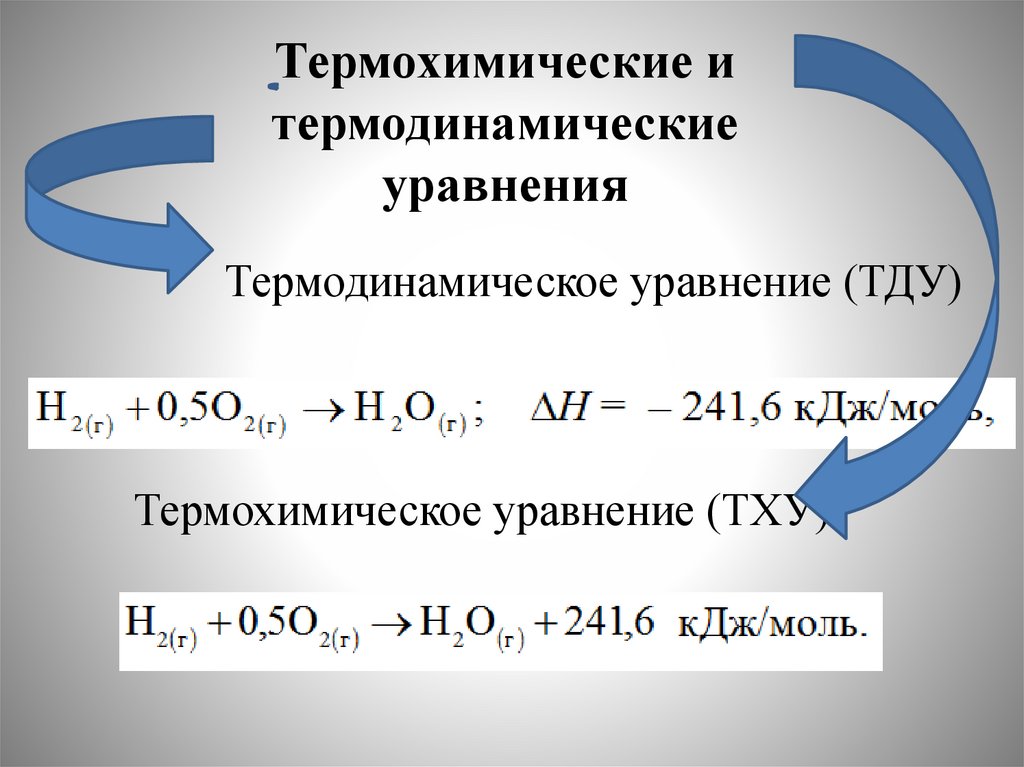
Термохимические итермодинамические
уравнения
Термодинамическое уравнение (ТДУ)
Термохимическое уравнение (ТХУ)
45.
Решение задач46.
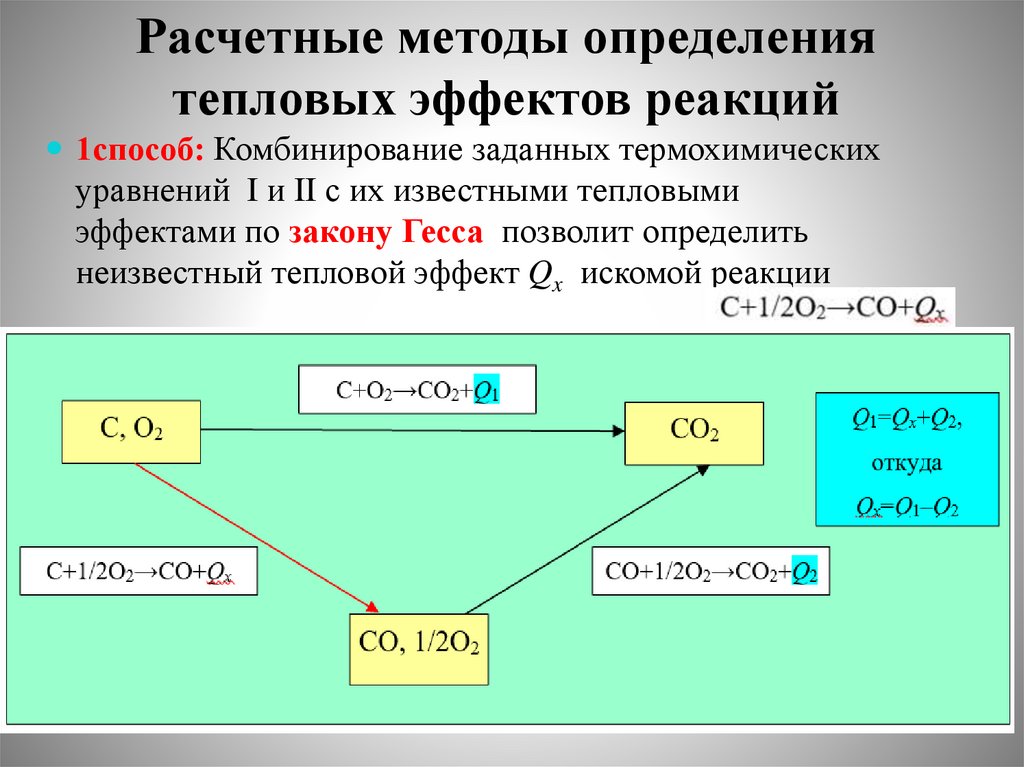
Расчетные методы определениятепловых эффектов реакций
1способ: Комбинирование заданных термохимических
уравнений I и II с их известными тепловыми
эффектами по закону Гесса позволит определить
неизвестный тепловой эффект Qx искомой реакции
47.
Примеры термохимических расчетов48.
Примеры термохимических расчетов49.
Примеры термохимических расчетовПРОВЕРКА:
50.
Примеры термохимическихрасчетов
51.
Примеры термохимических расчетов52.
Примеры термохимических расчетов53.
Примеры термохимических расчетов54.
Примеры термохимических расчетов• Энергия химической связи Eх.с – энергия, которую
нужно затратить, чтобы превратить один моль
газообразных молекул в отдельные газообразные атомы
(при н. у.) (энергия атомизации), отнесенная к одной
химической связи.
• Средние стандартные энтальпии связи могут
быть определены путем усреднения значений,
найденных для целых классов соединений:
< Eх.с.>= ∆H° атомизации/∑число х.с.
55.
Вычисление энергии связиПример 3:
Рассчитайте среднее значение энергии связи E C H в
молекуле метана на основании следующих данных
:
C графит 2H 2 г CH 4 г ,
H1 74,9 кДж
C графит C г ,
H 2 715,0 кДж
H 2 г 2H г ,
H 3 432,0 кДж
56.
Вычисление энергии связи:
57.
Экспериментальное определениетеплового эффекта
При калориметрических опытах величина и знак теплового
эффекта ∆H или ∆U
процесса определяются по изменению температуры калориметра
∆H = Cp·∆T, Cp= f(T)
∆U = Cv·∆T, Cv= f(T)
58.
ЭнтальпияВЫВОДЫ:
1. Изменение энтальпии характеризует всеобщее
стремление систем к минимуму энергии, к
энергетически выгодному состоянию. ΔrH < 0,
2. По fНо можно судить об устойчивости вещества:
устойчиво
взрывчатое вещество
fНо (Н2О) = -285,7 кДж/моль
fНо(С6Н2СН 3 (NO2) 3)) =
=980кДж/моль
59.
Энтальпия3. Изменение энтальпии системы не может служить единственным
критерием самопроизвольного осуществления химической
реакции, т.к. среди самопроизвольных реакций есть как
экзотермические, так и эндотермические:
MnO2(кр) + HCl(р-р) = MnCl2(р-р) + Cl2(г) + H2O(ж)
rНо = 64 кДж/моль
2Na(кр) + Cl2(г) = NaCl(кр)
rНо = 411 кДж/моль
Необходимо учитывать еще один фактор (вероятностный фактор),
определяющий способность самопроизвольно переходить из более
упорядоченного к менее упорядоченному (более хаотичному)
состоянию. Учитывать энтропию реакции rS
60.
Далее (несколько слайдов) необязательныйматериал, его нет в программе нашего курса (они
только для любознательных)
Необязательно!
61.
Зависимость тепловогоэффекта от температуры
62.
Теплоемкость63.
• Теплоемкость – это мераинертности системы к нагреванию
(или охлаждению), она численно
равна количеству теплоты, которое
необходимо подвести к системе,
чтобы повысить её температуру на
один градус.
64.
• Теплоемкость зависит от температуры.Поэтому различают среднюю и
истинную теплоёмкости.
• Средняя теплоемкость системы в
интервале температур Т1 – Т2 равна
отношению количеству теплоты,
подведенной к системе Q, к величине
этого интервала:
Q
Q
C
T2 T1 T
65.
• Истинная теплоёмкостьопределяется по уравнению:
δQ
Q
C lim
T T 0 dT
• Зависимость между истинной и
средней теплоемкостями выражается
уравнением:
T2
1
C
C dT
T2 T1 T1
66.
• Теплоемкость системы зависит от её массы (иликоличества вещества), т.е. это экстенсивное
свойство системы.
• Если теплоемкость отнести к единице массы, то
получается интенсивная величина – удельная
теплоемкость суд [Дж/кг К].
• Если же отнести С к количеству вещества
системы, получается мольная теплоемкость сm
[Дж/моль К].
67.
• В случае газов различают:• теплоемкость при постоянном
давлении Ср
δ
Q
d
H
Р
C
P
dT
dT
• теплоемкость при постоянном
объеме СV
δQV dU
CV
dT dT
68.
• В случае идеального газауказанные теплоемкости
связаны между собой
уравнением:
• СP = С V + R
69.
• Молярная теплоемкостьидеального одноатомного газа
равна:
• СV = 3/2R CP = 5/2R
• двухатомного газа:
• СV = 5/2R CP = 7/2R
70.
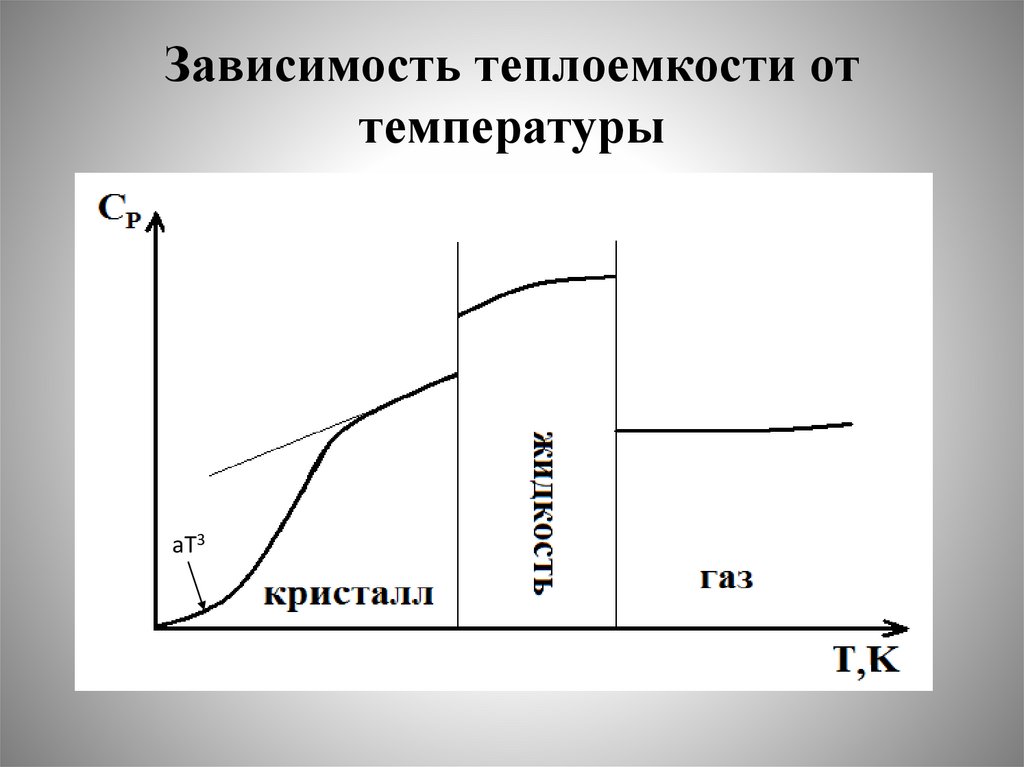
Зависимость теплоемкости оттемпературы.
Температурные ряды
71.
• Обычно зависимость теплоемкости оттемпературы передают с помощью
эмпирических уравнений вида температурных рядов:
c
C Р a bT 2
T
C Р a bT cT
2
где a, b, с и c const, они приведены в
справочниках физико-химических свойств
веществ.
72.
Зависимость теплоемкости оттемпературы
аТ3
73.
И снова зависимость тепловогоэффекта от температуры
74.
• Уравнениеr H 0
o
r CP
T Р
• называют законом Кирхгофа в
дифференциальной форме
75.
Интегрирование уравненияКирхгоффа
r H
0
C
r P
T Р
0
d
H
C
dT
r
r
0
0
P
76.
• Интегрирование уравнения Кирхгофа отТ1 до Т2 дает:
r H
T2
o
T2
r H r C dT
0
T1
0
P
T1
• Обычно Т1 = 298 К:
T
r H
o
T
r H
0
298
r C dT
0
P
298
77.
1. Для оценочных расчетовrН0Т предполагают, что
СРi= const, тогда:
r H r H
0
T
0
298
C Р (T 298)
0
78.
С учётом зависимости СР оттемпературы:
CP = a + bT + cT2
CP = a + bT + c /T2
результат интегрирования
уравнения:
T
0
r H T0 r H 298
a bT cT 2 c T 2 dT
298
79.
Имеет вид:b 2
2
r H r H a (T 298)
(T 298 )
2
c 3
1
1
3
(T 298 ) c
3
T 298
0
T
0
298
80.
Здесь:a j a j ( A j ) i аi ( Ai )
b j b j ( A j ) i bi ( Ai )
с j с j ( A j ) i сi ( Ai )
уравнений:
CР a bT cT
2
c
C Р a bT 2
T
81.
• Схема вычислений rН Т реакций припроизвольной температуре Т следующая.
• Сначала по стандартным теплотам образования
или теплотам сгорания веществ вычисляют
rН 298 реакции (так, как это описано выше).
• Далее по уравнению Кирхгоффа рассчитывают
тепловой эффект при любой температуре Т:
T
r H r H
0
T
0
298
r C dТ
0
P
298
82.
Если нужно вычислить тепловойэффект при любой температуре и
V = const
• Вычисляют:
T
r H r H
0
T
0
298
r C dТ
0
P
298
• Затем вычисляют:
• rU = rН R T
83.
Задача 2• Для реакции 2SO2 + O2 = 2SO3 при 298 К
вычислите тепловой эффект: а) при Р =
const и б) при V = const. Теплоты
образования веществ в стандартных
условиях возьмите в справочнике.
• Решение. Выписываем из справочника (см.
табл. 40 [1]) стандартные теплоты
образования участников реакции:
• ∆f





































































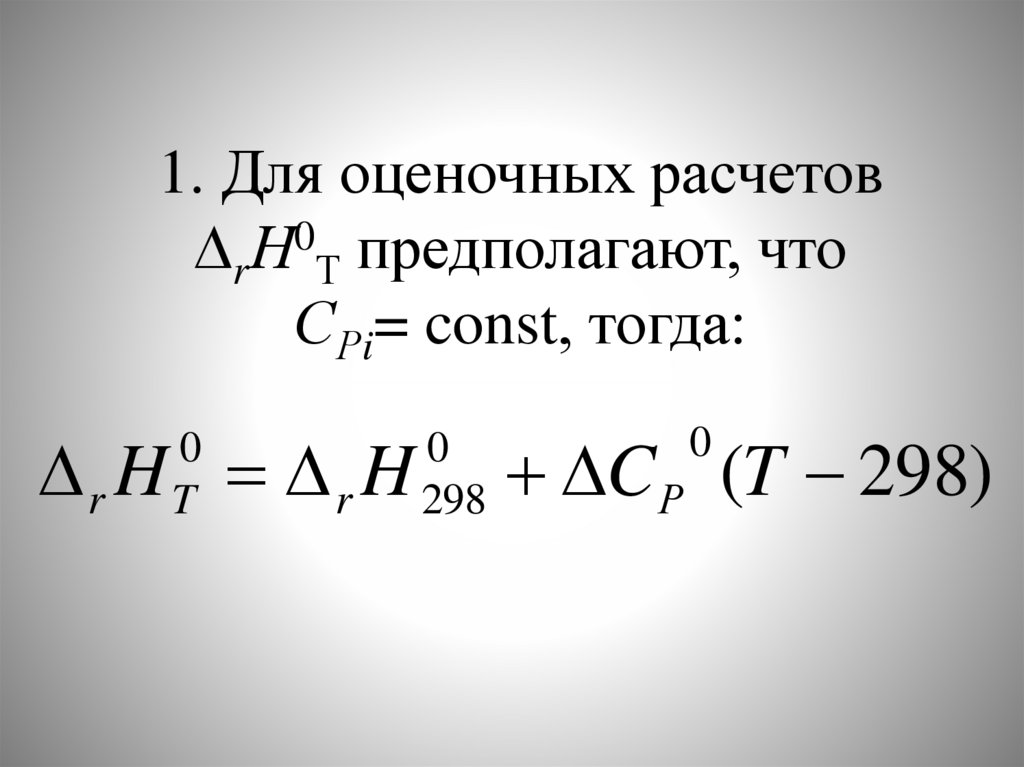

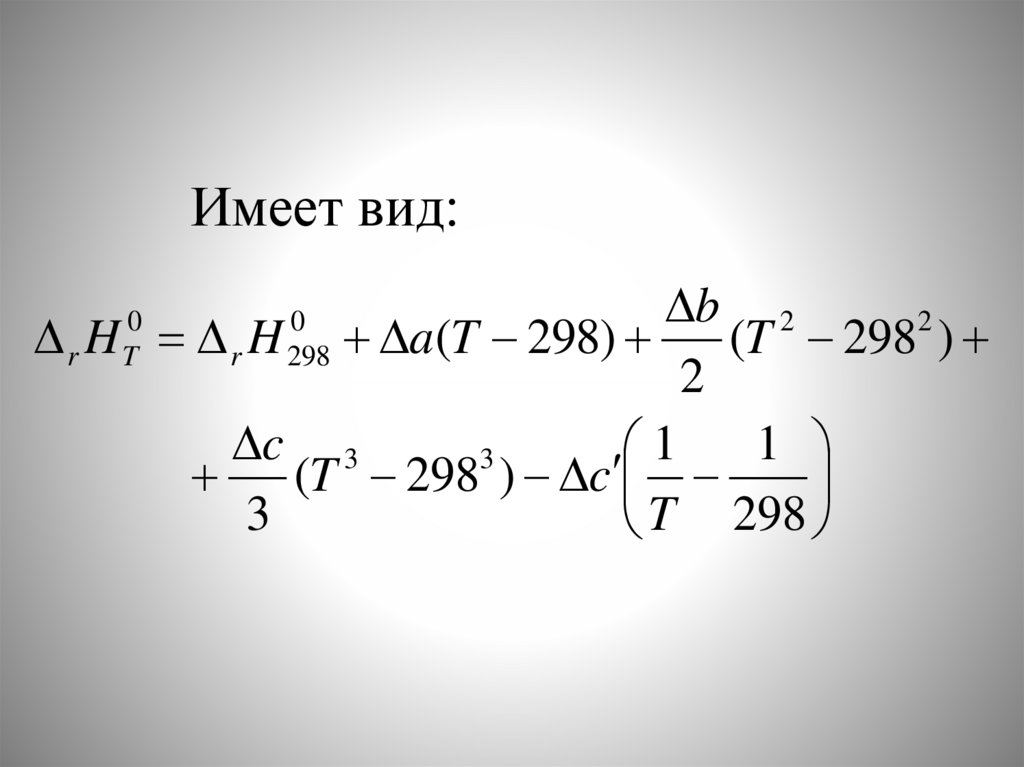
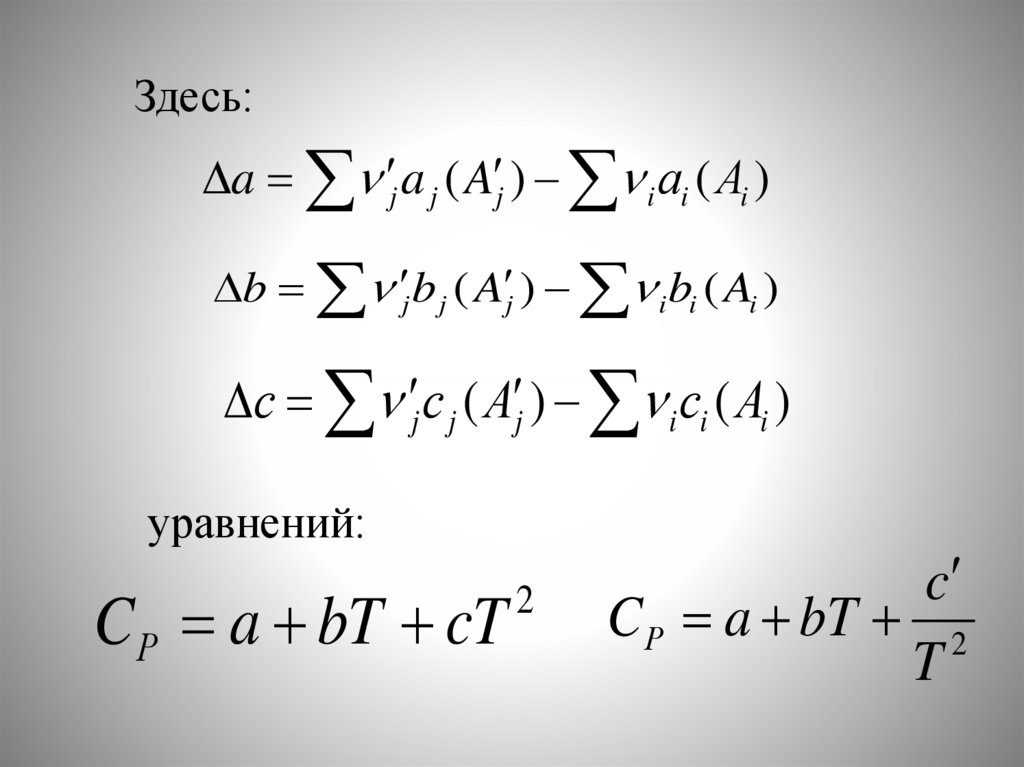

































































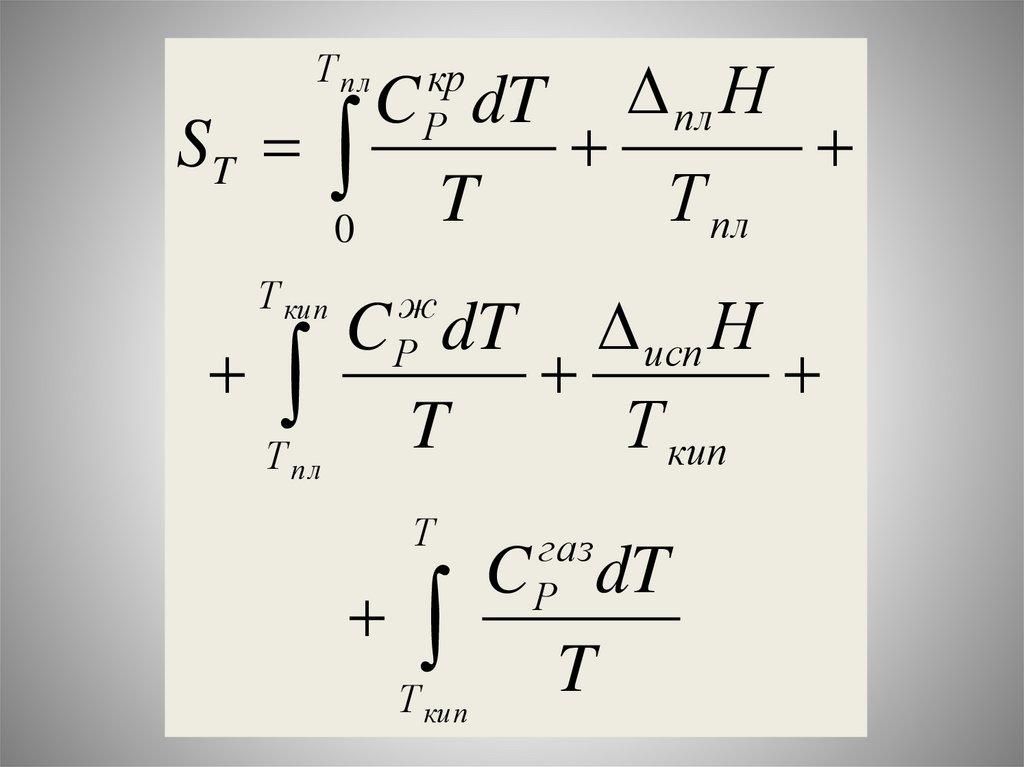
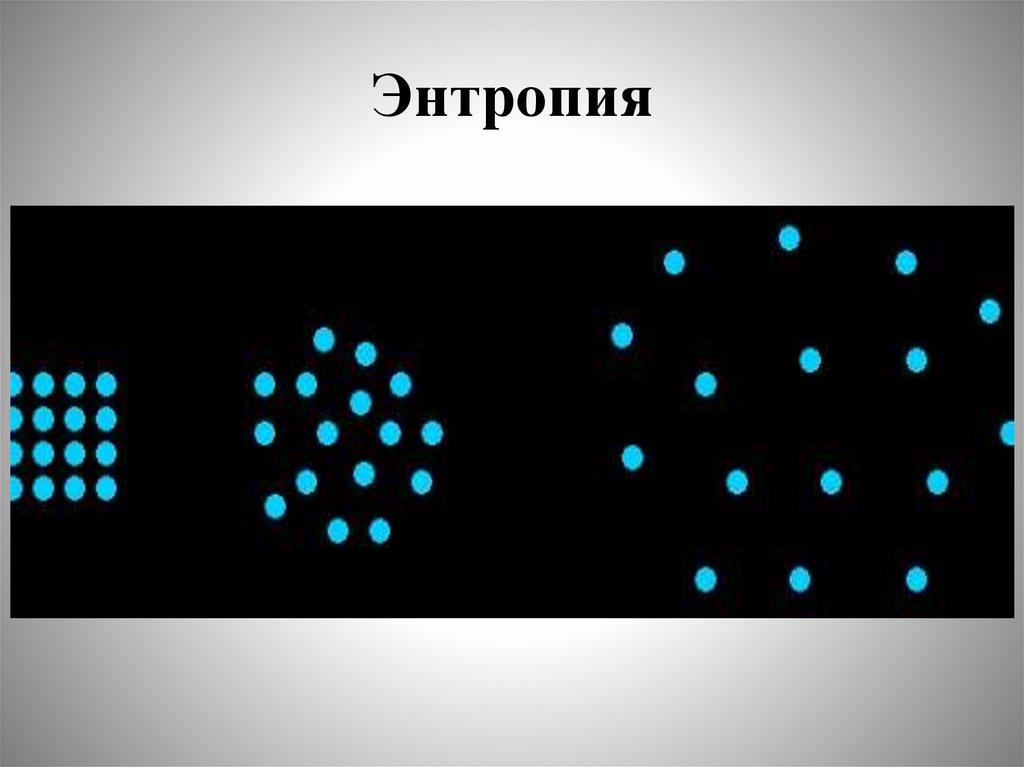
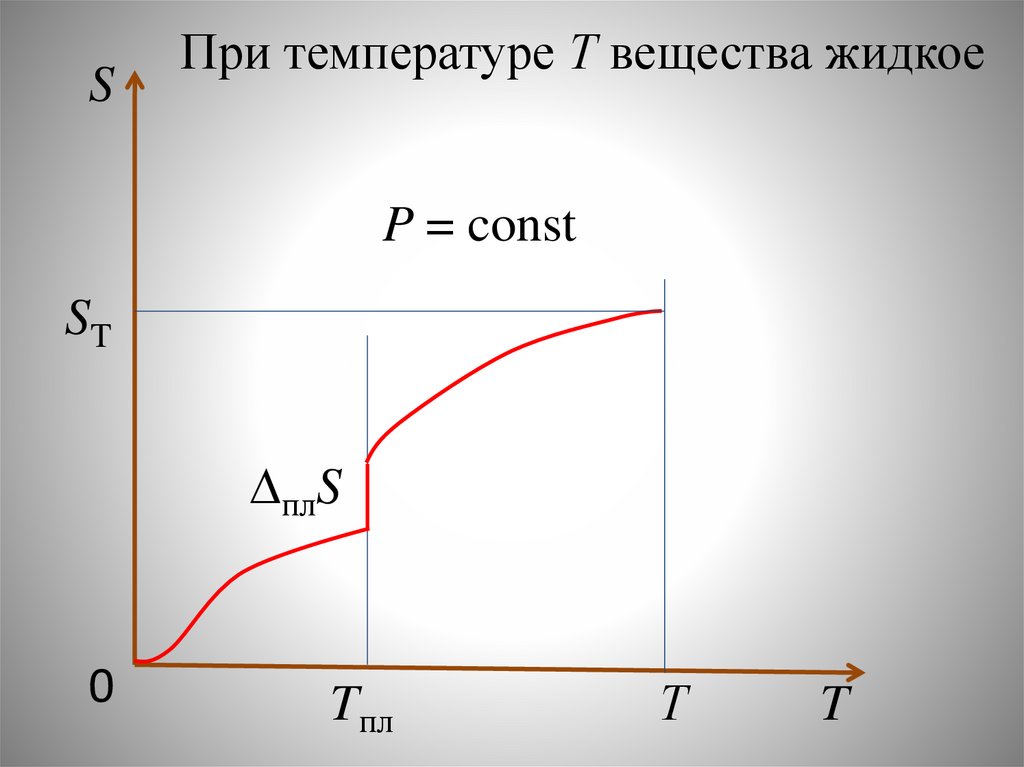
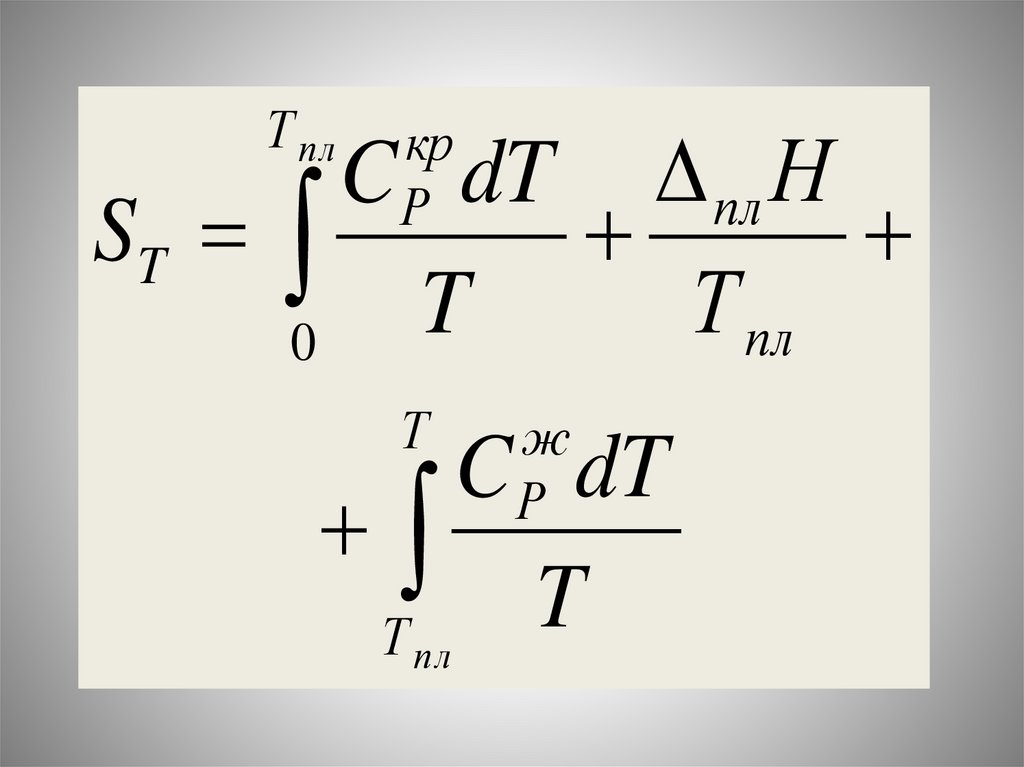

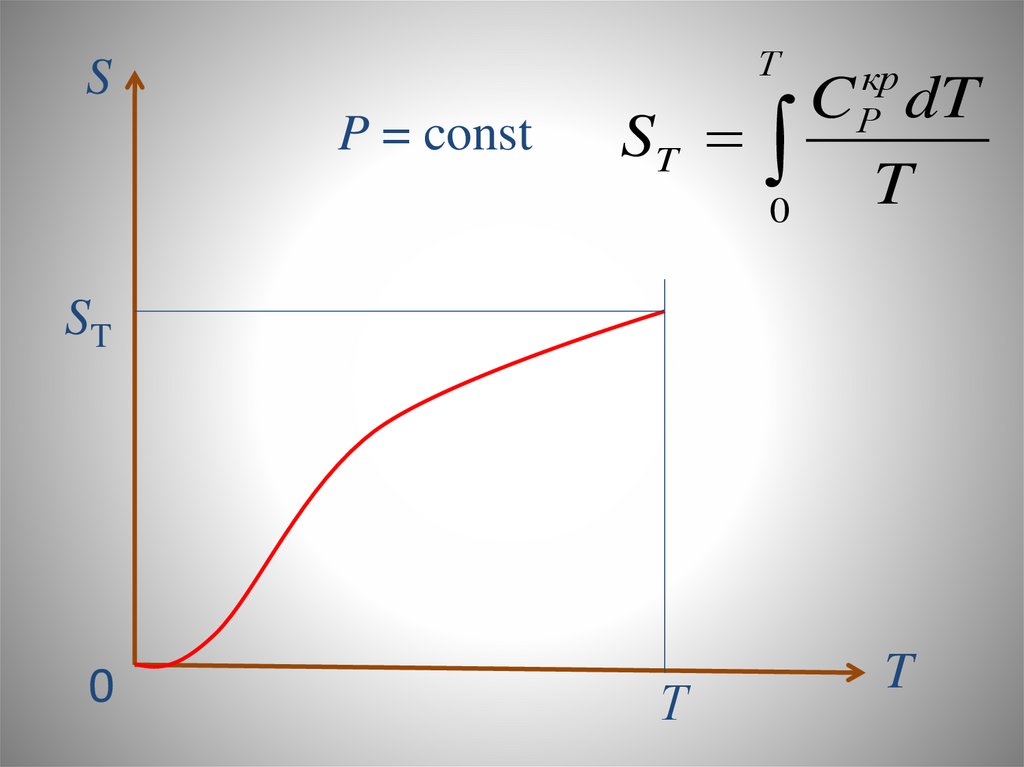





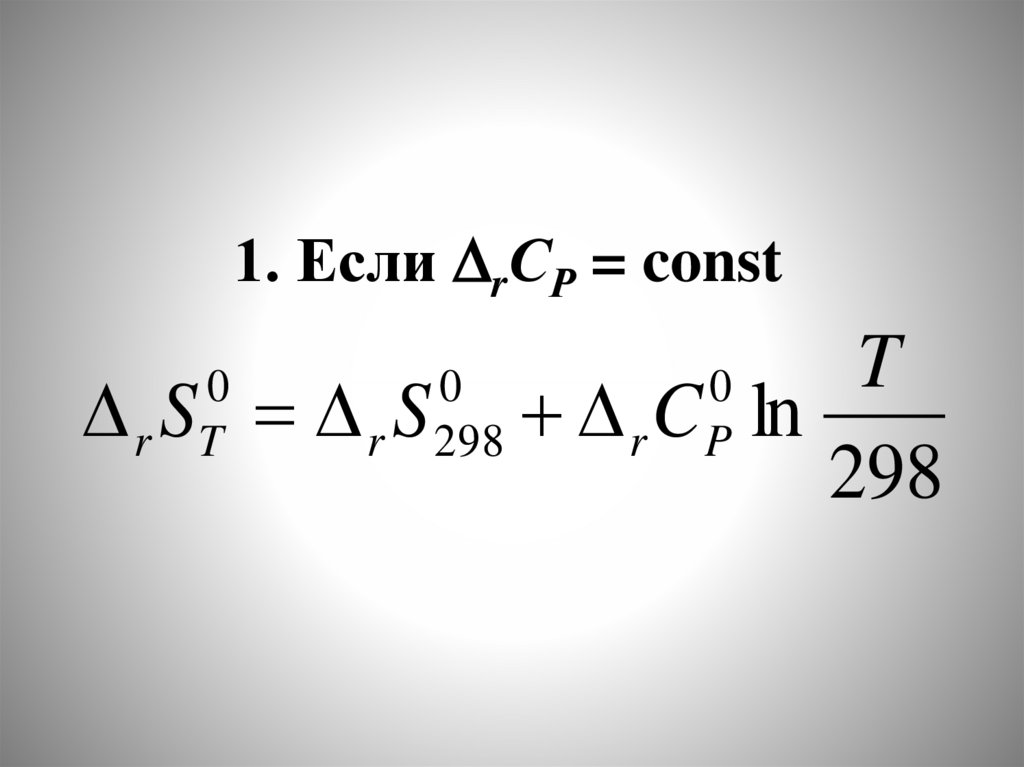
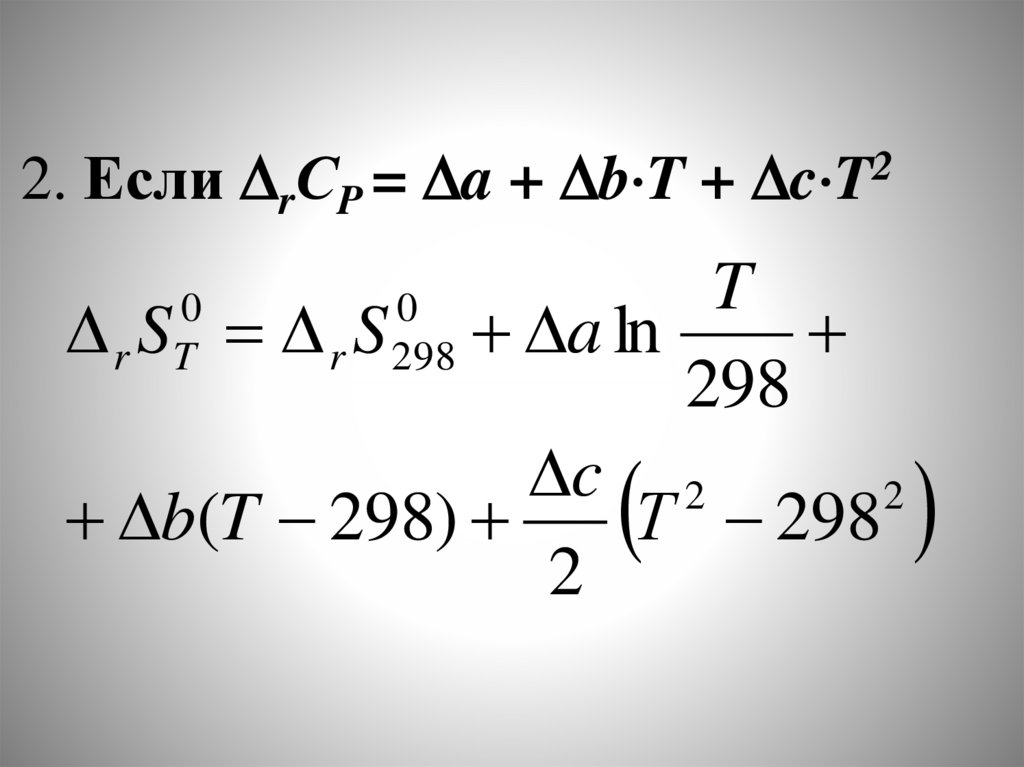

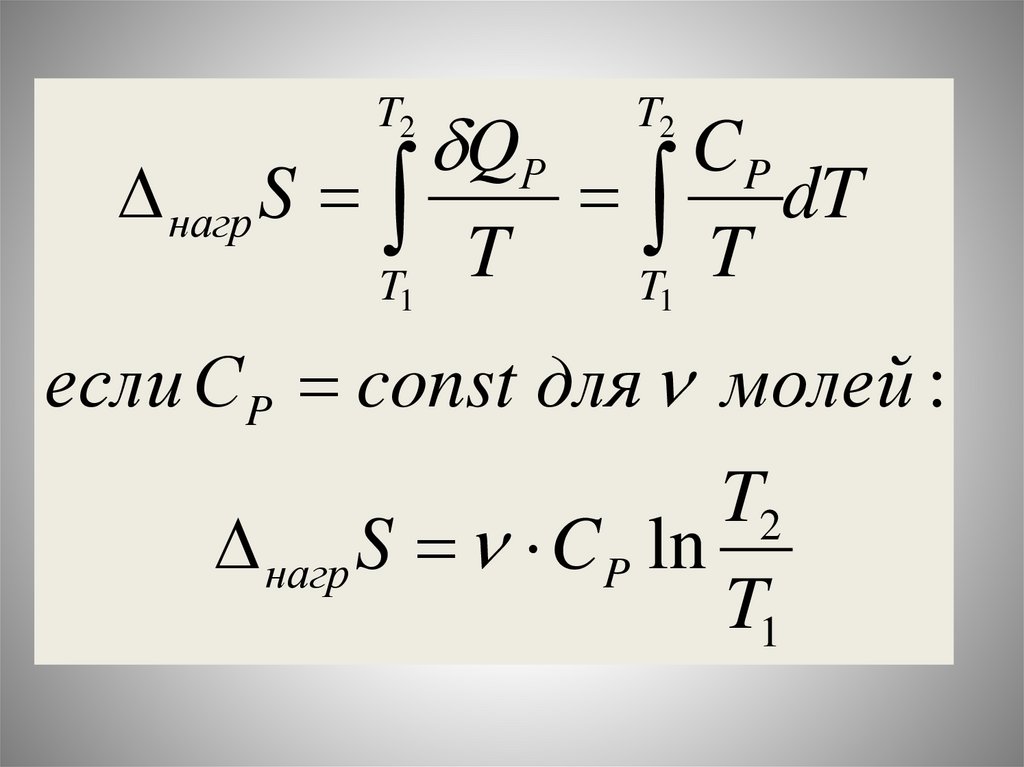
















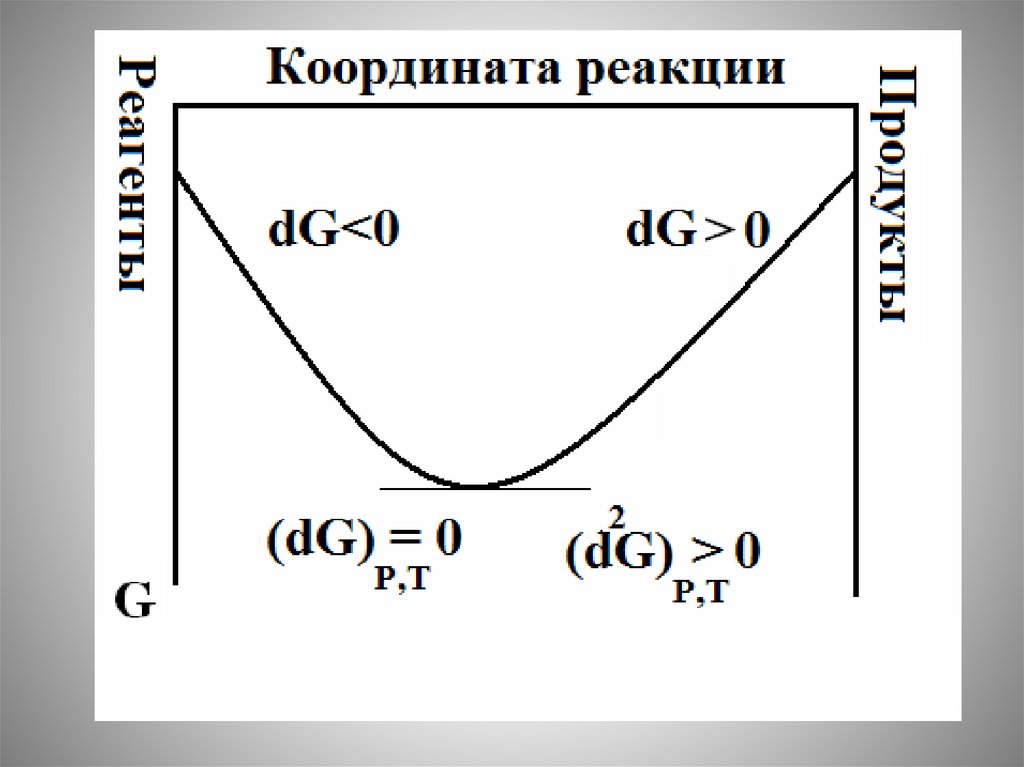





























 Химия
Химия








