Похожие презентации:
Обратимые и необратимые реакции. Химическое равновесие и его смещение
1.
Обратимые инеобратимые реакции.
Химическое равновесие
и его смещение.
2.
Необратимые реакции — это реакции,при которых исходные вещества
полностью превращаются в продукты.
а) газа;
б) осадка;
в) воды.
3.
Например,• Na2CO3 + H2SO4 → Na2SO4 + H2O +↑CO2
• BaCl2 + H2SO4 →↓ BaSO4 + 2HCl
• 2NaOH + H2SO4 → Na2SO4 + 2H20
4.
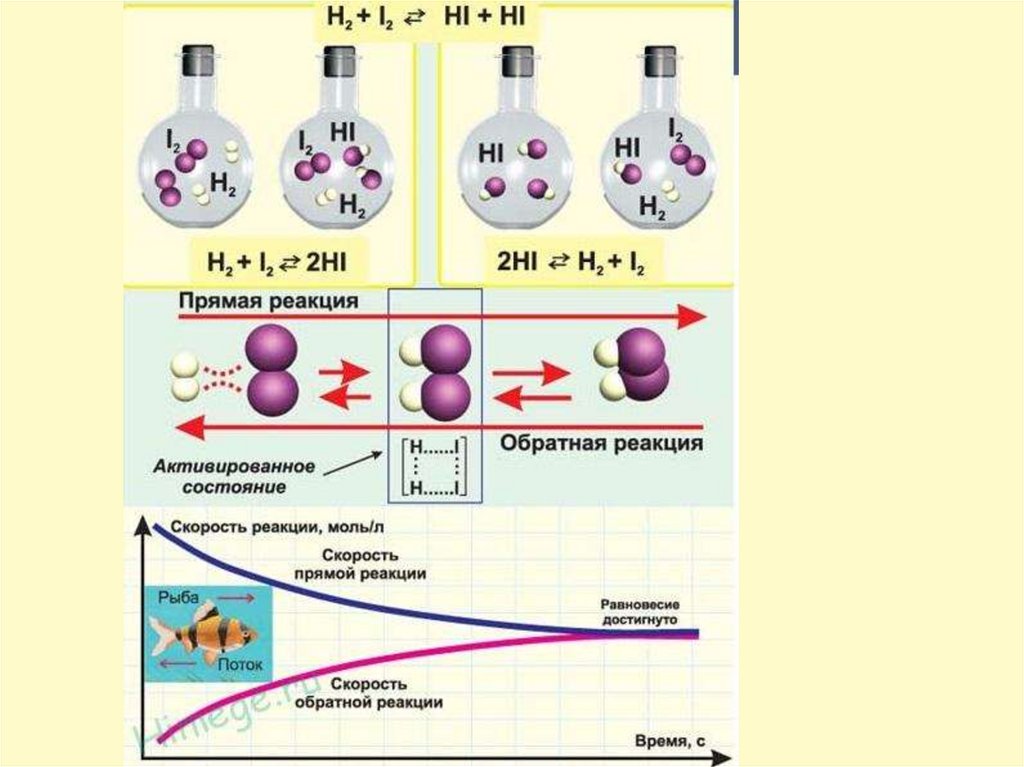
Обратимые реакции — химическиереакции, протекающие одновременно в
двух противоположных направлениях
(прямом и обратном).
N₂ + 3H₂ ↔ 2NH₃
N₂ + 3H₂ → 2NH₃ прямая реакция Vпр
2NH₃ → N₂ + 3H₂ обратная реакция Vобр
5.
6.
Состояние, когда скорость прямойреакции равна скорости обратной
реакции,
называют
химическим
равновесием.
Vпр = Vобр
На химическое равновесие влияют:
а) концентрации исходных веществ и продуктов;
б) температура;
в) давление.
7.
Принцип Ле-Шателье.При изменение внешних условий
химическое равновесие смещается
в сторону той реакции, которая
ослабляет внешние воздействия.
8.
Как сместится равновесие в системе:N₂ + 3H₂ ↔ 2NH₃ + Q ,
1 моль 3 моль
2 моль
1) При увеличении давления(р)
система стремится к уменьшению р (числа
молекул), т.е. вправо к NH₃( меньше молекул).→
2) При уменьшении t,
система стремится к увеличению t, т.е. вправо к
NH₃( в сторону экзотермической реакции). →
3) При уменьшении концентрации Н₂ система
стремится к увеличению конц. Н₂, т.е. влево к Н₂.←
9.
Влияние концентрации• При повышении концентрации одного из
исходных веществ равновесие сдвигается в
направлении образования продуктов
реакции;
• При повышении концентрации одного из
продуктов реакции равновесие сдвигается в
направлении образования исходных
веществ.
10.
Влияние температурыПри повышении температуры химическое
равновесие смещается в направлении
эндотермической реакции, при понижении
температуры
—
в
направлении
экзотермической реакции.
Экзотермическая реакция идет с выделением
тепла +Q
Эндотермическая
реакция
идет
с
поглощением тепла –Q.
11.
Влияние давления• При повышении давления равновесие
сдвигается в направлении образования
веществ (исходных или продуктов) с
меньшим объемом;
• При понижении давления равновесие
сдвигается в направлении образования
веществ с большим объемом.
12.
Перечислить факторы смещения равновесиявправо в реакции:
C +CO2 ↔2CO – Q
O2 + 2H2 ↔ 2H₂O + Q


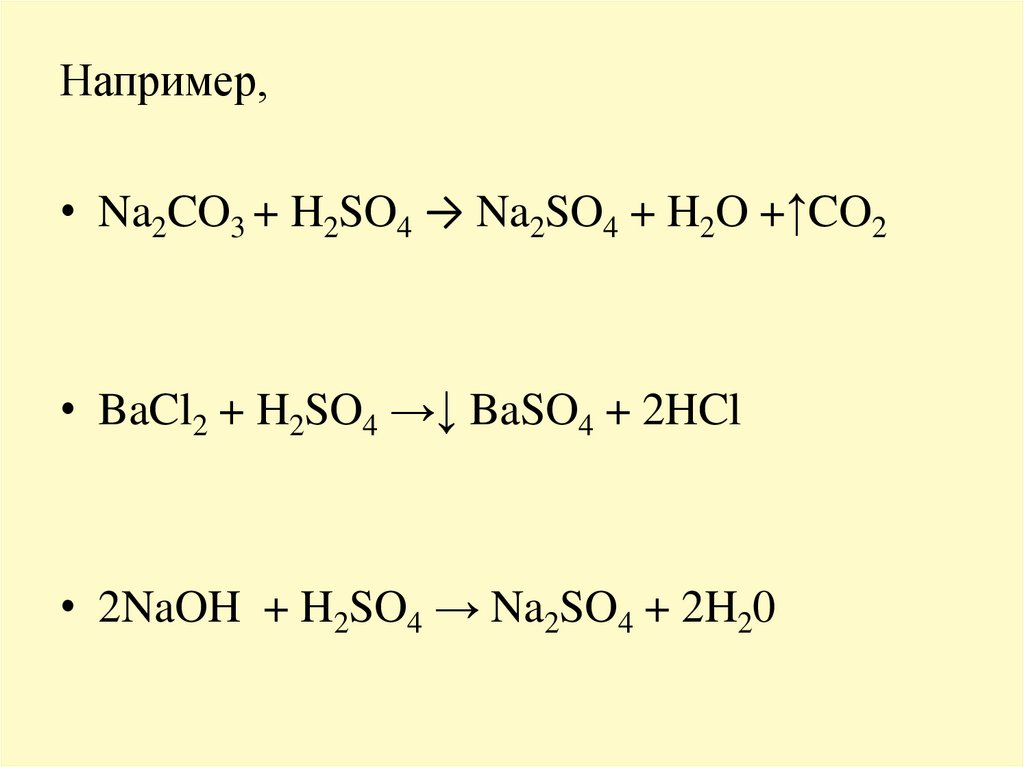








 Химия
Химия








