Похожие презентации:
Обратимость химических реакций. Химическое равновесие
1.
Обратимость химических реакций.Химическое равновесие.
2.
Химическиереакции
Необратимые
А+В→С+D
Это химические реакции, протекающие
только в одном направлении.
- РИО (↑ ↓, H2O)
3.
Химическиереакции
Обратимые
А+В⇆С+D
Это химические реакции, протекающие
одновременно и в прямом и в обратном
направлениях.
t 1000
2H2 + O2 ⇆ 2H2O
400
t = 600 C
4.
5.
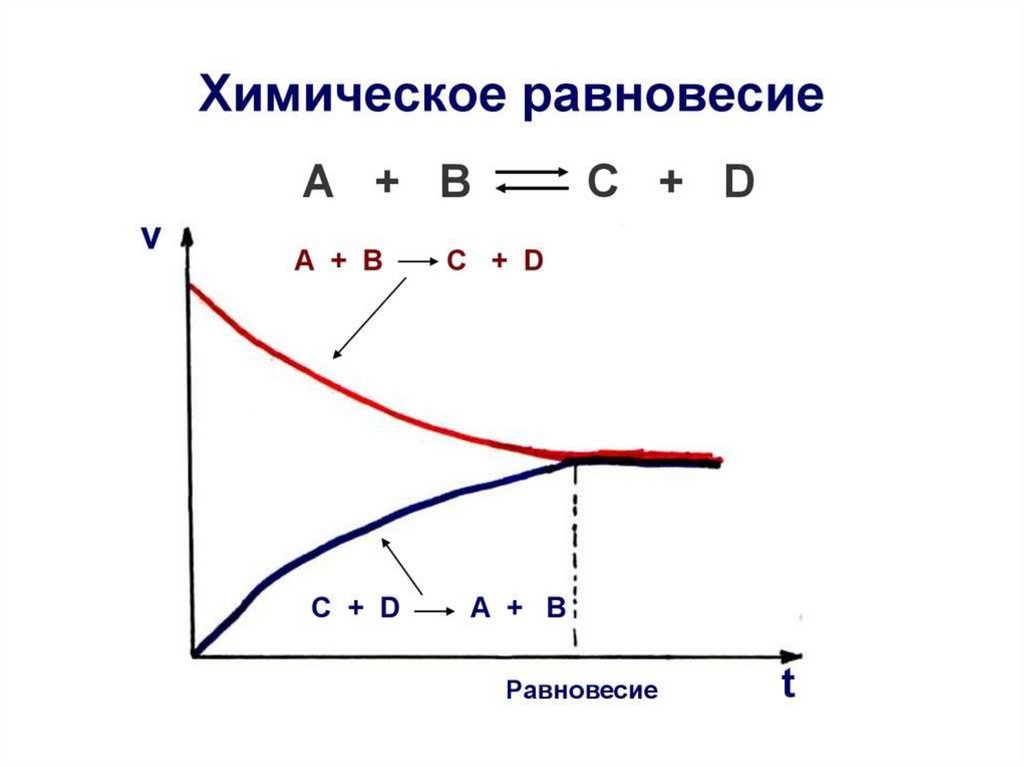
Химическое равновесие — это динамическоесостояние обратимой реакции, при котором
скорость прямой реакции, равна скорости
обратной реакции.
Vпр. = Vобр.
6.
Принцип Ле — ШательеЕсли на систему, находящуюся в равновесии
оказать внешнее воздействие, то равновесие в
системе сместится в сторону той реакции,
которая ослабит это воздействие.
7.
Факторы, влияющие на химическое равновесие1) температура
2) давление
3) катализаторы
8.
1) Влияние температурыРеакции, сопровождающиеся выделением
теплоты, называются экзотермическими.
N2 + 3H2 → 2 NH3 + Q (экзо-)
Реакции, сопровождающиеся поглощением
теплоты, называются эндотермическими.
2NH3 → N2 + 3H2 - Q (эндо- )
9.
T ↑ , равновесие смещается в сторонуэндотермической реакции ( -Q ).
T ↓ , равновесие смещается в сторону
экзотермической реакции ( + Q).
- Q N2 + 3H2 ⇆ 2NH3 + Q
10.
ПримерQ-
С(т)+O2(г) CO2(г)
T ↑, равновесие сместится ВЛЕВО
T ↓, равновесие сместится ВПРАВО
+Q
11.
2) Влияние давленияСмещение равновесия возможно ТОЛЬКО ДЛЯ
ГАЗООБРАЗНЫХ веществ!!!!
Р ↑, равновесие смещается в сторону меньшего
объема.
Р ↓, равновесие смещается в сторону большего
объема.
12.
При понижении давления равновесие сдвигается в напрПример1.
СаО (т) + СО2 (г) СаСО3 (т)
0 + 1
0
При повышении давления равновесие
смещается в сторону меньшего числа моль, т.е. вправ
13.
Пример 2N2 (г)+ 3H2(г) ↔ 2NH3 (г)
1 моль + 3 моль ↔ 2 моль
4↔2
При понижении давление равновесие сместится в сторон
При повышении давления равновесие сместится в сторон
14.
3) Влияние концентрацииКатализаторы не влияют на положение равновесия!
При введении катализатора ускоряется скоро
15.
↑ концентрацию реагентов, равновесиесместится в сторону продуктов ( в сторону прямой
реакции);
↑ концентрацию продуктов реакции, равновесие
сместится в сторону реагентов ( в сторону обратной
реакции).
16.
ПримерСО2 (г)+ Н2(г) ↔СО(г) + Н2О (г)
При повышении концентрации водорода равновесие
При повышении концентрации угарного газа равнове
17.
влением смещения химического равновесия в этой реакции. К каждой позиции,SO2(г) + Cl2(г) ⇆ SO2Cl2(г)
Внешнее воздействие
1. добавление SO2
2. понижение давления
3. повышение давления
4. повышение содержания
Смещение химического равновесия
A. в сторону продуктов реакции
B. в сторону исходных веществ
C. не происходит смещения
SO2Cl2
18.
Установите соответствие между уравнением химической реакции инаправлением смещения химического равновесия при увеличении давлени
Уравнение реакции
1. N2(г) + 3H2(г) ⇆ 2NH3(г)
Смещение химического равновесия
A. в сторону продуктов реакции
2. 2Н2(г) + О2(г) ⇆ 2Н2О(г)
B. в сторону исходных веществ
3. H2(г) + Cl2(г) ⇆ 2НCl(г)
C. не происходит смещения
4. СН4(г) ⇆ С(т) + 2Н2(г)
19.
Установите соответствие между способом воздействия на равновесную системMgO(тв) + CO2(г) ⇆ MgCO3(тв) +Q
Внешнее воздействие
1. уменьшение температуры
Смещение химического равновесия
A. в сторону прямой реакции
2. уменьшение концентрации СО2
B. в сторону обратной веществ
3. уменьшение давления
C. практически не смещается
4. добавление катализатора


















 Химия
Химия








