Похожие презентации:
Второе начало термодинамики
1. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
2.
Самопроизвольные процессы в природе протекаюттолько в одном направлении и до определенного
предела.
Формулировки:
1. Невозможен самопроизвольный переход тепла
от тела менее нагретого к телу более нагретому.
2. Невозможно превратить теплоту в работу, не
производя
никакого другого действия, кроме
охлаждения источника теплоты.
3. Вечный двигатель второго рода невозможен.
Двигатель, единственным результатом действия
которого было бы получение работы за счет тепла
окружающей среды.
2
3.
Всесамопроизвольные
процессы
в
макроскопических
системах
протекают
в
направлении от менее вероятного к более
вероятному состоянию системы (Больцман)
Термодинамическая
функция,
которая
характеризует меру неупорядоченности системы,
т.е. неоднородность расположения и движения ее
частиц, называется ЭНТРОПИЕЙ (S).
Q
S ;
T
Для изобарного
процесса
Дж/моль К
H
S
;
T
= для обратимого процесса
∆H = T . ∆S
> для необратимого процесса
∆H < T . ∆S
3
4.
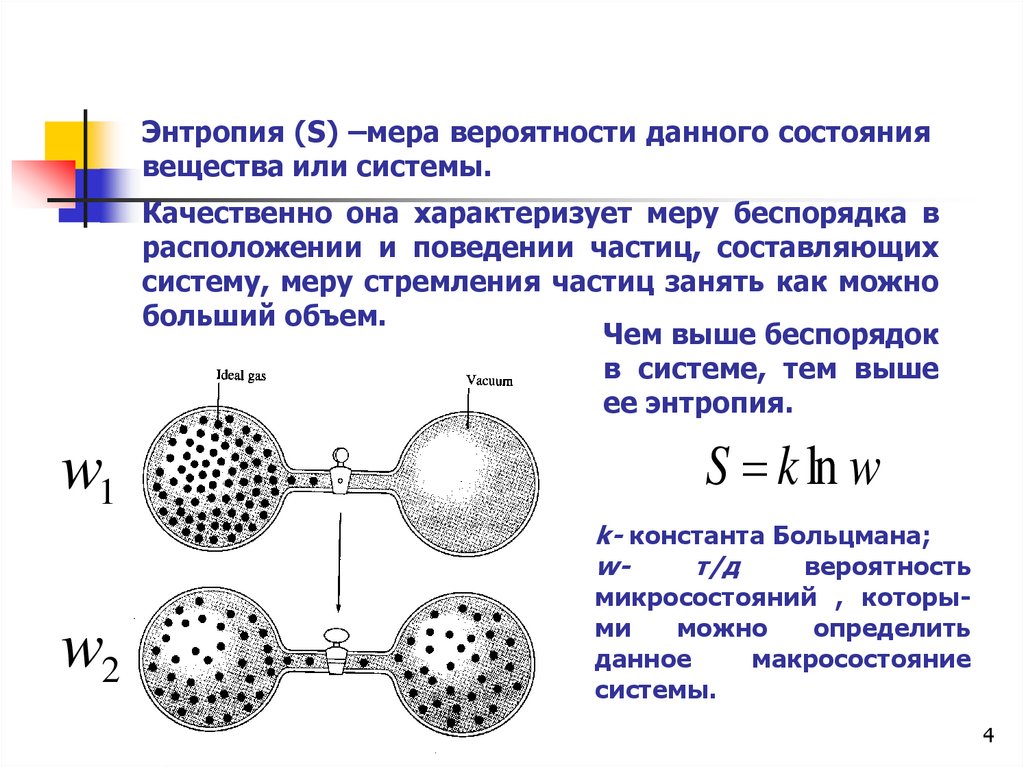
Энтропия (S) –мера вероятности данного состояниявещества или системы.
Качественно она характеризует меру беспорядка в
расположении и поведении частиц, составляющих
систему, меру стремления частиц занять как можно
больший объем.
Чем выше беспорядок
в системе, тем выше
ее энтропия.
w1
S k ln w
k- константа Больцмана;
wт/д
вероятность
w2
микросостояний , которыми
можно
определить
данное
макросостояние
системы.
4
5.
S S2 S1;w2
S k ln w2 k ln w1 k ln
w1
Т.к. в самопроизвольном
процессе
S - энтропийный фактор
w2 w1 , то S 0
В изолированных системах самопроизвольно могут
совершаться только такие необратимые процессы,
при которых энтропия системы возрастает (S >0).
При
достижении
равновесия
энтропия
изолированной системы максимальна, а ∆S=0.
S х. р n(S )прод m(S )исх
0
0
0
5
6.
Энтропия зависит от следующих факторов:1. От агрегатного состояния и природы вещества
S(газ) > S(жидк.) > S(тв.)
2. От температуры. С увеличением температуры
энтропия возрастает
3. При повышении давления энтропия уменьшается
т.к. снижается неупорядоченность движения частиц.
4. С увеличением числа частиц в системе энтропия
увеличивается
6
7.
Энергия Гиббса - изобарно-изотермический потенциалили свободная энергия.
G H T S
или
G U P V T S или
U G P V T S
∆G – часть внутренней энергии системы, способная
при изобарно-изотермических условиях превратиться
в работу.
P∆V- часть внутренней энергии, затрачиваемая
системой на совершение работы против сил внешнего
давления .
T∆S – «связанная энергия», представляющая собой
часть внутренней энергии, которая в указанных
условиях не может быть превращена в работу.
«Связанная энергия» тем больше, чем больше
энтропия системы.
7
8.
Биохимическиереакции,
сопровождающиеся
уменьшением энергии Гиббса (∆G < 0), называют
экзергоническими
Биохимические
реакции,
сопровождающиеся
увеличением энергии Гиббса (∆G > 0), называют
эндергоническими и они невозможны без внешнего
подвода энергии
ПРИНЦИП ЭНЕРГЕТИЧЕСКОГО СОПРЯЖЕНИЯ
БИОХИМИЧЕСКИХ РЕАКЦИЙ
В энергетическое сопряжение вступают реакции,
характеризующиеся большой убылью свободной
энергии. В основном это реакция гидролиза АТФ
8
9.
В условиях организма гидролиз АТФ сопровождаетсяпереносом фосфата на другой субстрат
+13,4 кДж/моль
- 30,5 кДж/моль
- 17,1 кДж/моль
При образовании сложного эфира глюкозы и фосфорной
кислоты необходима энергия реакции гидролиза АТФ
Суммарная реакция идет самостоятельно.
9








 Химия
Химия








