Похожие презентации:
Второе начало термодинамики
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙМЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Кафедра химии
• Функции состояния системы. Энтропия.
Энергия Гельмгольца. Энергия Гиббса.
Химический потенциал
• Второе начало термодинамики
• Термодинамика химического равновесия
2.
Энтропия характеризует связанную энергию. Вреальных необратимых системах только часть
энергии превращается в работу, другая часть
энергии является как бы связанной. Мера
неупорядоченности системы.
3.
ЭнтропияЭнтропия (по Клаузиусу) – функция
состояния система, приращение которой (ΔS)
равно
минимальной
теплоте
(Qmin),
поступившей в систему в обратимом
изотермическом процессе, деленной на
абсолютную температуру (Т), при которой
совершается этот процесс.
ΔS = Qmin / T, [Дж · моль-1 · К-1].
4.
ЭнтропияЭнтропия связана с вероятностью состояния
системы уравнением Больцмана:
S = КБ · lnW, где
KБ - постоянная Больцмана,
KБ = R / Nа = 1,38· 10-23 Дж · К-1;
W - вероятность состояния системы, т.е. число
микросостояний, которым может быть реализовано
данное макросостояние.
Опытным путем определяют приращение
энтропии: ΔS = S2 – S1.
5.
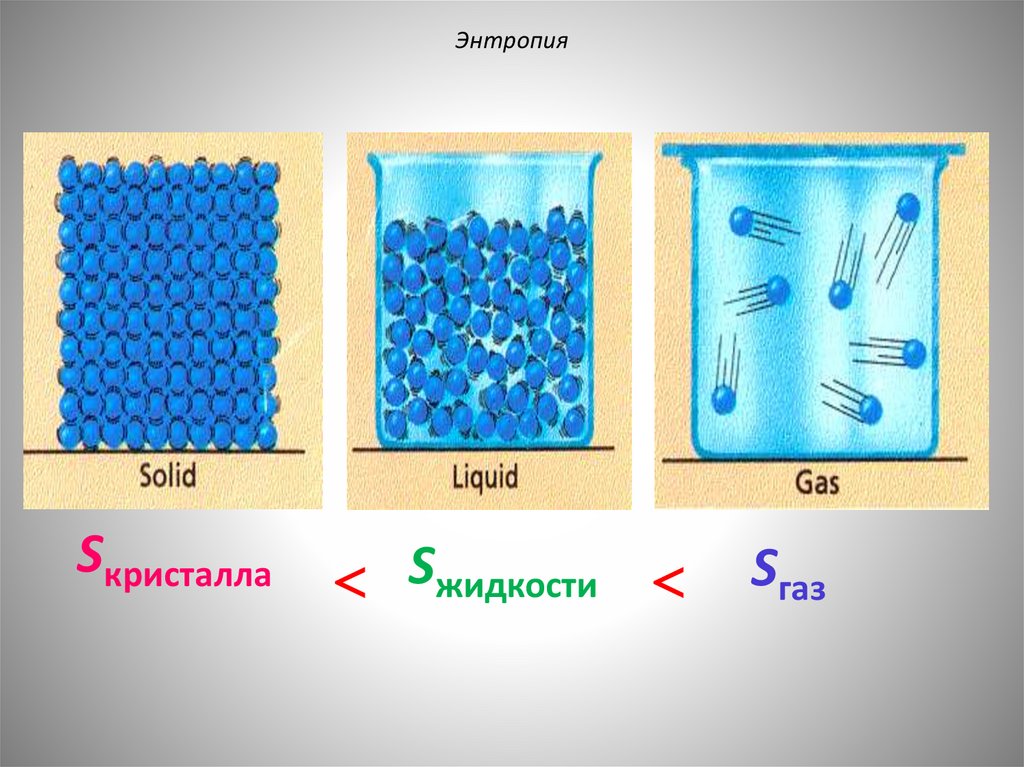
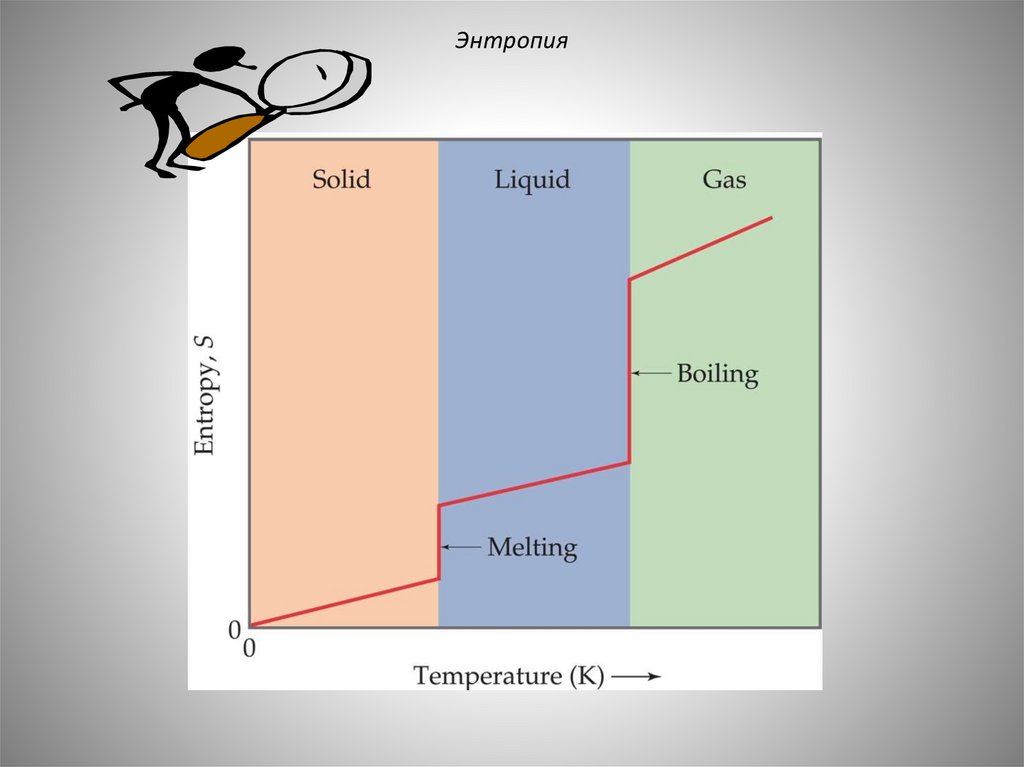
ЭнтропияЧем выше энтропия, тем больше неупорядоченность системы.
6.
ЭнтропияSкристалла
Sжидкости
Sгаз
7.
Энтропия8.
ЭнтропияРостом энтропии ΔS ˃ 0 сопровождаются такие
самопроизвольные процессы, как испарение
жидкости, таяние льда, растворение веществ в
растворителях, т.е. процессы, которые приводят к
увеличению беспорядка в системе.
Снижением энтропии ΔS ˂ 0 сопровождаются
процессы кристаллизации веществ,
реакции
полимеризации, поликонденсации, т.е. процессы,
которые приводят к увеличению упорядоченности в
системе.
9.
ЭнтропияКак бы Вы описали объект, у которого S = 0?
0K
Абсолютно твердый кристалл
без движения
Чисто теоретически
Невозможно достигнуть абсолютного
нуля!
10.
ЭнтропияЭнтропия Вселенной всегда возрастает!
“Мама, это не моя вина…
Это Вселенная хочет, чтобы моя
комната выглядела так!”
11.
ЭнтропияДля изолированных систем
является
критерием
протекания процессов:
энтропия
самопроизвольного
a) Самопроизвольный процесс: S > 0
b) Обратный процесс:
S < 0
c) Состояние равновесия:
S = 0
12.
ЭнтропияПриращение энтропии:
1.) Ag+(р-р)+ Cl-(р-р) AgCl(к)
1) S < 0
2.) NH4Cl(к) NH3(г)+ HCl(г)
2) S > 0
3.) H2(г) + Br2(г) 2HBr(г)
3) S?
13.
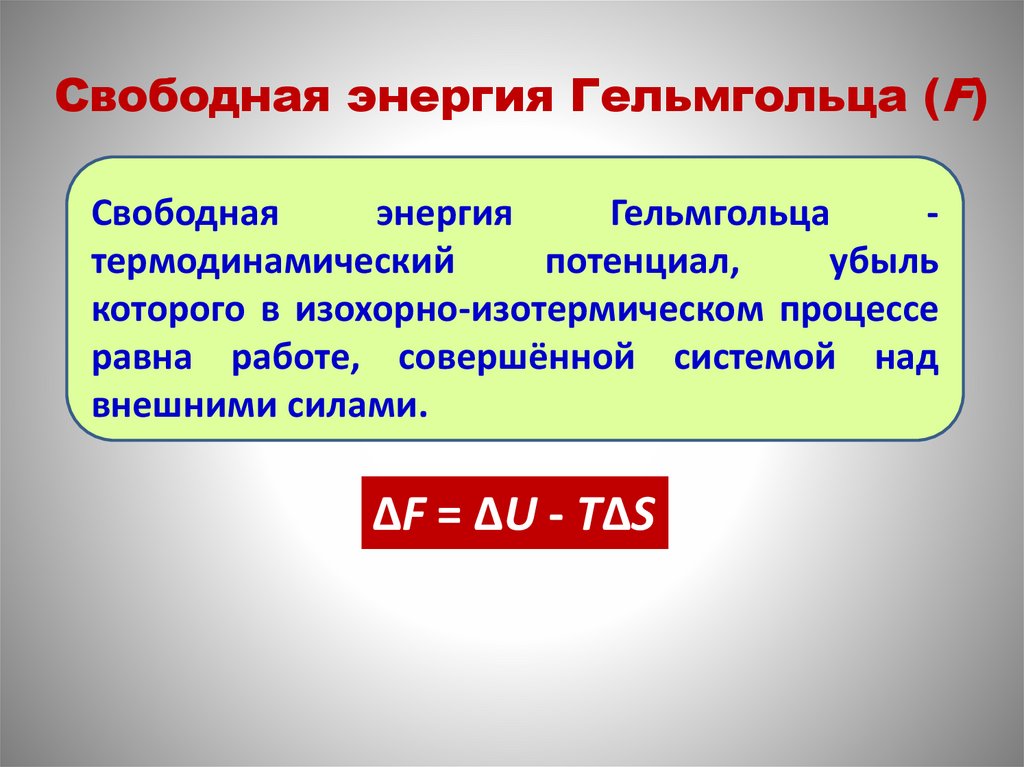
Свободная энергия Гельмгольца (F)Свободная
энергия
Гельмгольца
термодинамический
потенциал,
убыль
которого в изохорно-изотермическом процессе
равна работе, совершённой системой над
внешними силами.
ΔF = ΔU - TΔS
14.
Свободная энергия Гиббса (G)Свободная энергия Гиббса (G) или изобарноизотермический
потенциал
это
часть
потенциальной энергии реагирующих веществ,
которая может быть использована для
осуществления полезной работы.
При протекании изобарно-изотермических
процессов:
ΔG = ΔH - TΔS
15.
Свободная энергия ГиббсаАнализ уравнения:
1. Энтальпийный фактор ΔH. Определяет
стремление системы снизить свою энергию за счет
образования сложных частиц из более простых,
при этом совершается полезная работа.
2. Энтропийный фактор TΔS. Определяет
стремление
системы
к
хаотичному
неупорядоченному состоянию за счет распада
сложных
частиц
на
более
простые
и
распределению их по всему объему системы.
16.
Свободная энергия ГиббсаВеличина ΔG служит критерием возможности
самопроизвольного протекания процессов.
Процесс протекает самопроизвольно, если ΔG < 0.
При ΔG > 0, процесс самопроизвольно не протекает.
Если ΔG = 0, то в системе установилось состояние
равновесия.
17.
Свободная энергия ГиббсаВлияние температуры на знак и величину ΔG:
1. При ΔН > 0 , ΔS > 0 , процесс протекает
самопроизвольно только при высоких температурах.
2. При ΔН > 0, ΔS < 0 , процесс самопроизвольно не
протекает ни при каких температурах.
3. При ΔН < 0, ΔS > 0, процесс самопроизвольно
протекает при любых температурах.
4. При ΔН < 0, ΔS < 0, процесс самопроизвольно
протекает только при низких температурах.
18.
Химический потенциал(μ)Химический потенциал какого-либо вещества в
системе равен отношению энергии Гиббса (G) к
количеству вещества (n).
μ = G(x)/n(x),
отсюда G(х) = n(х)·μ(х)
Если система состоит из нескольких веществ x1, x2, x3…,
то: G = n(x1) ·μ(x1)+n(x2) ·μ(x2)+n(x3) ·μ(x3) + …
19.
Свободная энергия ГиббсаДля вещества, находящегося в растворе, μ зависит от
концентрации раствора, и природы растворителя.
Уравнением изотермы:
μ(x) = μ0(x) + R·T·InC(x), где
μ(x) – химический потенциал [Дж · моль-1];
μ0(x) – стандартный химический потенциал;
С(x) – молярная концентрация вещества x [моль·дм-3].
С увеличением концентрации вещества в системе
значение μ увеличивается, т.е. ∆μ(х) ˃ 0, а с
уменьшением – снижается, т.е. ∆μ(х) ˂ 0.
20.
Второе начало термодинамикиВторой закон термодинамики устанавливает
направление протекания самопроизвольных
процессов.
21.
Второе начало термодинамикиСуществуют различные
равнозначные по смыслу
формулировки 2-го начала
термодинамики.
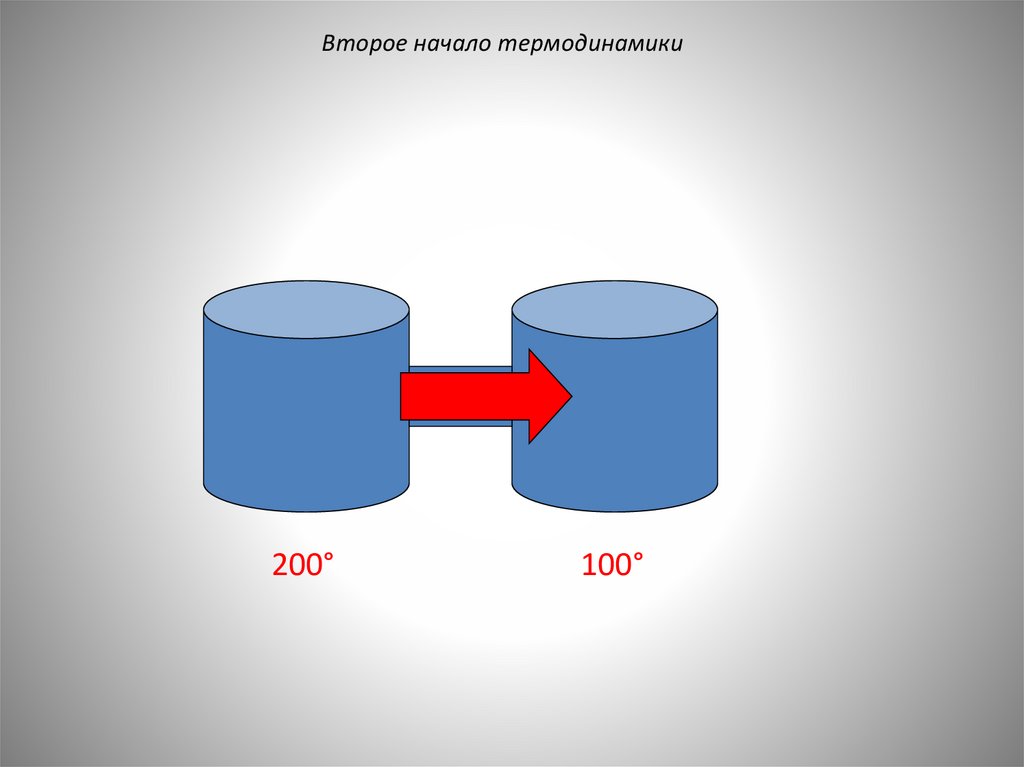
М.В. Ломоносов (1850),
Р. Клаузиус, (1850): теплота не
может переходить сама
собой от более холодного
тела к более теплому.
22.
Второе начало термодинамики23.
Второе начало термодинамики200°
100°
24.
Второе начало термодинамики200°
100°
25.
Второе начало термодинамики200°
100°
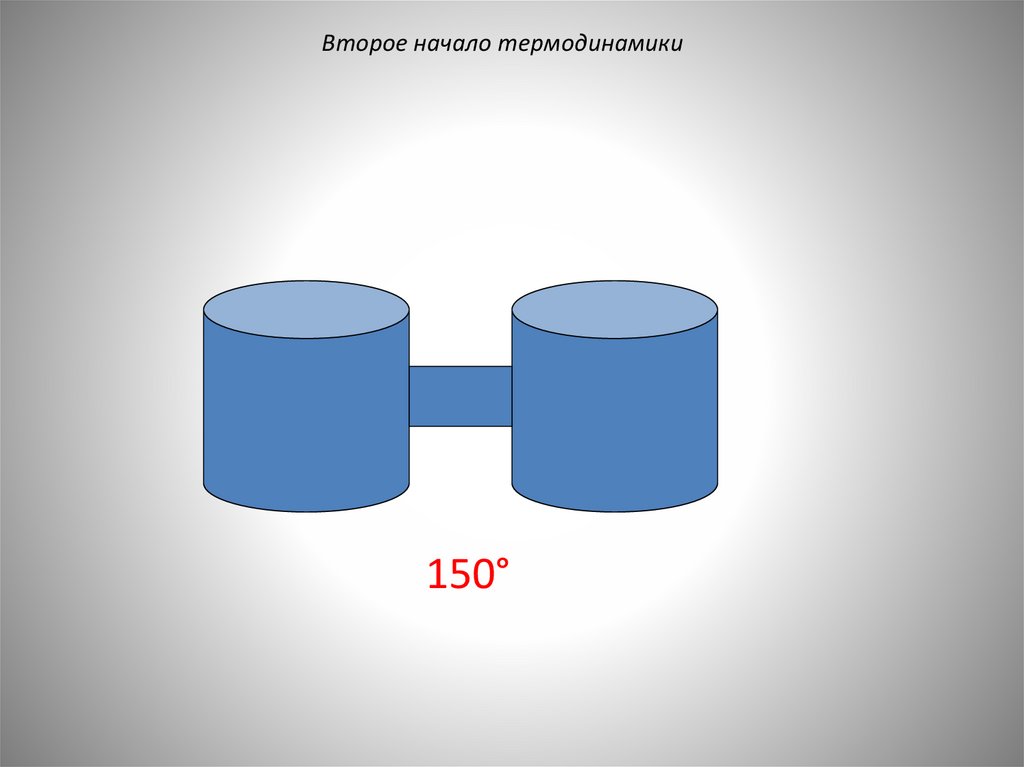
26.
Второе начало термодинамики150°
27.
Второе начало термодинамики150°
28.
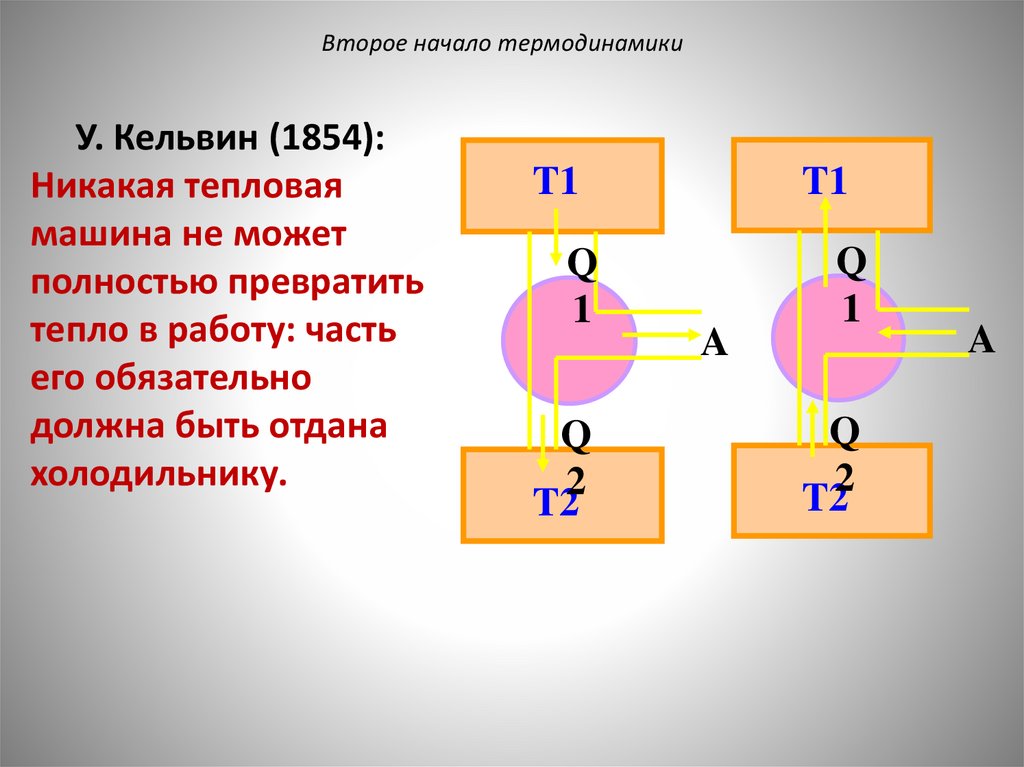
Второе начало термодинамикиУ. Кельвин (1854):
Никакая тепловая
машина не может
полностью превратить
тепло в работу: часть
его обязательно
должна быть отдана
холодильнику.
T1
T1
Q
1
Q
1
Q
2
T2
A
Q
T22
A
29.
Второе начало термодинамикиВ. Освальд (1888):
Невозможен вечный
двигатель второго рода,
т.е. невозможно полное
превращение теплоты в
работу.
30.
Второе начало термодинамикиПаровой двигатель
31.
СПОНТАННОНЕ-
СПОНТАННО
Второе начало термодинамики
Больцман: самопроизвольно
могут протекать только такие
процессы, при которых
система из менее вероятного
состояния переходит в более
вероятное состояние.
32.
Второе начало термодинамикиДля изолированной системы (при U = const,
V = const) критерием самопроизвольности
процесса является энтропия (S).
Процесс протекает самопроизвольно, если ΔS > 0.
Протекает обратный процесс, если ΔS < 0
В момент равновесия ΔS = 0.
33.
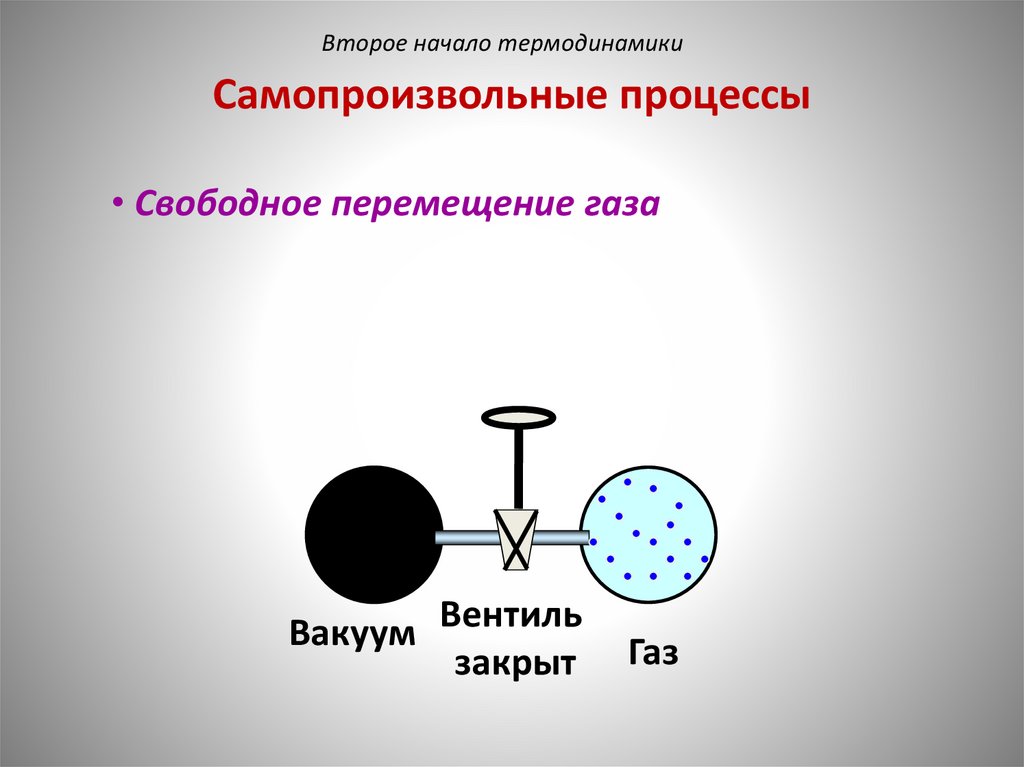
Второе начало термодинамикиСамопроизвольные процессы
• Свободное перемещение газа
Вакуум Вентиль
закрыт
Газ
34.
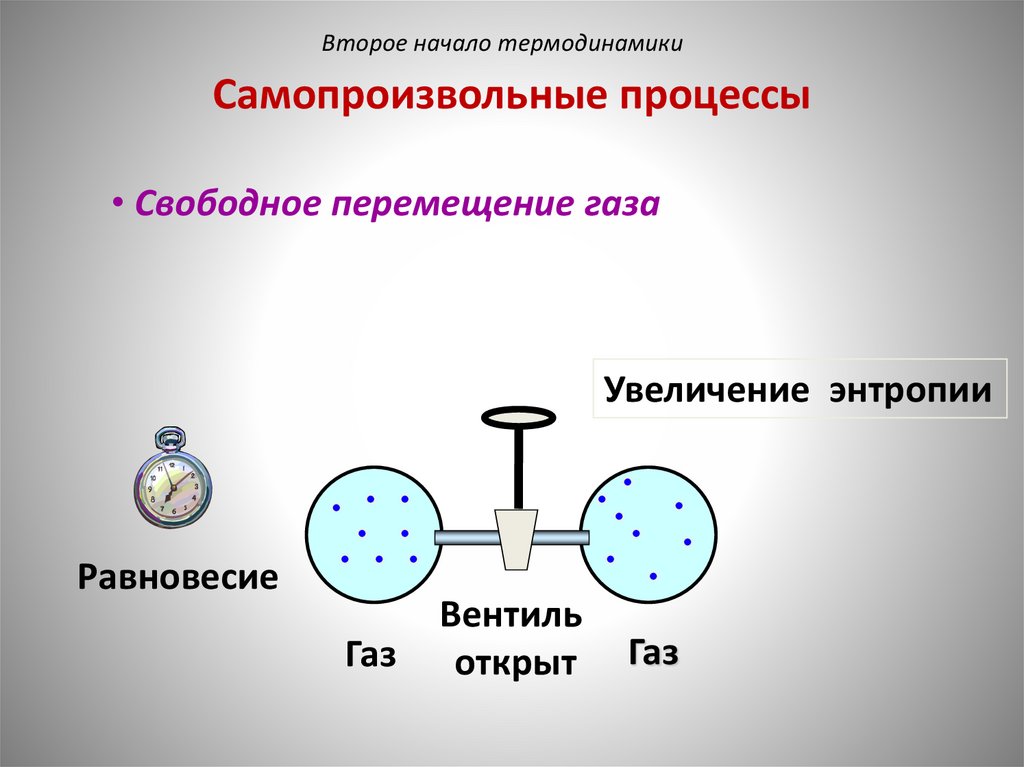
Второе начало термодинамикиСамопроизвольные процессы
• Свободное перемещение газа
Увеличение энтропии
Равновесие
Газ
Вентиль
открыт
Газ
35.
Второе начало термодинамикиСовременная формулировка: энергия
любого вида может переходить от одного
тела к другому только в том случае, если
термодинамический потенциал её у первого
тела выше, чем у второго.
36.
Второе начало термодинамикиДля процессов, протекающих при р = соnst и
Т = соnst, роль термодинамического потенциала
выполняет энергия Гиббса (изобарно-изотермический
потенциал),
а в случае процессов, протекающих при V = соnst и
Т = соnst – энергия Гельмгольца (изохорноизотермический потенциал).
37.
Второе начало термодинамикиВ условиях постоянной температуры и
давления
самопроизвольно
могут
протекать только такие процессы, при
которых система способна совершать
работу против внешних сил, то есть для
которых изменение энергии Гиббса –
величина отрицательная.
38.
Второе начало термодинамикиМатематическое выражение 2-го начала термодинамики:
ΔG0пр. = ∑nΔG0обр.(прод.) - ∑nΔG0обр.(реаг.)
ΔG0пр.= ΔН0 – ТΔS0
При ΔG < 0 процесс протекает самопроизвольно.
При ΔG > 0 процесс самопроизвольно не протекает.
При ΔG = 0 в системе установилось состояние
равновесия.
39.
Биоэнергетика39
40.
БиоэнергетикаОсобенности организации живых систем
Биологические системы являются
открытыми.
Процессы в живых системах в
конечном итоге необратимы.
Живые системы не находятся в
состоянии равновесия.
Все биологические системы
гетерогенны.
41.
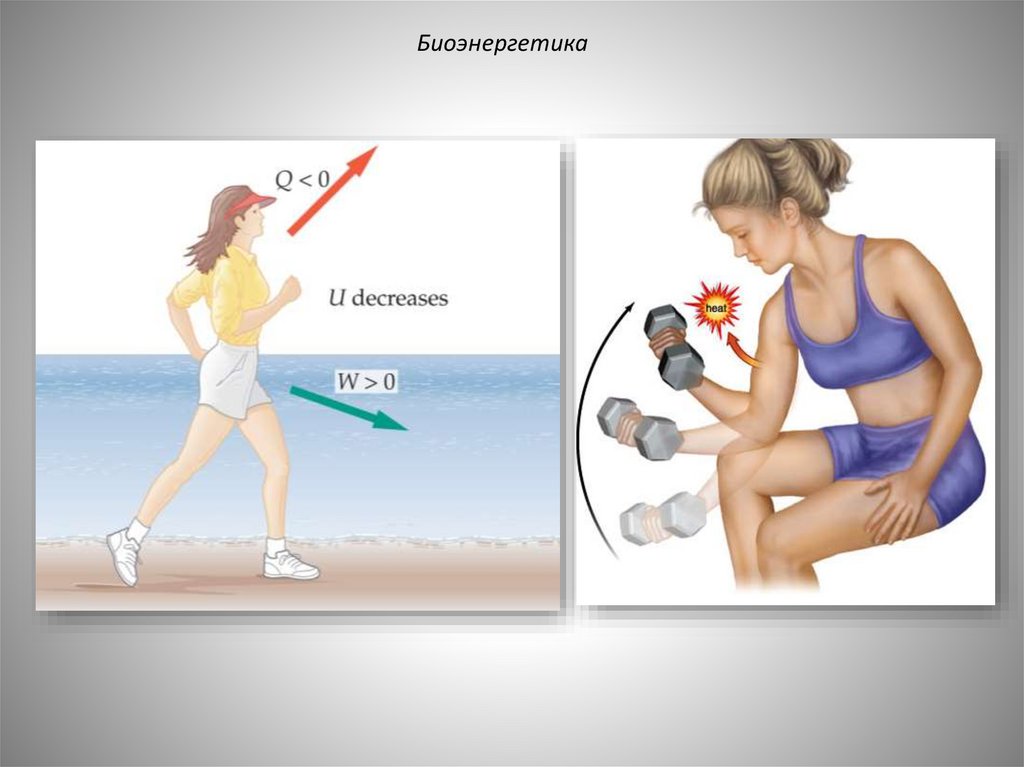
БиоэнергетикаОсновным источником энергии для организма
человека является химическая энергия, заключенная
в пищевых продуктах, часть которой расходуется на:
• совершение работы внутри организма, связанной с
дыханием, кровообращением и т.д.;
• нагревание вдыхаемого воздуха, потребляемой
воды и пищи;
• покрытие потерь теплоты в окружающую среду с
выдыхаемым
воздухом
и
с
продуктами
жизнедеятельности;
• на совершение внешней работы, связанной с
перемещениями
человека,
его
трудовой
деятельностью и т.д.
42.
Биоэнергетика43.
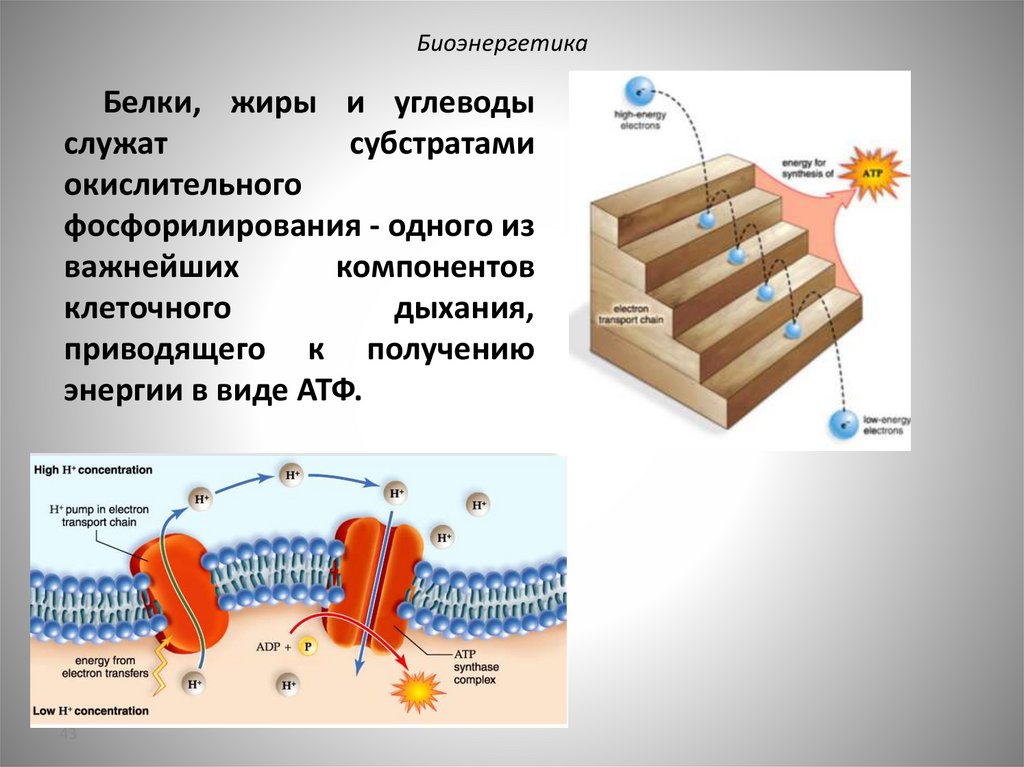
БиоэнергетикаБелки, жиры и углеводы
служат
субстратами
окислительного
фосфорилирования - одного из
важнейших
компонентов
клеточного
дыхания,
приводящего к получению
энергии в виде АТФ.
43
44.
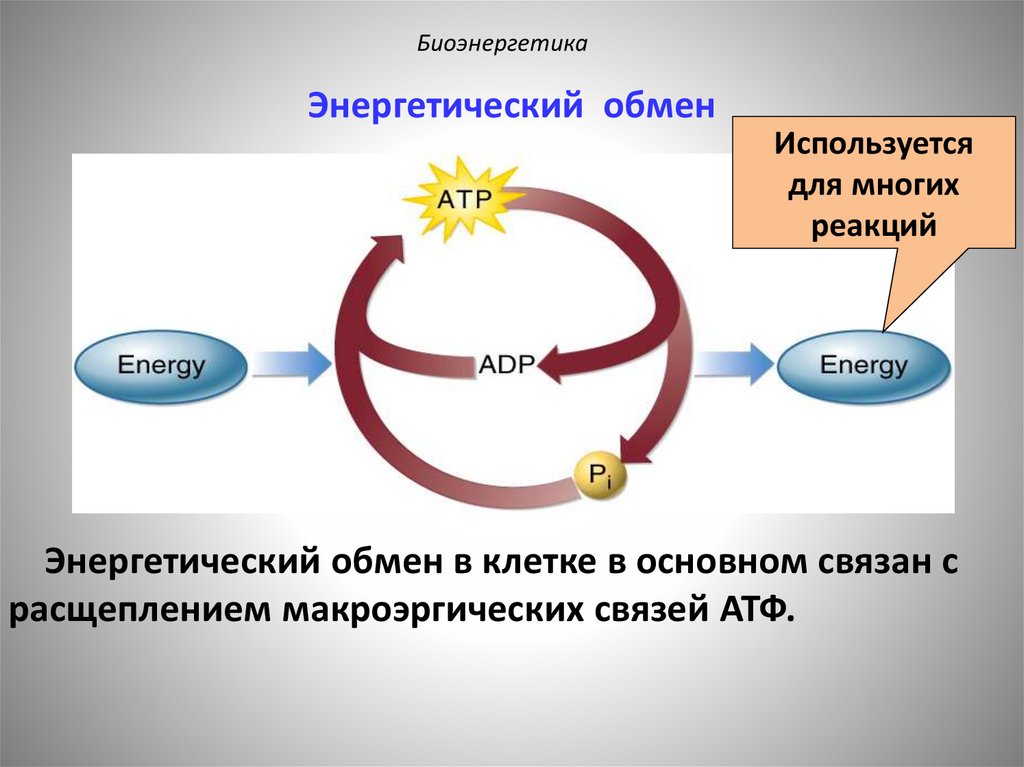
БиоэнергетикаЭнергетический обмен
Используется
для многих
реакций
Энергетический обмен в клетке в основном связан с
расщеплением макроэргических связей АТФ.
45.
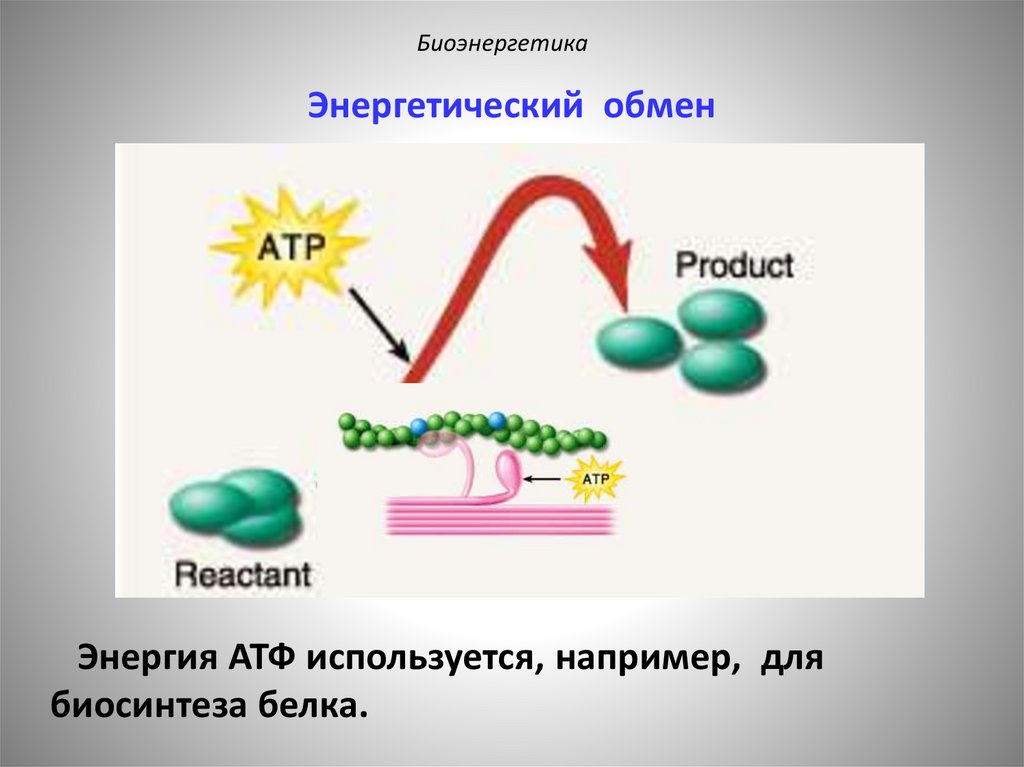
БиоэнергетикаЭнергетический обмен
Энергия АТФ используется, например, для
биосинтеза белка.
46.
БиоэнергетикаСостояние открытой системы, для
которой характерно постоянство ее
параметров, неизменность во времени
скоростей притока и удаления веществ и
энергии, называется стационарным.
47.
БиоэнергетикаВ термодинамике открытых систем важной
величиной является производная энтропии по
времени, которая показывает прирост энтропии в
единицу времени. В стационарном состоянии
организма эта производная всегда больше нуля.
Cнижении энтропии (негэнтропия) за счет
потребления организмом из окружающей среды
питательных веществ с низким значением
энтропии
происходит одновременно с
увеличением энтропии за счет выделения в среду
продуктов
распада,
обладающих
высокой
энтропией.
48.
БиоэнергетикаТеорема Пригожина
Производство энтропии системой,
находящейся в стационарном состоянии,
стремится к минимуму.
dS/dt = dSорг/dtорг + dSсреда/dtсреда
dS/dt – скорость изменения энтропии;
dSорг/dtорг – скорость изменения энтропии внутри
организма;
dSсреда/dtсреда – скорость изменения энтропии
вследствие обмена организма с окружающей
средой и массой и энергией.
49.
Термодинамика химического равновесия50.
Термодинамика химического равновесияРавновесное состояние такое состояние системы, когда при
постоянных внешних условиях параметры
системы не изменяются во времени.
Динамическое равновесие:
с одинаковой скоростью
51.
Термодинамика химического равновесияСостояние химического равновесия характеризуют
законом действующих масс.
Для обратимой химической реакции вида:
aA + bB ↔ dD + eE
при постоянных внешних условиях отношение
произведения концентрации продуктов к
произведению концентрации реагентов с
учетом
стехиометрии
есть
величина
постоянная
и
называется
константой
химического равновесия (KC).
52.
Термодинамика химического равновесияЗакон действующих масс (гомогенные
системы)
aA + bB
• c(A) = [A] = const
• c(B) = [B] = const
• c(D) = [D] = const
• c(E) = [E] = const
dD + eE
d
e
[ D] [ E ]
Kc
a
b
[ A] [ B]
Вещества в твердой фазе в уравнение не входят.
53.
Термодинамика химического равновесияКонстанта химического равновесия зависит
от природы реагирующих веществ и
температуры и не зависит от их концентрации.
Константа равновесия (КС ) может
изменяться от 0 до ∞.
Если k = 0, реакция не протекает;
K = ∞, реакция идет до конца;
K> 1, химическое равновесие смещено в
сторону образования продуктов;
K< 1, химическое равновесие смещено в
сторону образования реагентов.
54.
Сдвиг химического равновесияПринцип Ле Шателье (1884):
Любое
воздействие
на
систему,
находящуюся в состоянии химического
равновесия, вызывает в ней изменения,
стремящиеся ослабить это воздействие.
55.
Принцип Ле ШательеВлияние концентрации
d
e
[ D] [ E ]
Kc
a
b
[ A] [ B]
При V = const:
• Введение реагента
• Введение продукта
• Удаление реагента
• Удаление продукта
Kc = const
56.
Принцип Ле ШательеВлияние концентрации
2SO2 + O2
2SO3
• при увеличении концентрации О2
Kc = const
57.
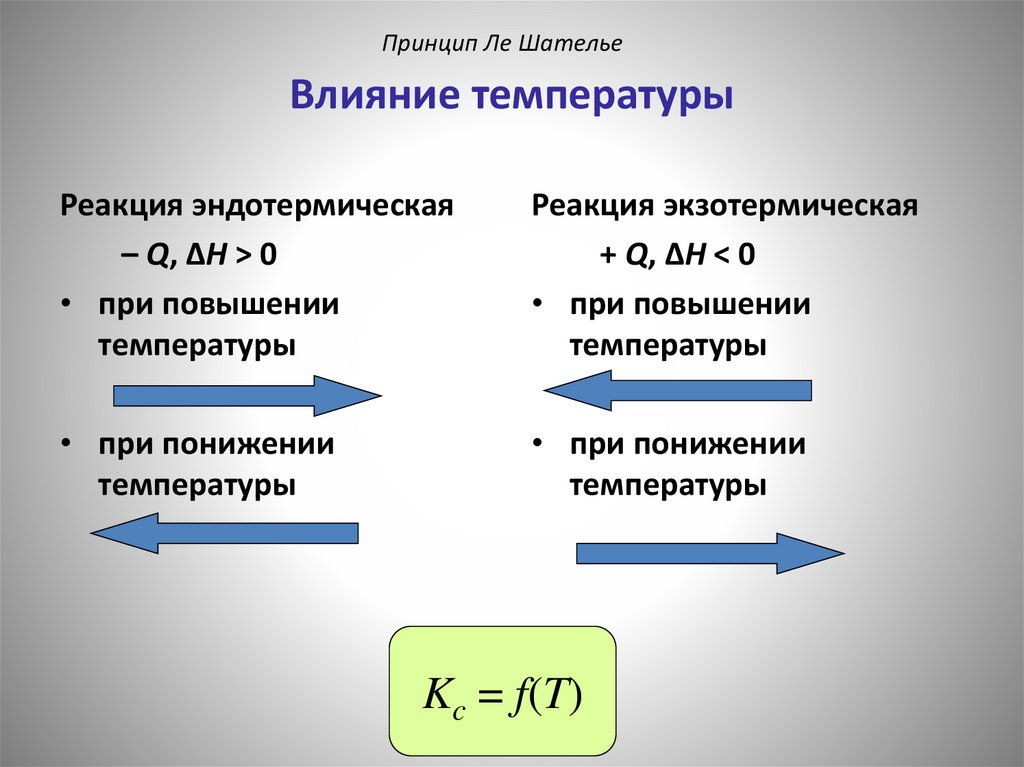
Принцип Ле ШательеВлияние температуры
Реакция эндотермическая
– Q, ΔH > 0
• при повышении
температуры
Реакция экзотермическая
+ Q, ΔH < 0
• при повышении
температуры
• при понижении
температуры
• при понижении
температуры
Kc = f(T)
58.
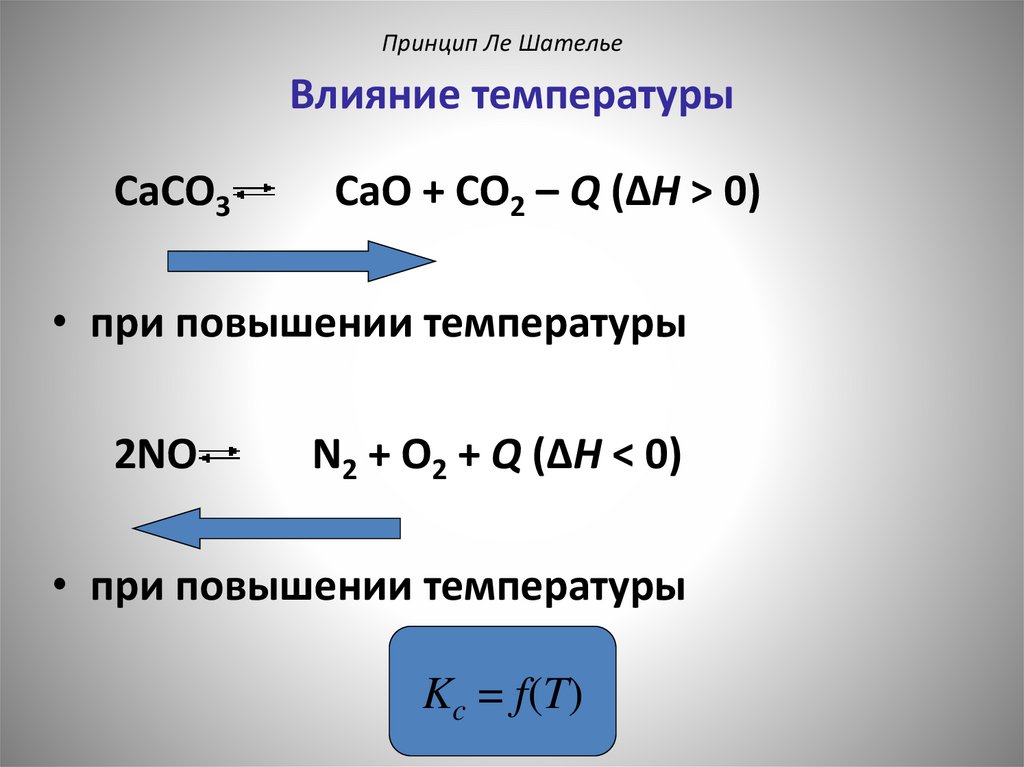
Принцип Ле ШательеВлияние температуры
CaCO3
CaO + CO2 – Q (ΔH > 0)
• при повышении температуры
2NO
N2 + O2 + Q (ΔH < 0)
• при повышении температуры
Kc = f(T)
59.
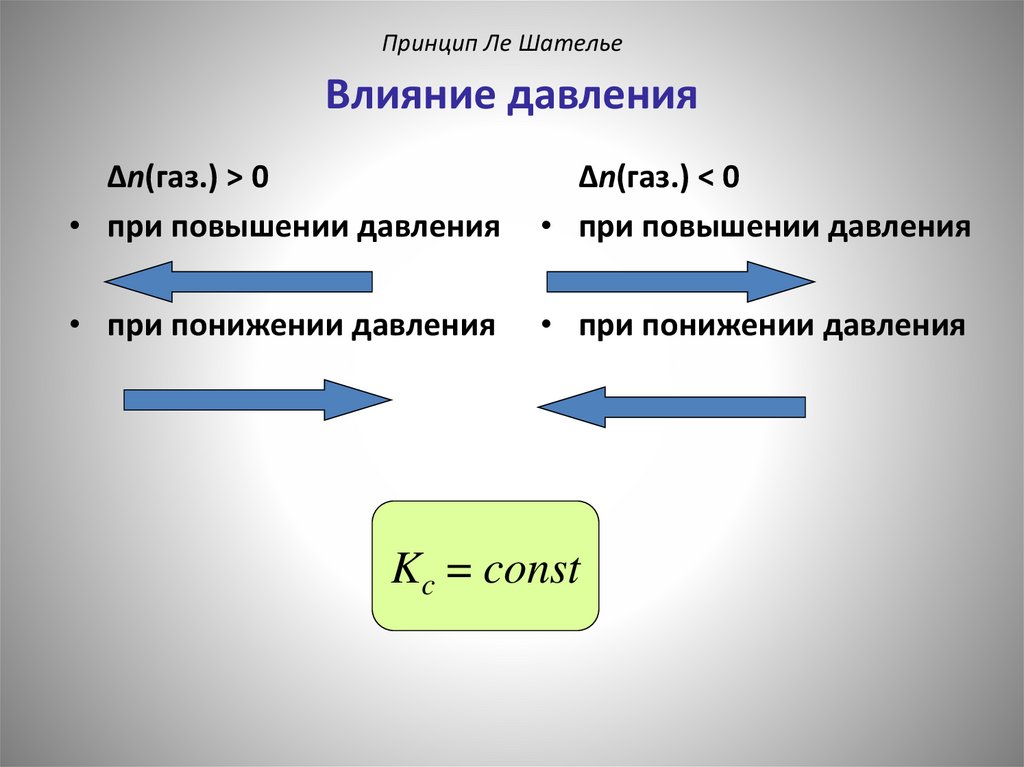
Принцип Ле ШательеВлияние давления
aA + bB
dD + eE
d
e
[ D] [ E ]
Kc
a
b
[ A] [ B]
если d + e = a + b
Δn(газ.) = 0
давление не влияет
60.
Принцип Ле ШательеВлияние давления
Δn(газ.) > 0
• при повышении давления
Δn(газ.) < 0
• при повышении давления
• при понижении давления
• при понижении давления
Kc = const
61.
Принцип Ле ШательеВлияние давления
N2 + 3H2
2NH3
Δn(газ.) = 2 – 4 < 0
• при повышении давления
62.
Принцип Ле ШательеВлияние катализатора
• не влияет на Kc
• не является реагентом или продуктом
• => не смещает химическое равновесие
• ускоряет его достижение
63.
Термодинамика химического равновесияНаправление данной химической реакции
общего вида:
aA + bB
cC + dD
при заданных концентрациях веществ (A, B, C, D)
при постоянной температуре можно представить с
помощью уравнения изотермы:
ΔGпроц. = ΔG0проц. + RTℓnПс,
где ΔGпроц. – изменение энергии Гиббса реакции,
ΔG0проц. – изменение стандартной энергии Гиббса
ΔG0проц. = -RТℓnКс.
64.
Термодинамика химического равновесияПс – величина стехиометрического соотношения
концентраций веществ, участвующих в реакции
при заданных условиях:
СCс • СDd
Пс a b
C A • CB
Преобразованное уравнение изотермы:
Gпроц. - RTlnКС RT ln ПС RT (ln ПС ln KС )
ПС
Gпроц. RTln
КС
65.
Термодинамика химического равновесияАнализ уравнения изотермы
Пс
Пс
1
,
ln
0, G 0
Если ПС > КС, то К
Кс
с
–
протекает обратный процесс.
Если ПС < КС, то
Пс
П
1, ln с 0, G 0 –
Кс
Кс
протекает прямой процесс.
Если ПС = КС, то П с 1, ln П с 0, G 0 –
Кс
состояние равновесия.
Кс
66.
Вопросы для самоконтроля1. Охарактеризуйте термодинамические
функции состояния (энтропия, свободная
энергия Гельмгольца, свободная энергия Гиббса,
химический потенциал).
2. В чем сущность современной формулировки
второго закона термодинамики?
3. Охарактеризуйте уравнение изотермы.
67.
СПАСИБО ЗА ВАШЕВНИМАНИЕ!
















































 Химия
Химия








