Похожие презентации:
Химическое равновесие и условия его смещения
1.
Химическое равновесиеи условия его смещения
2. Химические реакции
НеобратимыеРеакции, которые протекают
только в одном направлении,
т.е продукты этих реакций не
взаимодействуют друг с
другом с образованием
исходных веществ
Например:
BaCl2 + H2SO4→BaSO4↓ + 2HCl
2KMnO4→K2MnO4 + MnO2 + O2↑
NaOH + HNO3→NaNO3 + H2O
Обратимые
Реакции, которые
одновременно протекают в
прямом и обратном
направлениях
aA + bB ⇄ cC + dD
Например:
2SO2 + O2 ⇄ 2SO3
CO2 + H2O ⇄ H2CO3
3.
СO2 + H2O ⇄ H2СO3данная реакция не идет до конца потому, что
одновременно происходят две реакции –
прямая (между углекислым газом и водой)
и обратная (разложение угольной кислоты)
Химические реакции, протекающие при данных
условиях во взаимно противоположных
направлениях, называются обратимыми
4.
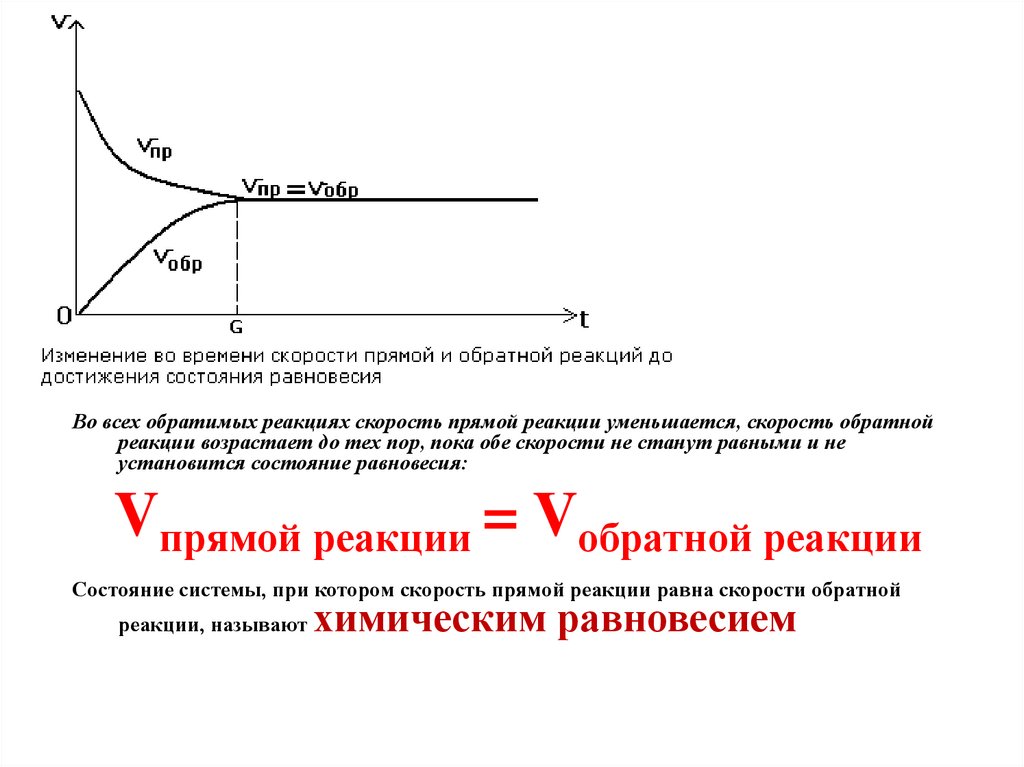
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратнойреакции возрастает до тех пор, пока обе скорости не станут равными и не
установится состояние равновесия:
Vпрямой реакции = Vобратной реакции
Состояние системы, при котором скорость прямой реакции равна скорости обратной
реакции, называют
химическим равновесием
5.
6.
Кр<1 в равновесной системе преобладаютисходные вещества
Кр>1 в равновесной системе преобладают
продукты реакции
7.
В состоянии химического равновесияколичественное соотношение между
реагирующими веществами и продуктами
реакции остается постоянным: сколько
молекул продукта реакции в единицу времени
образуется, столько их и разлагается.
Состояние химического равновесия сохраняется
до тех пор, пока остаются неизменными
параметры реакции:
концентрация,
температура
давление
8.
Принцип Ле-Шателье определяетнаправление смещения равновесия:
Если на систему, находящуюся в
равновесии оказали внешнее воздействие,
то равновесие в системе сместится в
сторону обратную этому воздействию
9. Влияние концентрации
если увеличить концентрацию исходныхвеществ, то равновесие смещается в сторону
образования продуктов реакции
и наоборот, если увеличить концентрацию
продуктов реакции, то равновесие смещается
в сторону образования исходных веществ
10. Влияние температуры
Запомнить: В состоянии химического равновесия, еслипрямая реакция экзотермическая (с выделением
теплоты), то обратная будет эндотермической (с
поглощением теплоты).
Вывод: увеличение температуры смещает равновесие в
сторону эндотермической реакции, а уменьшение
температуры – в сторону экзотермической реакции.
Примеры:
а) N2 (г) + 3H2 (г) ⇄ 2NH3 (г) + 92,4 кДж (экзотермическая
– выделение тепла)
При повышении температуры равновесие сместится в
сторону реакции разложения аммиака (←)
б) N2 (г) + O2 (г) ⇄ 2NO (г) – 180,8 кДж
кДж (эндотермическая - поглощение тепла)
При повышении температуры равновесие сместится в
сторону реакции образования NO (→)
11.
Влияние давления(только для газообразных веществ)
при повышении давления равновесие смещается в
сторону уменьшения объема (V), при понижении
давления – в сторону увеличения объёма(V)
Рассмотрим на примере реакции:
N2 (г) + 3H2 (г) ⇄ 2NH3 (г)
1V(N2 ) +3V(H2) ⇄ 2V(NH3)
При повышении давления (P):
В левой части уравнения реакции 4V газообразных
веществ
в правой части
уравнения 2V газообразных веществ,
следовательно, равновесие смещается вправо (→)
12.
Влияют ли катализаторы?На течение химической реакции влияют вещества –
катализаторы.
Но при использовании катализатора понижается
энергия активации как прямой, так и обратной
реакции на одну и ту же величину и
поэтому равновесие не смещается.
Вывод: катализаторы и ингибиторы не влияют
на смещение химического равновесия.
13.
Укажите, как повлияет:а) повышение давления;б) повышение температуры;
в) увеличение концентрации кислорода на
равновесие системы:
2CO (г) + O2 (г) ⇄ 2CO2 (г) + Q
Рассуждаем так:
а) в левой части уравнения имеем 3 объема газообразных веществ (смотрим на
коэффициенты перед формулами газообразных веществ) 2V(СО) + 1V(O2)=3V, а
в правой части уравнения имеем 2 объема газообразных веществ , а именно
2V(СО2) . Вывод: равновесие при повышении давления смещается в сторону
уменьшения объемов, значит равновесие сместится при повышении давления
вправо.
б) так как реакция является экзотермической (+ Q), потому что тепловой эффект
(Q) со знаком «+» при повышении температуры равновесие будет смещаться
влево, то есть в сторону эндотермической реакции.
в) если увеличить концентрацию кислорода (O2), то мы автоматически
увеличиваем скорость прямой реакции. Скорость прямо-пропорцинальна
концентрации. Вспомните основное кинетическое уравнение: Vпрямой реакции
=k (ССО)2 (СО2)1 Вывод: при повышении концентрации кислорода увеличится
скорость прямой реакции, значит равновесие сместится вправо.
14.
Во сколько раз изменится скорость прямой иобратной реакции в системе:
2SO2(г) + O2(г) ⇄ 2SO3(г)
если объем газовой смеси уменьшить в три
раза?
В какую сторону сместится равновесие
системы?
15.
Решение. Обозначим концентрации реагирующих веществ:сSO = a, сО = b, сSO = с. Согласно закону действия масс
скорости V прямой и обратной реакции до изменения объема:
Vпр = Ка2b
2
2
3
Vобр = К1с2.
После уменьшения объема гомогенной системы в три раза
концентрация каждого из реагирующих веществ увеличится в
с
с
с
три раза: SO2 = 3а, О2 =3b;
SO3 = 3с. При новых
концентрациях скорости прямой и обратной реакции:
Vпр = К(3а)2(3b) = 27Ка2b
Отсюда:
Vобр = К1(3с)2 = 9К1с2
Следовательно, скорость прямой реакции увеличилась в 27 раз,
а обратной – только в девять раз. Равновесие системы
сместилось в сторону образования SO3.
16.
При повышении давленияравновесие смещается вправо в
системе:
А)2CO2(г) ⇄ 2CO(г) + O2(г)
Б)С2Н4(г) ⇄ С2Н2(г) + Н2(г)
В)PCl3(г) + Cl2(г) ⇄ PCl5(г)
Г)H2(г) + Сl2(г) ⇄ 2 HCl(г)
17.
В какой системе состояние химическогоравновесия не изменится при увеличении давления?
А)CO(г) + H2O(г) ⇄ CO2(г) + H2(г)
Б) CH4(г) + H2O(г) ⇄ CO(г) + 3H2(г)
В) C(тв) + H2O(г) ⇄ CO(г) + H2(г)
Г) 2NO(г) + O2(г) ⇄ 2NO2(г)
18.
В системе N2(г)+ O2(г) ⇄ 2NO(г)−Qхимическое равновесие не смещается при:
А) увеличении концентрации NO
Б) повышении давления
В) повышении температуры
Г) увеличении концентрации O2
19.
В системе CO2(г)+ C(тв) ⇄ 2CO(г)−Qсмещение химического равновесия вправо
произойдёт при:
А) повышении температуры
Б) использовании катализатора
В) увеличении давления
Г) уменьшении концентрации исходных
веществ
20.
Химическое равновесие в системеС2Н5ОН +СН3СООН ⇄ СН3СООС2Н5 + Н2О – Q
смещается в сторону продуктов реакции при:
А) добавлении воды
Б) уменьшении концентрации
уксусной кислоты
В) увеличении концентрации эфира
Г) удалении воды
21.
Изменение давления не повлияет на состояниехимического равновесия в системе
А)2NO(г) + O2(г)⇄ 2NO2(г)
Б) N2(г)+ 3H2(г) ⇄ 2NH3(г)
В) 2CO(г)+ O2(г)⇄ 2CO2(г)
Г) N2(г)+ O2(г) ⇄ 2NO(г)
22.
Химическое равновесие в системеC4H10(г) ⇄ C4H6(г) + 2H2(г) − Q
сместится в сторону продуктов реакции при:
А) повышении температуры
Б) понижении температуры
В) использовании катализатора
Г) уменьшении концентрации C4H10





















 Химия
Химия








