Похожие презентации:
Химическое равновесие. Условия его смещения
1. Химическое равновесие. Условия его смещения.
Выполнила:Преподаватель химии Ляскевич Л.Н.
2. Конечно, научная истина всегда пробьёт себе путь в жизнь, но сделать этот путь скорым и более прямым зависит от людей, а не от
истины.(П.Л.Капица)
3. Богиня правосудия Фемида
Прежде чем вынестирешение, на одну
чашу весов помещала
все хорошие поступки
человека, а на
другую—все плохие. А
чтобы решение было
справедливым, ей
завязывали глаза.
4. Закон единства и борьбы противоположностей (закон диалектики)
Равновесие:это гармония
это соотношение между чем-либо
это совместимость
несовместимого
это состояние покоя под
действием
противоположных сил…
5. Обратимыми называются реакции, которые одновременно протекают в двух взаимно противоположных направлениях. Обратимые реакции не
доходят до конца изаканчиваются установлением химического
равновесия.
V, моль/л·с
Скорость прямой
реакции
V1 = V2
Скорость обратной
реакции
Момент равновесия
6. Химическое равновесие
Состояние химическогообратимого процесса,
при котором скорость
прямой реакции равна
скорости обратной
реакции
Vпр =Vобр
7. Если вы правильно решите химический ребус, то получится название основного правила, которому подчиняются сдвиги химического
равновесия.1,2
+
Р
V
2,3,4
3,4
Kr
Be
5,2
1,3,2
2
Все 3
Известен Всюду на Земле
Анри Луи Ле Шателье
Он не был королем и принцем,
Зато открыл прекрасный принцип,
Который химикам полезен.
8. Принцип Ле Шателье (принцип «делай наоборот и добьёшься своего»)
Если изменить одно из условий—температуру, давление или
концентрацию веществ, —при
которых данная система находится в
состоянии химического равновесия,
то равновесие сместится в
направлении, которое препятствует
этому изменению.
9. Принцип Ле Шателье
Изменение равновесных концентрацийЧтобы сместить равновесие в
сторону образования вещества,
необходимо увеличить
концентрацию исходных веществ и
уменьшить концентрацию
продукта.
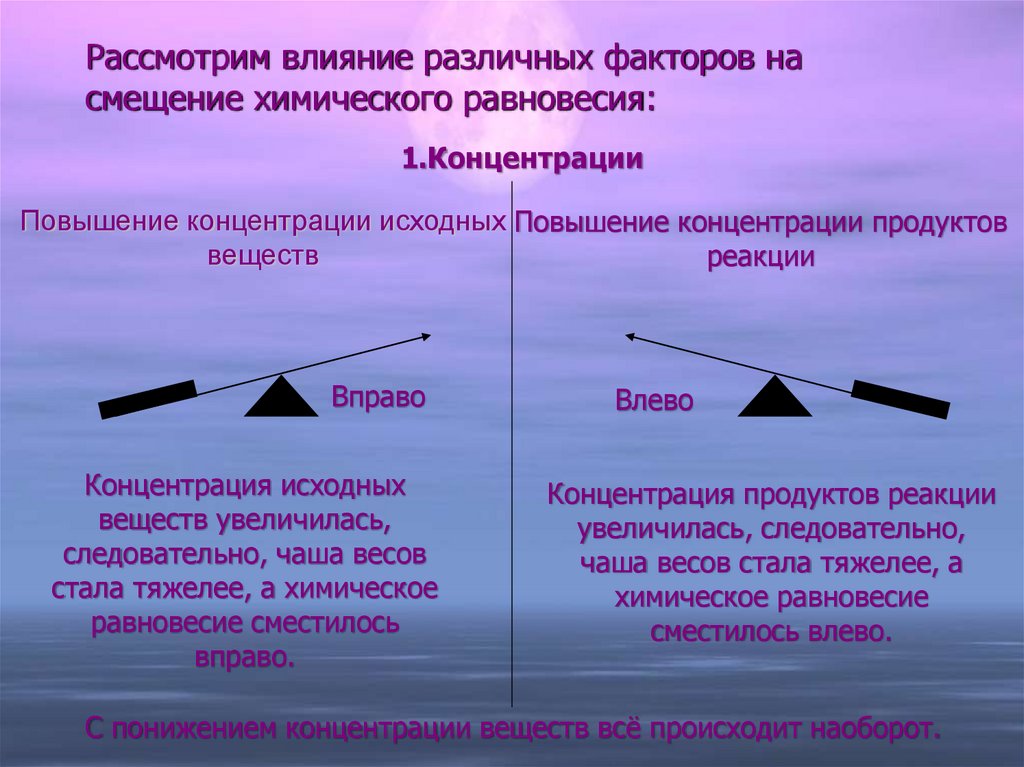
10. Рассмотрим влияние различных факторов на смещение химического равновесия:
1.КонцентрацииПовышение концентрации исходных Повышение концентрации продуктов
веществ
реакции
Вправо
Концентрация исходных
веществ увеличилась,
следовательно, чаша весов
стала тяжелее, а химическое
равновесие сместилось
вправо.
Влево
Концентрация продуктов реакции
увеличилась, следовательно,
чаша весов стала тяжелее, а
химическое равновесие
сместилось влево.
С понижением концентрации веществ всё происходит наоборот.
11. Принцип Ле Шателье
Изменение давленияПри увеличении давления в
реакционной смеси равновесие
смещается в сторону уменьшения
объёма веществ, и ,наоборот, при
уменьшении давления—в сторону
увеличения объёма (в газовой
системе)
12. Понижение давления Понижение Р приводит к увеличению V, следовательно, реакция будет идти в сторону увеличения V, т.е. влево в
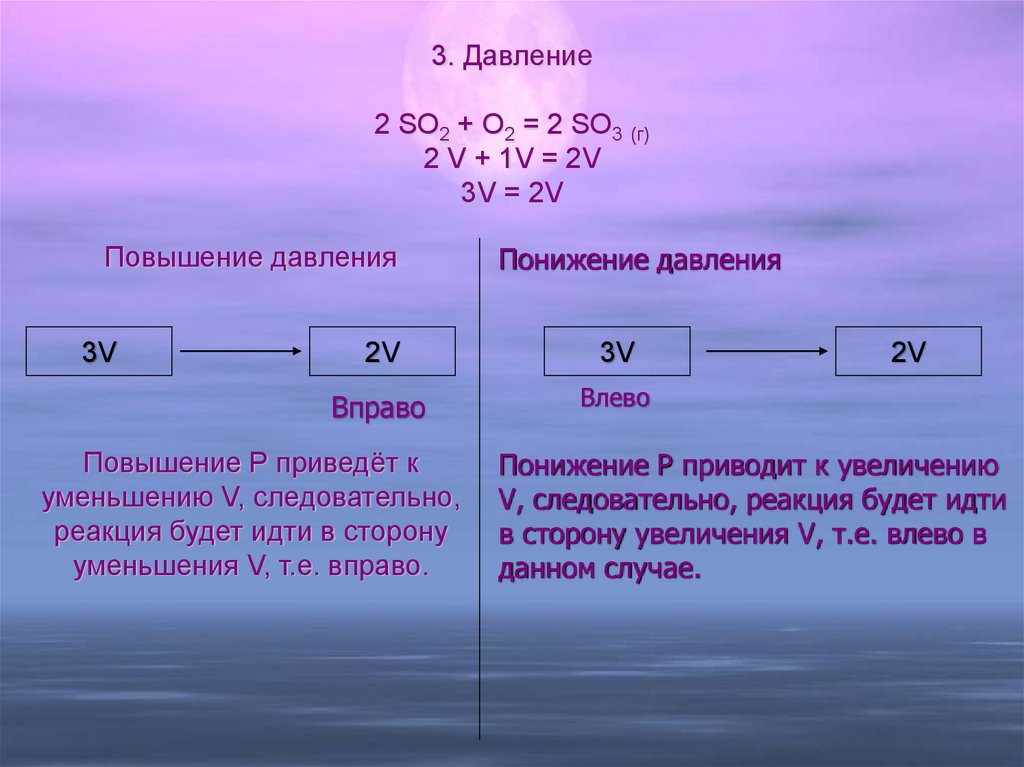
3. Давление2 SO2 + O2 = 2 SO3 (г)
2 V + 1V = 2V
3V = 2V
Повышение давления
3V
Понижение давления
2V
3V
Вправо
Влево
Повышение Р приведёт к
уменьшению V, следовательно,
реакция будет идти в сторону
уменьшения V, т.е. вправо.
2V
Понижение Р приводит к увеличению
V, следовательно, реакция будет идти
в сторону увеличения V, т.е. влево в
данном случае.
13. Принцип Ле Шателье
Изменение температурыПри повышении
температуры равновесие
сместится в сторону
эндотермической
реакции, а при
понижении—в сторону
экзотермической
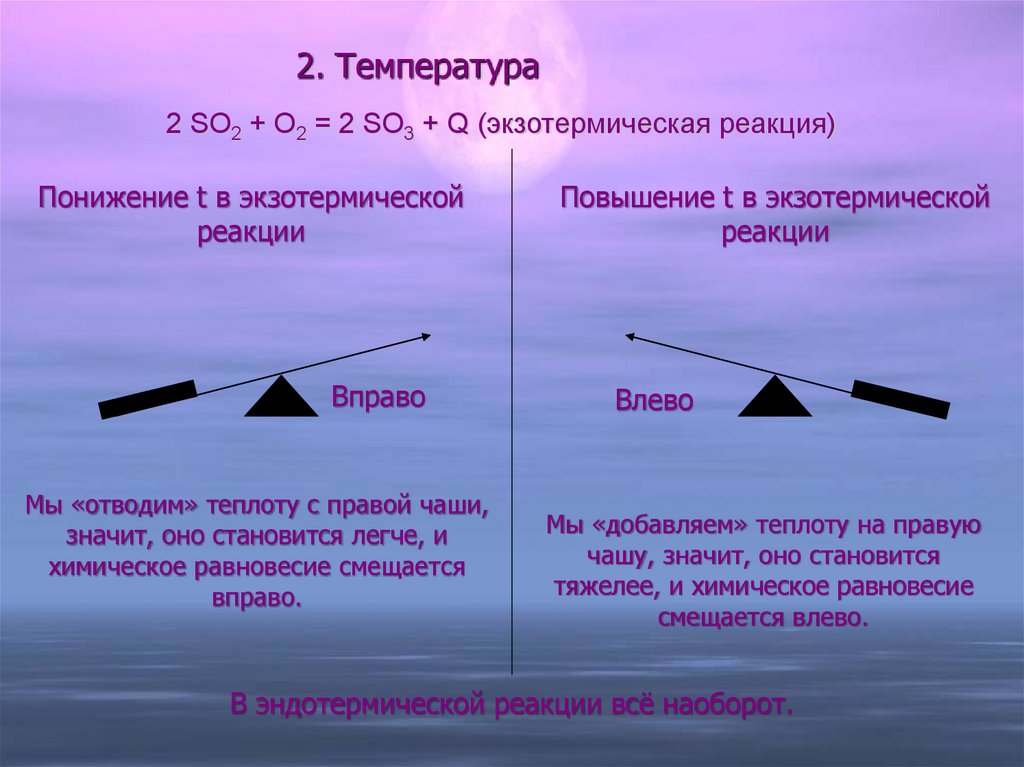
14. 2. Температура
2 SO2 + O2 = 2 SO3 + Q (экзотермическая реакция)Понижение t в экзотермической
реакции
Вправо
Мы «отводим» теплоту с правой чаши,
значит, оно становится легче, и
химическое равновесие смещается
вправо.
Повышение t в экзотермической
реакции
Влево
Мы «добавляем» теплоту на правую
чашу, значит, оно становится
тяжелее, и химическое равновесие
смещается влево.
В эндотермической реакции всё наоборот.
15. Fe, p, t 3H2 + N2 ↔ 2NH3 + Q
Характеристика прямой реакцииVпр > Vобр
- реакция экзотермическая
- идёт с уменьшением давлении
- концентрации азота и водорода
уменьшаются
- концентрация аммиака
повышается
16. Задание на закрепление
1 заданиеДать характеристику реакции.
Как сместится равновесие реакции:
2 NOг + O2 = 2 NO2 Г - Q
а) при понижении давления?
б) при повышении температуры
Ответ обоснуйте.
2 задание
Дать характеристику реакции.
Как повлияет на смещение равновесия:
N2г + O2 = 2 NOг – Q
а) увеличение температуры?
б) уменьшение давления?
Ответ обоснуйте.
17.
«Человек есть тайна. Её надоразгадать, и ежели будешь
разгадывать всю жизнь, то не
говори, что потерял время. Я
занимаюсь этой тайной, ибо хочу
быть человеком.»
(Фёдор Достоевский)
18.
Спасибо за урок!До новой
встречи!















 Химия
Химия








