Похожие презентации:
Растворы. Справочник
1.
Растворы2.
Справочник.Справочник.
Растворы – это гомогенные (однородные) системы,
состоящие из двух и более компонентов и продуктов
их взаимодействия.
Точное определение раствора ( 1887 год
Д.И.Менделеев):
Раствор – гомогенная (однородная)
система, состоящая из
частиц растворенного
вещества, растворителя
и продуктов
их взаимодействия.
3.
Справочник.Растворы подразделяются:
1. Молекулярные – водные растворы неэлектролитов
( спиртовой раствор иода, раствор глюкозы).
2. Молекулярно-ионные – растворы слабых
электролитов ( азотистая и угольная кислоты,
аммиачная вода).
3. Ионные растворы –
растворы
электролитов.
4.
Справочник.Растворение –
физико – химический процесс, в котором
наряду с образованием обычной механической
смеси веществ идет процесс взаимодействия
частиц растворенного вещества с
растворителем.
5.
Растворимость –свойство вещества растворяться в воде или другом
растворе.
Коэффициент растворимости (S) – максимальное число г
вещества , которое может раствориться в 100г растворителя
при данной температуре.
Вещества.
Хорошо
растворимые
S > 1г
Мало
растворимые
S =0,01 – 1 г
Нерастворимые
S< 0,01 г
6.
Классификация растворов•Насыщенный – раствор, в котором при
данной температуре вещество
больше не растворяется;
•Ненасыщенный – раствор, в котором
при данной температуре находится
меньше растворяемого вещества, чем
•в его насыщенном растворе;
•Пересыщенный – раствор, в котором
при данной температуре находится
больше растворяемого вещества, чем
в его насыщенном растворе при
•тех же условиях.
7.
8.
Влияние различных факторов нарастворимость.
Давление
Растворимость
Природа
растворителя
Температура
Природа
растворенных
веществ
9.
Концентрация раствора –это содержание вещества в определенной массе
или объеме раствора.
10.
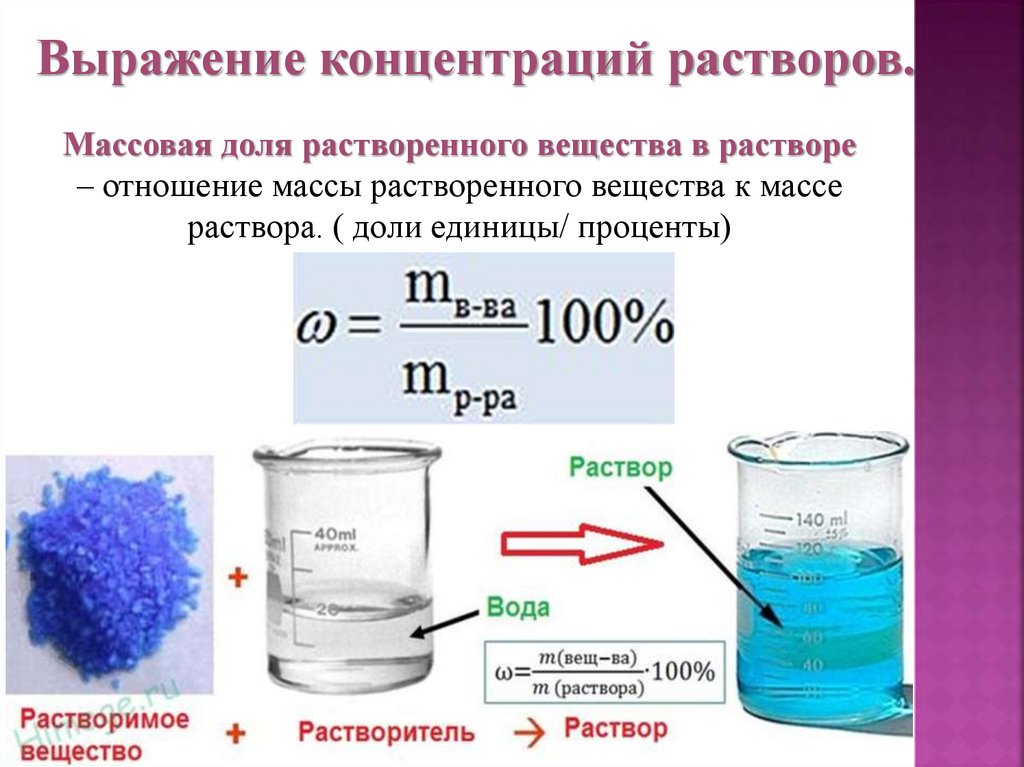
Выражение концентраций растворов.Массовая доля растворенного вещества в растворе
– отношение массы растворенного вещества к массе
раствора. ( доли единицы/ проценты)
11.
Выражение концентраций растворов.Молярность - число молей растворенного вещества
в 1 л раствора.
ʋ - количество вещества (моль);
V – объем раствора (л);
12.
Природные растворы.1. Минеральная вода.
2. Кровь животных.
3. Морская вода.
13.
Практическое применениерастворов.
1. Продукты питания.
2. Лекарственные
препараты.
3. Минеральные столовые
воды.
4. Сырье промышленности.
5. Биологическое значение
растворов.
14.
Домашнее задание Решить задачи1. В 73 г раствора соляной кислоты с массовой долей
5% поместили избыток цинка. Вычислите объем
выделившегося газа (н. у.).
2. Рассчитайте массу осадка, который
выпадет при взаимодействии избытка
карбоната калия с 17,4 г раствора
нитрата бария с массовой долей
последнего 15%.
3. При взаимодействии избытка раствора
карбоната калия с 10%-ным раствором
нитрата бария выпало 3,94 г осадка.
Определить массу взятого для опыта
раствора нитрата бария.













 Химия
Химия








