Похожие презентации:
Растворимость. Раствор
1.
Растворимость2.
Раствором называют гомогеннуюсистему, состоящую из 2-х или более
компонентов.
3.
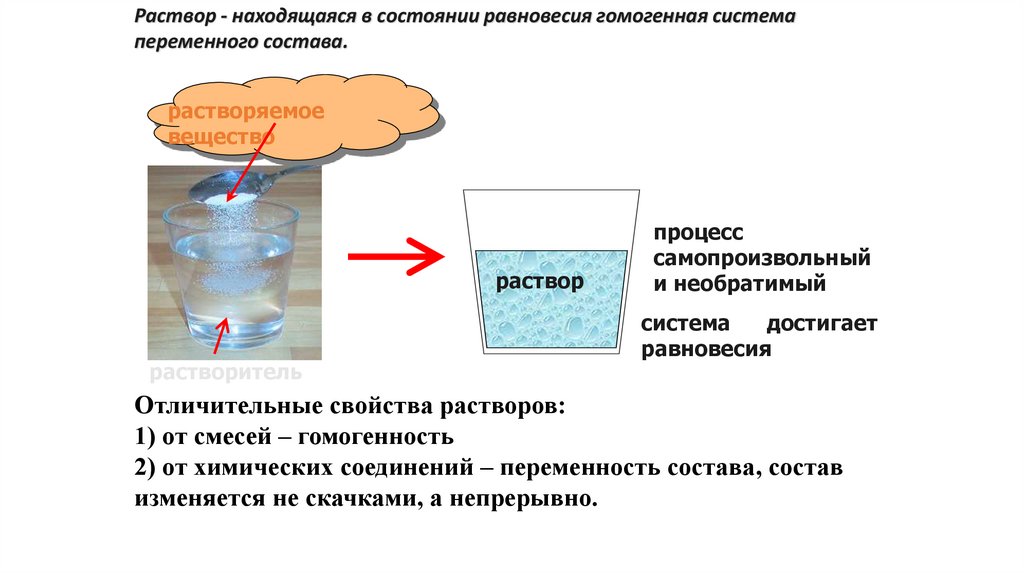
Раствор - находящаяся в состоянии равновесия гомогенная системапеременного состава.
растворяемое
вещество
раствор
растворитель
процесс
самопроизвольный
и необратимый
система
достигает
равновесия
Отличительные свойства растворов:
1) от смесей – гомогенность
2) от химических соединений – переменность состава, состав
изменяется не скачками, а непрерывно.
4.
КОМПОНЕНТЫ РАСТВОРА: РАСТВОРИТЕЛЬ И РАСТВОРЕННОЕВЕЩЕСТВО (неразличимы невооруженным глазом).
РАСТВОРИТЕЛЬ сохраняет свое агрегатное состояние в растворе
РАСТВОРЕННОЕ ВЕЩЕСТВО – не сохраняет агрегатное состояние
после растворения
водка
Раствор спирта в воде, т.к.
содержание спирта 40%
спирт
медицинский
Раствор воды в спирте, т.к.
содержание спирта 96%
В растворах электролитов электролит – всегда
растворенное вещество:
98%-ый раствор H2SO4 в H2O
40%-ый раствор NaOH в H2O
1%-ый раствор NaCl в H2O
5.
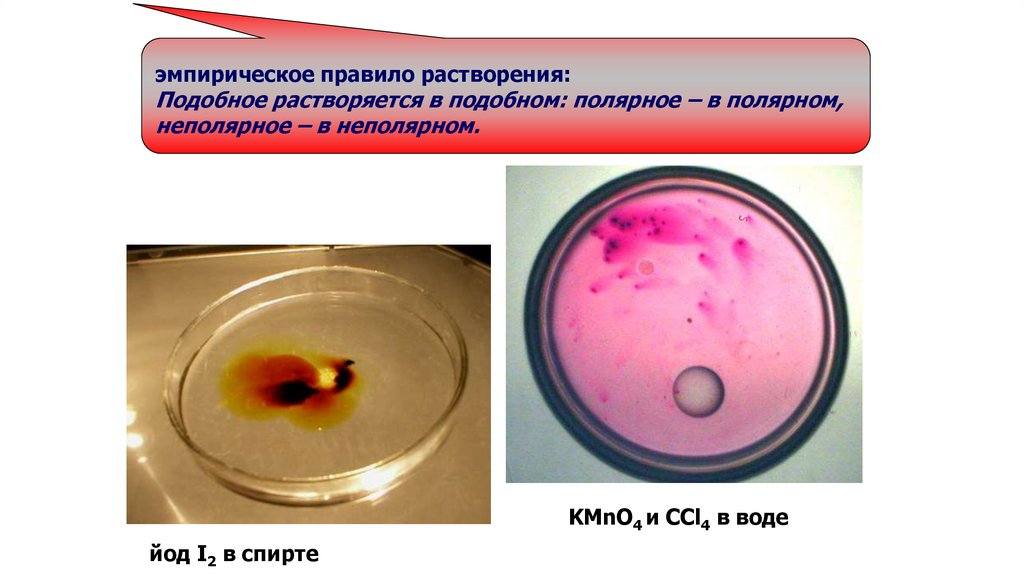
эмпирическое правило растворения:Подобное растворяется в подобном: полярное – в полярном,
неполярное – в неполярном.
KMnO4 и CCl4 в воде
йод I2 в спирте
6.
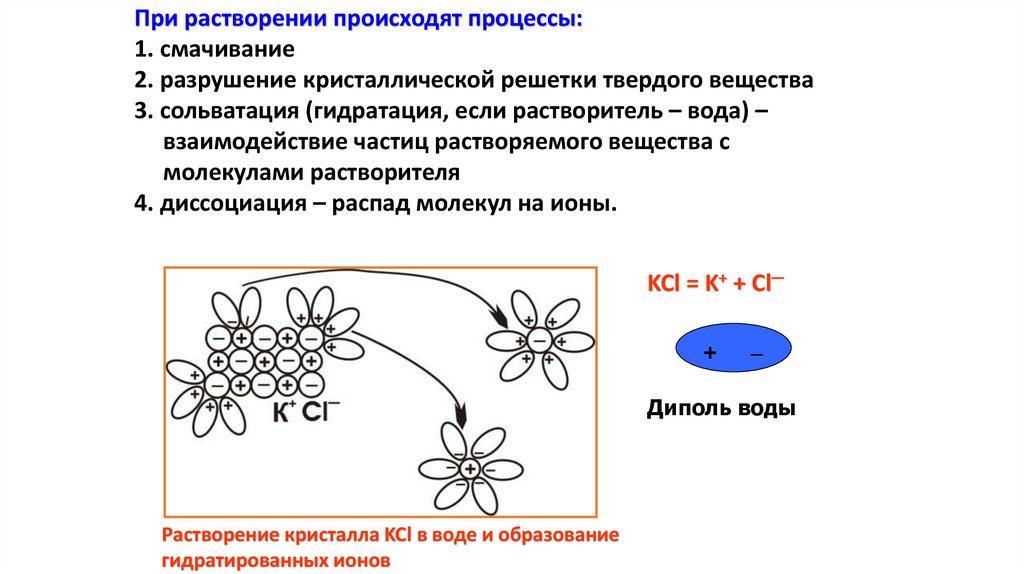
При растворении происходят процессы:1. смачивание
2. разрушение кристаллической решетки твердого вещества
3. сольватация (гидратация, если растворитель – вода) –
взаимодействие частиц растворяемого вещества с
молекулами растворителя
4. диссоциация – распад молекул на ионы.
KCl = K+ + Cl─
+
_
Диполь воды
Растворение кристалла KCl в воде и образование
гидратированных ионов
7.
РАСТВОРЫ:- концентрированные – содержание
растворенного вещества свыше 5%;
- разбавленные – содержание до 5%.
8.
Растворимость (Ks)Растворимость – это предельная масса растворенного вещества,
которая способна раствориться в 100г растворителя при данных
условиях. В результате получается насыщенный раствор.
9.
РАСТВОРИМОСТЬ – свойствовеществ растворяться в воде или
другом растворителе.
Иногда: растворимость концентрация
насыщенного раствора
10.
По растворимости растворы делят на 3 группы1.
Насыщенный
раствор
содержит
максимальное
количество
растворяемого
вещества при данной температуре.
2. Ненасыщенный раствор - содержит меньше
растворяемого вещества, чем насыщенный
раствор при данной температуре.
3. Пересыщенный раствор - содержание
растворяемых веществ больше при данной
температуре, чем в их насыщенных растворах.
11.
Кристаллы KCl в егопересыщенном
водном растворе
12.
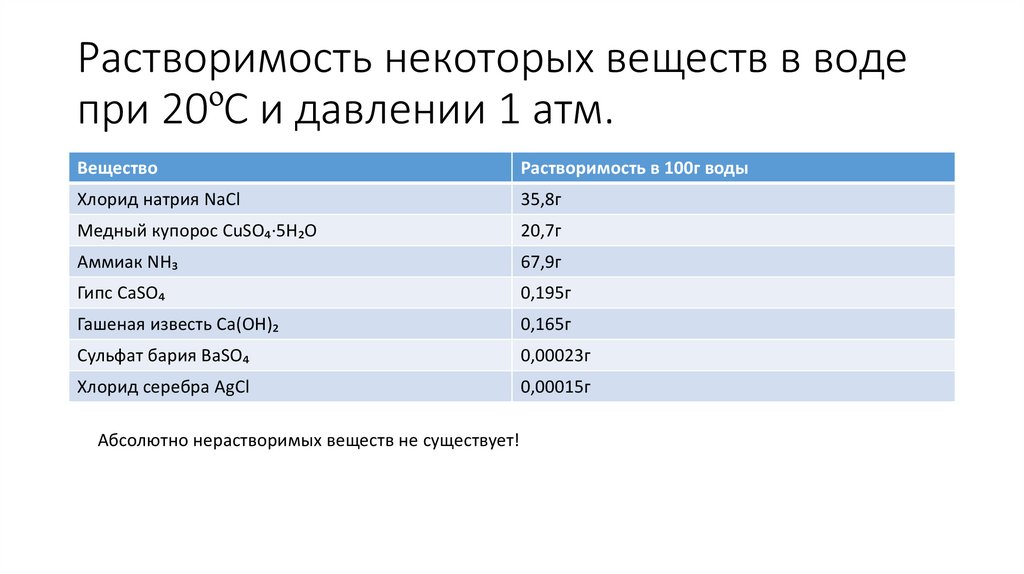
Растворимость некоторых веществ в водепри 20ºС и давлении 1 атм.
Вещество
Растворимость в 100г воды
Хлорид натрия NaCl
35,8г
Медный купорос CuSO₄·5H₂O
20,7г
Аммиак NH₃
67,9г
Гипс CaSO₄
0,195г
Гашеная известь Ca(OH)₂
0,165г
Сульфат бария BaSO₄
0,00023г
Хлорид серебра AgCl
0,00015г
Абсолютно нерастворимых веществ не существует!
13.
Таблица растворимости14.
Растворимость зависитот природы растворителя;
от природы растворяемого вещества;
от их агрегатного состояния;
от температуры;
от давления (для газов).
15.
От природы вещества:• Кристаллы из молекул с ковалентными неполярными связями
практически не растворимы в воде
• Вещества ионной природы (щелочи, соли) и полярные вещества
(спирты) хорошо растворяются в воде
От температуры:
• Растворимость твердых веществ с повышением температуры
увеличивается
• Растворимость газообразных веществ с ростом температуры
уменьшается
От давления:
• Давление очень сильно влияет на растворимость газов. Больше
давление – больше растворимость.
16.
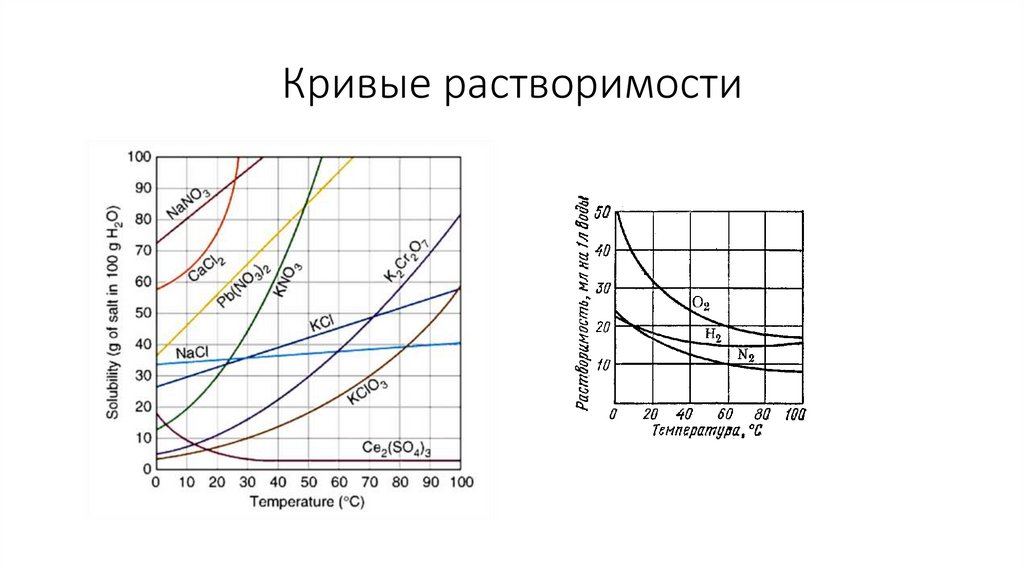
Кривые растворимости17.
Что происходит с насыщенным растворомпри понижении температуры?
Растворимость NaCl при 100ºС равна 39,2г , при 20ºС равна 35,7г.
Возьмем 100г воды и приготовим насыщенный раствор хлорида
натрия при 100ºС, затем охладим его до 20ºС, часть соли выпадет в
осадок. Чему равна масса осадка?
Масса воды не изменилась, масса соли в
насыщенном растворе уменьшилась
Δm = 39,2-35,7 = 3,5г
В осадок выпадает 3,5 г соли из каждых
139,2г насыщенного при 100ºС раствора.
100ºС
20ºС
18.
Задача. Определите, сколько г бромида калия выпадет в осадок приохлаждении 300г насыщенного при 100ºС раствора до температуры 10ºС.
(Запишите число с точностью до целых)
Температура, ºС
10
20
30
40
60
80
100
Растворимость, г на
100г воды
60
65
71
76
86
95
103
Если приготовить горячий насыщенный раствор в 100г воды, а потом его охладить, то выпадет
Δm = 103-60 = 43г бромида калия, т.е.
Из 203г (103г соли + 100г воды) насыщенного раствора выпадет 43 г бромида калия
Из 300г насыщенного раствора ……………………………………………………… Хг бромида калия
Х= 300·43:203= 63,547 = 64г
Ответ: 64г.
19.
Произведение растворимости:Равновесие между осадком малорастворимого сильного
электролита и насыщенным раствором:
AgCl Ag+ + Cl─
20.
Произведение концентраций ионов внасыщенном растворе трудно
растворимого электролита при
постоянной температуре является
постоянной величиной. Эта
величина называется произведением
растворимости (ПР).
21.
Образование осадкаОсадок образуется в том случае, когда произведение
концентраций ионов малорастворимого электролита
превысит величину его произведения
растворимости при данной температуре.
[Ag+]∙[Cl-] < ПРAgCl - ненасыщенный раствор
[Ag+]∙[Cl-] = ПРAgCl - насыщенный раствор
[Ag+]∙[Cl-] > ПРAgCl - перенасыщенный раствор
22.
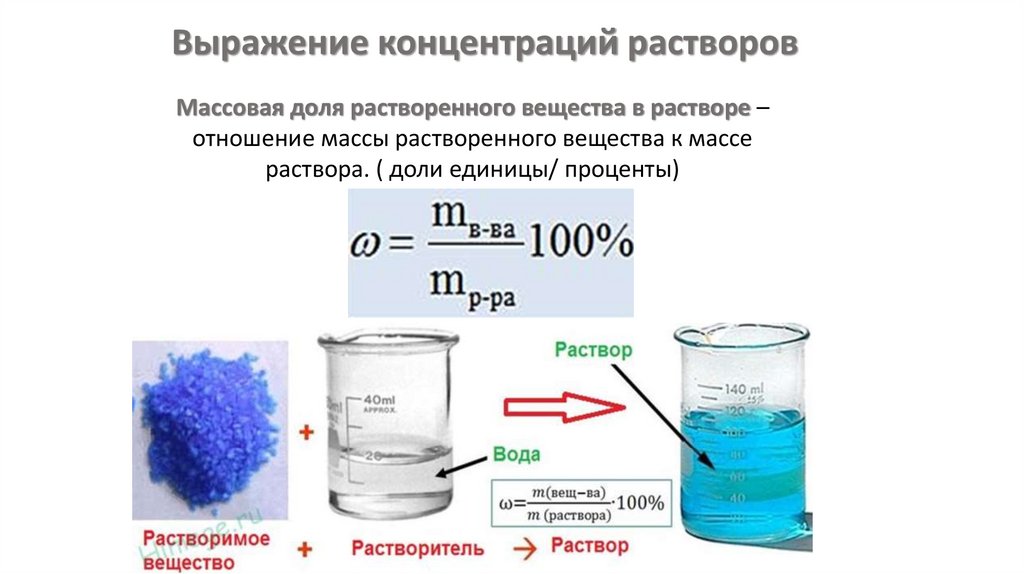
Выражение концентраций растворовМассовая доля растворенного вещества в растворе –
отношение массы растворенного вещества к массе
раствора. ( доли единицы/ проценты)
23.
Выражение концентраций растворовМолярность - число молей растворенного вещества
в 1 л раствора.
ʋ - количество вещества (моль);
V – объем раствора (л);
24.
Выражение концентраций растворовЭквивалентная концентрация (нормальность) – число
эквивалентов растворенного вещества в 1л раствора.
ʋ экв. - количество
эквивалентов;
V – объём раствора, л.
25.
Выражение концентраций растворовМоляльная концентрация (моляльность) – число молей
растворенного вещества на 1000 г растворителя.
26.
Природные растворы1. Минеральная вода.
2. Кровь животных.
3. Морская вода.
27.
Практическое применение растворов1. Продукты питания.
2. Лекарственные
препараты.
3. Минеральные столовые
воды.
4. Сырье промышленности.
5. Биологическое значение
растворов.
28.
Задача. Определите растворимость сульфата калия при температуре 10ºС, еслипри охлаждении 250г насыщенного при 100ºС раствора соли выпало 30г осадка.
(Запишите число с точностью до целых)
Температура, ºС
0
20
30
40
60
80
100
Растворимость, г на
100г воды
7,3
11,1
12,9
14,8
18,2
21,4
24,1
Пусть растворимость K₂SO₄ при 10ºС равна Хг на 100г воды
Из 250г насыщенного раствора выпадает 30г соли
Из (100+24,1)г насыщенного раствора……. (24,1-Х)г соли
250·(24,1-Х)=30·(100+24,1)
Х=9,208=9 г
Ответ: 9г.
29.
Задача. Определите массу соли, которую необходимо добавить к 200г растворас массовой долей нитрата калия 10%, чтобы получить насыщенный при 60ºС
раствор. (Запишите число с точностью до целых)
Температура, ºС
0
20
30
40
60
80
100
Растворимость, г на
100г воды
13,3
31,6
45,8
63,9
110
169
246
200г 10% раствора соли содержат 200·0,1= 20г соли и 180г воды
При 60ºС в 100г воды растворяется 110г соли, а
в 180г воды………………… хг соли.
Х = 180·110:100=198г. Значит, необходимо добавить Δm=198-20=178г
соли
Ответ: 178г соли.
30.
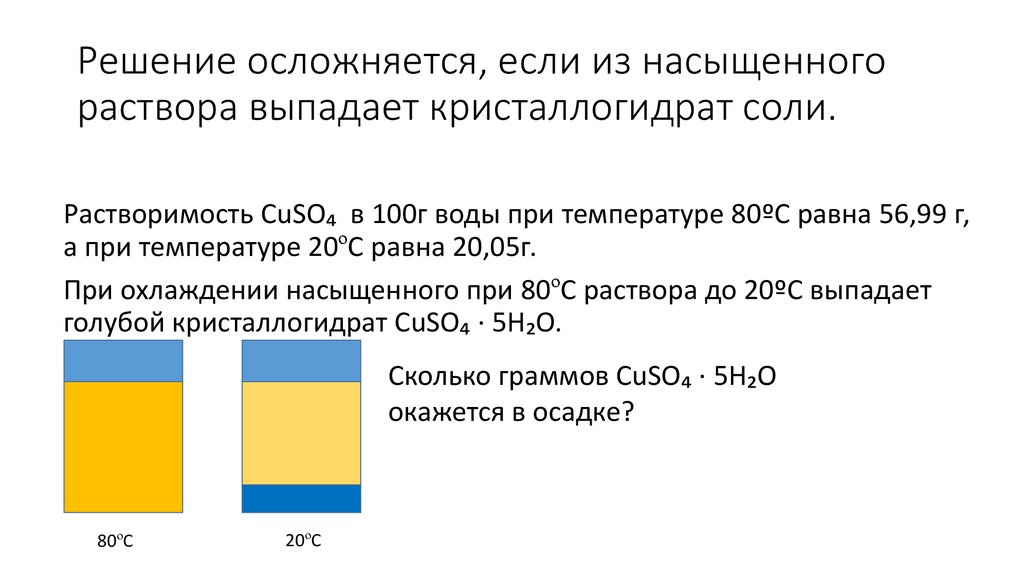
Решение осложняется, если из насыщенногораствора выпадает кристаллогидрат соли.
Растворимость CuSO₄ в 100г воды при температуре 80ºС равна 56,99 г,
а при температуре 20ºС равна 20,05г.
При охлаждении насыщенного при 80ºС раствора до 20ºС выпадает
голубой кристаллогидрат CuSO₄ · 5Н₂О.
Сколько граммов CuSO₄ · 5Н₂О
окажется в осадке?
80ºС
20ºС
31.
Задачи на разбавление иконцентрирование раствора
Эти задачи связаны с изменением
ω растворенного вещества:
• Добавили воду
• Выпарили воду
• Добавили растворенное
вещество
• Добавили раствор того же
вещества с другой ω
32.
Задача. Сколько граммов 65%-ного раствора азотной кислоты надо смешивать с270г 10%-ного раствора этого же вещества, чтобы получить 20%-й раствор?
Ответ запишите в виде целого числа.
За Х удобно принять ответ на вопрос, т.е. массу 65%-го раствора
азотной кислоты.
ω = 0,65х + 270·0,1
х + 270
= 0,2
Отсюда х = 60
Ответ: 60г
33.
Задача. Сколько граммов 98%-й серной кислоты надо добавить к300г воды, чтобы получить 10%-й раствор кислоты? Ответ запишите
в виде целого числа.
Пусть х это масса 98%-го раствора серной
кислоты
0,98х
300 + х
ω=
34г
= 0,1 Отсюда х = 34,09 Ответ:


























 Химия
Химия








