Похожие презентации:
Понятие атом
1.
2.
Понятие атом возникло в глубокой древностиАтом – «неделимый»
Электрон – «янтарь» 1891г. Стони - Ирландский
физик;
Д. Томсон, Ж Перрен 1897г. доказали что электроны
несут на себе отрицательный заряд (-1).
Д. Томсон сумел доказать, что масса электрона
меньше массы атома водорода в 2000 раз.
Опыт Д. Томсона и Ж. Перрена доказал наличие
катодных лучей(поток электронов).
А. Беккерель доказал радиоактивность 1896г.
М. Склодовская-Кюри, П. Кюри изучение
радиоактивности 1897-1903 г.
3.
4.
5. Планетарная модель атома
1911 г. – Эрнест РезерфордАТОМ
ядро
протоны
Электронная
оболочка
нейтроны
(1871–1937)
английский физик
электроны
6. Основные характеристики элементарных частиц
Свойствачастицы
Масса
Заряд
Обозначение
Число частиц
Частица
протон
электрон
нейтрон
7.
В Солнечной системепланеты вращаются вокруг
Солнца
В атоме электроны
вращаются вокруг атомного
ядра, которое заряжено
положительно и
притягивает отрицательно
заряженные электроны
8.
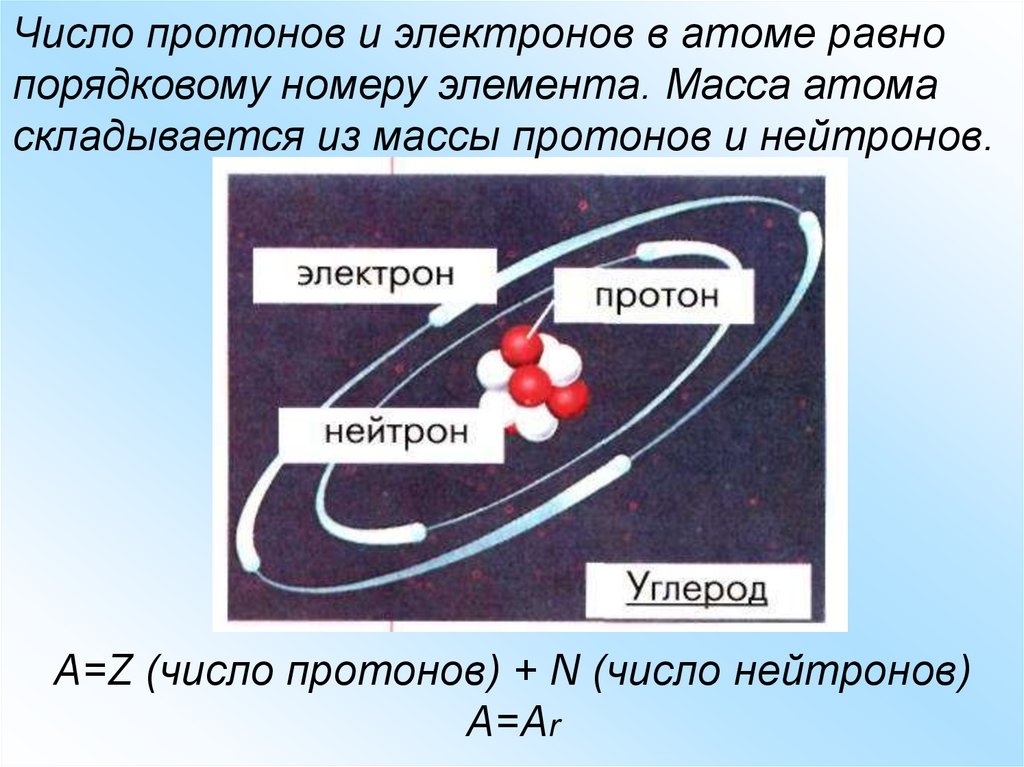
Число протонов и электронов в атоме равнопорядковому номеру элемента. Масса атома
складывается из массы протонов и нейтронов.
A=Z (число протонов) + N (число нейтронов)
А=Аr
9.
10.
Состав атомов химическихэлементов
Характеристики элемента
Знаки химических элементов
Na
P
Порядковый номер
11
15
Число протонов
11
15
Число электронов
11
15
Заряд ядра
+11 +15
Массовое число
23
31
Число нейтронов
12
16
Al
I
Au
F
H
11.
Основные выводыАтом является мельчайшей частицей вещества
Вся масса атома сосредоточена в его ядре, объем
которого чрезвычайно мал по сравнению с
объемом атома
Атом – сложная нейтральная частица, состоящая
из протонов, электронов и нейтронов
Атом электронейтрален, так как содержит
одинаковое число протонов и электронов, равное
порядковому номеру элемента
12.
Домашнее задание § 7Учить определения











 Химия
Химия








