Похожие презентации:
Атом - сложная частица
1.
Понятие «атом» возникло ещёв античном мире (в переводе
с греческого «атом» означает
«неделимый»).
2.
В 1896 г. открыл явлениерадиоактивности (самопроизвольный
распад атомов некоторых элементов).
А. Беккерель
1853–1908 гг.
3.
В 1899–1903 гг. установил природуα-, β- и γ-лучей, образующихся
при радиоактивном распаде.
В 1899–1903 гг. открыл ядра атомов.
Э. Резерфорд
1871–1937 гг.
4.
В 1909 г. Определил заряд электрона.Р. Милликен
1868–1953 гг.
5.
В 1904 г. в работе «О структуре атома»дал описание своей модели,
получившей образное название
«пудинг с изюмом».
– +
+
–
Дж. Томпсон
1856–1940 гг.
–
+
+
–
6.
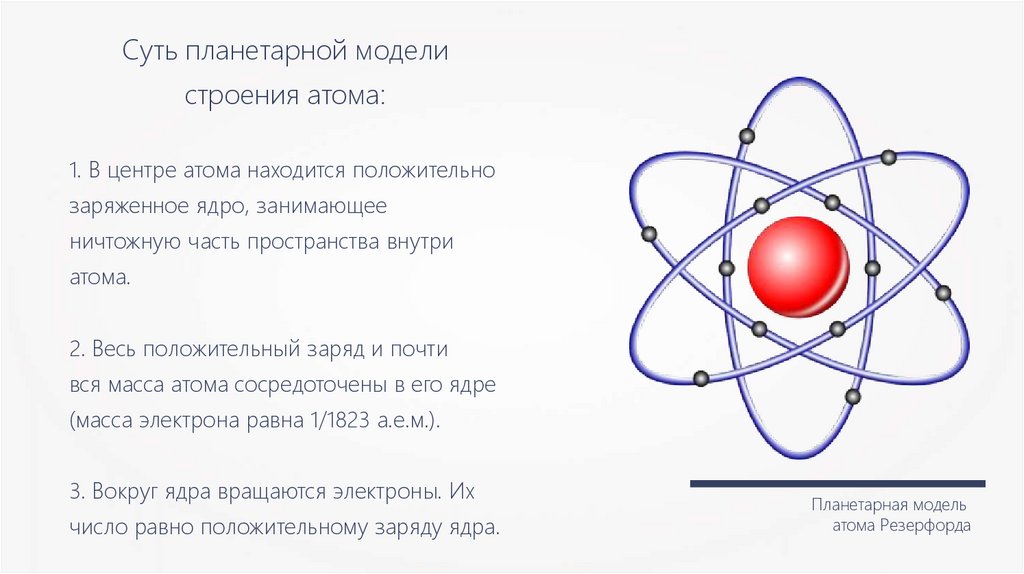
Суть планетарной моделистроения атома:
1. В центре атома находится положительно
заряженное ядро, занимающее
ничтожную часть пространства внутри
атома.
2. Весь положительный заряд и почти
вся масса атома сосредоточены в его ядре
(масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их
число равно положительному заряду ядра.
Планетарная модель
атома Резерфорда
7.
Электрон, двигаясь вокруг ядра с ускорением,должен был бы, согласно электромагнитной
теории, непрерывно излучать энергию. Это
привело бы к тому, что электрон должен был
бы двигаться вокруг ядра по спирали и в
конце концов упасть на него.
Планетарная модель
атома Резерфорда
8.
Датский физик. В 1913 г. предложил своютеорию строения атома. Как и Резерфорд,
он считал, что электроны двигаются вокруг
ядра подобно планетам, движущимся
вокруг Солнца.
В 1912 г. Дж. Франк и Г. Герц доказали
дискретность энергии электрона в атоме,
что позволило Бору положить в основу
новой теории два необычных
предположения.
Н. Бор
1885–1962 гг.
9.
Постулаты теории Н. Бора1. Электрон может вращаться вокруг ядра не по
произвольным, а только по строго определенным
(стационарным) круговым орбитам.
2. При движении по стационарным орбитам
электрон не излучает и не поглощает энергии.
10.
Внёс квантовые представления в строениеатома, но использовал при этом
традиционные классические понятия
механики, рассматривая электрон как
частицу, движущуюся со строго
определённой скоростью по строго
определённым траекториям.
Н. Бор
1885–1962 гг.
11.
Электронное облакоЯдро
Наиболее существенным нововведением явилось понятие об электронном облаке,
которое пришло на смену понятию об электроне только как частице.
12.
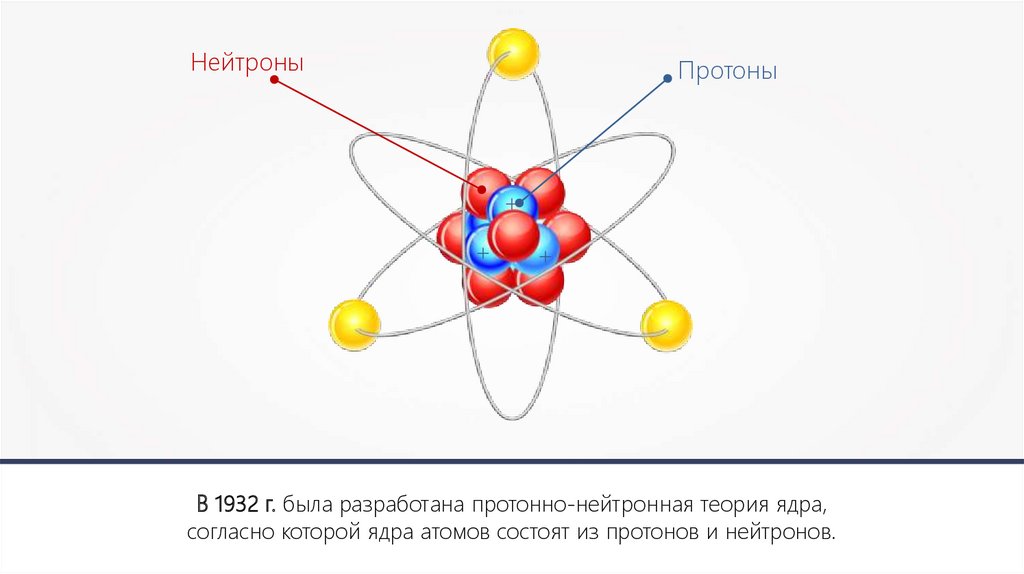
НейтроныПротоны
+
+
+
В 1932 г. была разработана протонно-нейтронная теория ядра,
согласно которой ядра атомов состоят из протонов и нейтронов.
13.
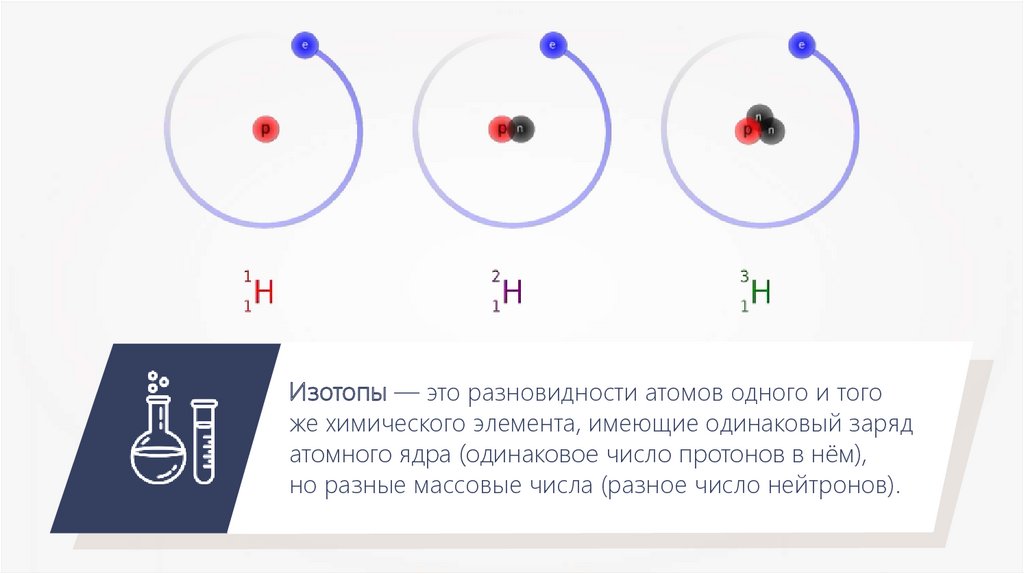
14.
Изотопы — это разновидности атомов одного и тогоже химического элемента, имеющие одинаковый заряд
атомного ядра (одинаковое число протонов в нём),
но разные массовые числа (разное число нейтронов).
15.
n=A-pn — число нейтронов
A — массовое число
p — число протонов
16.
n=A-pA = 27
p = 13
17.
27-13=14A = 27
p = 13
18.
19.
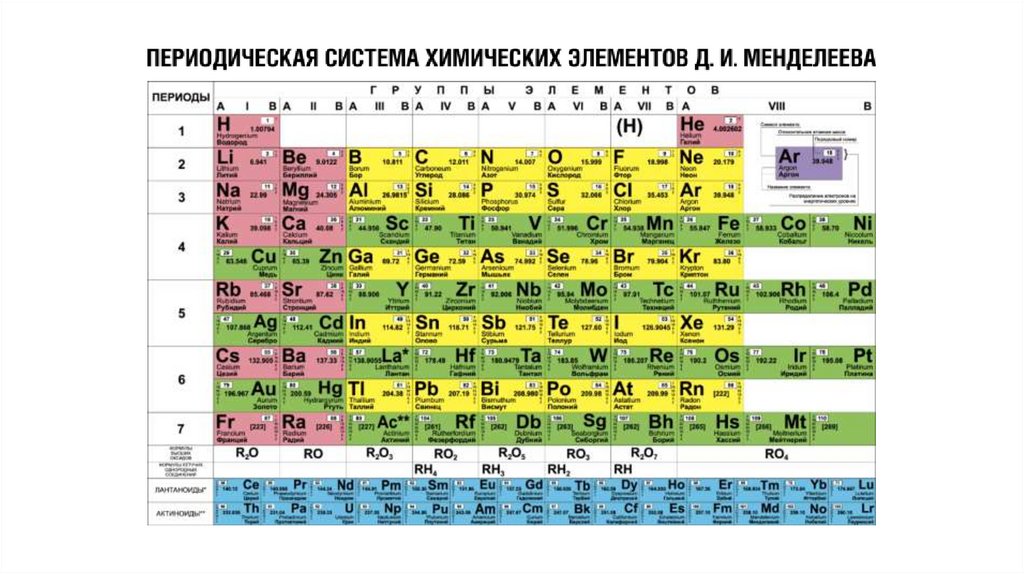
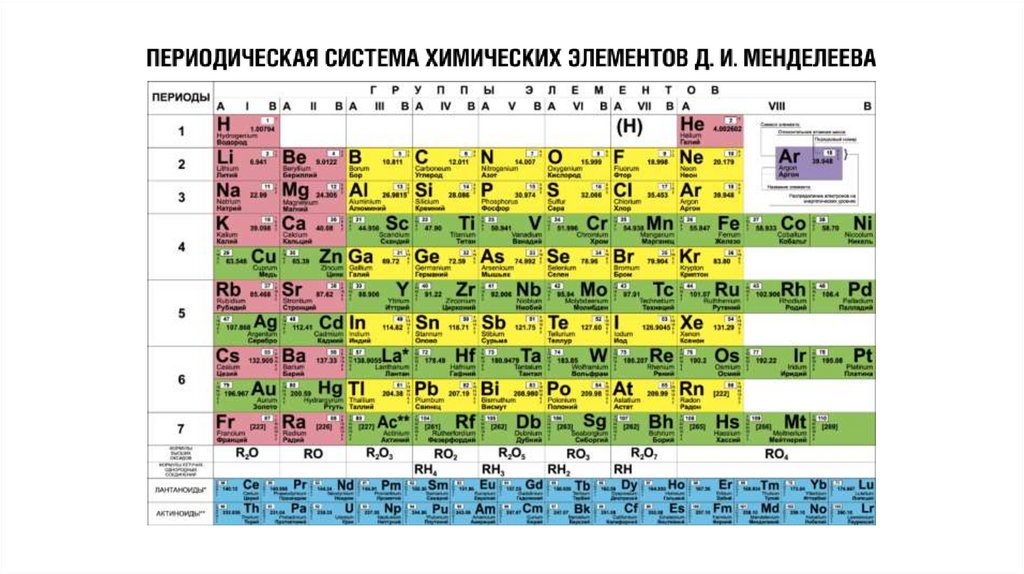
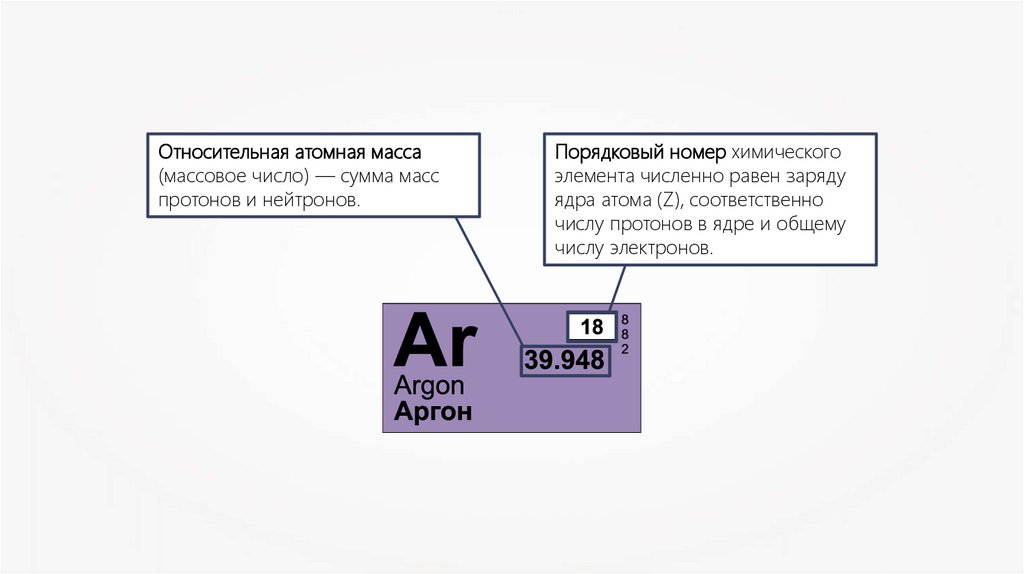
Относительная атомная масса(массовое число) — сумма масс
протонов и нейтронов.
Порядковый номер химического
элемента численно равен заряду
ядра атома (Z), соответственно
числу протонов в ядре и общему
числу электронов.
20.
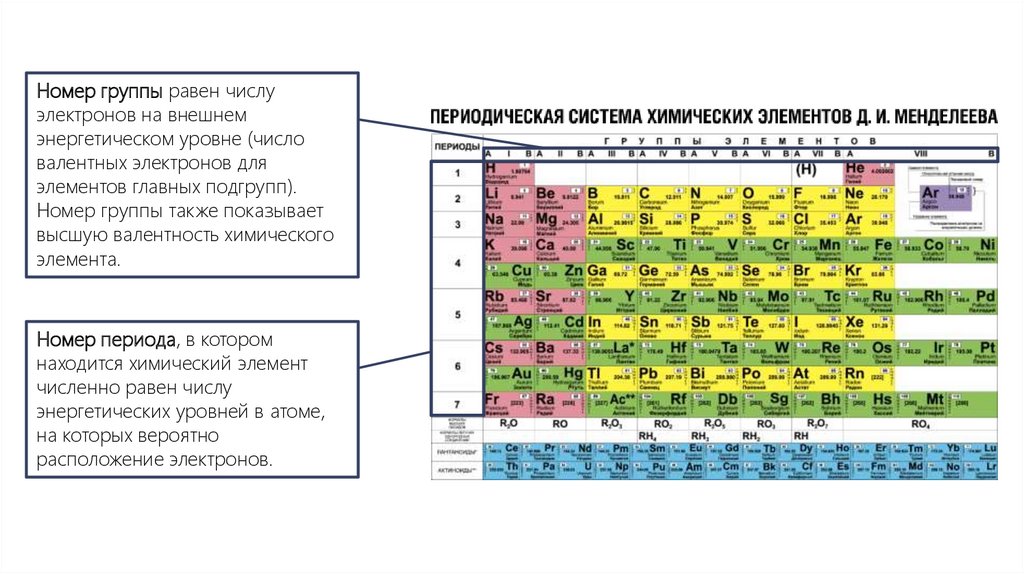
Номер группы равен числуэлектронов на внешнем
энергетическом уровне (число
валентных электронов для
элементов главных подгрупп).
Номер группы также показывает
высшую валентность химического
элемента.
Номер периода, в котором
находится химический элемент
численно равен числу
энергетических уровней в атоме,
на которых вероятно
расположение электронов.
21.
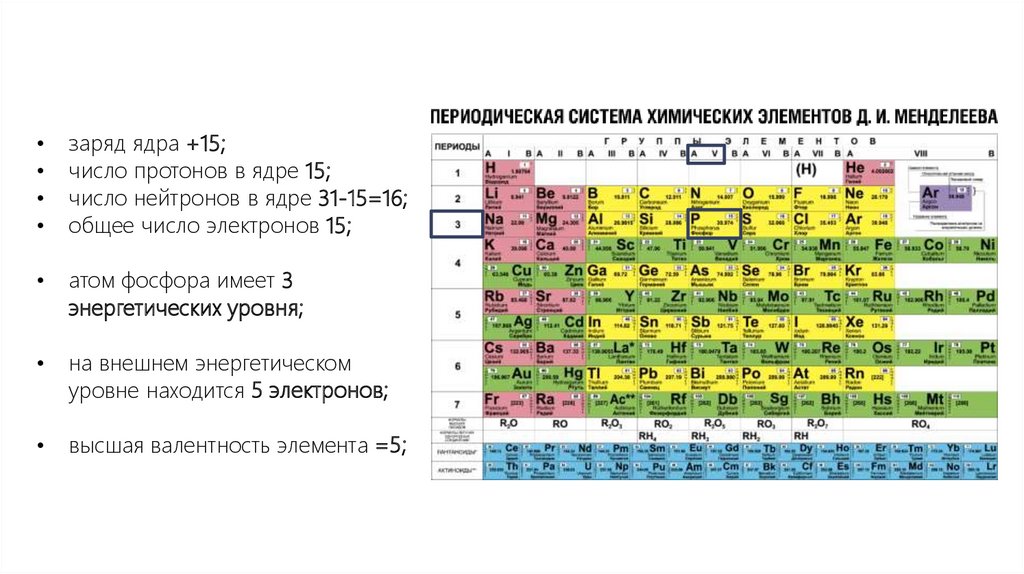
заряд ядра +15;
число протонов в ядре 15;
число нейтронов в ядре 31-15=16;
общее число электронов 15;
атом фосфора имеет 3
энергетических уровня;
на внешнем энергетическом
уровне находится 5 электронов;
высшая валентность элемента =5;













 Химия
Химия








