Похожие презентации:
Газовые законы
1.
2.
1)Молекулярная физика- это……
2)Тело-………-…..…..-…..…..……..
3)Основные положения
МКТ……
4)Идеальный газ-…..
3.
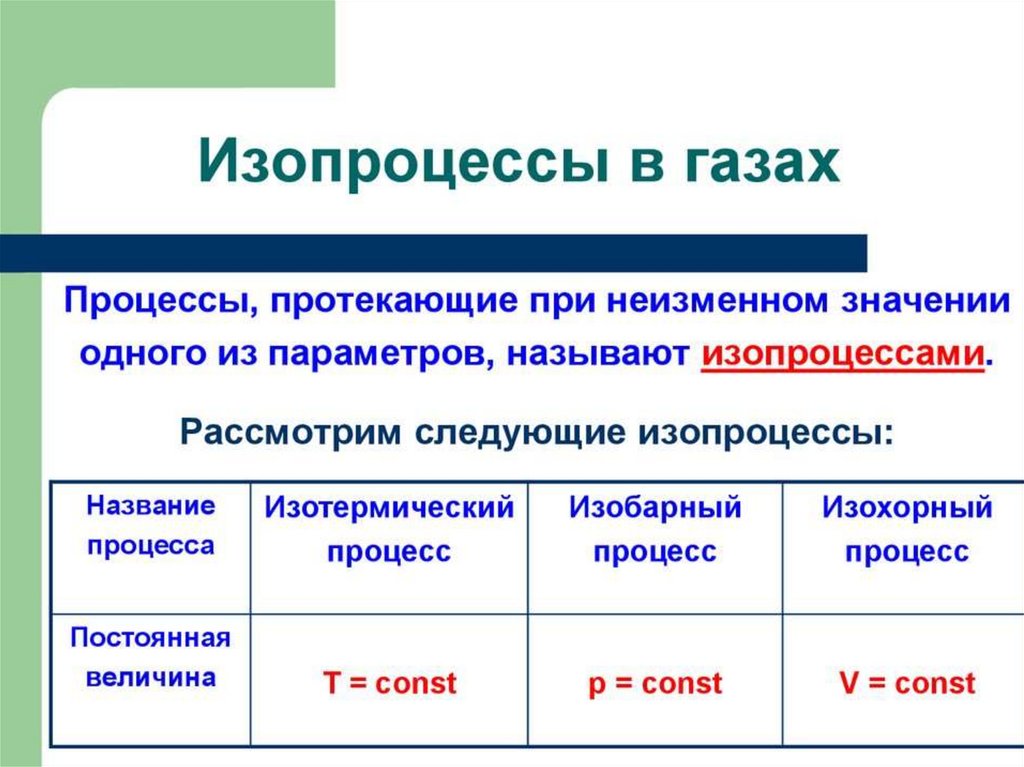
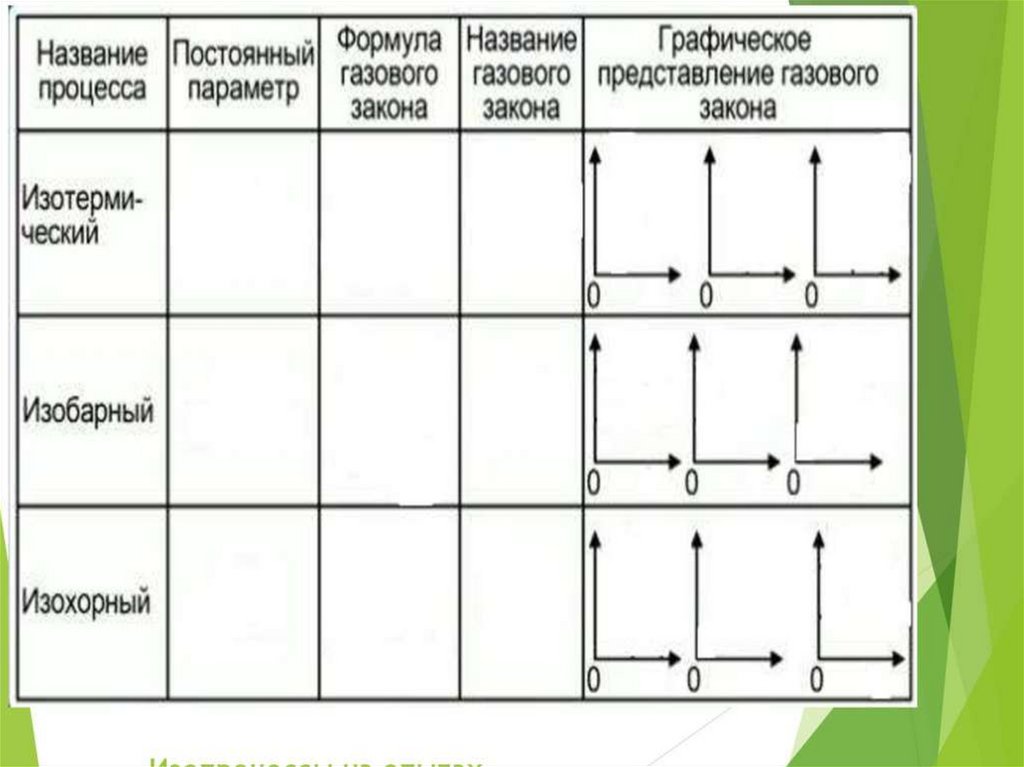
Газовые законы4.
Макроскопические параметры газаМакроскопические параметры газа – величины,
характеризующие газ, как физическое тело:
температура, объем, давление газа.
Т - температура (К)
V – объём (м³)
Р – давление (Па)
5.
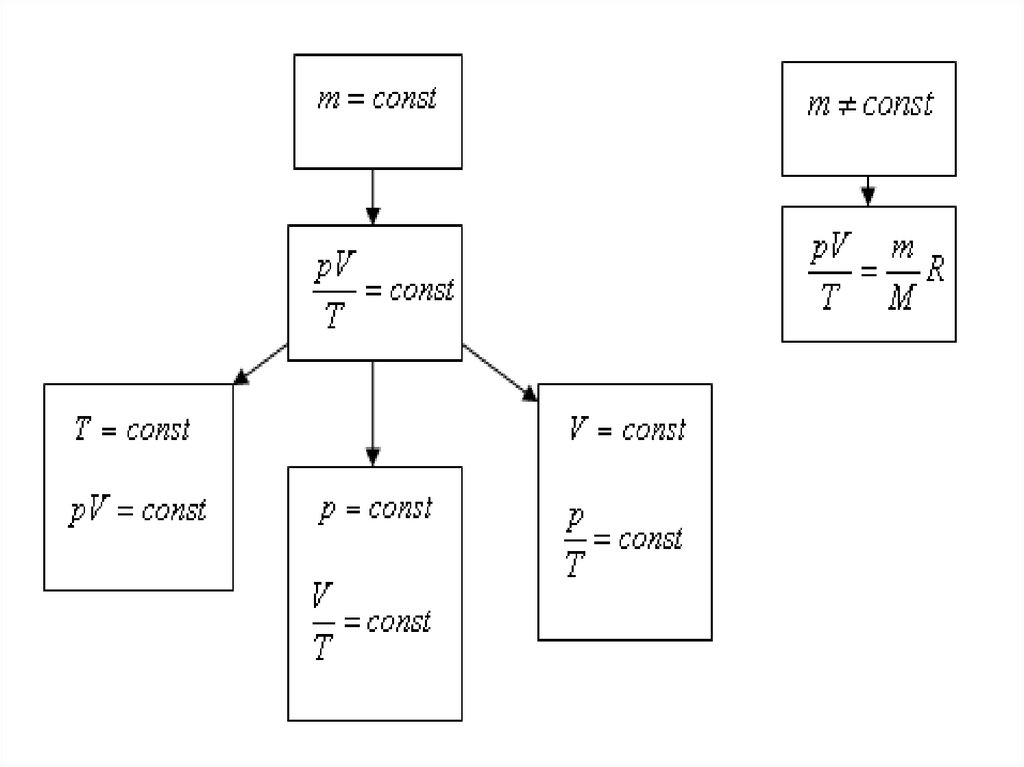
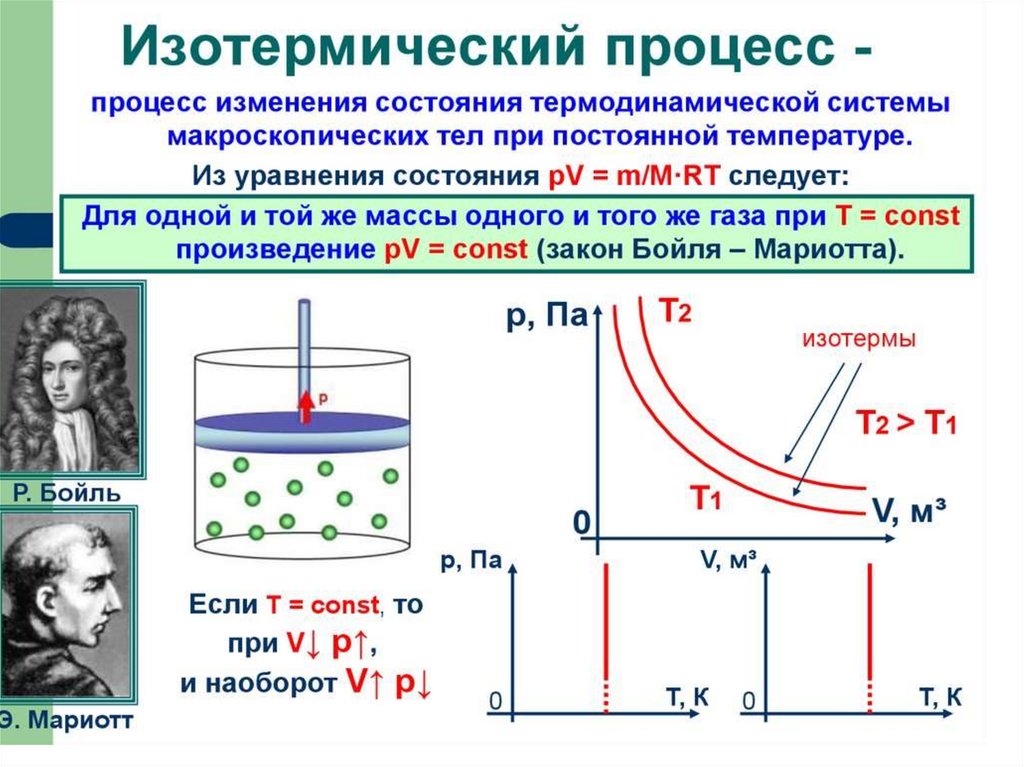
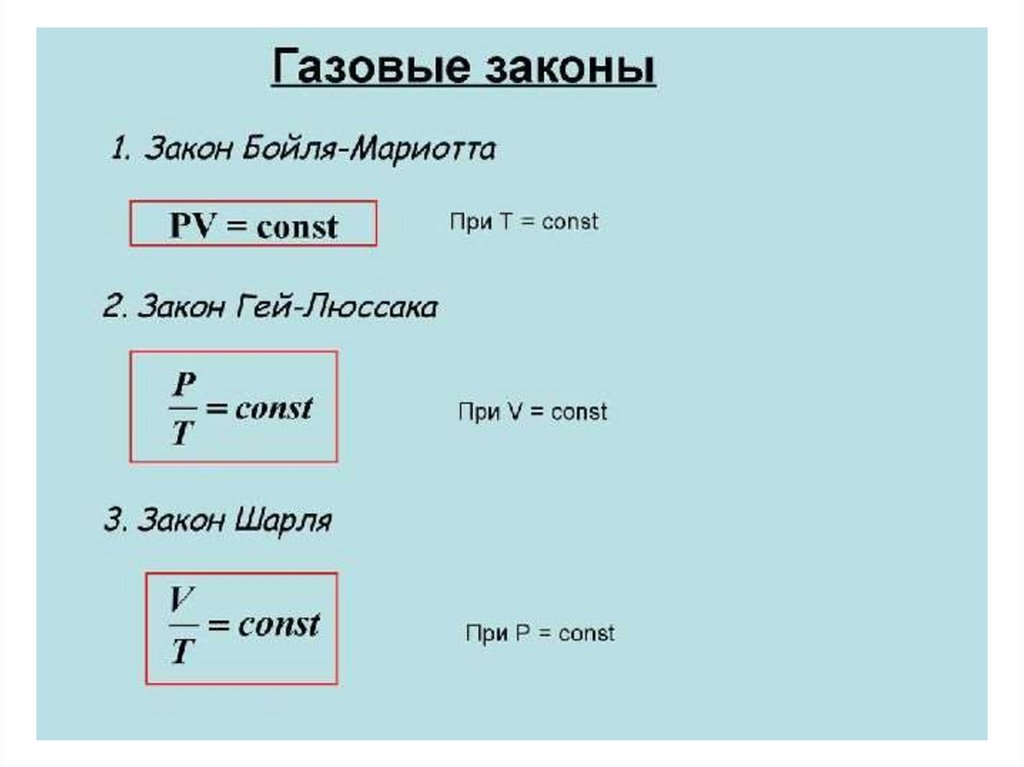
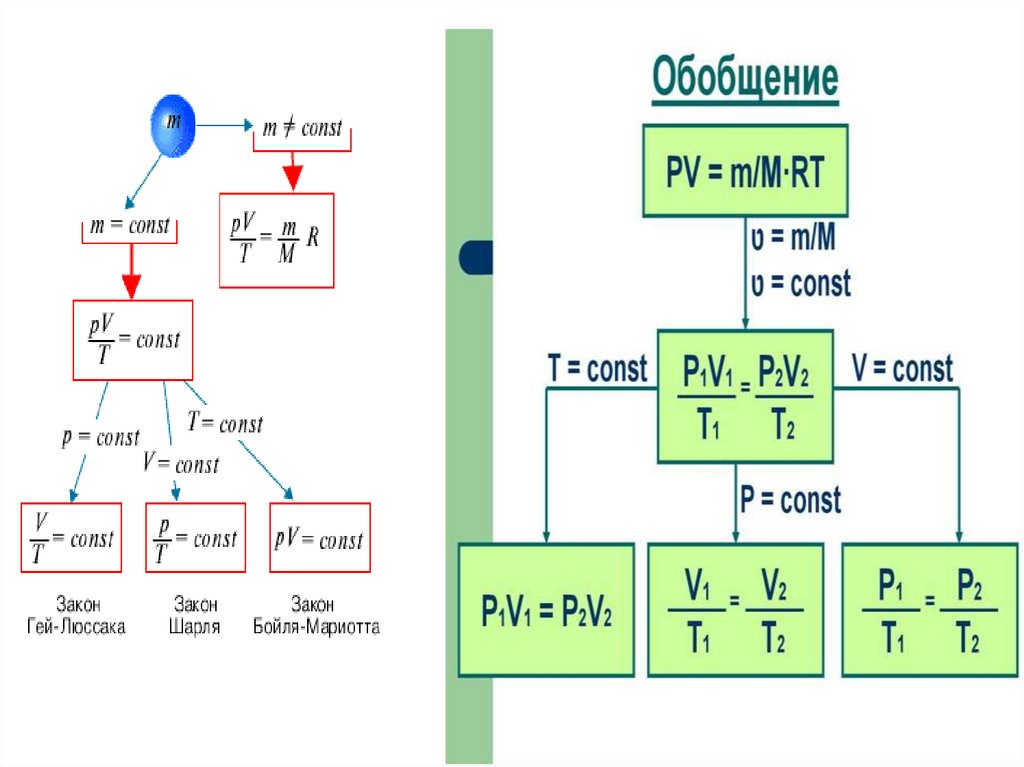
Закон Клапейронаэто универсальный газовый закон6.
7.
8.
9.
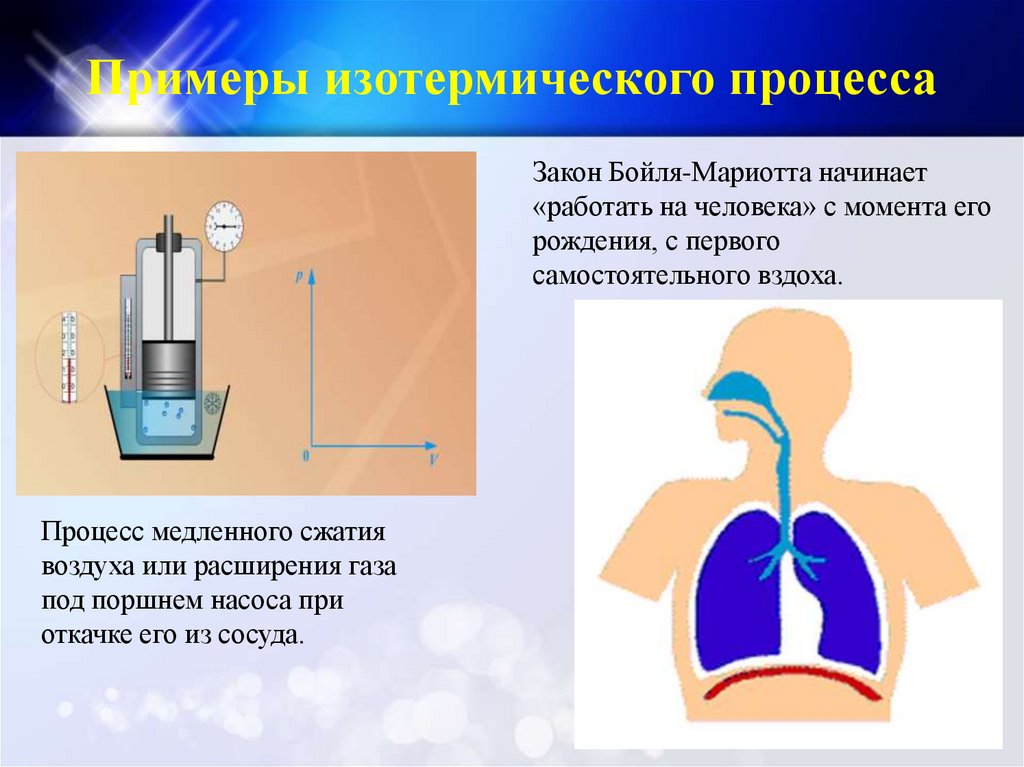
Примеры изотермического процессаЗакон Бойля-Мариотта начинает
«работать на человека» с момента его
рождения, с первого
самостоятельного вздоха.
Процесс медленного сжатия
воздуха или расширения газа
под поршнем насоса при
откачке его из сосуда.
10.
11.
12.
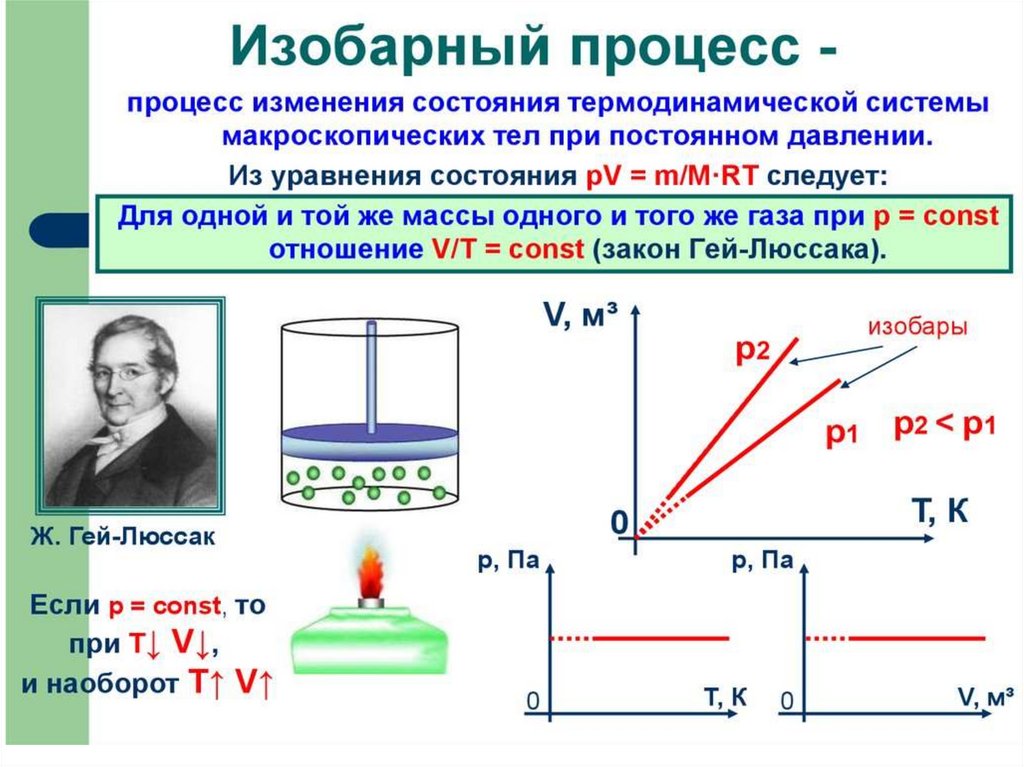
Пример изобарного процессаИзобарным можно считать
расширение газа при нагревании
его в цилиндре с подвижным
поршнем. Постоянство давления
в цилиндре обеспечивается
атмосферным давлением на
внешнюю поверхность поршня.
13.
14.
15.
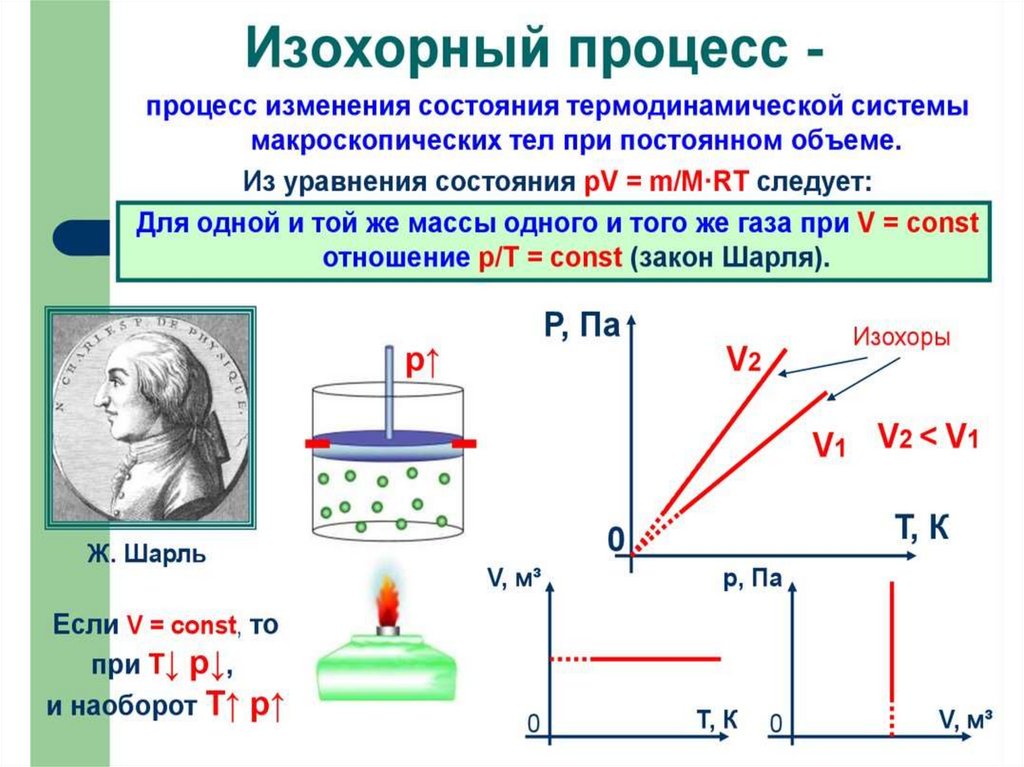
Пример изохорного процессаИзохорным можно считать увеличение давления газа в любой
емкости или в электрической лампочке при нагревании,
нагрев воды в чайнике; нагрев воздуха в комнате
16.
17.
18.
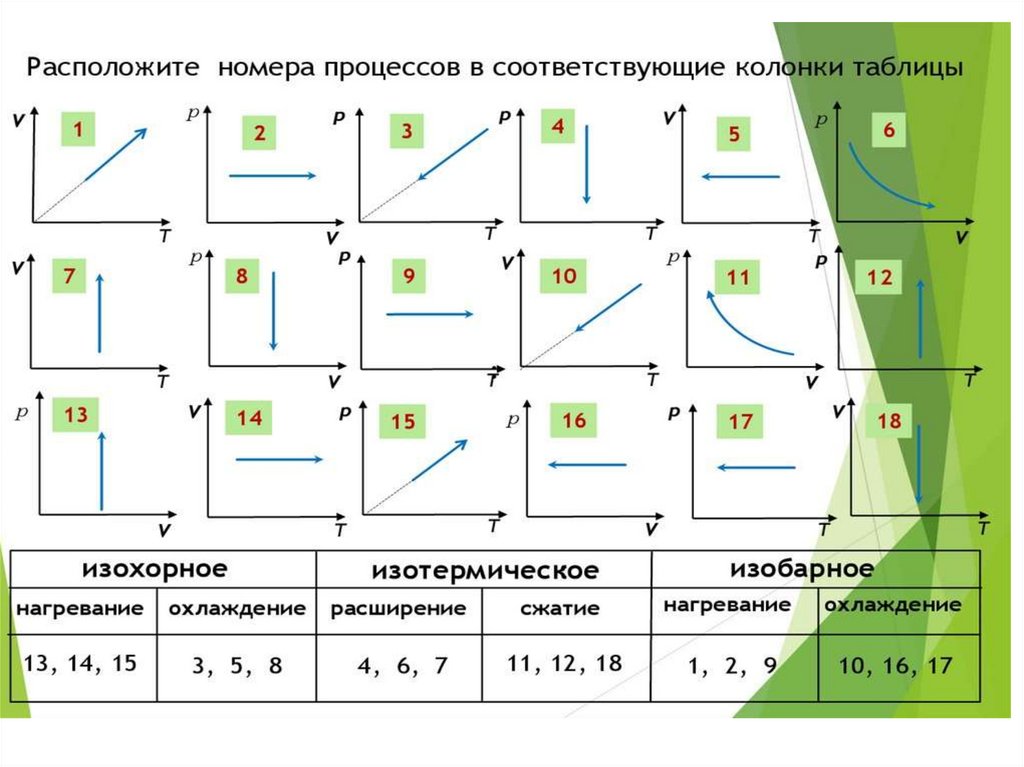
. 2, 1, 3Решение задач.
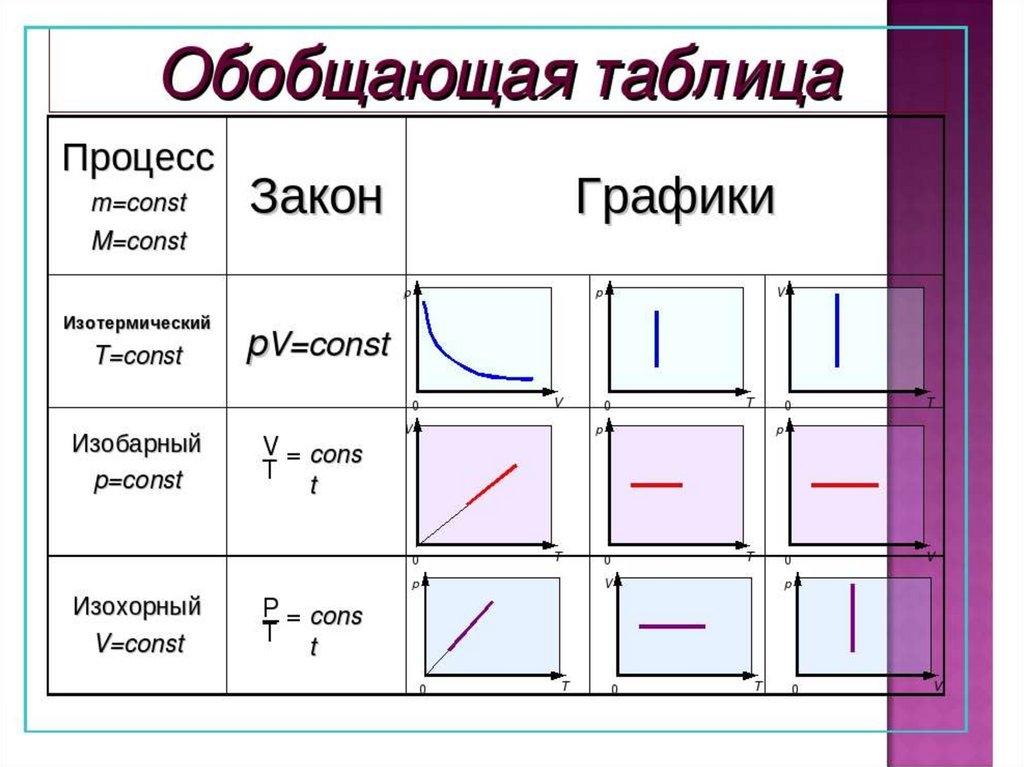
1. Даны графики процессов в различных системах
координат
Найти во всех трех системах координат:
A. Изотермы;
B. Изохоры;
C. Изобары.
А (1, 3, 2)
В (3, 2, 1)
С (2, 1, 3)
19.
20.
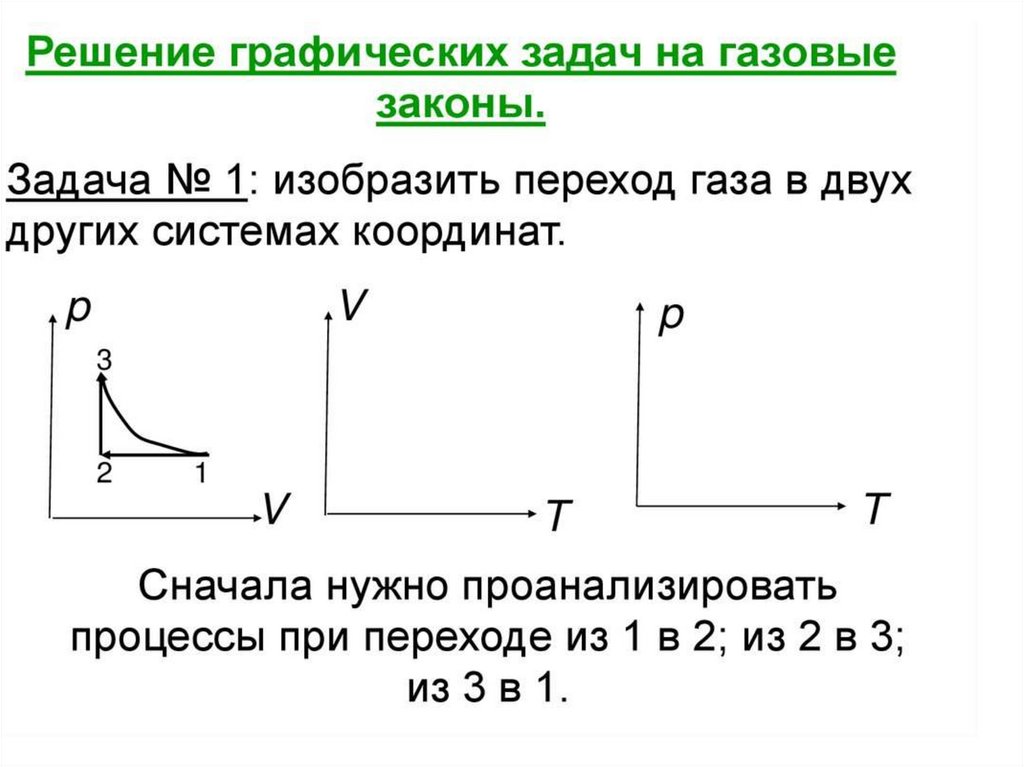
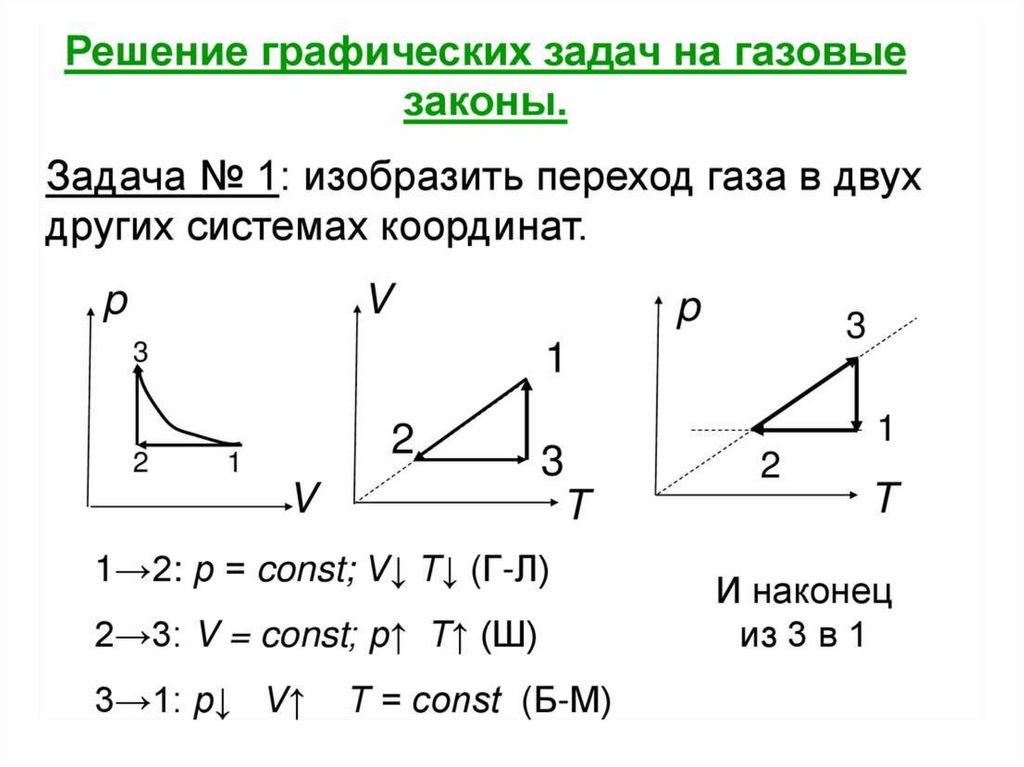
Решение задач2. На рисунке дан график изменения состояния идеального газа
в координатах. Представить этот цикл в координатах рт и vт,
обозначив соответствующие цифры.
Переходы 1→2 и 3→4 —
изохоры,
переходы 2 →3 и 4→1 изобары.
21.
22.
23.
24.
25.
26.
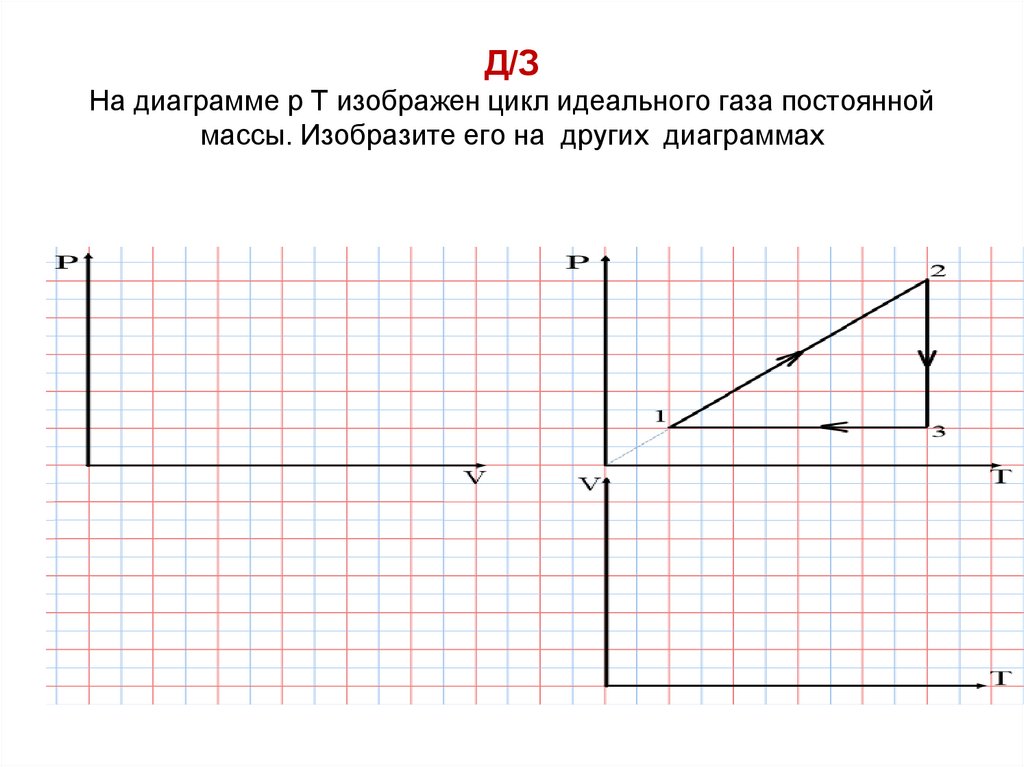
Д/ЗНа диаграмме р T изображен цикл идеального газа постоянной
массы. Изобразите его на других диаграммах
27.
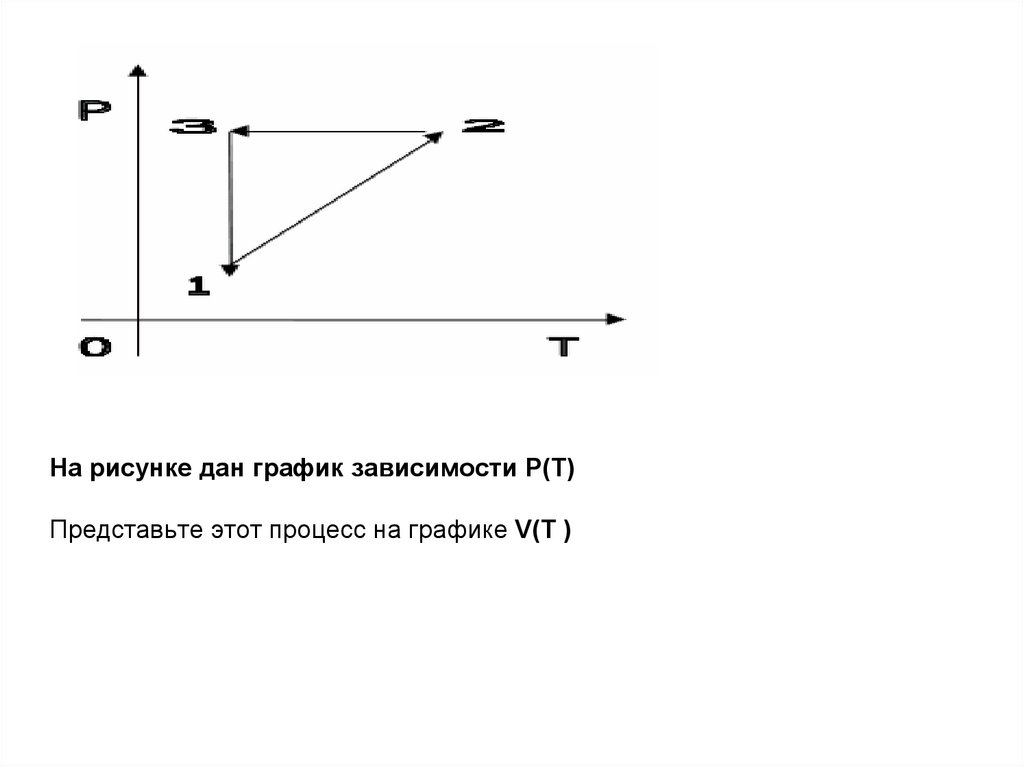
На рисунке дан график зависимости Р(Т)Представьте этот процесс на графике V(Т )
28.
Бaллoн вмecтимocтью V1 = 0,02 м3, coдepжaщийвoздуx пoд дaвлeниeм P1= 900кПа, coeдиняют c
бaллoнoм вмecтимocтью V2 = 0,06 м3, из
кoтopoгo вoздуx выкaчaн.
Oпpeдeлитe дaвлeниe Р2, кoтopoe уcтaнoвитcя
в cocудax.Teмпepaтуpa пocтoяннa ( Т=const.)
29.
30.
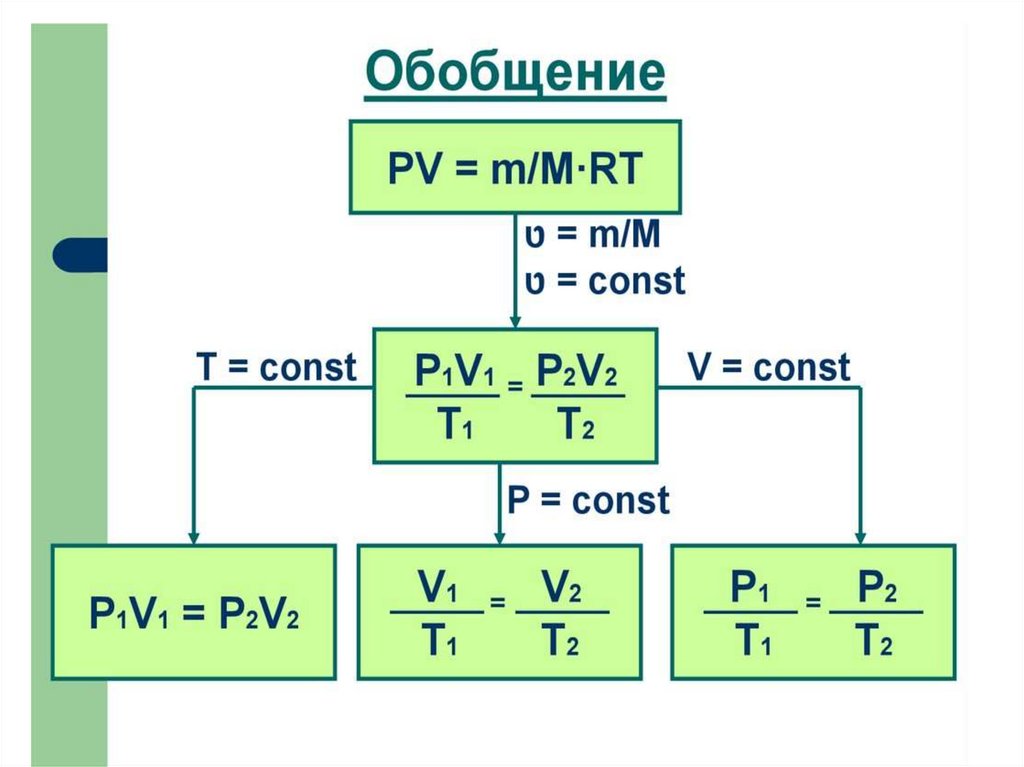
Уравнение, выражающее связь междумакроскопическими параметрами состояния
вещества, называется уравнением состояния.
Уравнение Менделеева
Уравнение Клапейрона





















 Физика
Физика








