Похожие презентации:
Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико- хімічний процес. Кристалогідрати
1. Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати
ПрезентаціяТеплові явища, що супроводжують
розчинення речовин. Розчинення як
фізико-хімічний процес. Кристалогідрати
2. Мета уроку
• ознайомити учнів фізико-хімічною природою процесу"розчинення;
• з'ясувати внутрішню сутність процесу розчинення;
• показати, що процес розчинення супроводжується не лише
фізичними явищами, але й хімічною взаємодією розчинника
й розчиненої речовини;
• дати уявлення про теплові явища, що супроводжують
процес розчинення;
• сформувати поняття про кристалогідрати
3. Актуалізація знань
Бесіда.• Які суміші називають розчинами?
• 3 яких компонентів складаються розчини?
• Які розчини називають насиченими,
ненасиченими, розбавленими, концентрованими?
• Чи може розбавлений розчин бути насиченим?
• Чи обов'язково концентрований розчин буде
насиченим?
Тести
4. Проблемні питання:
1. При утворенні хімічного зв'язку енергія поглинається чивиділяється?
2. При руйнуванні хімічного зв'язку енергія поглинається чи
виділяється?
.
5. Розчини
Якірозчини є
в нашому
організмі?
6. Утворення розчинів
• Яким явищем єдифузія?
7. Пригадайте…
• Ознаки хімічних реакцій8. Теплові ефекти при розчиненні
Виділення або поглинаннятепла є ознакою хімічної
реакції?
9. Теплові ефекти розчинення
При розчиненні відбуваються два процеси:Перший - руйнування хімічних зв'язків у кристалічних
решітках; при цьому енергія поглинається.
Другий - утворення міжмолекулярних зв'язків при
гідратації; при цьому енергія виділяється.
Загальний тепловий ефект розчинення дорівнює сумі
двох теплових ефектів названих процесів
10.
Якщопри
гідратації
виділяється
енергії
більше,
ніж
витрачається на руйнування кристалічних решіток, то при
розчиненні енергія виділяється і розчин нагрівається і навпаки.
Q розчинення = Q гідратації — Q крист. решітки
Якщо Q гідратації < Q крист. решітки, то Q розчинення < 0
(теплота поглинається)
Якщо Q гідратації > Q крист. решітки, то Q розчинення > 0
(теплота виділяється)
11. Теплові явища під час розчинення речовин у воді
Розчинення кальцій хлоридуРозчинення амоній нітрату
12.
Бесіда.Яким процесом (фізичним чи хімічним) є розчинення?
Чому розчинення є фізичним процесом? (При розчиненні відбувається
подрібнення речовини)
Чому розчинення не є фізичним процесом? (Тому що розчинення
супроводжується тепловим ефектом - енергія хімічних зв'язків
переходить у теплову)
Чому розчинення є хімічним процесом? (Руйнування одних хімічних
зв'язків і утворення інших)
Чому розчинення не є хімічним процесом? (Тому що не відбувається
утворення нових речовин)
Висновок: розчинення є фізико-хімічним процесом.
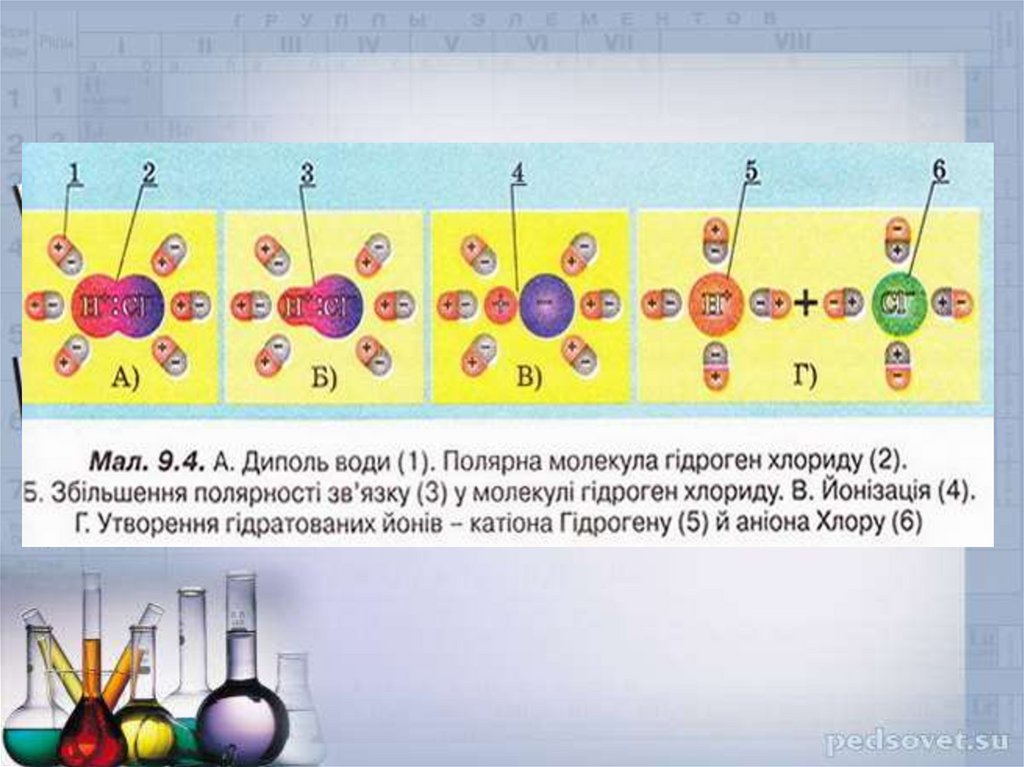
13. Процес розчинення
Вода є чудовим розчинником для полярних інеполярних речовин, які мають заряджені
часточки
14.
15. Кристалогідрати
Тверді речовини, які містять у своєму складіводу називають кристалогідратами, а вода
що
міститься
кристалізаційною.
в
них
У
називається
кристалогідратах
кожна молекула речовини оточена певною,
характерною
молекул води.
для
речовини
кількістю
16.
Більшістьгідратів
є
нестійкими
сполуками,
після
випаровування води вони розпадаються, через деякий час
вони
знову
перетворюються
на
гідрати
відбувається в вологому місці).
Взаємоперетворення мідного купоросу
CuSO4 · 5H2O і купрум (II) сульфату
(краще
це
17.
Деякі кристалогідрати і безводні солі:а) CuSO4 · 5H2O і безводний купрум (ІІ) сульфат;
б) CoCl2 · 6H2O і безводний кобальт (ІІ) хлорид.
Малюнок показує, що речовини можуть змінювати свій
колір, утворюючи кристалогідрати.
18. Розв'язування задач із застосуванням поняття про кристалогідрати
1. Кристалогідраткупрум (II) сульфату
масою 5 г розчинили в
5 мл води. Розрахуйте
масову частку солі в
добутому розчині.
19. Розв'язування задач із застосуванням поняття про кристалогідрати
2. Яку масу глауберовоїсолі необхідно додати до
100 мл 8% -го розчину
натрій сульфату (густина
1,07 г/мл), щоб подвоїти
масову частку речовини в
розчині?
20. Розв'язування задач із застосуванням поняття про кристалогідрати
3. 25 г мідного купоросу розчинили у 135 води. Визначтемасову частку розчиненої речовини (M(CuSO4) = 160 г/моль, a
M(CuSO4 · 5Н2О) = 250г/моль).
4. Яку масу мідного купоросу й води треба взяти для
приготування 40 кг 20% -го розчину купрум сульфату?
21.
Зкріплення знаньПобудуйте графік розчинності мідного купоросу CuSO45H2О в
воді за наступним даним:
Температура,
ºС
Розчинність,
г/л
0
150
10
170
20
190
30
240
40
290
50
340
60
390
г/л
400
300
200
100
10
20
30
40
50
ºС
22.
Використовуючи графік визначте:1) Яку масу CuSO4 ·5H2 O можна розчинити в
100 мл води при 40 ºС.
29 г
2) Припустіть яку масу CuSO4 ·5H2 O можна
розчинити в 1 л води при 70 ºС.
3) Яка маса солі CuSO4 ·5H2 O випаде в вигляді
440 г
кристаликів из розчину, котрий приготували з
340 г солі и 1 л води при 50 ºС и охолодили
до 30 ºС.
100 г
23. Домашнє завдання
1.Вивчити §4 підручника.
2.
Виконати завдання після параграфа
3.
Виготовити самостійно кристал з розчину мідного купоросу
24.
25. Список використаних джерел
Література:Попель П.П. Хімія: підруч. для 9 кл. загальноосвіт. навч. закл. / П.П.Попель,
Л.С.Крикля – К.: ВЦ «Академія», 2009 – 232 с.: іл. (книга двох авторів).
Дігавцова Л.Ю. Хімія. 9 клас : Плани-конспекти уроків на друкованій
основі / Л. Ю. Дігавцова — Х. : Вид-во «Ранок», 2013. — 128 с. — (Серія
«Конструктор уроку»). (книга одного автора).
Старовойтова І.Ю. Усі уроки хімії 9 клас / І.Ю.Старовойтова, О.В.Люсай. –
Х.: Вид. Група «Основа», 2009 – 239, [1]с.: іл.,табл. – (Серія « 12 – річна
школа»). (книга одного автора).
Григорович О.В. Хімія. 9 клас: Розширене календарне планування уроків /
О.В. Григорович, О.М. Гостинникова, А.В. Трушина – Х.: Веста:
Видавництво «Ранок», 2007. – 96 с. – (На допомогу вчителю). (книга трьох
авторів).
26. Список використаних джерел
Інтернет-ресурси1.
https://www.youtube.com/watch?v=1pRdKf1DQB4
2.
http://www.myshared.ru/slide/779045/
3.
http://disted.edu.vn.ua/courses/learn/2205
4.
http://edufuture.biz/index.php?title=Розчинність,_її_залежність_від_
різних_чинників._Фізикохiмічна_суть_процесу_розчинення._Поняття_про_кристалогідрати

























 Химия
Химия








