Похожие презентации:
Строение электронной оболочки
1.
Презентация созданаучителем химии
Тишкиной Е.М.
2. Орбиталь -
Орбиталь это область пространства, где вероятностьнахождения электрона равна 90 %.
Орбиталь атома водорода (у него 1 электрон):
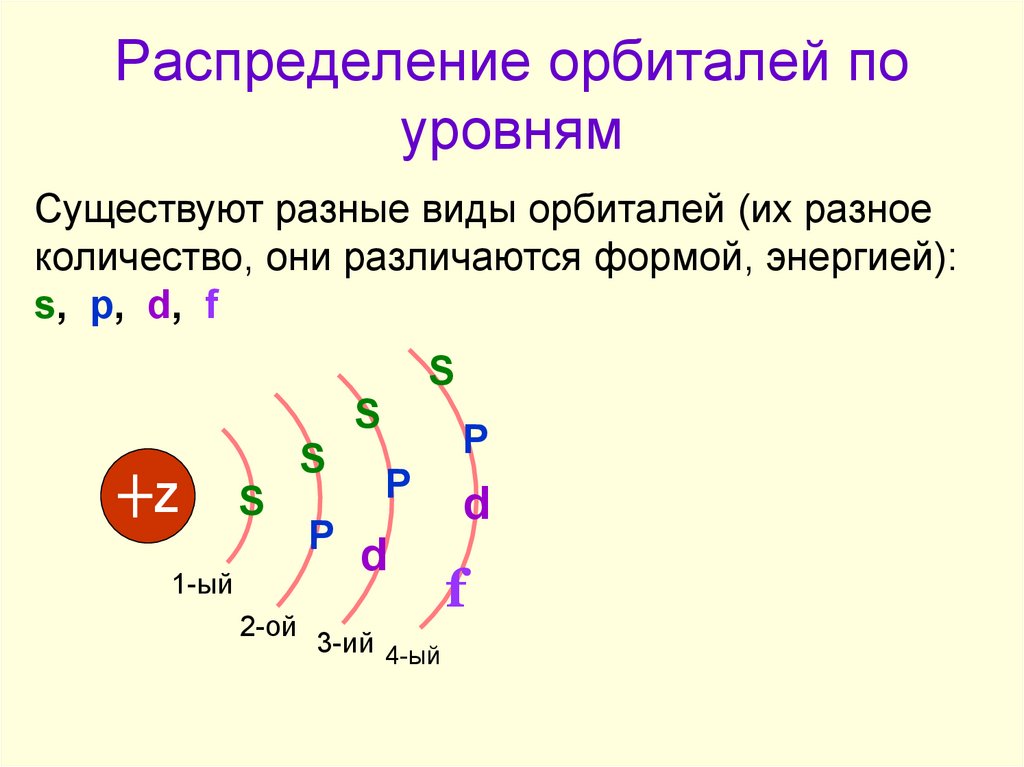
3. Распределение орбиталей по уровням
Существуют разные виды орбиталей (их разноеколичество, они различаются формой, энергией):
s, p, d, f
S
S
S
Z
S
1-ый
2-ой
P
P
P
d
3-ий 4-ый
d
f
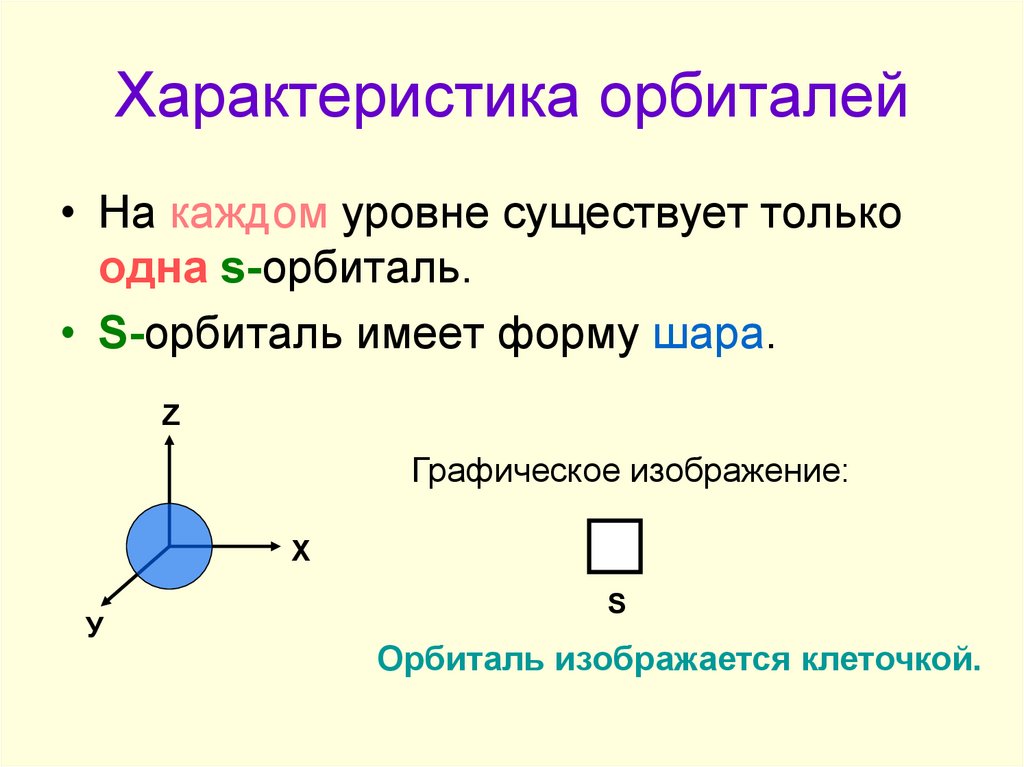
4. Характеристика орбиталей
• На каждом уровне существует толькоодна s-орбиталь.
• S-орбиталь имеет форму шара.
Z
Графическое изображение:
Х
У
S
Орбиталь изображается клеточкой.
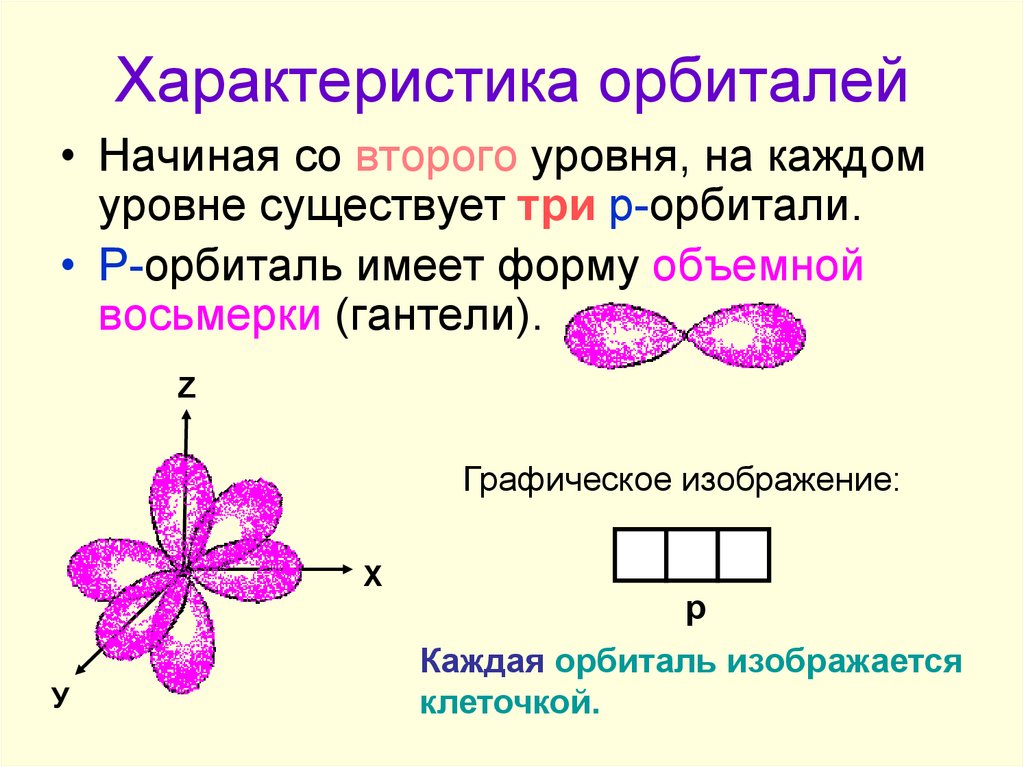
5. Характеристика орбиталей
• Начиная со второго уровня, на каждомуровне существует три р-орбитали.
• Р-орбиталь имеет форму объемной
восьмерки (гантели).
Z
Графическое изображение:
Х
У
р
Каждая орбиталь изображается
клеточкой.
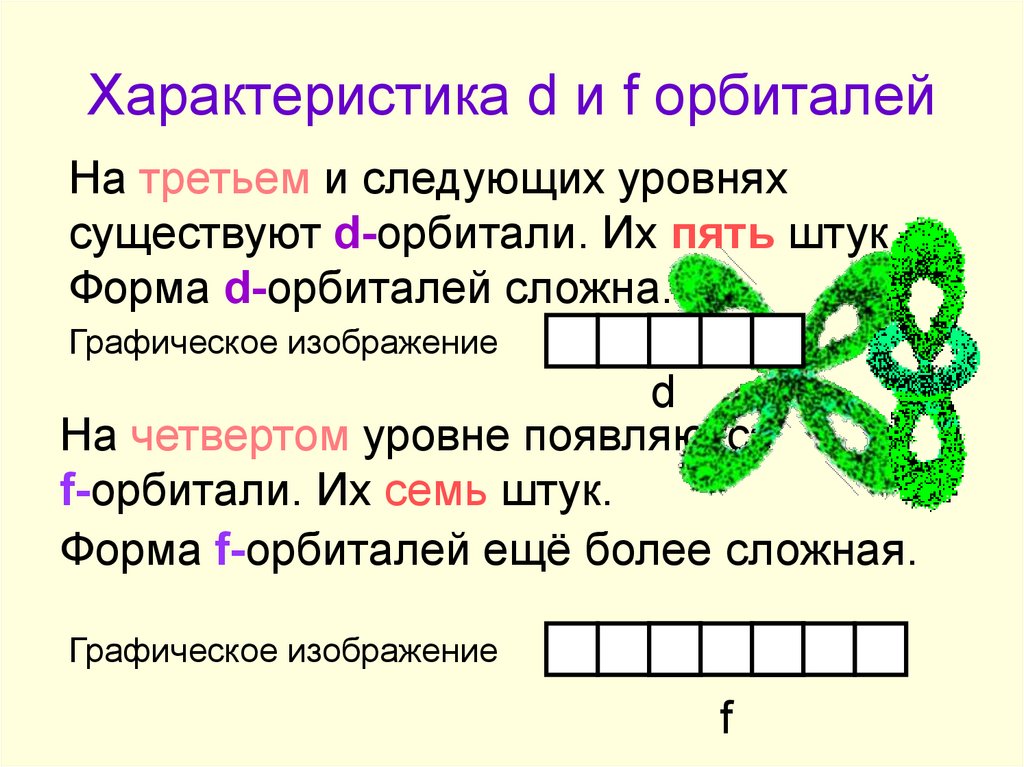
6. Характеристика d и f орбиталей
На третьем и следующих уровняхсуществуют d-орбитали. Их пять штук.
Форма d-орбиталей сложна.
Графическое изображение
d
На четвертом уровне появляются
f-орбитали. Их семь штук.
Форма f-орбиталей ещё более сложная.
Графическое изображение
f
7. Принципы заполнения орбиталей электронами.
1) Принцип наименьшей энергии:электрон идет на ту орбиталь, энергия
которой меньше.
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p…
2) Принцип Паули:
на одной орбитали не может быть
больше двух электронов. Если два – то
разные.
Может
быть
Запрещено
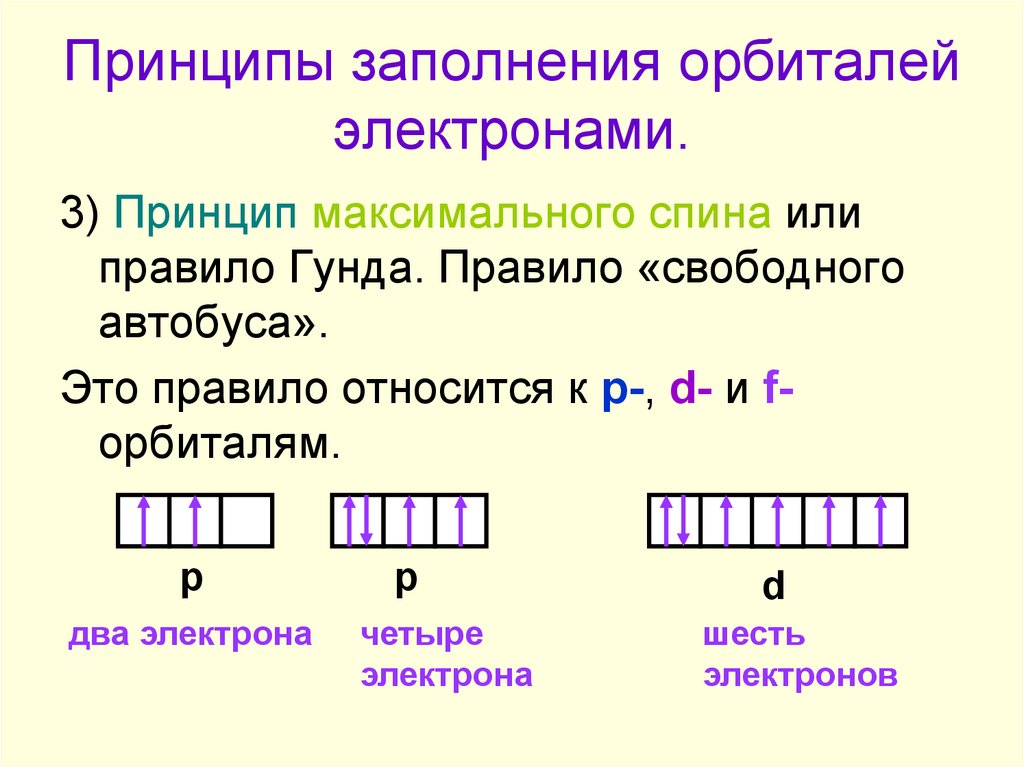
8. Принципы заполнения орбиталей электронами.
3) Принцип максимального спина илиправило Гунда. Правило «свободного
автобуса».
Это правило относится к p-, d- и fорбиталям.
р
два электрона
р
четыре
электрона
d
шесть
электронов



 Химия
Химия








