Похожие презентации:
Ферменты (лекция 6)
1.
Лекция 6Ферменты
2.
Ферменты (энзимы) –это биологические катализаторы белковой (не всегда)
природы
от лат. fermentum – закваска
от греч. эн – внутри
зиме - закваска
3.
Ферментативная реакция:E + S ↔ ES ↔ E + P
E – энзим (фермент)
S – субстрат
ES – фермент-субстратный комплекс
P – продукт
4.
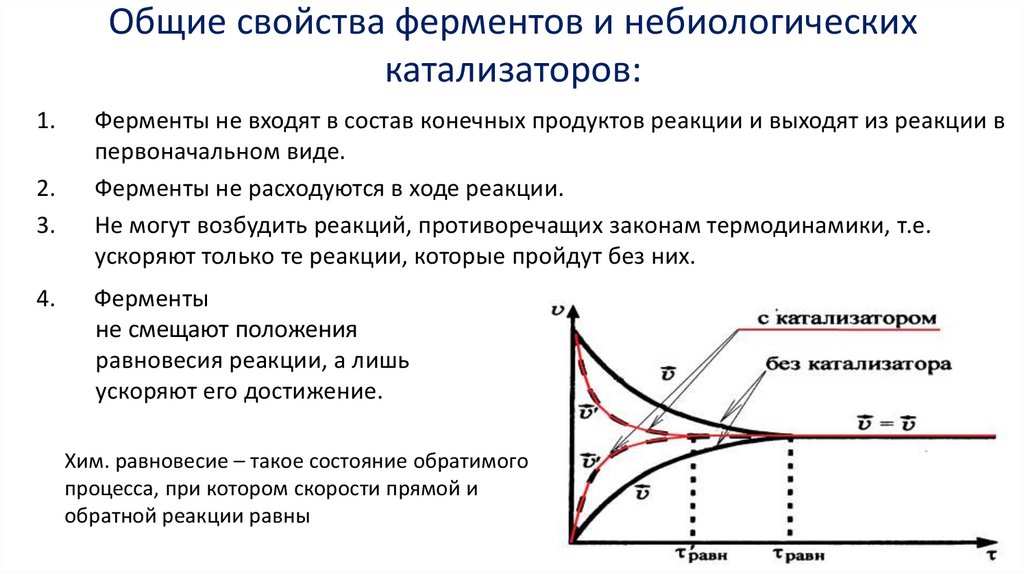
Общие свойства ферментов и небиологическихкатализаторов:
1.
2.
3.
4.
Ферменты не входят в состав конечных продуктов реакции и выходят из реакции в
первоначальном виде.
Ферменты не расходуются в ходе реакции.
Не могут возбудить реакций, противоречащих законам термодинамики, т.е.
ускоряют только те реакции, которые пройдут без них.
Ферменты
не смещают положения
равновесия реакции, а лишь
ускоряют его достижение.
Хим. равновесие – такое состояние обратимого
процесса, при котором скорости прямой и
обратной реакции равны
5.
Специфические свойства ферментов1.
Ферменты – по химическому строению – белки и могут быть РНК (рибонуклеопротеины = рибозимы).
2.
Скорость реакции, катализируемой ферментом выше, чем в присутствии небиологических
катализаторов.
Пример: при t0=250C мочевина разлагается до аммиака за 2х10 9 с
Фермент уреаза ускоряет разложение мочевины до 2х10 -4с
Ускорение в 10 13 раз!
3.
Почти 100% выход целевого продукта.
Из многих возможных путей превращения субстрата фермент ускоряет лишь один путь.
4.
Обладают узкой специфичностью к субстрату (веществу на которое они действуют).
Абсолютная специфичность: амилаза расщепляет только крахмал, липаза – только ацилглицерины (жиры).
Относительная специфичность: карбоксипептидаза А быстро отщепляет от С-конца ароматические или крупные
алифатические аминокислоты (фен, тир, три, лей, илей и др.), хуже – глу, гис, ала,сер, лиз. Очень медленно – гли, асп. Не
отщепляет – про, арг.
5.
Активность (скорость ферментативной реакции) можно регулировать
(температура, рН, ингибиторы и активаторы).
6.
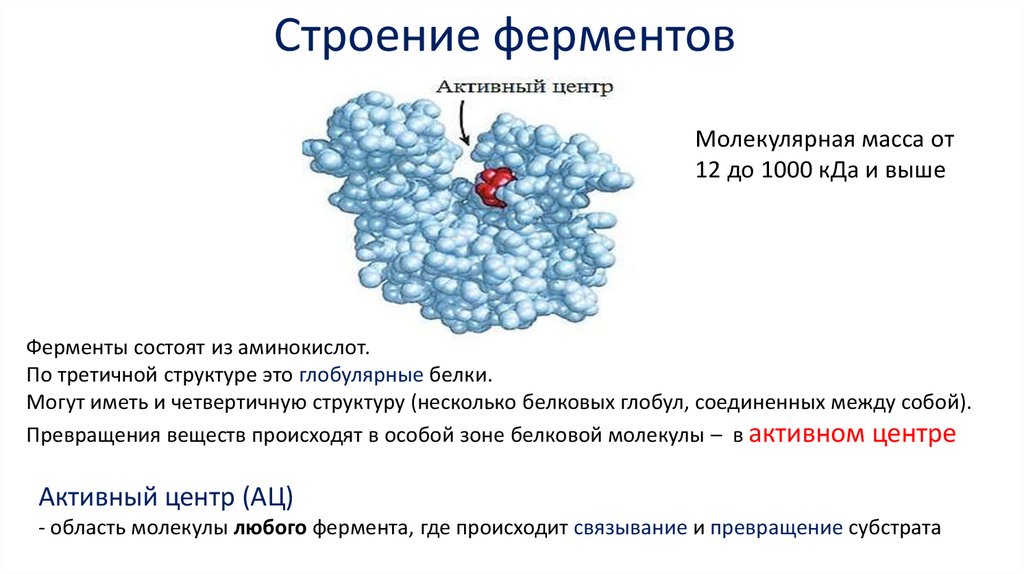
Строение ферментовМолекулярная масса от
12 до 1000 кДа и выше
Ферменты состоят из аминокислот.
По третичной структуре это глобулярные белки.
Могут иметь и четвертичную структуру (несколько белковых глобул, соединенных между собой).
Превращения веществ происходят в особой зоне белковой молекулы – в активном центре
Активный центр (АЦ)
- область молекулы любого фермента, где происходит связывание и превращение субстрата
7.
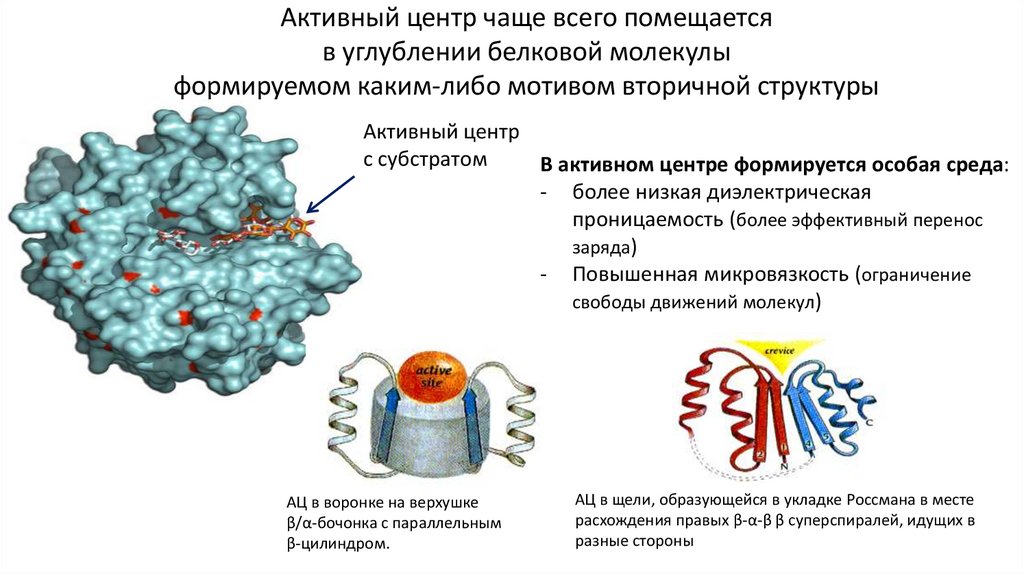
Активный центр чаще всего помещаетсяв углублении белковой молекулы
формируемом каким-либо мотивом вторичной структуры
Активный центр
с субстратом
В активном центре формируется особая среда:
- более низкая диэлектрическая
проницаемость (более эффективный перенос
заряда)
- Повышенная микровязкость (ограничение
свободы движений молекул)
АЦ в воронке на верхушке
β/α-бочонка с параллельным
β-цилиндром.
АЦ в щели, образующейся в укладке Россмана в месте
расхождения правых β-α-β β суперспиралей, идущих в
разные стороны
8.
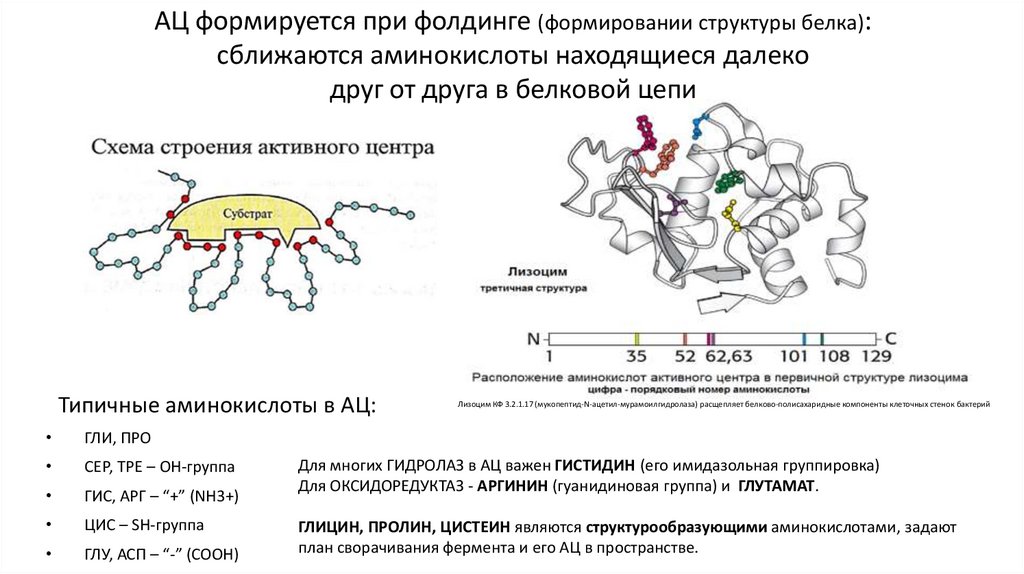
АЦ формируется при фолдинге (формировании структуры белка):сближаются аминокислоты находящиеся далеко
друг от друга в белковой цепи
Типичные аминокислоты в АЦ:
ГЛИ, ПРО
СЕР, ТРЕ – ОН-группа
ГИС, АРГ – “+” (NH3+)
ЦИС – SH-группа
ГЛУ, АСП – “-” (СООН)
Лизоцим КФ 3.2.1.17 (мукопептид-N-ацетил-мурамоилгидролаза) расщепляет белково-полисахаридные компоненты клеточных стенок бактерий
Для многих ГИДРОЛАЗ в АЦ важен ГИСТИДИН (его имидазольная группировка)
Для ОКСИДОРЕДУКТАЗ - АРГИНИН (гуанидиновая группа) и ГЛУТАМАТ.
ГЛИЦИН, ПРОЛИН, ЦИСТЕИН являются структурообразующими аминокислотами, задают
план сворачивания фермента и его АЦ в пространстве.
9.
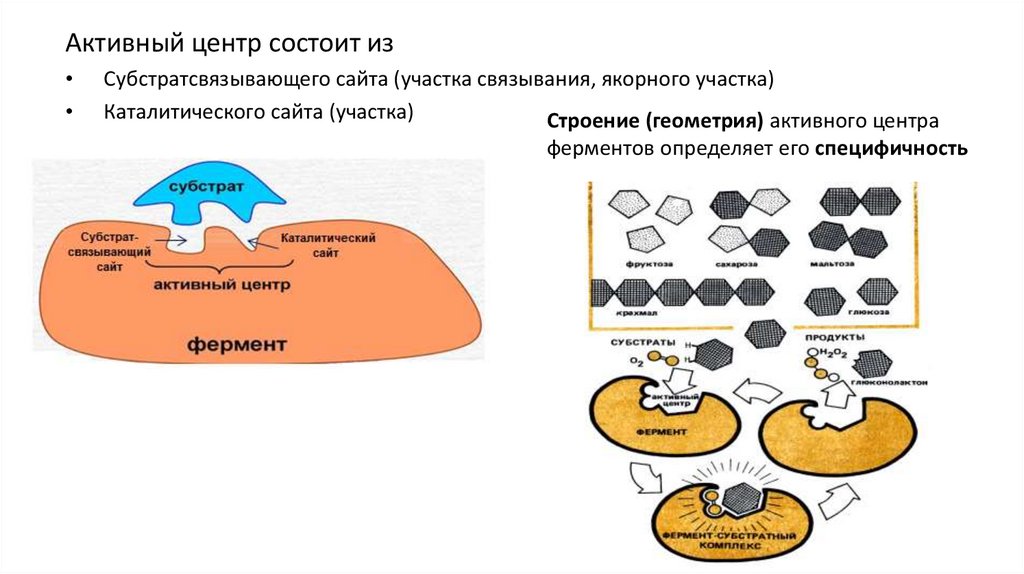
Активный центр состоит изСубстратсвязывающего сайта (участка связывания, якорного участка)
Каталитического сайта (участка)
Строение (геометрия) активного центра
ферментов определяет его специфичность
10.
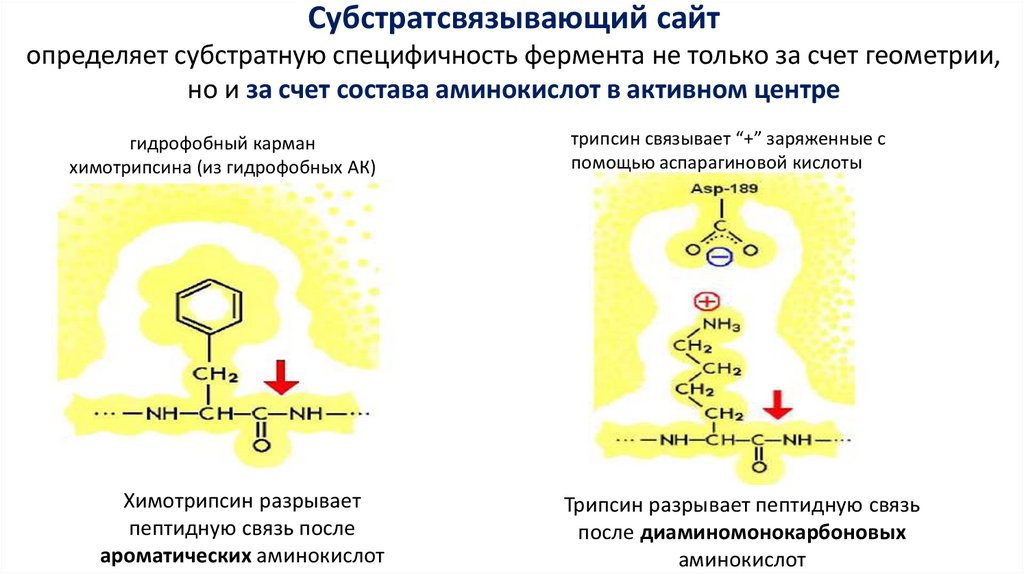
Субстратсвязывающий сайтопределяет субстратную специфичность фермента не только за счет геометрии,
но и за счет состава аминокислот в активном центре
гидрофобный карман
химотрипсина (из гидрофобных АК)
Химотрипсин разрывает
пептидную связь после
ароматических аминокислот
трипсин связывает “+” заряженные с
помощью аспарагиновой кислоты
Трипсин разрывает пептидную связь
после диаминомонокарбоновых
аминокислот
11.
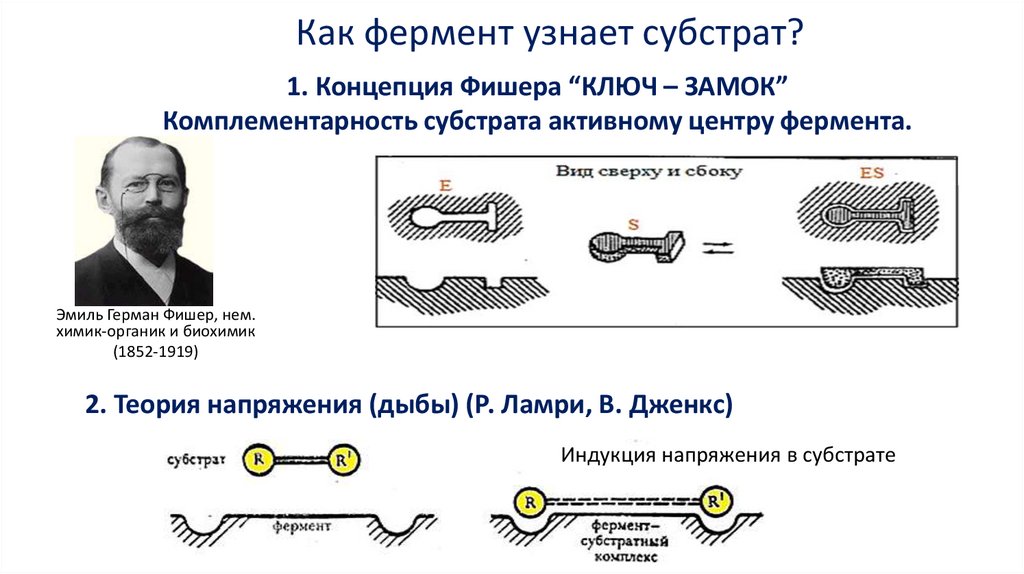
Как фермент узнает субстрат?1. Концепция Фишера “КЛЮЧ – ЗАМОК”
Комплементарность субстрата активному центру фермента.
Эмиль Герман Фишер, нем.
химик-органик и биохимик
(1852-1919)
2. Теория напряжения (дыбы) (Р. Ламри, В. Дженкс)
Индукция напряжения в субстрате
12.
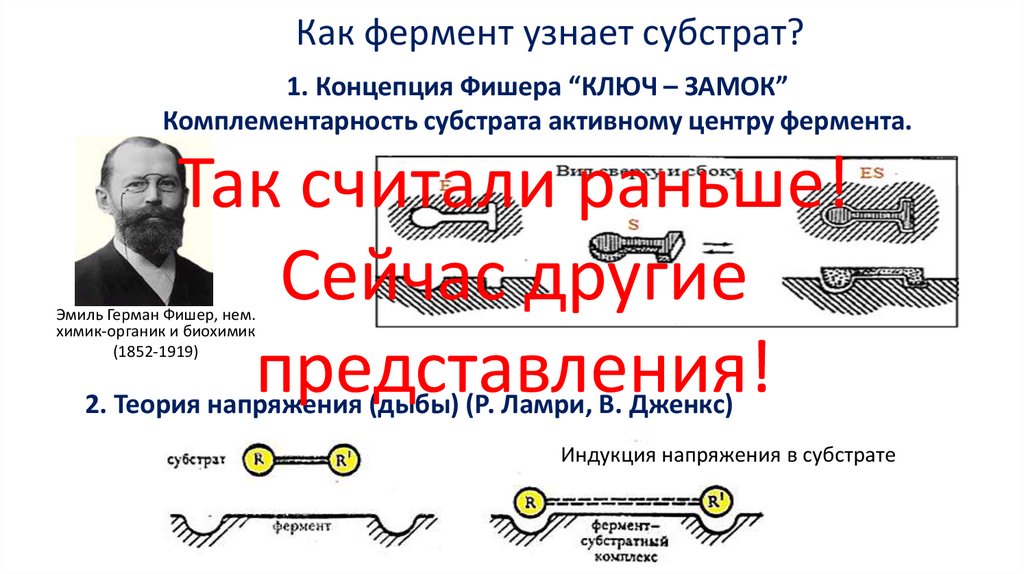
Как фермент узнает субстрат?1. Концепция Фишера “КЛЮЧ – ЗАМОК”
Комплементарность субстрата активному центру фермента.
Так считали раньше!
Сейчас другие
представления!
Эмиль Герман Фишер, нем.
химик-органик и биохимик
(1852-1919)
2. Теория напряжения (дыбы) (Р. Ламри, В. Дженкс)
Индукция напряжения в субстрате
13.
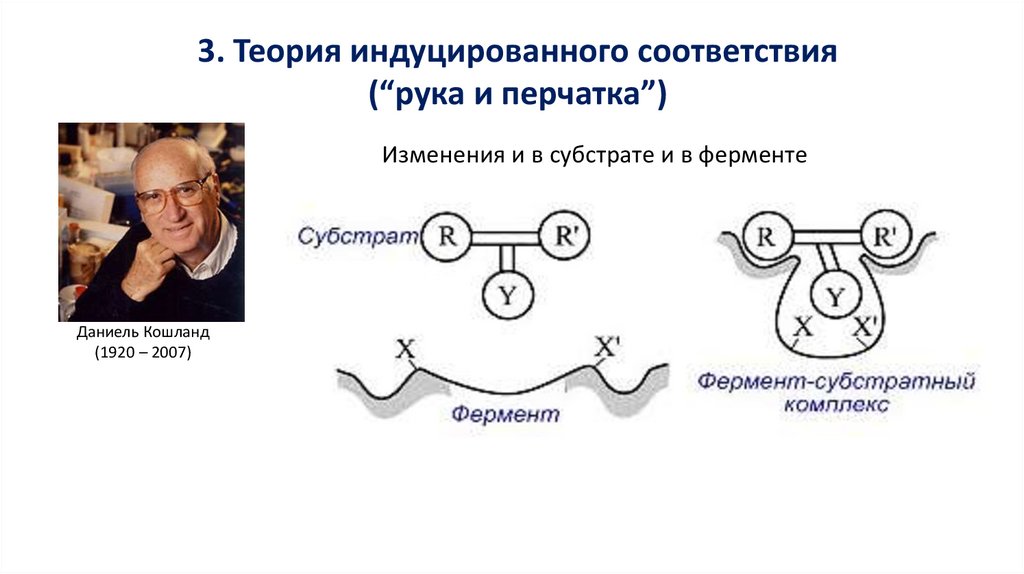
3. Теория индуцированного соответствия(“рука и перчатка”)
Изменения и в субстрате и в ферменте
Даниель Кошланд
(1920 – 2007)
14.
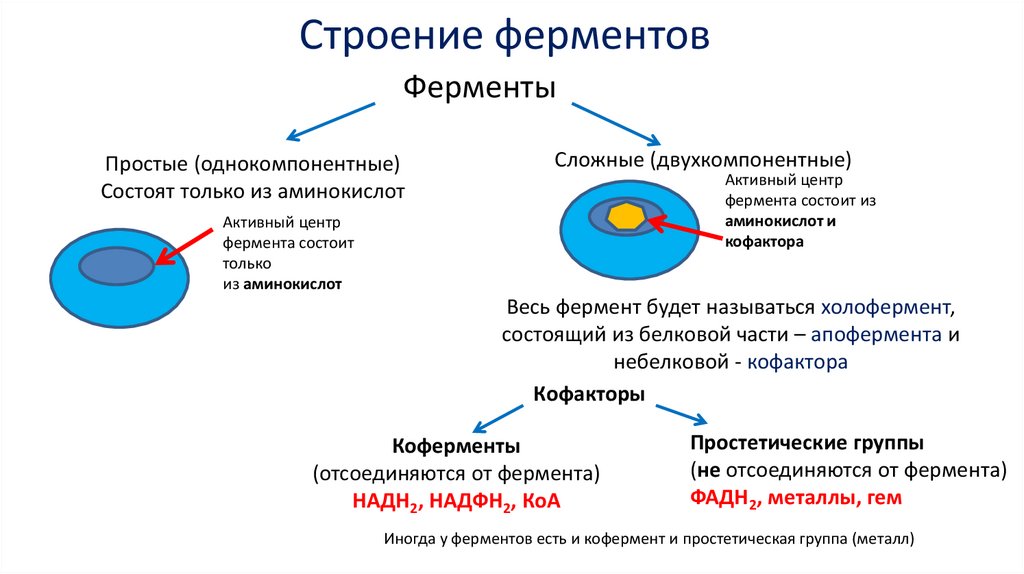
Строение ферментовФерменты
Простые (однокомпонентные)
Состоят только из аминокислот
Сложные (двухкомпонентные)
Активный центр
фермента состоит из
аминокислот и
кофактора
Активный центр
фермента состоит
только
из аминокислот
Весь фермент будет называться холофермент,
состоящий из белковой части – апофермента и
небелковой - кофактора
Кофакторы
Коферменты
(отсоединяются от фермента)
НАДН2, НАДФН2, КоА
Простетические группы
(не отсоединяются от фермента)
ФАДН2, металлы, гем
Иногда у ферментов есть и кофермент и простетическая группа (металл)
15.
Роль частей сложного фермента в катализе:Сложные ферменты
КОФАКТОР:
АПОФЕРМЕНТ:
- определяет специфичность фермента за
счет аминокислот сайта связывания;
- усиливает каталитические функции
кофакторов;
- участвует в акте катализа;
- обеспечивает контакт между апоферментом и
субстратом;
- стабилизирует апофермент;
- частный случай:
фотосенсорные простетические группы – флавины, птерины
у ДНК-фотолиаз, катализирующих устранение тиминовых димеров;
у криптохромов – протеинкиназ серин-треонинового типа.
Ферменты переходят в активное состояние под действием света.
16.
КофакторыКоферменты
(отсоединяются от фермента)
Простетические группы
(не отсоединяются от фермента)
Кофакторы:
органические небелковые компоненты ферментов:
1. Нуклеотидного типа строения (АМФ, нуклеозиддифосфаты сахаров, ФМН, ФАД, НАД(Ф), КоА и др.)
2. Производные витаминов (аскорбиновой кислоты, тиамина (В1), рибофлавина (В2), никотинамида (В3),
пантотеновой кислоты (В5), пиридоксина (В6), фолиевой кислоты, биотина, других)
3. Алифатические соединения (глутатион, липоевая кислота).
неорганические:
4. Металлы
5. FeS-центры и аналогичные им структуры
17.
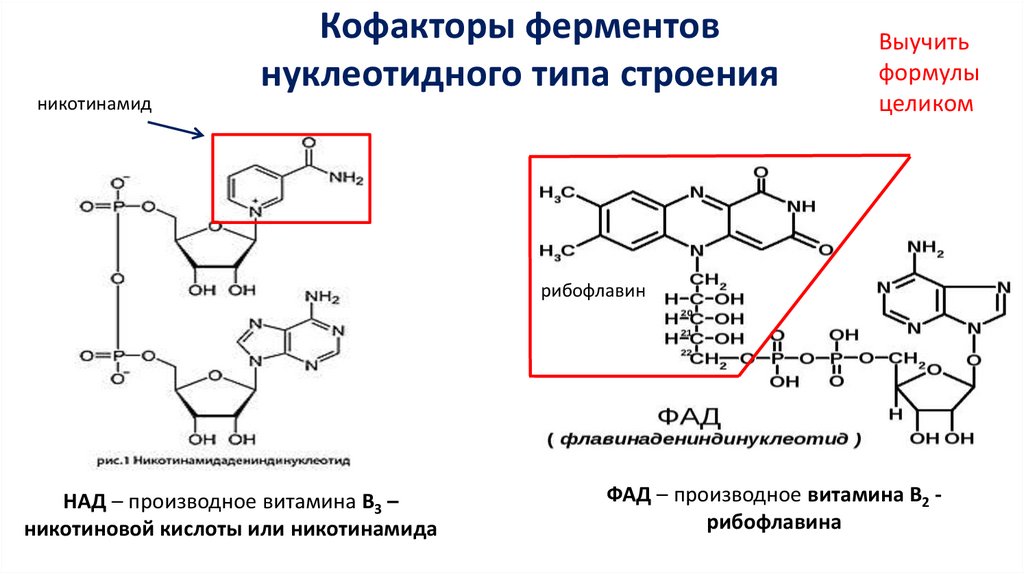
никотинамидКофакторы ферментов
нуклеотидного типа строения
Выучить
формулы
целиком
рибофлавин
НАД – производное витамина В3 –
никотиновой кислоты или никотинамида
ФАД – производное витамина В2 рибофлавина
18.
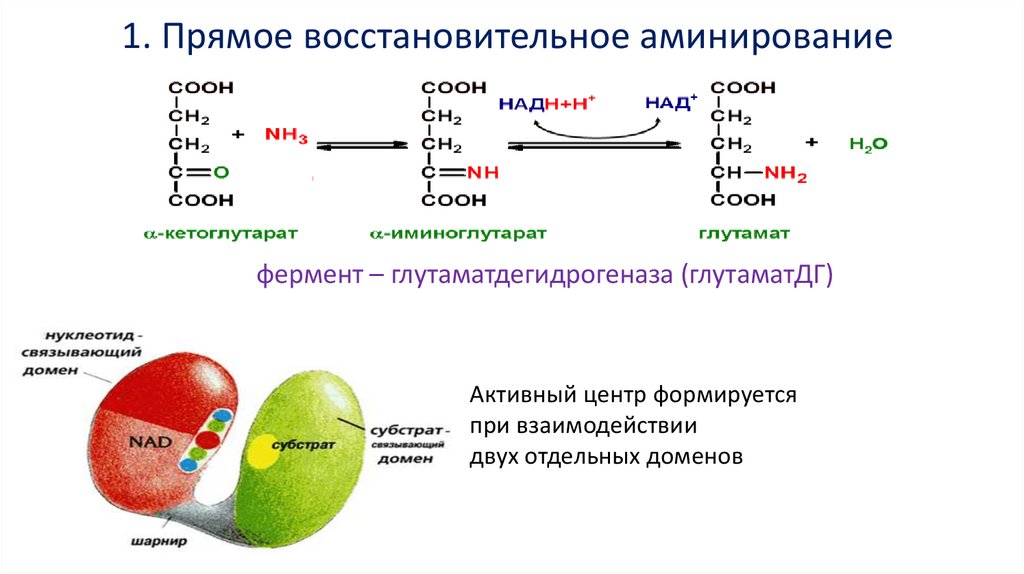
1. Прямое восстановительное аминированиефермент – глутаматдегидрогеназа (глутаматДГ)
Активный центр формируется
при взаимодействии
двух отдельных доменов
19.
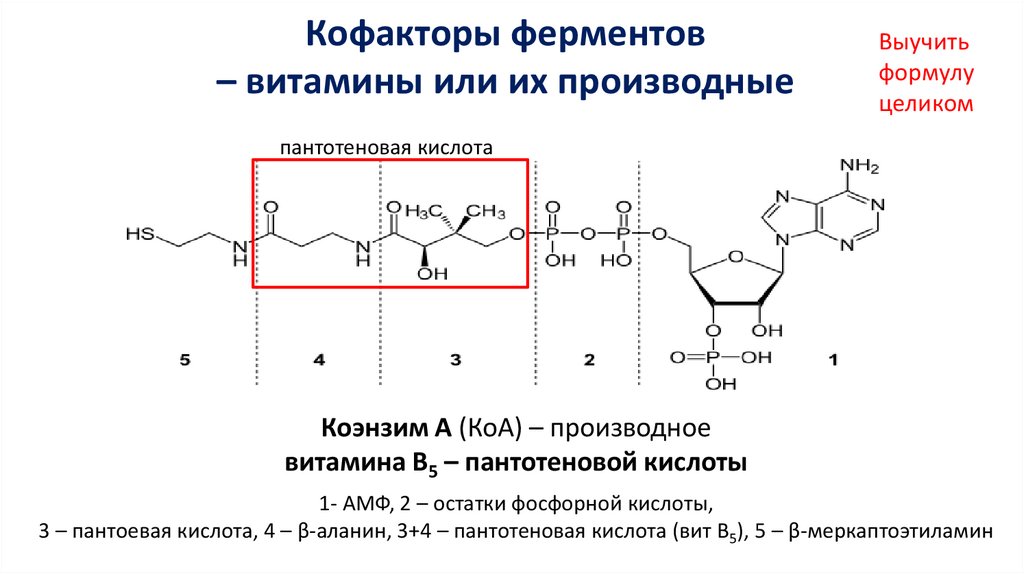
Кофакторы ферментов– витамины или их производные
Выучить
формулу
целиком
пантотеновая кислота
Коэнзим А (КоА) – производное
витамина В5 – пантотеновой кислоты
1- АМФ, 2 – остатки фосфорной кислоты,
3 – пантоевая кислота, 4 – β-аланин, 3+4 – пантотеновая кислота (вит В5), 5 – β-меркаптоэтиламин
20.
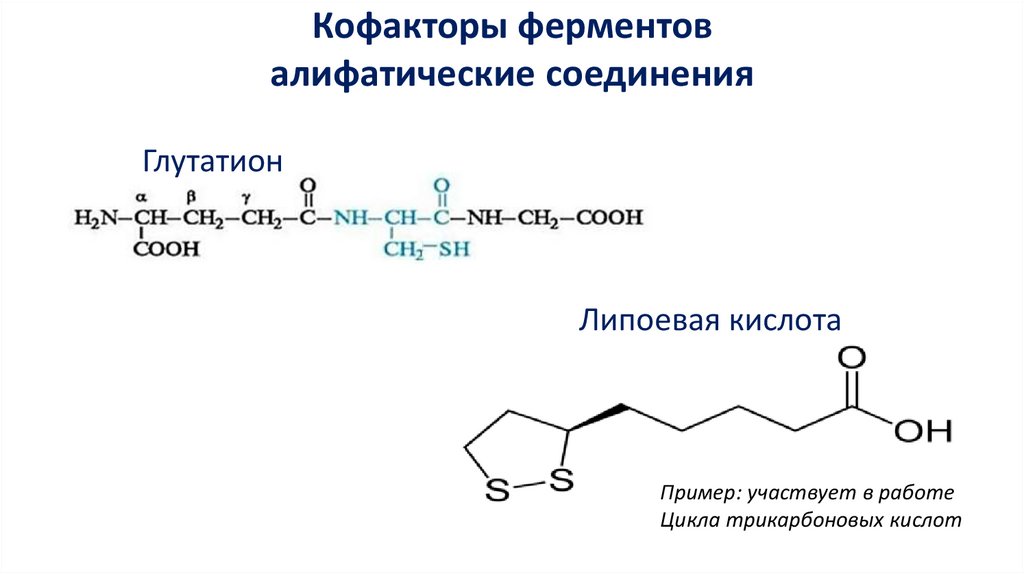
Кофакторы ферментовалифатические соединения
Глутатион
Липоевая кислота
Пример: участвует в работе
Цикла трикарбоновых кислот
21.
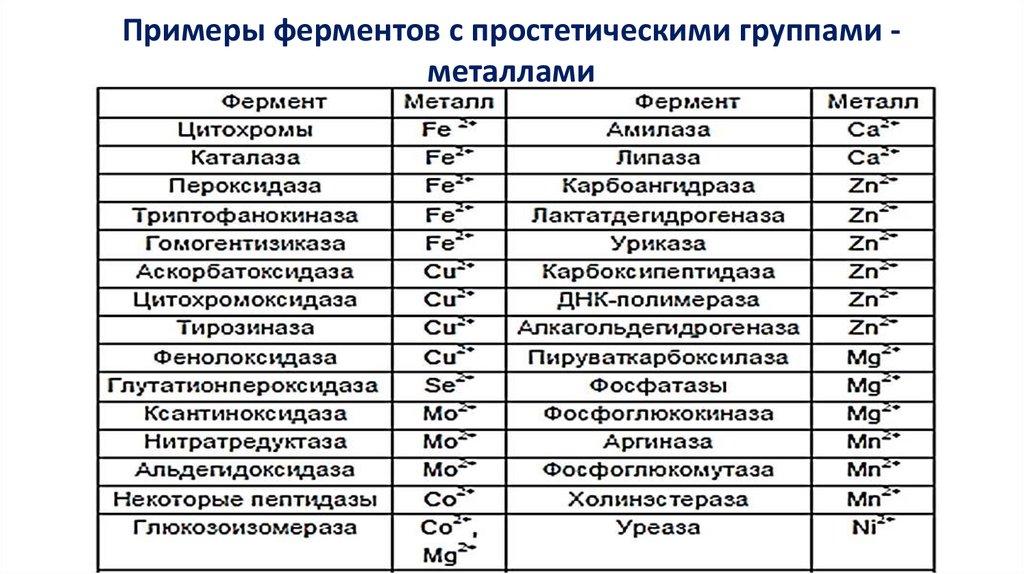
Примеры ферментов с простетическими группами металлами22.
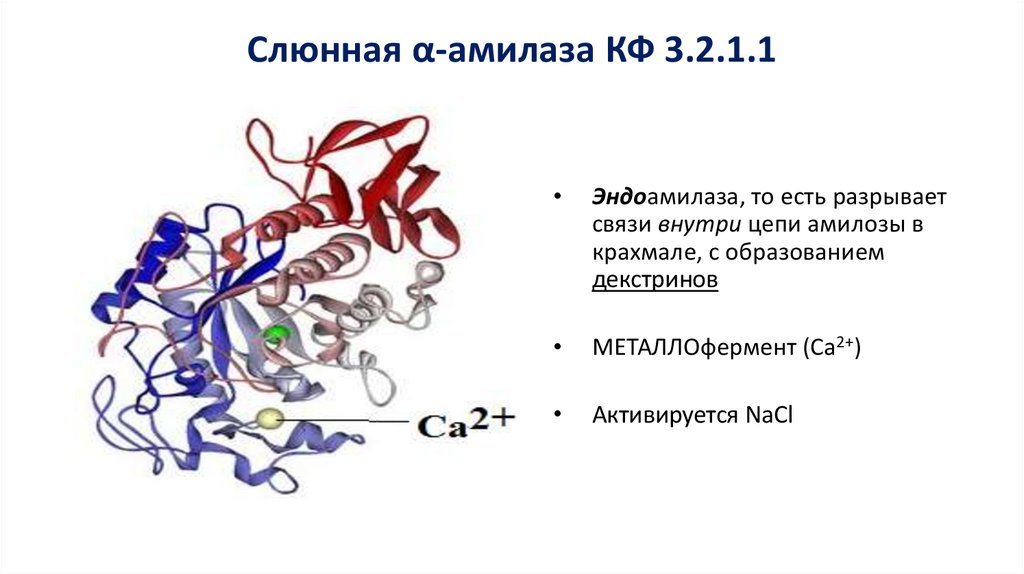
Слюнная α-амилаза КФ 3.2.1.1Эндоамилаза, то есть разрывает
связи внутри цепи амилозы в
крахмале, с образованием
декстринов
МЕТАЛЛОфермент (Са2+)
Активируется NaCl
23.
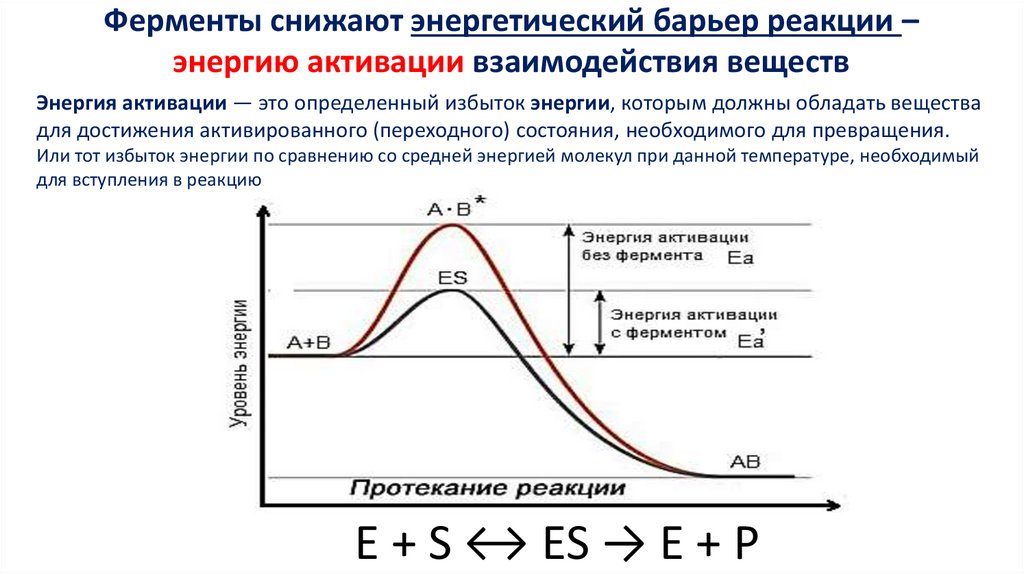
Ферменты снижают энергетический барьер реакции –энергию активации взаимодействия веществ
Энергия активации — это определенный избыток энергии, которым должны обладать вещества
для достижения активированного (переходного) состояния, необходимого для превращения.
Или тот избыток энергии по сравнению со средней энергией молекул при данной температуре, необходимый
для вступления в реакцию
E + S ↔ ES → E + P
24.
Механизм ферментативного катализаФерменты эффективно ускоряют химические реакции,
снижая энергию активации.
Это происходит из-за образования
фермент-субстратного комплекса ES, что приводит к:
- увеличению времени взаимодействия метаболитов реакции;
- “удобной” для катализа ориентации субстратов;
- одновременному воздействию на субстрат нескольких реакционных групп фермента;
E + S ↔ ES → E + P
E – энзим (фермент)
S – субстрат
ES – фермент-субстратный комплекс
P – продукт
25.
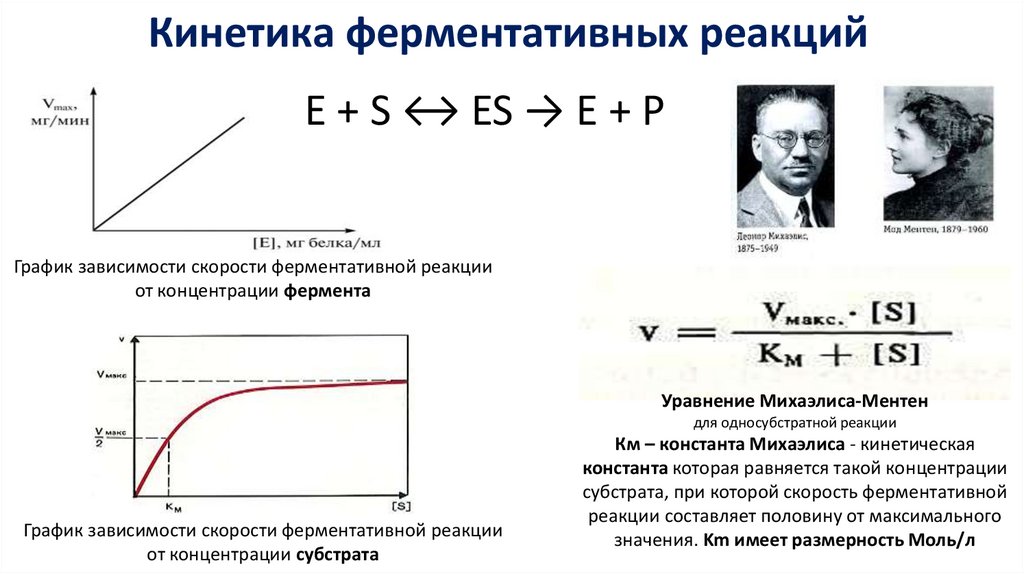
Кинетика ферментативных реакцийE + S ↔ ES → E + P
График зависимости скорости ферментативной реакции
от концентрации фермента
Уравнение Михаэлиса-Ментен
для односубстратной реакции
График зависимости скорости ферментативной реакции
от концентрации субстрата
Км – константа Михаэлиса - кинетическая
константа которая равняется такой концентрации
субстрата, при которой скорость ферментативной
реакции составляет половину от максимального
значения. Km имеет размерность Моль/л







 Биология
Биология








