Похожие презентации:
Ступінь електролітичної дисоціації
1.
2.
3.
Чи всі електроліти однаковою міроюрозпадаються на йони?
Яка частка молекул, що розпались
на йони, до загального числа молекул?
Чи відбувається процес зміщення
дисоціації і за яких умов?
4.
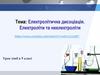
Якщо опустити електроди для визначення електропровідностів концентрований розчин натрій хлориду, то побачимо найбільший струм
5.
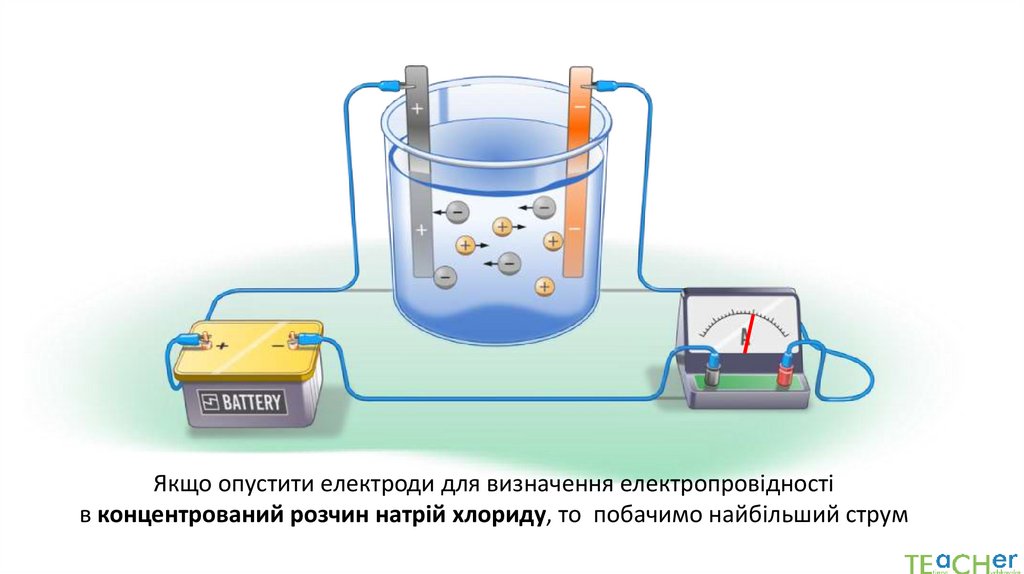
В концентрованому розчині оцтової кислоти спостерігаємо слабкий струм6.
При додаванні води до розчину оцтової кислоти електричний струм зростає7.
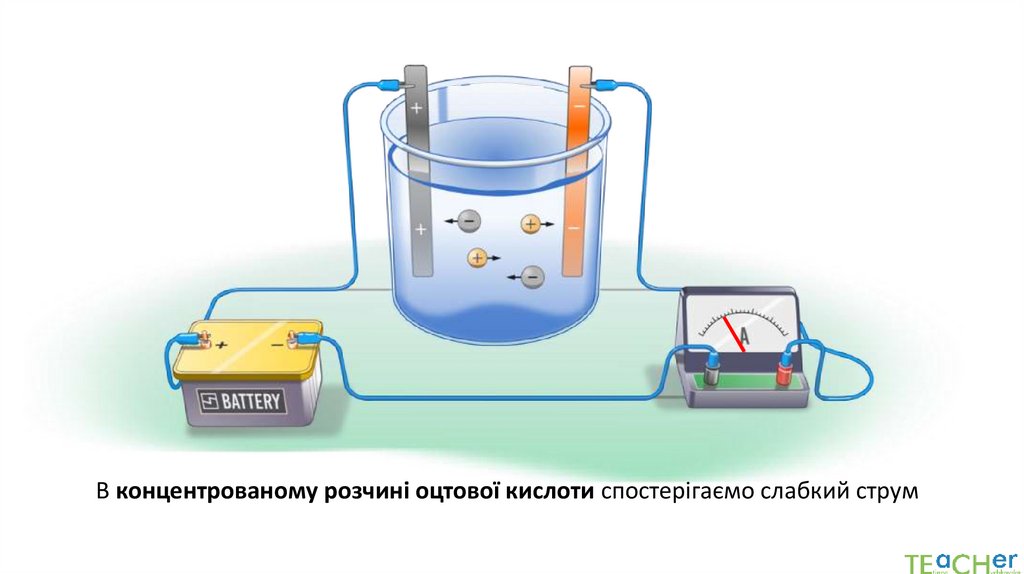
Чим більше йонів міститься в розчині, тим вища його електропровідністьПодальше розведення розчину натрій хлориду
не впливає на рівень вироблення електричного струму
8.
Робимо висновки:1. Деякі електроліти у водних розчинах повністю
дисоціюють на йони незалежно від їхньої концентрації:
до таких електролітів належать речовини з йонною
кристалічною ґраткою.
9.
Робимо висновки:2. Відомі електроліти, які дисоціюють частково:
при розведенні розчинів цих речовин число молекул,
що розпадаються на йони, зростає і навпаки.
10.
Робимо висновки:3. Відношення числа молекул, що розпались на йони,
до загального числа молекул, які наявні у розчині,
називають ступенем дисоціації
Nдис 100%
=
Nзаг
11.
Сильний електроліт – це речовина, яка, розчиняючись у воді, повністю дисоціюєна йони. Це означає, що в розчині він практично не залишається в молекулярній
формі, а всі молекули розпадаються на позитивні та негативні йони.
Через велику кількість йонів у розчині сильні електроліти мають високу
електричну провідність.
До сильних електролітів належать майже всі розчинні солі, сильні основи
(наприклад, натрій гідроксид NaOH, калій гідроксид KOH), сильні кислоти:
хлорна – нітратна – хлоридна – сульфатна
HClO4
HNO3
HCl
H2SO4
Значення ступеня електролітичної дисоціації у сильних електролітів
перевищує 30%.
12.
Слабкий електроліт – це речовина, яка, розчиняючись у воді, частково дисоціюєна йони, залишаючи в розчині значну кількість недисоційованих молекул. Лише
невелика частина молекул розпадається на йони.
Через меншу кількість іонів у розчині слабкі електроліти мають меншу
електричну провідність порівняно зі сильними електролітами.
До слабких електролітів належать багато органічних кислот (оцтова кислота
CH3COOH, молочна кислота С3Н6О3), такі неорганічні кислоти:
карбонатна – сульфідна – силікатна
H2CO3
H2S
H2SiO3
Слабкими електролітами є амоній гідроксид NH4OH та вода
Значення ступеня електролітичної дисоціації у слабких електролітів
менше 3%.
13.
Електроліти середньої сили – це речовини, які дисоціюють в розчині частково,але не настільки, як слабкі електроліти, і не настільки повністю, як сильні
електроліти. Вони мають проміжні властивості між цими двома категоріями.
Провідність таких розчинів є середньою.
До електролітів середньої сили відносяться деякі амфотерні гідроксиди та
солі, такі як амоній хлорид NH₄Cl і амоній сульфат (NH₄)₂SO₄, кислоти:
сульфітна – ортофосфатна – флуоридна – нітритна
H2SO3
H3PO4
HF
HNO3
Значення ступеня електролітичної дисоціації у слабких електролітів 3-30%.
14.
Дисоціація багатоосновних кислот відбувається ступінчасто,у декілька стадій, з поступовим відщепленням катіонів гідрогену
H3РO4
H2РO
4
4
+
H + Н2РO
дигідрогенортофосфат-йон
+
H + НРO
24
гідрогенортофосфат-йон
HРO
24
+
H + РO
34
ортофосфат-йон
Дисоціація відбувається більш повно на першій стадії, порівняно з другою чи третьою
15.
Задача 1.Деякий електроліт має загальне число молекул 200. Його ступінь дисоціації = 40%.
Яке число молекул цього електроліту здатне до дисоціації?
Дано: Nзагальне = 200,
= 40%
Знайти: Nдис - ?
Розв’язання:
1. Запишемо формулу для знаходження ступеня дисоціації:
Nдис
N
заг
= Nзаг
100%, звідки Nдис =
100%
2. Підставляємо значення умови задачі:
Nдис = 40% 200 = 80 молекул
100%
Відповідь: до дисоціації здатні 80 молекул.
16.
Задача 2.Число молекул електроліту у розчині 500. Число молекул, що дисоціювали, дорівнює
100. Який ступінь дисоціації такого електроліту?
Дано: Nзагальне = 500,
Nдис = 100.
Знайти:
-?
Розв’язання:
1. Запишемо формулу для знаходження ступеня дисоціації:
Nдис
= Nзаг
100%.
2. Підставляємо значення умови задачі:
100 100%
=
= 20%
500
Відповідь: ступінь дисоціації 20%.
17.
Задача 3.Кількість речовини розчину аргентум нітрату = 0,1 моль. При його дисоціації
утворилось 8,7 г йонів аргентуму. Який ступінь дисоціації електроліту?
Розв’язання:
Дано: n(AgNO3) = 0,1 моль,
1. Запишемо рівняння дисоціації аргентум нітрату:
mдис Ag += 8,7 г.
+
AgNO
3
Ag + NO3
Знайти:
-?
1 моль
0,1 моль
1 моль 1 моль
0,1 моль – може утворитись
+
2. Знайдемо кількість речовини йонів Ag , що утворилась:
m
8,7 г
n=
. Тоді n =
= 0,081 моль
108 г/моль
M
3. Знаходимо ступінь дисоціації:
Nдис
0,081 моль
=
= Nзаг
100% = 81%
100%;
0,1 моль
Відповідь: ступінь дисоціації 81%.















 Химия
Химия