Похожие презентации:
Закон сохранения массы веществ
1. Закон сохранения массы веществ.
2. Закон сохранения массы веществ
Масса веществ, вступивших вхимическую реакцию, равна массе
веществ, получившихся в
результате реакции.
(современная формулировка)
3.
4. М.В. Ломоносов, 1748 г.
«Все перемены в натуре случающиесятакого суть состояния, что сколько
чего у одного тела отнимется,
столько же присовокупится к
другому. Так, ежели где убудет
материи, то умножится в другом
месте;...»
5.
Спустя 41 год послеопытов Ломоносова
французский учёный
Антуан Лоран
Лавуазье
практически
повторил
формулировку
закона в своём
учебнике.
6. На основании закона сохранения массы веществ составляют уравнения химических реакций
7. Химическим уравнением
• Химическим уравнением- называют условную запись химической
реакции с помощью химических формул и
математических знаков
(индексов и коэффициентов)
8. Правила составления химических уравнений
1. В левой части уравнения записатьформулы реагентов. Затем поставить
стрелку
а)
N2 + H2 →
9. 2. В правой части (после стрелки) записать формулы веществ, образующихся в результате реакции (продуктов)
а) N2 + H2 → NH310. Алгоритм расстановки коэффициентов в уравнении химической реакции.
1. Подсчитать количество атомов каждогоэлемента в правой и левой части
N2 + H2 → NH3
2
2
1 3
11.
2. Уравнение реакции составляетсяна основе закона сохранения массы
веществ, т. е. слева и справа должно
быть равное число атомов
Это достигается расстановкой
коэффициентов перед формулами
веществ
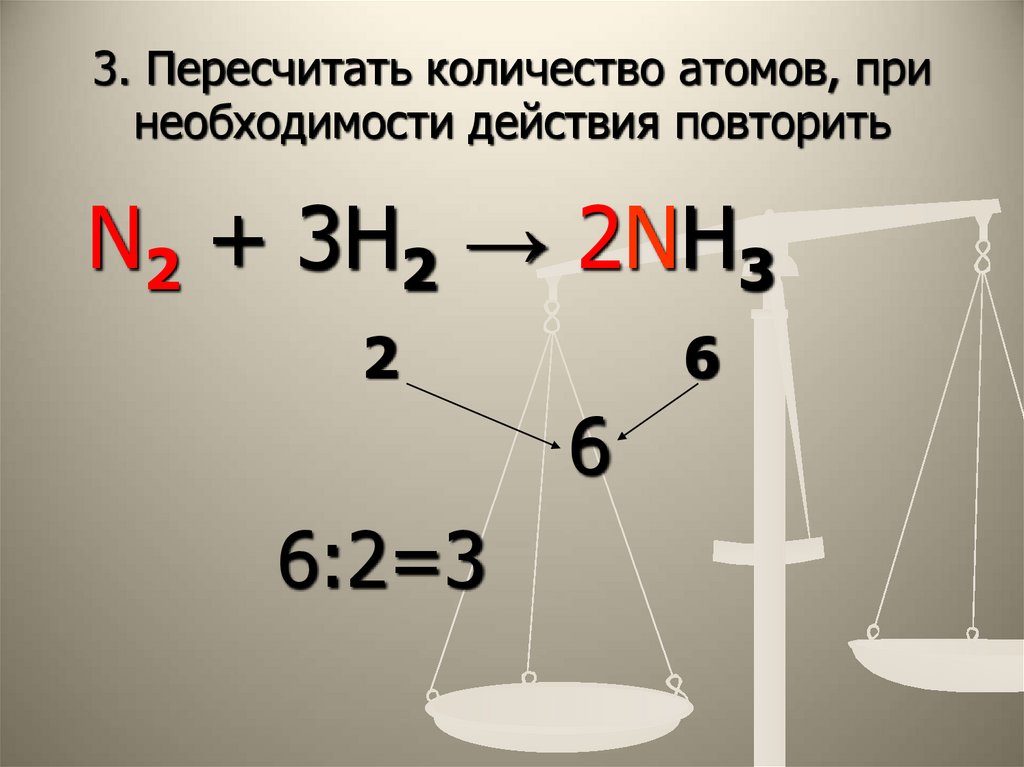
12. 3. Пересчитать количество атомов, при необходимости действия повторить
N2 + 3H2 → 2NH32
6
6
6:2=3
13. Уравнение химической реакции
Это условная запись химической реакции с помощьюхимических формул и математических знаков
2 Са
+
O2
2СаO
коэффициент
индекс
Исходные вещества
Продукты реакции
Качественная характеристика – какие вещества
вступают в реакцию и какие образуются
Количественная характеристика – в каком
количестве реагируют вещества, какое количество
продуктов реакции
14. Правило
Всоответствии с законом сохранения
массы веществ число атомов каждого
элемента в левой и правой частях
уравнения химической реакции должно
быть одинаковым.
2Са + O2 2 СаO
2 атома кальция и 2 атома кислорода
15. Составление уравнений реакций (алгоритм)
Запишите формулы исходных веществ,соединив их знаком «плюс», и поставьте
стрелку
Na+ Cl2
Запишите после стрелки формулы продуктов
реакции
Na + Cl2 NaCl
Расставьте коэффициенты так, чтобы число
атомов каждого химического элемента в
левой и правой частях уравнения было
одинаково
2 Na + Cl2 2 NaCl
16. Задания на закрепление
Исходныевещества
Напишите
уравнения
Р
O2
реакций, если Ва
O2
известны
Аl
O2
исходные
К
Cl2
вещества и
продукты
Fe2O3 H2
реакции
HCl NaOH
Продукты
реакции
Р2O5
ВаО
Аl2O3
КCl
Fe
H2O
NaCl
H2 O
17. Расставьте коэффициенты в уравнениях реакции.
1. Cu + O2 CuO2. HCl H2 +Cl2
3. Ag2O + C Ag +CO2
4. ZnO + HNO3 Zn(NO3)2 + H2O
18. Составьте уравнения реакций по названию веществ. Расставьте коэффициенты.
1.Цинк + хлорид водорода = хлорид цинка + водород
2.
Калий + сера = сульфид калия
3.
Хлорид алюминия = алюминий + хлор
















 Химия
Химия








