Похожие презентации:
Химическое уравнение. Закон сохранения массы веществ
1. Химическое уравнение. Закон сохранения массы веществ.
2. Историческая справка
Закон сохранениямассы веществ был
открыт
М.В.Ломоносовым
в 1748 году и
подтвержден
французским
химиком
А.Л.Лавуазье в 1789
году.
М.Ломоносов
А.Л.
Лавуазье
3. Закон сохранения массы
«Масса веществ,вступивших в
реакцию, равна
массе
образовавшихся
веществ»
4. Химическим уравнением
называют условную запись химическойреакции с помощью химических формул
и математических знаков.
Вещества, принимающие участие в
реакции, называются реагентами
или исходными веществами.
Вещества, образующиеся в
результате реакции – продуктами
реакции.
5. Знаки в химических уравнениях:
Знак+
→, =
⇄
↑
↓
Значение
Взаимодействие
Превращение веществ
Обратимая реакция
Выделение газа
Выделение осадка
Над стрелкой пишутся условия реакции, под
стрелкой иногда указывают продукты
реакции.
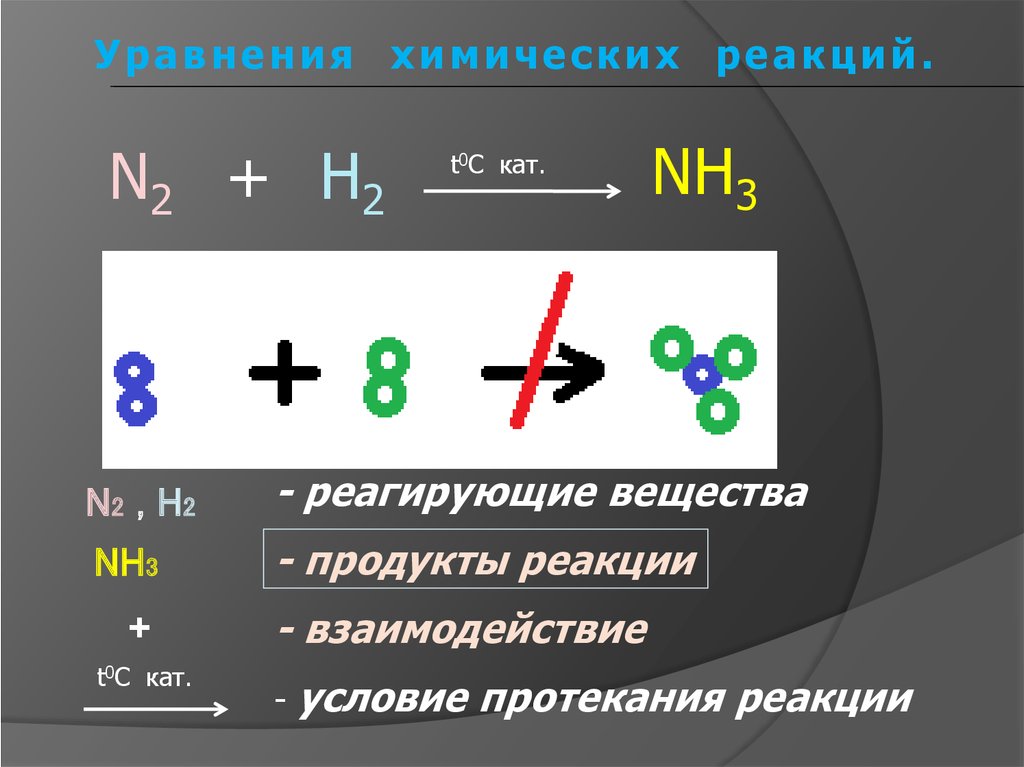
6.
Уравнения химических реакций.N 2 + H2
t0C кат.
NH3
N 2 , H2
- реагирующие вещества
NH3
- продукты реакции
+
t0C кат.
- взаимодействие
-
условие протекания реакции
7.
Уравнения химических реакций.N 2 + H2
t0C кат.
NH3
N 2 , H2
- реагирующие вещества
NH3
- продукты реакции
+
t0C кат.
- взаимодействие
-
условие протекания реакции
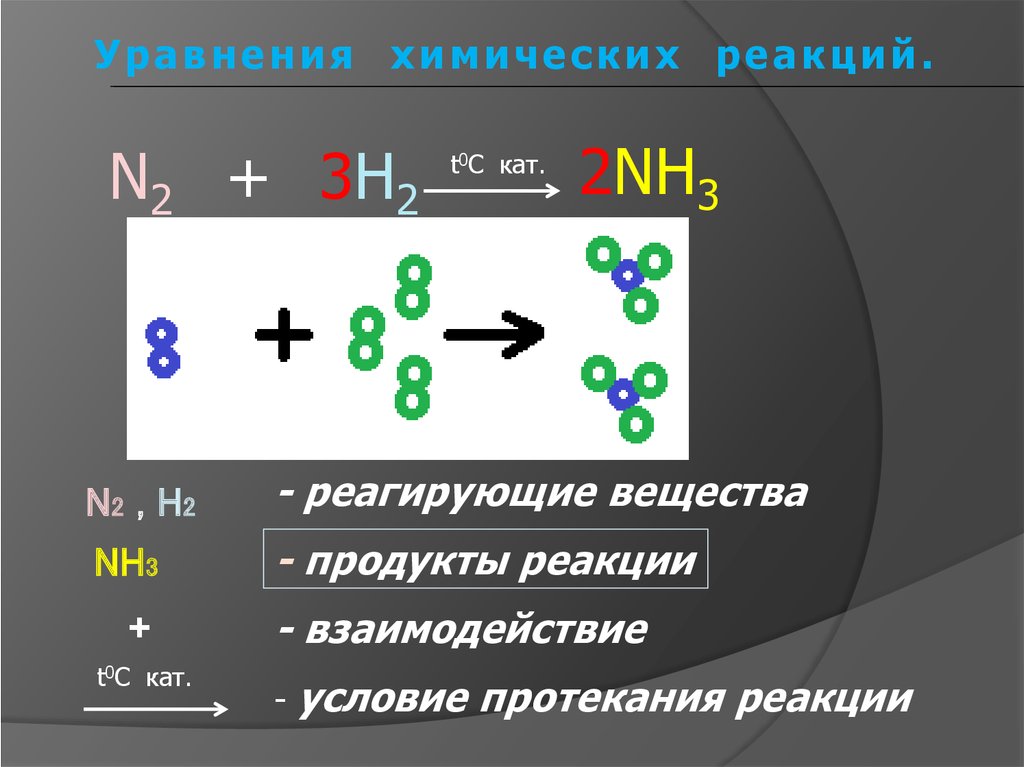
8.
Уравнения химических реакций.N2 + 3H2
t0C кат.
2NH3
N 2 , H2
- реагирующие вещества
NH3
- продукты реакции
+
t0C кат.
- взаимодействие
-
условие протекания реакции
9.
Алгоритм составления уравнений:Составим уравнение химической реакции
взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические
формулы реагентов (веществ, вступающих в реакцию).
Помните! Молекулы большинства простых газообразных
веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2.
Между реагентами ставим знак «+», а затем стрелку:
P + O2 →
2. В правой части (после стрелки) пишем химическую
формулу продукта (вещества, образующегося при
взаимодействии). Помните! Химические формулы
необходимо составлять, используя валентности атомов
химических элементов:
P + O 2 → P 2O 5
10.
3. Согласно закону сохранения массы веществ число атомовдо и после реакции должно быть одинаковым. Это
достигается путём расстановки коэффициентов перед
химическими формулами реагентов и продуктов химической
реакции.
Вначале уравнивают число атомов, которых в реагирующих
веществах (продуктах) содержится больше.
В данном случае это атомы кислорода.
Находим наименьшее общее кратное чисел атомов кислорода
в левой и правой частях уравнения. Наименьшее кратное для
атомов кислорода –10:
Находим коэффициенты путём
деления наименьшего кратного на
число атомов данного вида,
полученные цифры ставим в
уравнение реакции:
11.
4. Закон сохранения массы вещества невыполнен, так как число атомов фосфора в
реагентах и продуктах реакции не равно,
поступаем аналогично ситуации с кислородом:
Получаем окончательный вид уравнения
химической реакции. Стрелку заменяем на знак
равенства. Закон сохранения массы вещества
выполнен:
4P + 5O2 = 2P2O5
12.
Упражнения для закрепления1. Какой коэффициент стоит в уравнении реакции
перед формулой соляной кислоты?
Na + HCl
→ NaCl + H2
2. Продолжите уравнение реакции, расставьте
коэффициенты
Al + O2 →
3. Запишите уравнение реакции и расставьте
коэффициенты Сульфат натрия соединяется
с нитратом бария с образованием сульфата бария и
нитрата натрия.
4. Найдите ошибки.
Mg + HBr → MgBr2 + H2
BaO +H2So 4 → Ba2SO4 + H2O
ZnO + HNO3 → ZnNO 3 + H2O
5. Закончите уравнение
Li 2 O + SO3 → …………..
13.
Ответы к упражнениям.1. Какой коэффициент стоит в уравнении реакции перед
формулой соляной кислоты?
2Na + 2HCl → 2NaCl + H2
2. Продолжите уравнение реакции, расставьте
коэффициенты
4Al +3 O2 → 2Al2O2
3. Запишите уравнение реакции и расставьте
коэффициенты Сульфат натрия соединяется с нитратом бария с
образованием сульфата бария и нитрата натрия.
Na2 SO4 + Ba(NO3)2 → BaSO4 ↓ + 2Na NO3
4. Найдите ошибки.
Mg + 2 HBr → MgBr2 + H2
BaO +H2So4 → Ba2SO4 + H2O
ZnO + 2 HNO3 → Zn(NO3) 2 + H2O
5. Закончите уравнение
Li 2 O + SO3 =Li 2 SO4












 Химия
Химия








