Похожие презентации:
Элементы химической термодинамики. Первый закон термодинамики
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙМЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Кафедра химии
• Основные понятия химической термодинамики
• Термодинамические функции состояния
системы. Внутренняя энергия
• Первый закон термодинамики
• Энтальпия
• Термохимия. Основные понятия. Закон Гесса и
его следствия
2.
Основные понятия химическойтермодинамики
Термодинамика
–
это
наука,
изучающая взаимные превращения
различных видов энергии, связанные с
переходом энергии в форме теплоты и
работы.
3.
Медико-биологическое значение темытеоретическая основа при
осуществлении химического
и биологического синтеза
при изготовлении
лекарственных препаратов.
4.
Медико-биологическое значение темы• Термодинамический метод исследования
является одним из наиболее надежных способов
изучения обмена веществ и энергии в живых
организмах.
Превращения энергии,
происходящие в живых
организмах, являются
предметом
биоэнергетики.
5.
Основные понятия химической термодинамикиТермодинамическая система – это
любой объект природы, состоящий из
достаточно большого числа структурных
единиц,
в
частности
молекул,
отделенных от других объектов природы
реальной или воображаемой границей
раздела.
6.
Основные понятия химической термодинамикиЧасть объектов природы, не входящих в
систему, называются окружающей средой.
Важными
характеристикам
и системы
являются масса
вещества (m) и
энергия (Е или U).
7.
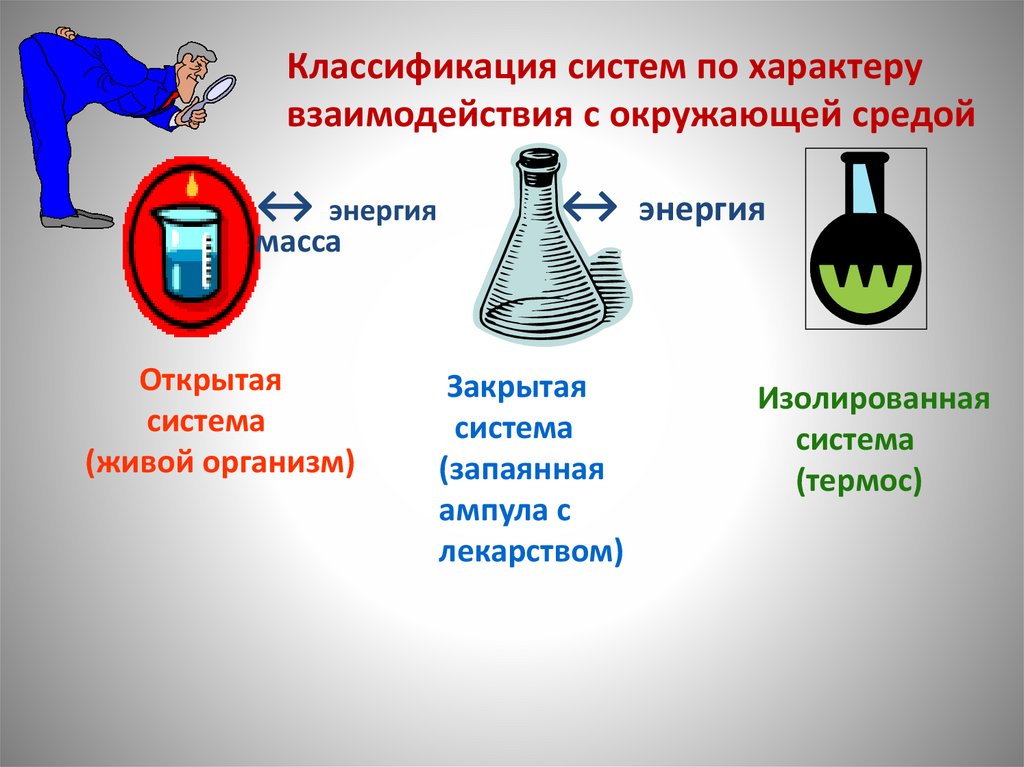
Классификация систем по характерувзаимодействия с окружающей средой
↔ энергия
масса
Открытая
система
(живой организм)
↔ энергия
Закрытая
система
(запаянная
ампула с
лекарством)
Изолированная
система
(термос)
8.
Основные понятия химической термодинамикиФаза – это часть системы с
одинаковыми физическими и
химическими
свойствами,
отделенная от других частей
границей
раздела,
при
переходе
через
которую
свойства резко меняются.
9.
Основные понятия химической термодинамикиВ зависимости от фазового состояния
различают:
1. Гомогенные системы. Это системы, в которых
все компоненты находятся в одной фазе, и в них
отсутствуют границы раздела. Пример: растворы
глюкозы, солей, кислот.
2. Гетерогенные системы. Они состоят из
нескольких фаз, отделенных границей раздела.
Пример: эритроциты - плазма крови, живой
организм.
10.
Основные понятия химической термодинамикиТермодинамическое
состояние
системы
совокупность всех физических и химических свойств
системы. Качественно характеризуется числом фаз и
химическим
составом,
количественно
термодинамическими параметрами и функциями.
Термодинамические параметры – это совокупность
физических величин, определяющих состояние
системы: температура (t), давление (р), объем (V).
концентрация (С).
11.
Основные понятия химической термодинамикиФункциональная зависимость термодинамических
параметров выражается уравнением состояния.
Для газообразных систем эти параметры связаны
между собой уравнением Менделеева-Клапейрона:
p·V = n(х)·R·Т,
n(x) = m(x) / M(x) [моль]
R = 8.314 Дж · моль-1·К-1
m(х)
p·V =
·R·T
M(х)
12.
Основные понятия химической термодинамикиТермодинамические
параметры
называются
стандартными,
если
они
определяются при стандартных условиях.
К стандартным условиям относят:
t = 250С или
Т = (t0С + 273) = 298 К
р = 101.3 кПа = 1 атм
С(х) = 1 моль · дм-3
13.
Основные понятия химической термодинамикиВ зависимости от того, какой из параметров
состояния при протекании термодинамического
процесса остается постоянным, различают
следующие термодинамические процессы:
изотермический (Т = const),
изобарный (р = const),
изохорный (V = const),
адиабатический (Q = const).
14.
Функции состояния системыВ термодинамике для определения
изменения энергии системы пользуются
различными
энергетическими
характеристиками, которые называются
термодинамическими
функциями
состояния системы.
15.
Функции состояния системыТермодинамические функции:
1. Внутренняя энергия (U)
2. Энтальпия (Н)
3. Энтропия (S)
4. Энергия Гельмгольца (F)
5. Энергия Гиббса (свободная энергия) (G)
6. Химический потенциал (μ)
16.
Функции состояния системыВнутренняя энергия (U)
Внутренняя энергия системы складывается
из кинетической энергии движения молекул
или атомов, образующих систему,
потенциальной энергии их взаимодействия и
внутримолекулярной энергии.
17.
Функции состояния системыВнутренняя энергия (U):
Абсолютное значение внутренней энергии измерить
невозможно, поэтому измеряют ее приращение:
Uсистемы = Uкон. - Uнач
Бесконечно малое изменение U является полным
дифференциалом dU.
17
18.
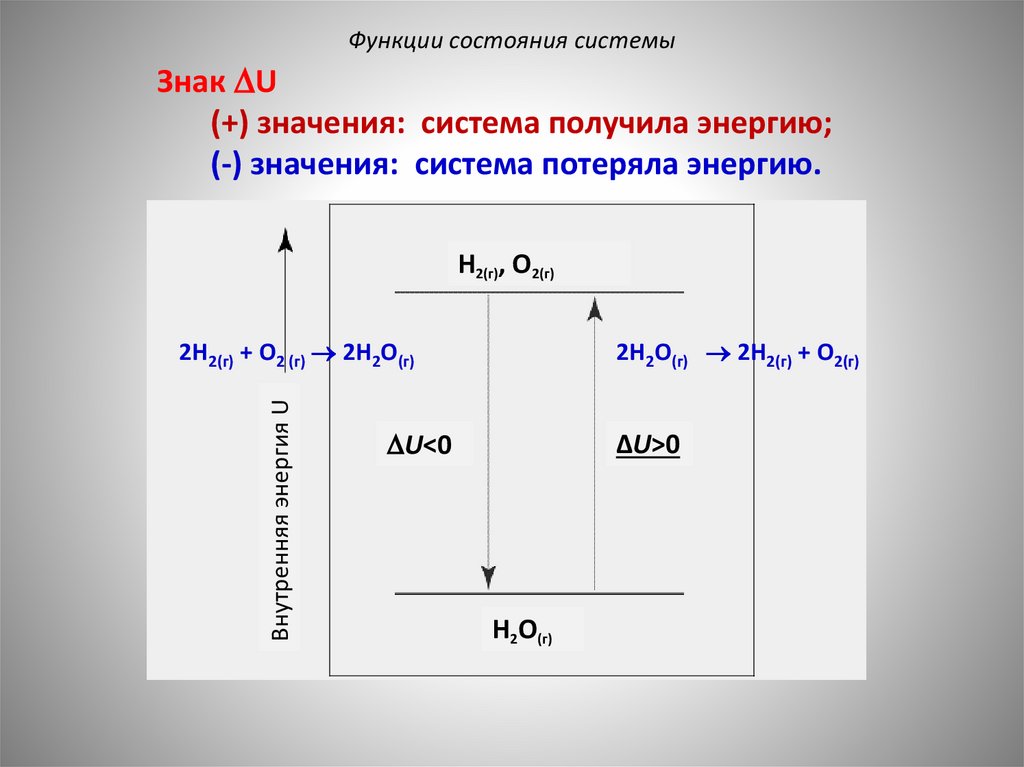
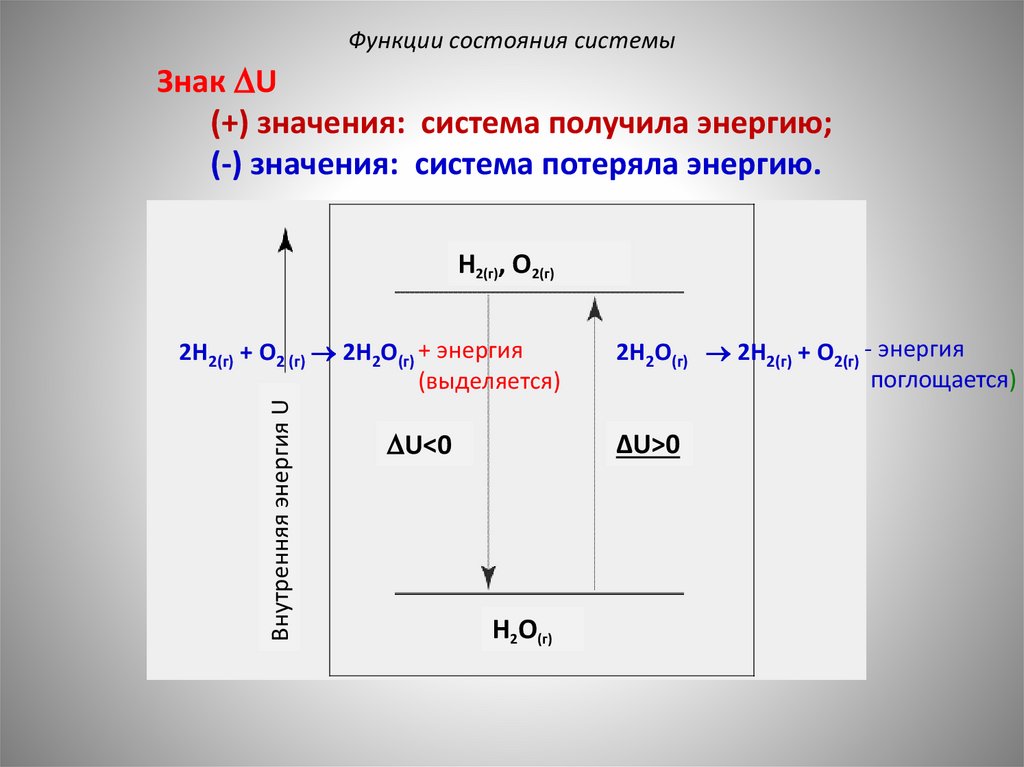
Функции состояния системыЗнак U
(+) значения: система получила энергию;
(-) значения: система потеряла энергию.
H2(г), O2(г)
Внутренняя энергия U
2H2(г) + O2 (г) 2H2O(г)
2H2O(г) 2H2(г) + O2(г)
U<0
ΔU>0
H2O(г)
19.
Функции состояния системыЗнак U
(+) значения: система получила энергию;
(-) значения: система потеряла энергию.
H2(г), O2(г)
Внутренняя энергия U
2H2(г) + O2 (г) 2H2O(г) + энергия
(выделяется)
U<0
2H2O(г) 2H2(г) + O2(г) - энергия
поглощается)
ΔU>0
H2O(г)
20.
Функции состояния системыВнутренняя энергия есть функция состояния
системы, приращение которой (ΔU) равно
теплоте, поступающей в систему при
изохорном процессе (V = const).
ΔU = QV [кДж/моль или кДж· моль-1], где
QV – теплота изохорного процесса.
21.
Функции состояния системыЕдиницы измерения энергии:
Джоуль = Дж
Так как Дж очень маленькая величина, обычно
используют кДж.
калория = кал 1 кал = 4.184 Дж
1 кал
4.184 Дж
Коэффициент пересчета!
21
22.
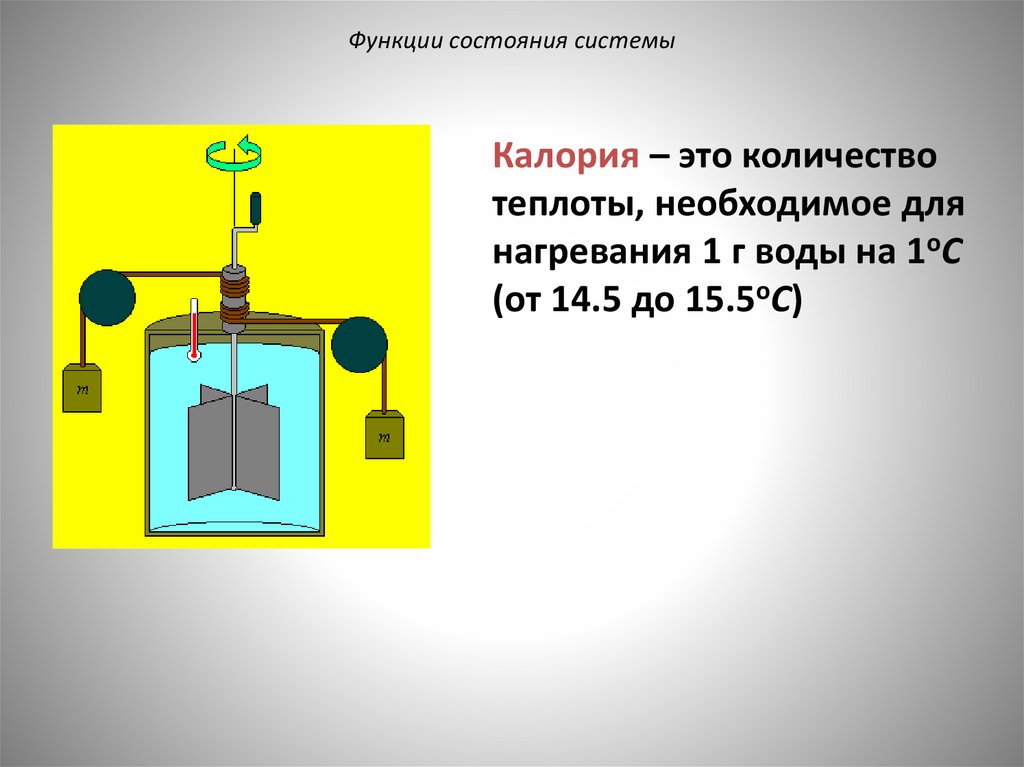
Функции состояния системыКалория – это количество
теплоты, необходимое для
нагревания 1 г воды на 1oC
(от 14.5 до 15.5oC)
23.
Первый закон термодинамикиПервый закон термодинамики
является постулатом: он не
может быть доказан логическим
путем, а вытекает из суммы
человеческого опыта.
Большая роль в обобщении
эмпирического опыта при
открытии закона принадлежит
Г.К. Гессу, Р. Майеру, Джоулю,
Гельмгольцу.
23
24.
Первый закон термодинамикиХимические процессы сопровождаются изменением энергии.
24
25.
Первый закон термодинамикиЯвляется количественным выражением всеобщего
закона природы о вечности материи и движения:
энергия в системе не создается из ничего и не
исчезает бесследно.
26.
Первый закон термодинамикиВечный
двигатель
первого
рода
невозможен
(работа
требует энергии).
27.
Первый закон термодинамикиСистема получает
теплоту за счет работы
внешних сил.
Q>0
Система теряет теплоту за
счет совершение ею
работы против внешних
сил.
Q<0
W>0 W<0
28.
Первый закон термодинамикиКак изменяется внутренняя энергия системы?
U
Q>0
Q<0
W>0
W<0
29.
Первый закон термодинамикиНа что расходуется теплота,
подведенная к системе?
30.
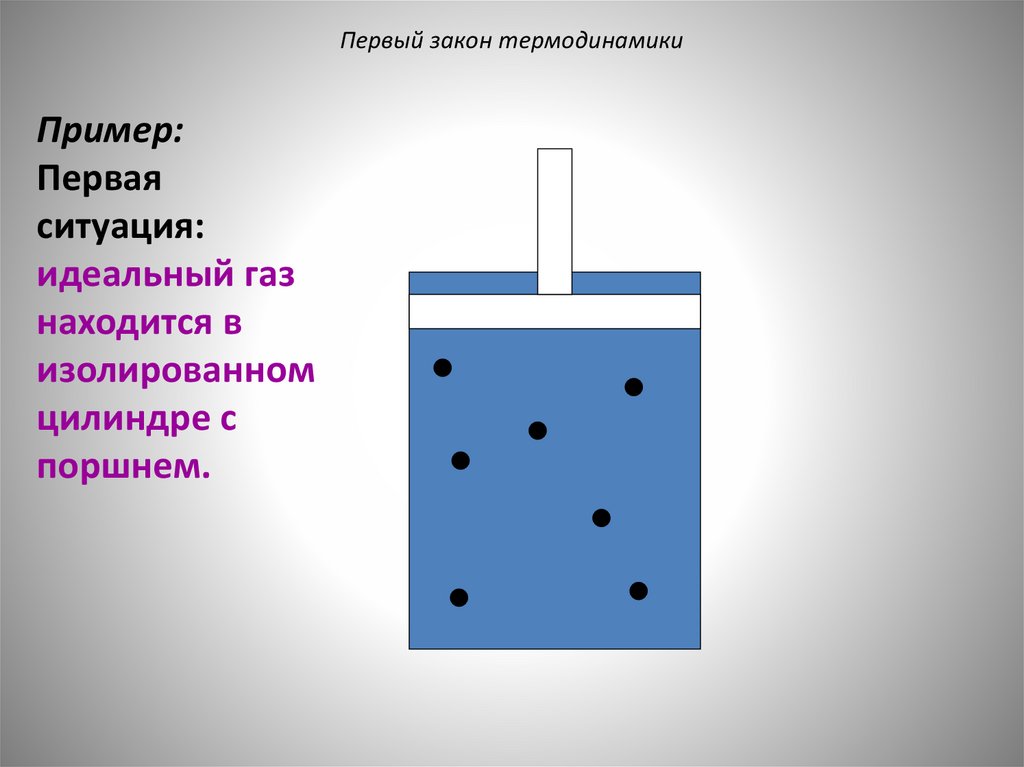
Первый закон термодинамикиПример:
Первая
ситуация:
идеальный газ
находится в
изолированном
цилиндре с
поршнем.
31.
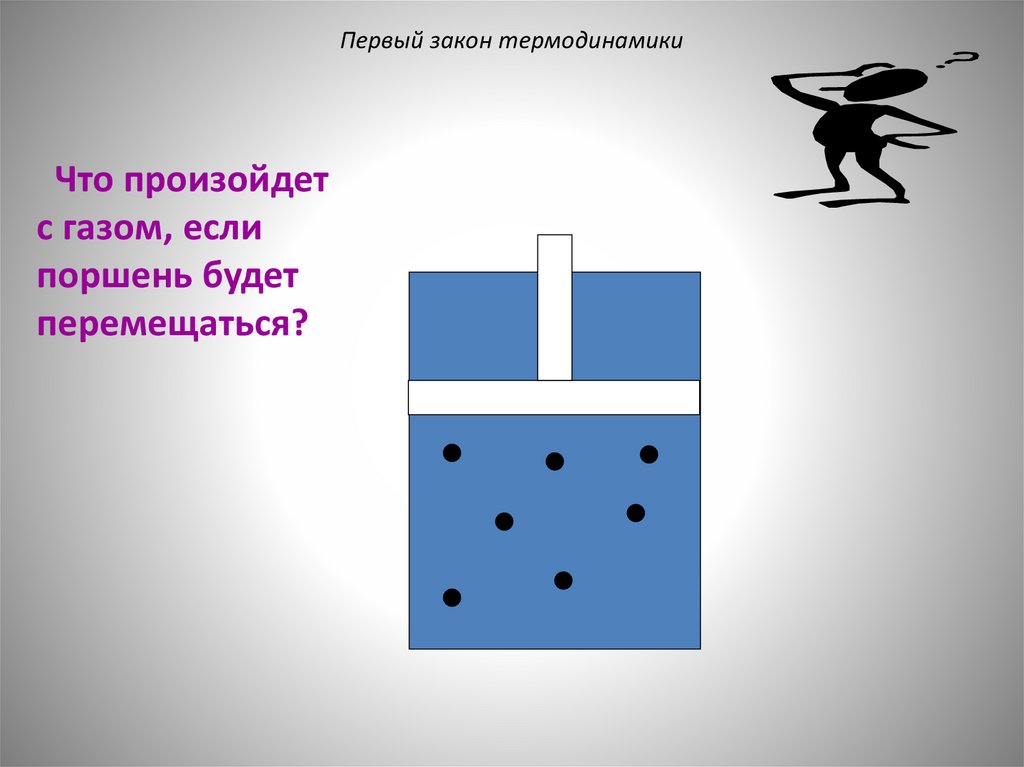
Первый закон термодинамикиЧто произойдет
с газом, если
поршень будет
перемещаться?
32.
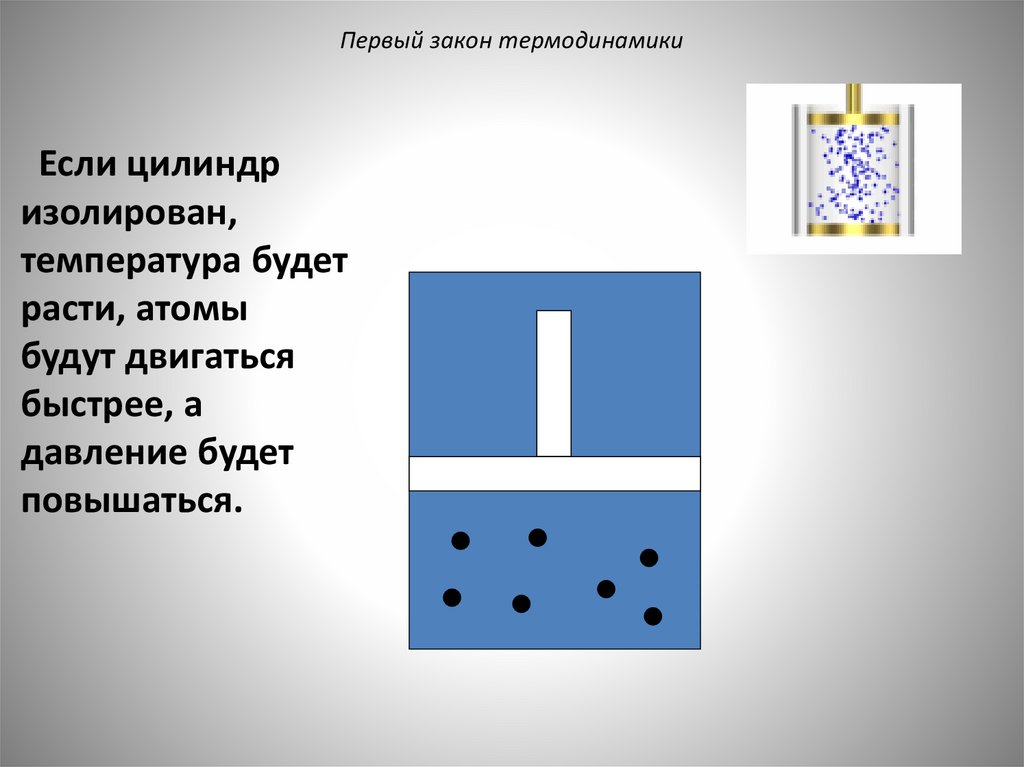
Первый закон термодинамикиЕсли цилиндр
изолирован,
температура будет
расти, атомы
будут двигаться
быстрее, а
давление будет
повышаться.
33.
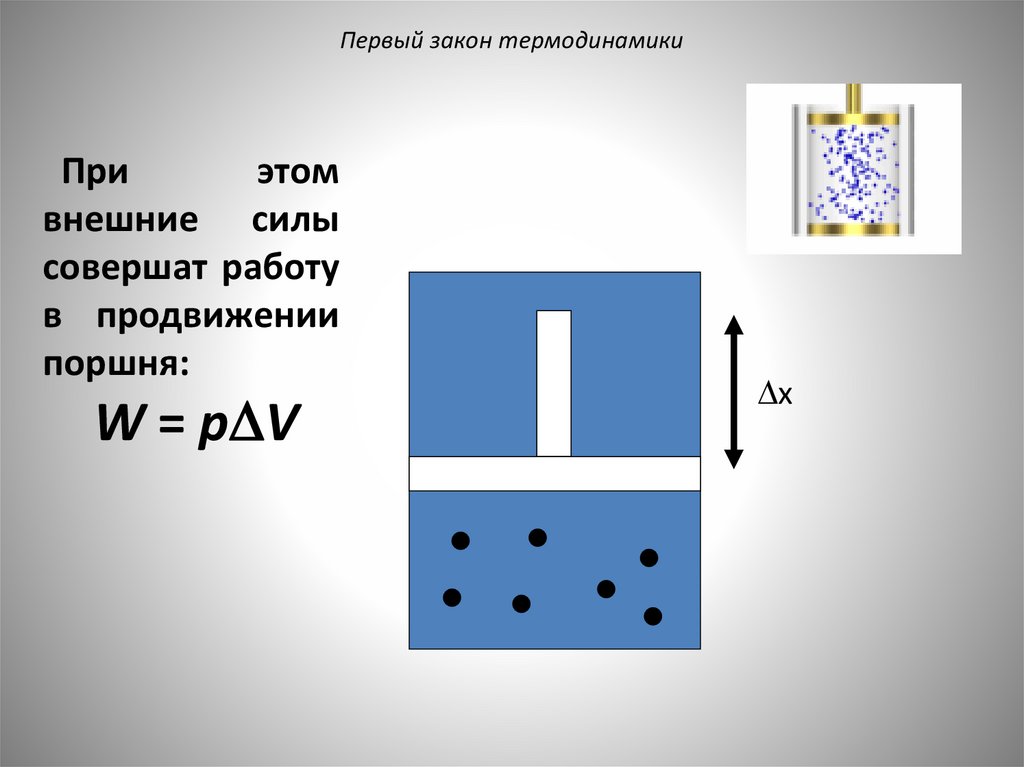
Первый закон термодинамикиПри
этом
внешние силы
совершат работу
в продвижении
поршня:
W = p V
x
34.
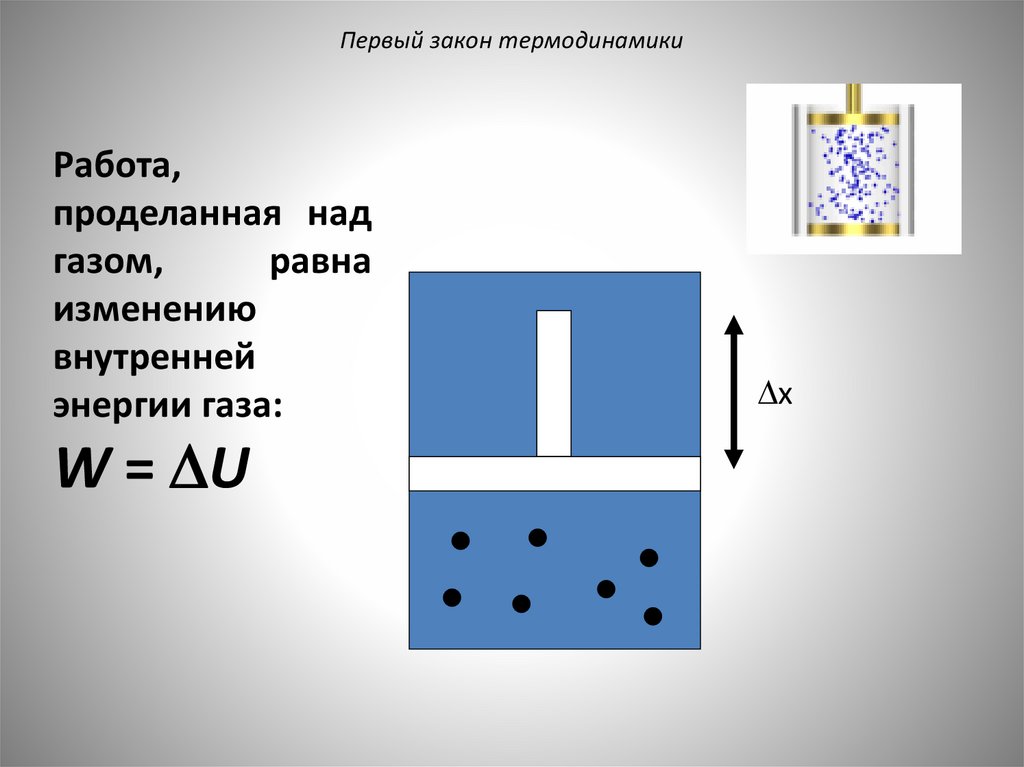
Первый закон термодинамикиРабота,
проделанная над
газом,
равна
изменению
внутренней
энергии газа:
W = U
x
35.
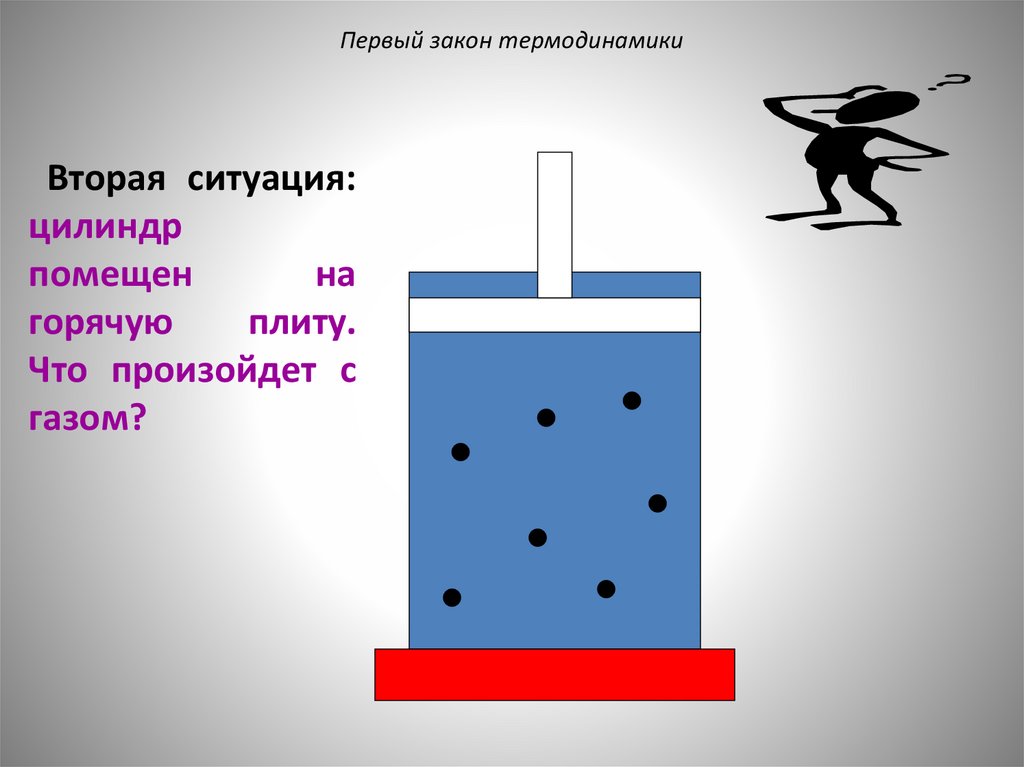
Первый закон термодинамикиВторая ситуация:
цилиндр
помещен
на
горячую
плиту.
Что произойдет с
газом?
36.
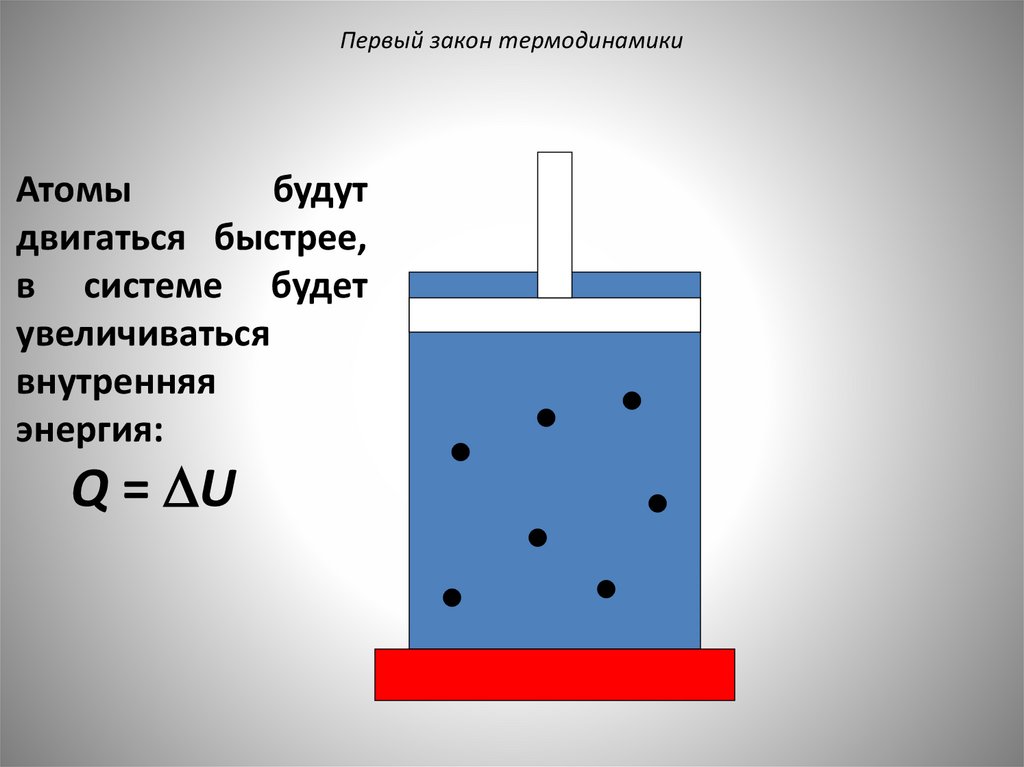
Первый закон термодинамикиАтомы
будут
двигаться быстрее,
в системе будет
увеличиваться
внутренняя
энергия:
Q = U
37.
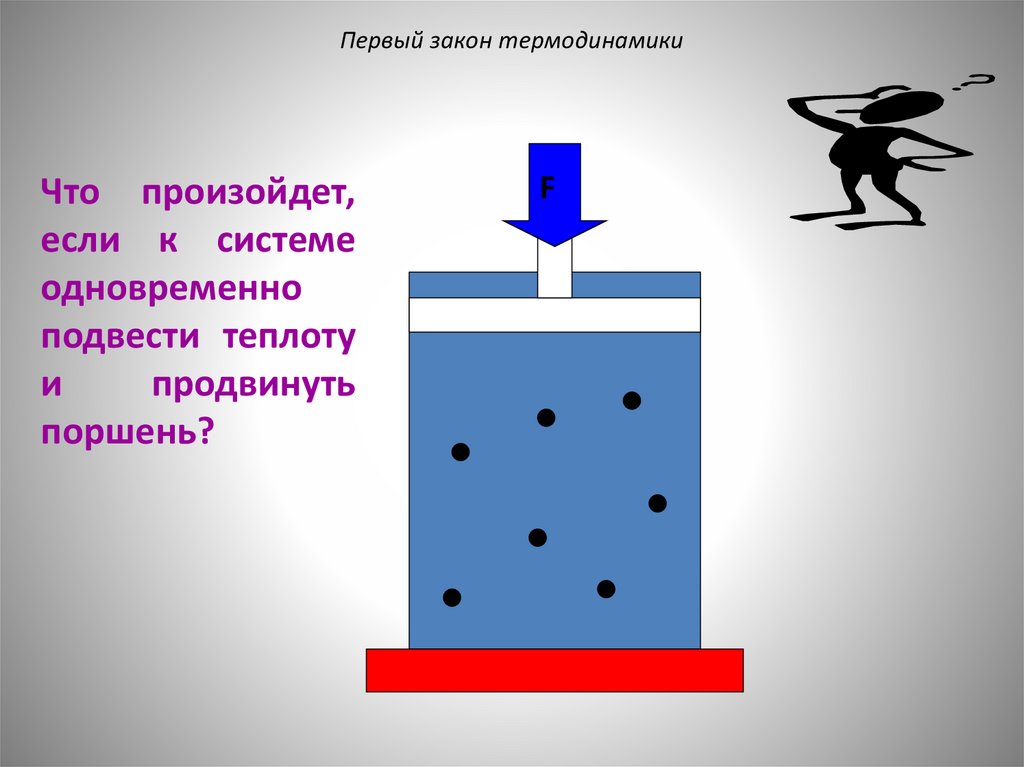
Первый закон термодинамикиЧто произойдет,
если к системе
одновременно
подвести теплоту
и
продвинуть
поршень?
F
38.
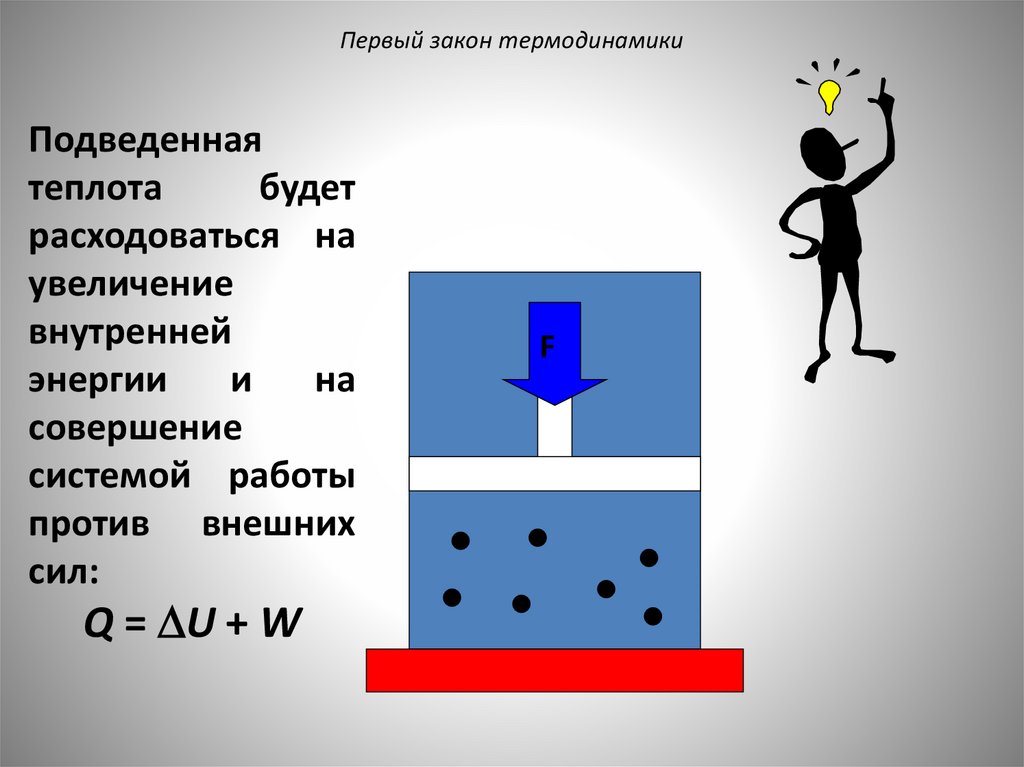
Первый закон термодинамикиПодведенная
теплота
будет
расходоваться на
увеличение
внутренней
энергии
и
на
совершение
системой работы
против внешних
сил:
Q = U + W
F
39.
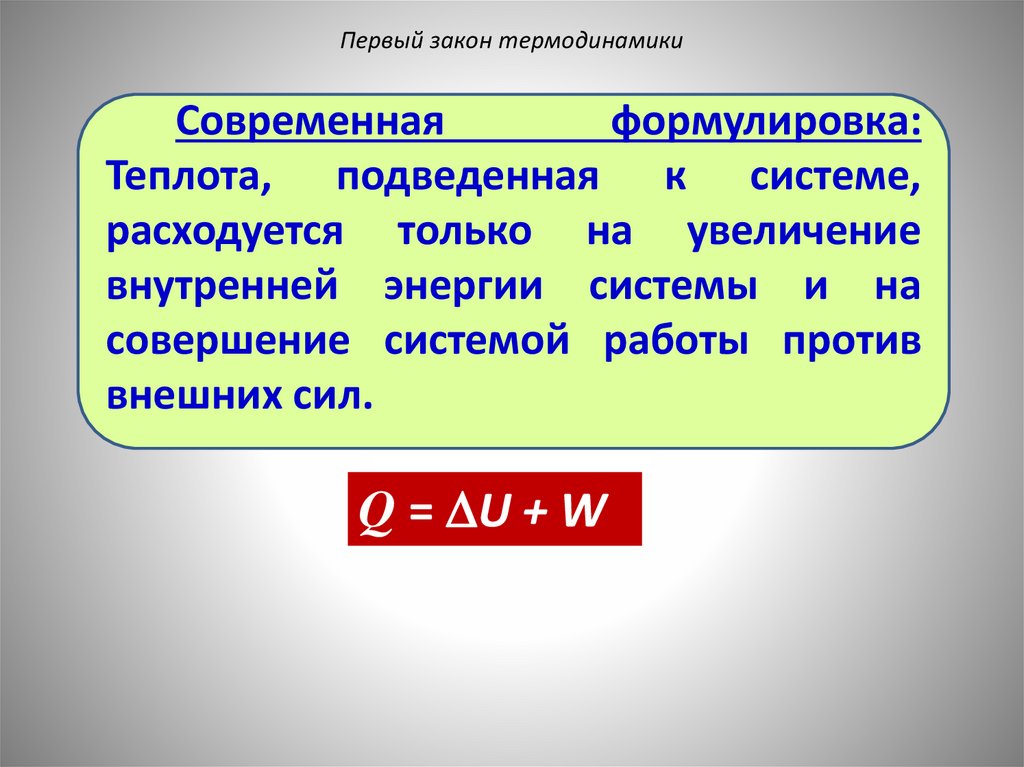
Первый закон термодинамикиСовременная
формулировка:
Теплота, подведенная к системе,
расходуется только на увеличение
внутренней энергии системы и на
совершение системой работы против
внешних сил.
Q = U + W
40.
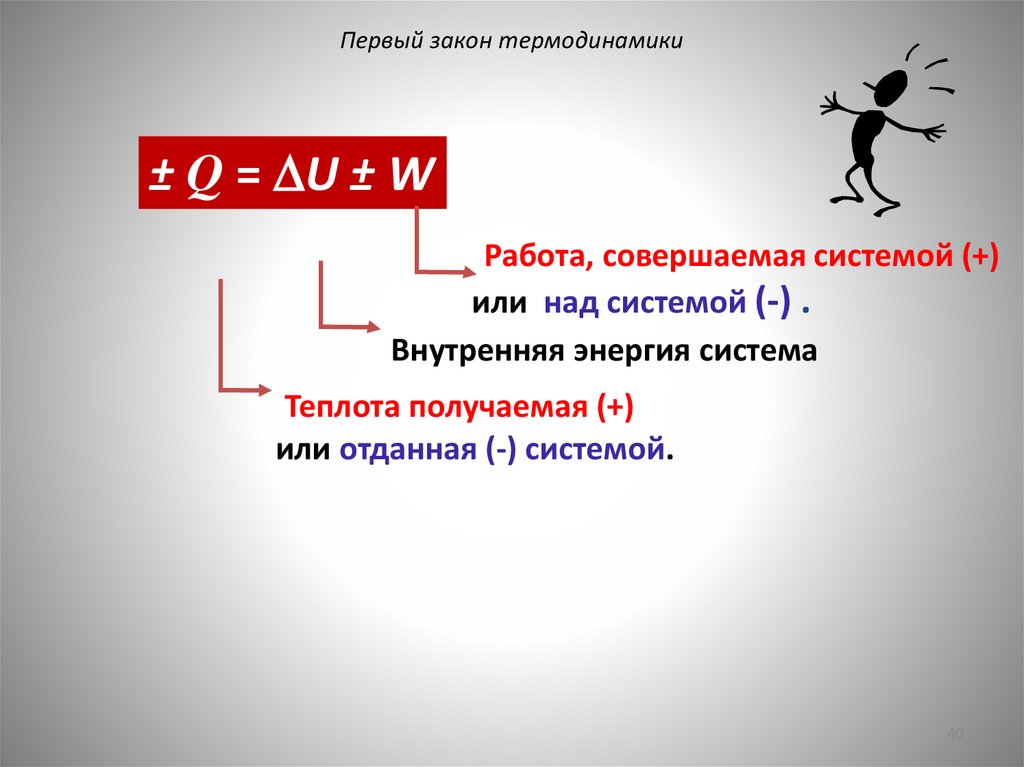
Первый закон термодинамики± Q = U ± W
Работа, совершаемая системой (+)
или над системой (-) .
Внутренняя энергия система
Теплота получаемая (+)
или отданная (-) системой.
40
41.
Первый закон термодинамикиВ биологических системах теплота обычно
отдается системой во внешнюю среду, а работа
совершается за счет убыли внутренней
энергии. Поэтому для биологических систем
математическую запись первого начала
термодинамики представляют:
-Q = -ΔU + W.
42.
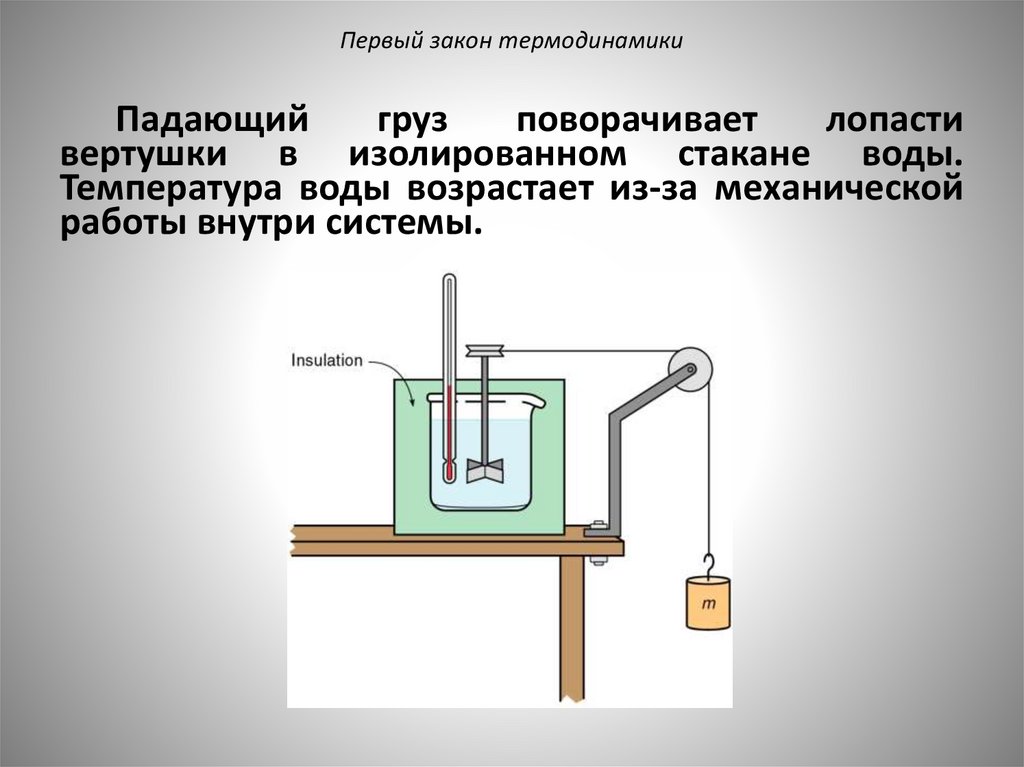
Первый закон термодинамикиПадающий
груз
поворачивает
лопасти
вертушки в изолированном стакане воды.
Температура воды возрастает из-за механической
работы внутри системы.
43.
Первый закон термодинамикиПар, идущий из чайника, заставляет вертушку
крутиться в обычной паровой турбине. Работа,
совершаемая паром, поднимает небольшой груз.
44.
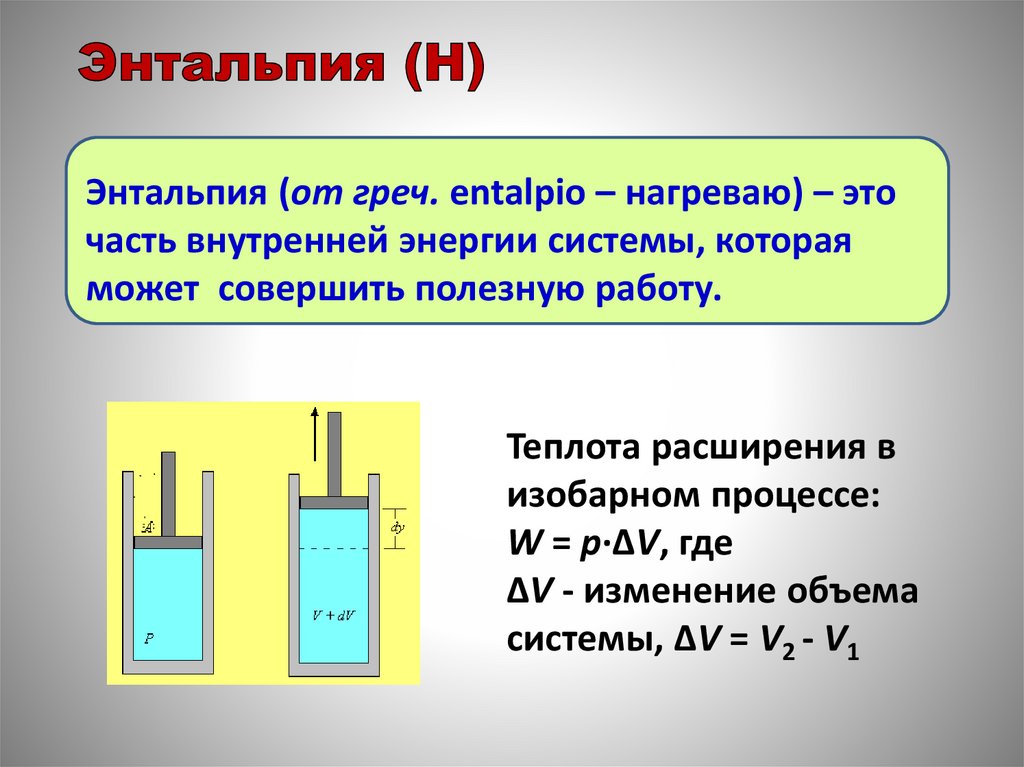
Энтальпия (от греч. entalpio – нагреваю) – эточасть внутренней энергии системы, которая
может совершить полезную работу.
Теплота расширения в
изобарном процессе:
W = p·ΔV, где
ΔV - изменение объема
системы, ΔV = V2 - V1
45.
ЭнтальпияИз первого закона ТД:
Q = ΔU + W
Qр = ΔU + р·ΔV = (U2 + р·V2) - (U1 + p·V1), где:
Qр - теплота изобарного процесса при
р = const;
U + р·V = Н, т. е. энтальпия,
=> Qр= Н2 - Н1 = ΔН,
т.е. ΔН = Qр
46.
ЭнтальпияЭнтальпия - это функция состояния
системы, приращение которой равно
теплоте, поступившей в систему, в
изобарном процессе.
Т.к. ΔН = Qр, => ΔН = ΔU + р·ΔV [кДж·моль-1]
Энтальпию часто называют «тепловой функцией»
или «теплосодержанием» системы.
47.
ЭнтальпияЭндотермический
процесс, ΔН > 0
Экзотермический
процесс, ΔН < 0
48.
ЭнтальпияЭнтальпия (H):
Абсолютное значение энтальпии измерить
невозможно, поэтому измеряют ее приращение:
Hсистемы = Hкон. – Hнач.
ΔН = Ср · ΔТ
48
49.
ТермохимияРаздел ТД, изучающий изменение энергии
при протекании химических процессов,
называется химической термодинамикой
или термохимией.
50.
Основные понятия термохимииХимическая реакция как термодинамический
процесс, заключается в превращении одних
веществ в другие за счет изменения состава и
(или) строения.
Для физико-химических процессов действует
закон
сохранения
массы,
установленный
М.В. Ломоносовым (m1 = m2).
51.
Основные понятия термохимииТермохимическое уравнение –
условное изображение физикохимического процесса.
Пример: ½N2(г)+ ½O2(г)= NO(г), ΔH > 0.
52.
Основные понятия термохимииОсобенности термохимических уравнений:
1. Уравнения записываются с учетом ТД функций
состояния системы (ΔH, ΔS).
2. Учитывается 1 моль вещества, поэтому возможны
дробные коэффициенты.
3. Указываются агрегатные состояния веществ.
4. С ТХ уравнениями могут производиться обычные
алгебраические действия.
53.
Закон ГессаЧастным выражением 1-го начала термодинамики
применительно к химическим процессам является закон
Гесса (1840 г):
Приращение
энтальпии
химического
процесса
в
изобарно-изотермических
условиях (тепловой эффект) зависит только
от природы и состояния реагентов и
продуктов процесса и не зависит от пути
протекания процесса.
54.
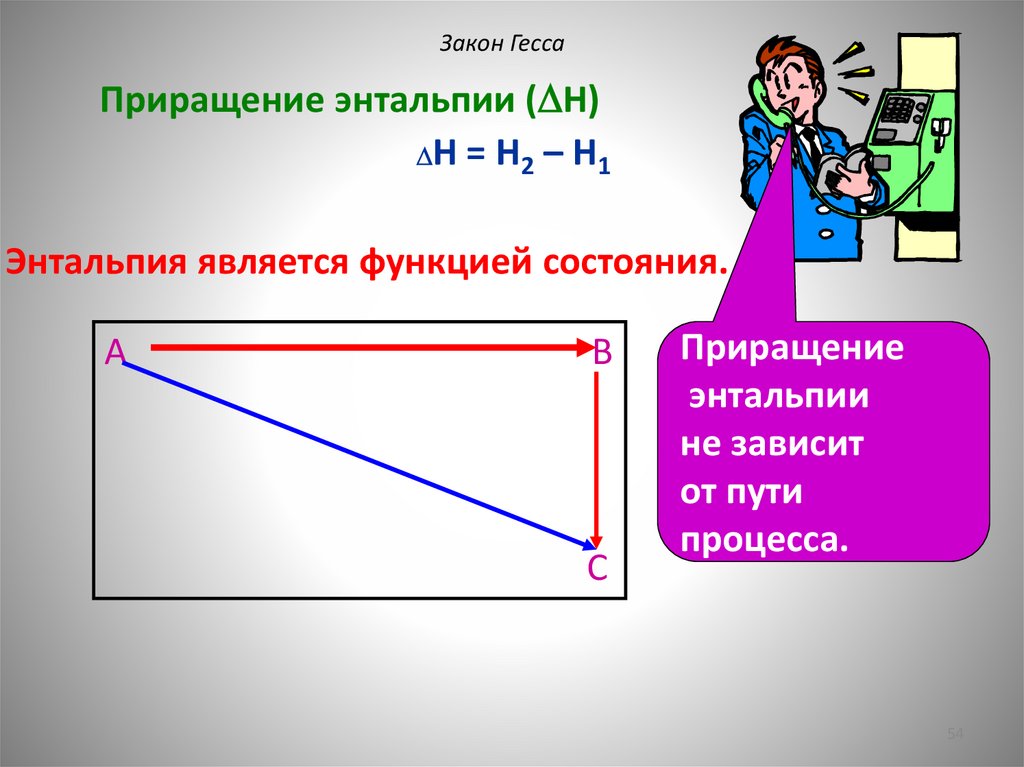
Закон ГессаПриращение энтальпии ( H)
H = H2 – H1
Энтальпия является функцией состояния.
A
B
С
Приращение
энтальпии
не зависит
от пути
процесса.
54
55.
Закон ГессаНапример: Если
С(к) + О2(г) = СО2(г), ΔН1;
или провести процесс по этапам:
С(к) + ½О2(г) = СО(г), ΔН2;
СО(г) + ½О2(г) = СО2(г), ΔН3,
то:
ΔН1 = ΔН2 + ΔН3.
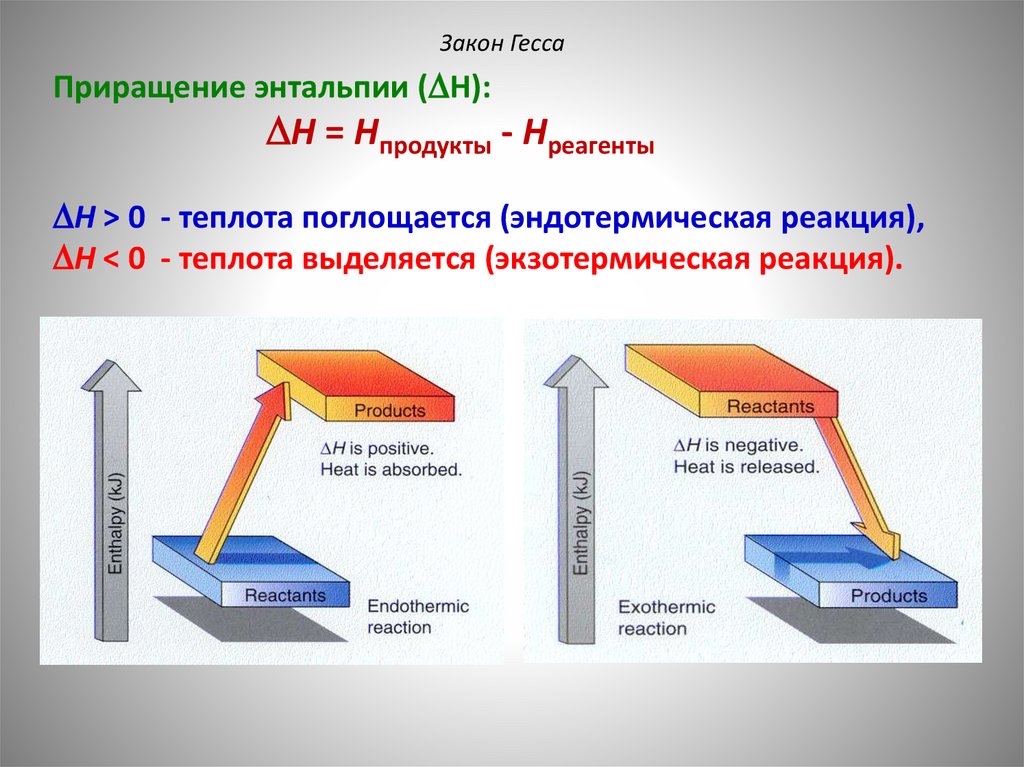
56.
Закон ГессаПриращение энтальпии ( H):
H = Hпродукты - Hреагенты
H > 0 - теплота поглощается (эндотермическая реакция),
H < 0 - теплота выделяется (экзотермическая реакция).
57.
Закон ГессаИз первого закона термодинамики:
Uсистема = - Uсреда
Каждому экзотермическому процессу соответствует
эндотермический процесс.
57
58.
Закон ГессаЗадача:
Реакция происходит в присутствии катализатора
MnO2:
2KClO3(к) 2KCl(к) + 3O2(г)
H = -89.7 кДж
Какой знак имеет H обратной реакции?
+89.7 кД
58
59.
Закон ГессаОпределите знак теплового эффекта процесса:
Плавление льда?
Кристаллизация воды?
Горение свечи?
Взрыв динамита?
59
60.
Закон ГессаРасчеты тепловых эффектов реакций (ΔН0проц. по
термохимическим уравнениям производят либо по
энтальпиям образования веществ, либо по
энтальпиям их сгорания, которые определены
экспериментально и являются табличными
величинами.
61.
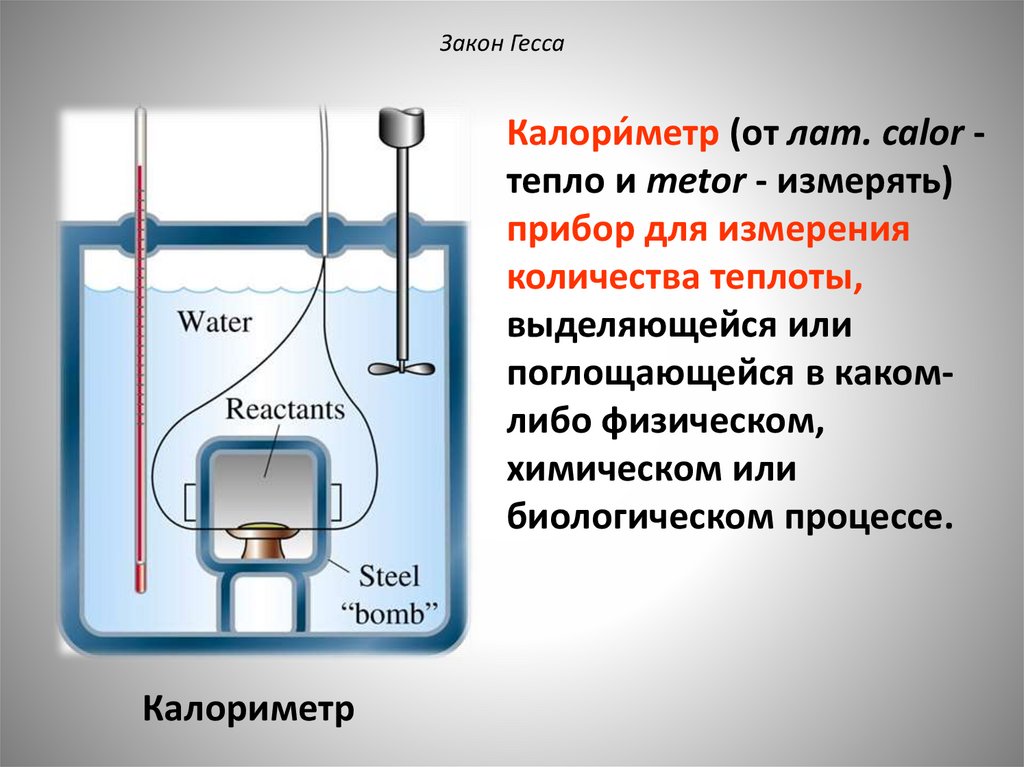
Закон ГессаКалори́метр (от лат. calor тепло и metor - измерять)
прибор для измерения
количества теплоты,
выделяющейся или
поглощающейся в какомлибо физическом,
химическом или
биологическом процессе.
Калориметр
62.
Закон ГессаЭнтальпия
образования
вещества (теплота образования
вещества) – это тепловой
эффект реакции образования 1
моль сложного вещества из
простых веществ, обозначается:
ΔHобр.(Х) [кДж · моль-1].
Калориметр
63.
Закон ГессаЭнтальпия
образования
вещества,
измеренная при стандартных условиях,
называется стандартной энтальпией
образования вещества и является
справочной величиной, обозначается:
ΔН0обр.(Х) [кДж · моль-1].
ΔН0обр. (простых веществ) = 0
64.
Первое следствие закона ГессаТепловой
эффект
процесса
равен
алгебраической сумме энтальпий образования
продуктов за вычетом алгебраической суммы
энтальпий образования реагентов с учетом их
стехиометрических коэффициентов.
ΔН0проц. = ∑nΔН0обр.(прод.) - ∑nΔН0обр.(реаг.) [кДж]
65.
Закон ГессаCS2(к) + 3O2(г) CO2(г) + 2SO2(г)
ΔН0обр.
87.9
кДж/моль:
0
-393.5
-296.8
Каждое значение ΔН0обр. должно
быть умножено на количество моль
вещества в уравнении.
65
66.
Закон ГессаCS2(к) + 3O2(г) CO2(г) + 2SO2(г)
ΔН0обр.
87.9
кДж/моль:
0
-393.5
-296.8
ΔН0проц. = ∑nΔН0обр.(прод.) - ∑nΔН0обр.(реаг.)
ΔН0проц .=ΔН0обр.(СО2(г)) + 2ΔН0обр.(SО2(г))- ΔН0обр.(СS2(к))-3ΔН0обр.(О2(г))
ΔН0проц. = [-393.5 + 2(-296.8)] - [87.9 + 3(0)] = -1075 кДж
66
67.
Закон ГессаДля
многих
органических
соединений
невозможно
одновременно
синтезировать
сложное вещество из простых и при этом
определить
тепловой
эффект
химической
реакции, поэтому для них основой расчетов
является энтальпия сгорания.
68.
Закон ГессаЭнтальпия
сгорания
вещества (теплота сгорания
вещества) – тепловой эффект
реакции сгорания 1 моль
сложного
вещества
до
высших
оксидов,
обозначается:
ΔHсгор.(Х) [кДж · моль-1].
Калориметр
69.
Закон ГессаЭнтальпия сгорания вещества,
измеренная при стандартных условиях,
называется стандартной, обозначается
ΔН0сгор.(Х) [кДж · моль-1].
ΔН0сгор.(высших оксидов) = 0
70.
Второе следствие закона ГессаТепловой эффект химического процесса равен
алгебраической сумме энтальпий сгорания
реагентов за вычетом алгебраической суммы
энтальпий сгорания продуктов с учетом их
стехиометрических коэффициентов.
ΔН0проц. = ∑nΔН0сгор.(реаг.) -∑nΔН0сгор.(прод.) [кДж]
71.
Закон ГессаЗадача 2. Рассчитать тепловой эффект
процесса спиртового брожения глюкозы,
исходя из стандартных энтальпий сгорания:
С6Н12О6(к) = 2С2Н5ОН(ж) + 2СО2(г).
ΔН0сгор.(С6Н12О6(к)) = -2815.78 кДж · моль-1
ΔН0сгор.(С2Н5ОН(ж)) = -1366.9 кДж · моль-1
Решение: по второму следствию закона Гесса:
ΔН0проц .= ΔН0сгор.(С6Н12О6(к) - 2ΔН0сгор.(С2Н5ОН(ж)) - 2ΔН0сгор.(СО2(г))
ΔН0проц.= - 2815.78 - 2·(-1366.9) - 2·(0) = - 82 кДж.
Процесс экзотермический.
72.
Закон ГессаЗакон Гесса и его следствия применяют в научной
диетологии.
С
его
помощью
оценивают
калорийность пищевых продуктов.
Коэффициентом
калорийности
называется тепловой эффект реакции
сгорания одного грамма вещества, взятый
с противоположным знаком.
К = - ΔН0сгор.(Х) [кДж · г-1].
73.
Закон ГессаПищевая калорийность
1000 кал = 1 ккал
Так... Пончик с калорийностью в 500 ккал на самом деле
содержит 500.000 кал.
(Съешь два, чтобы был миллион!)
73
74.
Закон ГессаПищевая калорийность
75.
Закон ГессаКоэффициенты калорийности основных
компонентов пищи равны:
К(белков и углеводов) = 16.5 – 17.2 кДж · г-1,
К(жиров) = 37.7 – 39.8 кДж · г-1.
Первое значение (16.5 и 37.7) – нижняя
граница. Второе значение (17.2 и 39.8) –
верхняя граница.
76.
Закон ГессаДля расчета калорийности пищевых продуктов
используют формулы:
По нижней границе:
К = 16.5m(б) + 16.5m(у) + 37.7m(ж) [кДж]
По верхней границе:
К = 17.2m(б) + 17.2m(у) + 39.8m(ж) [кДж]
77.
Закон ГессаЗадача 3. Рассчитайте калорийность 300 г
порции рыбы, если известно, что в 100 г этого
продукта содержится 12 г белков, 8 г жиров и 0.3 г
углеводов. Коэффициенты калорийности возьмите
по нижней границе.
Решение:
К = 3·[16.5m(б) + 16.5m(у) + 37.7m(ж)] [кДж]
К = 1514 кДж (336 кКал)
78.
Закон Гесса• На основании данных по калорийности
пищевых продуктов, составляется научнообоснованные нормы их потребления для
различных граждан населения, в зависимости
от пола, возраста, характера труда.
• Норма суточного потребления для взрослого
организма:
Белков - 80-100 г.
Жиров - 60-70 г.
Углеводов - 370-450 г.
79.
Закон ГессаСуточная потребность человека в энергии
составляет:
1. При легкой работе в сидячем положении8400-11700 кДж (2000-2800 ккал).
2. При умеренной и напряженной мышечной
работе- 12500-15100 кДж (3000-3600 ккал).
3. При тяжелых физических нагрузках-1670020900 кДж (4000-5000 ккал).
80.
Вопросы для самоконтроля1. Что Вы понимаете под термодинамической
системой?
2. Охарактеризуйте
термодинамические
функции состояния (внутренняя энергия,
энтальпия).
3. Сформулируйте первый закон термодинамики.
4. Сформулируйте закон Гесса и его следствия
81.
СПАСИБО ЗА ВАШЕВНИМАНИЕ!



























































 Химия
Химия