Похожие презентации:
Предмет физической химии. Основные разделы. Первый закон термодинамики
1.
Медицинский университет КарагандыШКОЛА ФАРМАЦИИ
Тема: Предмет физической химии. Основные
разделы. Первый закон термодинамики.
Дисциплина: Физическая и коллоидная химия
Специальность: Технология фармацевтического
производства, Фармация
Курс: 1, 2
Время (продолжительность): 1 академический час
Лектор: ассоциированный профессор Мамбетерзина Г.К.
2.
ПЛАН ЛЕКЦИИ1. Предмет физической химии.
2. Химическая термодинамика. Основные
понятия.
3. Первый закон термодинамики.
4. Термохимия. Закон Гесса.
5. Биоэнергетика.
3.
4.
Основные понятия химической термодинамикиТермодинамика - это
наука, изучающая
взаимные превращения
различных видов энергии,
связанные с переходом
энергии в форме теплоты и
работы.
5.
Основные понятия итермины
Термодинамическая система
- это любая совокупность тел,
отделенная от внешней среды
поверхностью раздела, внутри
которой возможен массо- и
теплообмен.
6.
Основные понятия термодинамикиВ зависимости от способности системы
обмениваться с окружающей средой энергией и
веществом различают изолированные, закрытые и
открытые системы.
Изолированной системой называют систему,
которая не обменивается с окружающей средой ни
веществом, ни энергией.
Систему, которая обменивается с окружающей
средой энергией и не обменивается веществом,
называют закрытой.
Открытой
системой
называют
систему,
обменивающуюся с окружающей средой и
веществом, и энергией.
7.
Классификация систем по характерувзаимодействия с окружающей средой
↔ энергия
масса
↔ энергия
Закрытая
Открытая
система
система
(живой организм) (запаянная
ампула с
лекарством)
Изолирован
ная система
(термос)
8.
Основные понятия химической термодинамикиФаза - это часть
системы с одинаковыми
физическими
и
химическими
свойствами, отделенная
от
других
частей
границей раздела, при
переходе через которую
свойства
резко
меняются.
9.
Основные понятия химической термодинамикиВ зависимости от фазового состояния
различают:
1. Гомогенные системы. Это системы, в
которых все компоненты находятся в
одной фазе, и в них отсутствуют границы
раздела. Пример: растворы глюкозы,
солей, кислот.
2. Гетерогенные системы. Они состоят
из нескольких фаз, отделенных границей
раздела. Пример: эритроциты - плазма
крови, живой организм.
10.
Основные понятия химической термодинамикиТермодинамический процесс –
изменение состояния системы,
сопровождающееся изменением
хотя бы одного
термодинамического параметра.
11.
Основные понятия химической термодинамикиВ зависимости от того, какой из
параметров состояния при протекании
термодинамического процесса остается
постоянным, различают следующие
термодинамические процессы:
изотермический (Т = const),
изобарный (р = const),
изохорный (V = const),
адиабатический (Q= const).
12.
Основные понятия химической термодинамикиТермодинамическое состояние
системы - совокупность всех
физических и химических свойств
системы.
Качественно характеризуется
числом фаз и химическим составом,
количественно термодинамическими параметрами.
13.
Основные понятия химической термодинамики• Термодинамические параметры - это совокупность
физических величин, определяющих состояние
системы: температура (t), давление (р), объем (V).
концентрация (с).
• Функциональная зависимость термодинамических
параметров выражается уравнением состояния.
• Для газообразных систем эти параметры связаны
между собой уравнением Менделеева – Клапейрона:
p·V= n(х)·R·Т,
n(x) =m(x)/M(x) [моль]
R= 8,3 14 Дж · моль-1·К-1
m(х)
p·V=
·R·T
M(х)
14.
Основные понятия химической термодинамикиТермодинамические параметры
называются стандартными, если они
определяются при стандартных условиях.
К стандартным условиям относят:
t=250С или
Т= (t0С +273) = 298 К
р= 101,3 кПа = 1 атм
С(х) = 1 моль · дм-3
15.
Функции состояния системыВ термодинамике для
определения изменения
энергии системы
пользуются различными
энергетическими
характеристиками,
которые называются
термодинамическими
функциями состояния
системы.
16.
Функции состояния системыК термодинамическим функциям
системы относятся:
1. Внутренняя энергия (U).
2. Энтальпия (Н).
3. Энтропия (S).
4 Энергия Гиббса (свободная
энергия) (G).
17.
18.
Функции состояния системы1. Внутренняя энергия (U)
Внутренняя энергия системы
складывается из кинетической
энергии движения молекул или
атомов, образующих систему,
потенциальной энергии их
взаимодействия и
внутримолекулярной энергии.
19.
Внутренняя энергия (U):Абсолютное значение внутренней энергии
измерить невозможно, поэтому измеряют
ее приращение:
Uсистемы = Uкон - Uнач
Бесконечно малое изменение U является
полным дифференциалом dU.
19
20.
Единицы измерения энергии:Джоуль = Дж
Так как Дж очень маленькая величина,
обычно используют кДж.
калория = кал 1 кал = 4.184 Дж
1 кал
4.184 Дж
Коэффициент пересчета!
20
21.
Первый закон термодинамикиПервый закон
термодинамики является
постулатом: он не может
быть доказан логическим
путем, а вытекает из суммы
человеческого опыта.
Большая роль в обобщении
эмпирического опыта при
открытии закона
принадлежит Г.К. Гессу, Р.
Майеру, Джоулю,
Гельмгольцу.
21
22.
23.
Функции состояния системыВнутренняя энергия есть функция
состояния
системы,
приращение
которой
(ΔU)
равно
теплоте,
поступающей в систему при изохорном
процессе (ΔV=const).
ΔU=Q V , где Q V - теплота изохорного
процесса.
ΔU - кДж/моль
24.
Энтальпия (от греч.entalpio - нагреваю) - это
часть внутренней энергии
системы, которая может
совершить полезную
работу.
Теплота расширения в изобарном процессе:
W= p·ΔV, где
ΔV - изменение объема системы, ΔV=V2-V1
25.
Функции состояния системыИз первого закона ТД:
Q = ΔU + W
Qр = ΔU + р·Δ V =(U2+р·V2) - (U1+ p·V1),
где:
Qр - теплота изобарного процесса
при р=const;
U + р·V = Н,
т. е. энтальпия, => Qр=Н2-Н1=ΔН,
т.е. ΔН=Qр
26.
Функции состояния системыЭнтальпия - это функция состояния
системы, приращение которой равно
теплоте, поступившей в систему в
изобарном процессе.
Т.к. ΔН=Qр, => ΔН = ΔU + р·ΔV [кДж·моль-1]
Энтальпию часто называют «тепловой
функцией» или «теплосодержанием»
системы.
27.
Функции состояния системыЭкзотермический
процесс, ΔН<0 .
Эндотермический
процесс, ΔН>0
28.
Энтальпия (H):Абсолютное значение
энтальпии измерить
невозможно, поэтому
измеряют ее приращение:
Hсистемы = Hкон - Hнач
28
29.
ТермохимияРаздел ТД, изучающий изменение
энергии при протекании химических
процессов, называется термохимией.
30.
Основные понятия термохимииТермохимическое
уравнение - условное
изображение физикохимического процесса.
31.
32.
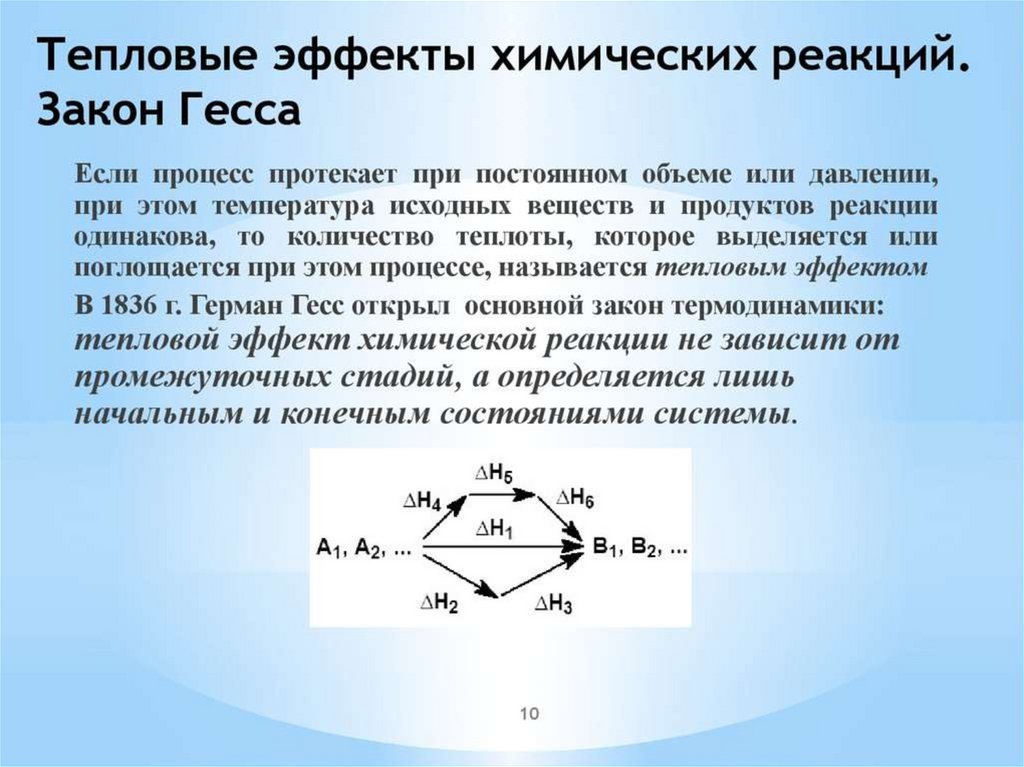
Закон ГессаНапример: Если
С (т) + О2 (г) = СО2 (г), ΔН1;
или провести процесс по этапам:
С (т) + 1/2О2 (г) = СО (г), ΔН2;
СО (г) + 1/2О2 (г) = СО2 (г), ΔН3,
то
ΔН1 = ΔН2 + ΔН3.
33.
Приращение энтальпии ( H)В реакции:
H = Hпродукты - Hреагенты
H > 0 - теплота поглощается,
H < 0 - теплота выделяется.
Окружающая среда
Система
Окружающая среда
Система
Теплота
Теплота
34.
Закон ГессаКалориметр
Энтальпия образования
вещества (теплота
образования) – это
тепловой эффект реакции
образования 1 моля
вещества из простых
веществ, обозначается:
ΔНобр(Х) [кДж · моль-1].
35.
Закон ГессаЭнтальпия образования, измеренная при
стандартных условиях, называется
стандартной энтальпией образования и
является справочной величиной,
обозначается:
ΔН0обр(Х) [кДж · моль-1].
Для простых веществ стандартная
энтальпия образования = 0.
ΔН0обр(простых веществ) = 0
36.
Первое следствие закона ГессаТепловой эффект
процесса
равен
алгебраической
сумме
энтальпий
образования
продуктов
за
вычетом
алгебраической
суммы
энтальпий
образования реагентов с учетом их
стехиометрических коэффициентов.
ΔН0проц. = ∑nΔН0обр(прод) - ∑nΔН0обр(реаг),
ΔН0проц.[кДж ·моль-1].
37.
CS2(к) + 3O2(г) CO2(г) + 2SO2(г)ΔН0обр:
87.9кДж/моль
0 кДж/моль -393.5 кДж/моль -296.8 кДж/моль
Каждое значение ΔН0 должно быть
умножено на количество моль
вещества в уравнении.
37
38.
CS2(к) + 3O2(г) CO2(г) + 2SO2(г)ΔН0обр:
87.9кДж/моль
0 кДж/моль
-393.5 кДж/моль -296.8 кДж/моль
ΔН0проц.= ∑nΔН0обр(прод.) - ∑nΔН0обр(реаг.)
ΔН0х.р. = [-393.5 + 2(-296.8)] - [87.9 + 3(0)]
ΔН0х.р. = -1073.4 кДж
Q= –∆Н, т.е. термохимический тепловой
эффект реакции равен по абсолютной величине
термодинамическому тепловому эффекту, но
противоположен по знаку.
38
39.
Закон ГессаЭнтальпия сгорания
(теплота сгорания) –
тепловой эффект реакции
сгорания 1 моля вещества
до высших оксидов,
обозначается:
ΔHсгор.(Х) [кДж · моль-1].
Калориметр
40.
Закон ГессаЭнтальпия сгорания, измеренная
при стандартных условиях, называется
стандартной,
обозначается ΔН0сгор.(Х) [кДж · моль1].
41.
Второе следствие закона Гесса:Тепловой эффект химического процесса
равен алгебраической сумме энтальпий
сгорания реагентов за вычетом
алгебраической суммы энтальпий сгорания
продуктов с учетом их стехиометрических
коэффициентов.
ΔН0проц. = ∑nΔН0сгор(реаг.) -∑nΔН0сгор(прод.),
[кДж · моль-1]
42.
Термодинамический метод исследования являетсяодним из наиболее надежных способов изучения
обмена веществ и энергии в живых организмах.
Превращения энергии,
происходящие в живых
организмах, являются
предметом
биоэнергетики.
43.
Особенности организации живых систем:Биологические системы
являются открытыми.
Процессы в живых системах в
конечном итоге необратимы.
Живые системы не находятся в
состоянии равновесия.
Все биологические системы
гетерогенны.
44.
45.
46.
Закон ГессаЗакон Гесса и его следствия применяют в
научной диетологии. С его помощью оценивают
калорийность пищевых продуктов.
Коэффициентом калорийности
называется тепловой эффект реакции
сгорания одного грамма вещества,
взятый с противоположным знаком.
К= - ΔН0сгор(Х)
47.
Закон ГессаКоэффициенты калорийности основных
компонентов пищи равны:
К (белков и углеводов) = 16,5 – 17,2 кДж · г-1,
К (жиров) = 37,7 – 39,8 кДж · г-1.
Первое значение (16,5 и 37,7) – нижняя
граница. Второе значение (17,2 - 39,8) –
верхняя граница.
48.
Закон ГессаДля расчета калорийности пищевых продуктов
используют формулы:
По нижней границе:
К = 16,5 m(б) + 16,5 m(у) + 37,7 m(ж) [кДж]
По верхней границе:
К = 17,2 m(б) + 17,2 m(у) + 39,8 m(ж) [кДж]
49.
Закон Гесса• На основании данных по калорийности пищевых
продуктов, составляется научно- обоснованные
нормы их потребления для различных граждан
населения, в зависимости от пола, возраста,
характера труда.
• Пользуясь этими данными как средними
величинами, врач составляет нормы потребления
пищевых веществ для каждого пациента в
отдельности.
• Норма суточного потребления для взрослого
организма:
Белков-80-100 г.
Жиров-60-70 г.
Углеводов-370-450 г.
50.
Закон ГессаСуточная потребность человека в энергии
составляет:
1. При легкой работе в сидячем положении8400-11700 кДж (2000-2800 ккал).
2. При умеренной и напряженной мышечной
работе- 12500-15100 кДж (3000-3600 ккал).
3. При тяжелых физических нагрузках-1670020900 кДж (4000-5000 ккал).
51.
Спасибоза Ваше внимание!

















































 Физика
Физика Химия
Химия








