Похожие презентации:
Расчет тепловых эффектов и показателей обеспеченности кислородом
1.
Практические занятияТема:
Расчет тепловых эффектов
и показателей
обеспеченности кислородом
2.
Используемые формулыВзаимосвязь между тепловыми эффектами
QV = QP + RT(n2 – n1) при постоянном объеме и постоянном
давлении
1 3
Q
1 2
Q
2 3
Q
Qсг=109,1·N+∑qi·∆i
N = 4a + b - P
Закон Гесса
Расчет теплоты сгорания по методу
Караша
Количество перемещающихся электронов
Кислородный баланс
b
d 2a 2 16
КБ
100
M
Кислородный коэффициент
d
b
2a
2
3.
Подразделение взрывчатых веществ по кислородному балансуI группа – ВВ с положительным кислородным балансом: углерод
окисляется до СО2, водород до Н2О, азот и избыток кислорода выделяются
в элементарном виде ( d > (2a + 0,5b), в составе ПВ содержатся O2,
СО2, H2O, N2).
II группа – ВВ с отрицательным кислородным балансом, когда
кислорода недостаточно для полного окисления компонентов до высших
оксидов и углерод частично окисляется до СО (но все элементы ВВ
превращаются в газы). ( При (a + 0,5b) < d < (2a + 0,5b) в составе ПВ –
СО2, СO, H2O, N2).
III группа – ВВ с отрицательным кислородным балансом
При d ≤ (a + 0,5b) в составе ПВ может присутствовать свободный углерод
в виде сажи; при d < a образование свободного углерода неизбежно.
4.
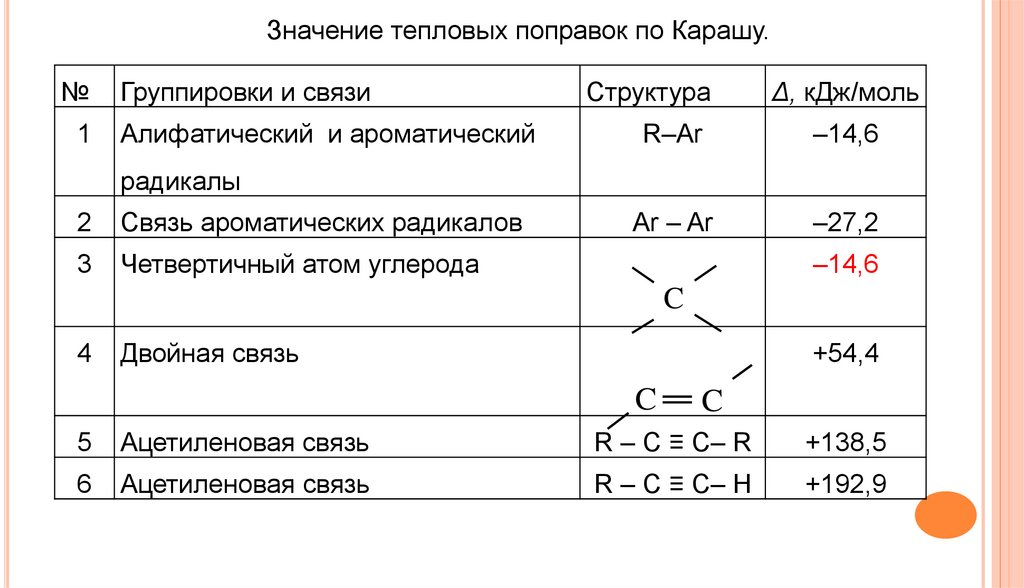
Значение тепловых поправок по Карашу.№
Группировки и связи
1
Алифатический и ароматический
Структура
Δ, кДж/моль
R–Ar
–14,6
Ar – Ar
–27,2
радикалы
2
Связь ароматических радикалов
3
Четвертичный атом углерода
–14,6
C
4
Двойная связь
+54,4
C
C
5
Ацетиленовая связь
R – C ≡ C– R
+138,5
6
Ацетиленовая связь
R – C ≡ C– H
+192,9
5.
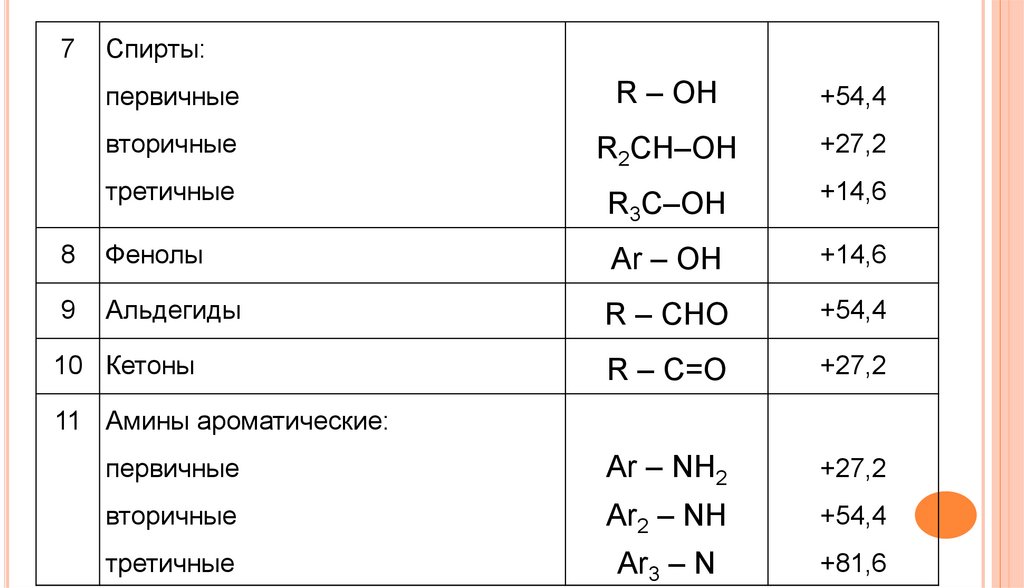
7Спирты:
первичные
R – OH
+54,4
вторичные
R2CH–OH
+27,2
R3C–OH
+14,6
третичные
8
Фенолы
Ar – OH
+14,6
9
Альдегиды
R – CHO
+54,4
R – C=O
+27,2
первичные
Ar – NH2
+27,2
вторичные
Ar2 – NH
+54,4
третичные
Ar3 – N
+81,6
10 Кетоны
11 Амины ароматические:
6.
12 Эфиры:простые
R
R'
O
+81,6
O
сложные алифатические
R
+69,1
C
O
O
сложные ароматические
Ar
C
R'
+41,8
O
R'
13 Кислоты
алифатические
R–COOH
0
ароматические
Ar–COOH
–54,4
7.
14 Амины алифатические:первичные
R–NH2
+54,4
вторичные
R2–NH
+81,6
15 Нитрогруппа
С–NO2
+54,4
16 Нитратная группа
С–O– NO2
0
17 Динитрогруппа
–C (NO2)2
–83,6
18 Нитраминная группа
=N–NO2
–15,9
19 Азидогруппа
–N3
+293
20 Динитрофтораминогруппа
–NF2
+301,2
8.
Теплоты образования продуктов взрыва и сгорания при постоянномдавлении
№
Вещество
0
Hобр
( p)
кДж/моль
Qобр(р),
кДж/моль
Qобр(V), кДж/моль
1
Углекислый газ СО2 (г)
–393,5
+ 393,5
2
Угарный газ СО (г)
–110,5
+110,5
+119,9
3
Вода Н2О (пар)
– 241,8
+ 241,8
+240,9
4
Вода Н2О (ж)
–285,8
+285,8
5
Оксид азота NO (г)
+90,4
–90,4
6
Оксид азота NO2 (г)
+33,9
–33,9
7
Оксид алюминия Al2O3
–1670
+1670
8
Хлорид водорода HCl (г)
–91,8
+91,8
9
Аммиак NH3 (г)
–46,2
+46,2
+43,6
9.
Пример 1. Рассчитать кислородный коэффициент и кислородный баланстротила. Сделать вывод о продуктах взрывного превращения
CH3
1)
O2N
Определяем брутто-формулу тротила
NO2
С7H5N3O6
NO2
5
6 2 7 2 16
КБ
100 74%;
227
6
5
2 7
2
0,36
10.
Исходя из полученных данных видно, что у тротил относится к веществамс отрицательным кислородным балансом (недостаточного своего кислорода
для полного окисления всех горючих элементов молекулы).
Далее нужно определить, содержится ли в составе продуктов взрыва
твердый углерод. Для этого нужно посмотреть соотношение между
горючими и окислительными элементами в молекуле. Проверяем условие:
(a + 0,5b) < d < (2a + 0,5b) или d ≤ (a + 0,5b) или d < a
Сначала проверяем условие d < a
6<7
Как видно неравенство соблюдается, следовательно в продуктах взрыва
тротила обязательно будет присутствовать свободный углерод.
11.
Пример 2. Рассчитать теплоту сгорания 1 моля динитротолуола пометоду Караша.
Решение : Сначала записываем формулу и брутто-формулу вещества
CH3
NO2
C7H6N2O4
Число перемещающихся электронов
NO2
N=4a+b–p=4·7+6–2=32.
В формуле присутствуют следующие группы, на которые делаются
тепловые поправки:
∆(С–NO2)= +54,4 кДж/моль , ∆( R–Ar)= –14,6 кДж/моль
Qсг=109,1·32+2·54,4+1·(–14,6)=3585,4 кДж/моль (856,3 ккал/моль)
12.
Пример 3: Рассчитать теплоту образования 1 кг динитротолуола припостоянном объеме, если известна его теплота сгорания при постоянном
давлении Qсг(p)= 3585,4 кДж/моль. Расчет произвести при воде жидкой.
Решение : Сначала записываем формулу и брутто-формулу вещества
CH3
NO2
NO2
C 7H 6N 2O 4
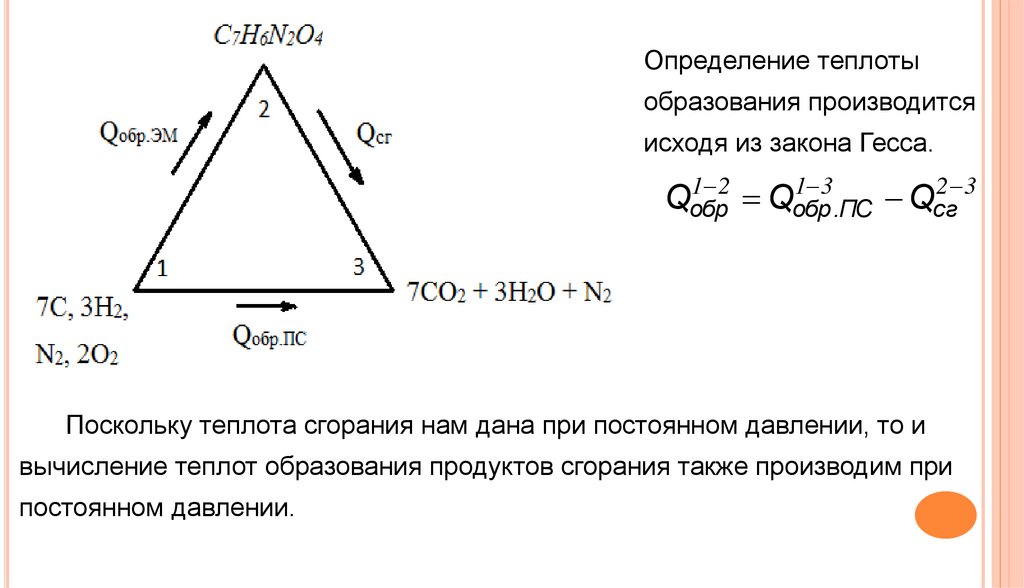
Далее для определения теплоты образования строим
треугольник Гесса.
В этом треугольнике:
-
в положении 1 находятся свободные элементы, из которых состоит
вещество;
-
в положении 2 – само вещество;
-
в положении 3 продукты реакции, в данном случае – сгорания, которые
определяются как: аСО2 + 0,5·bН2О + сN2 .
13.
Определение теплотыобразования производится
исходя из закона Гесса.
1 2
1 3
2 3
Qобр
Qобр
Q
.ПС
сг
Поскольку теплота сгорания нам дана при постоянном давлении, то и
вычисление теплот образования продуктов сгорания также производим при
постоянном давлении.
14.
Qобр.(р)(CO2) = + 393,5 кДж/моль;Qобр(.р)(H2Oж) = +285,8 кДж/моль
Q1-3обр.ПС= 7·393,5 + 3·285,8= 2754,5 + 854,4=3611,9 кДж/моль
Таким образом теплота образования ДНТ при постоянном давлении:
Q1-2обр.(р)= 3611,9 – 3585,4= 26,5 кДж/моль (6,33 ккал/моль).
Переводим в значение теплоты при постоянном объеме (с учетом
количества газообразных продуктов n2 = 0 моль, n1 = 6 моль):
Q1-2обр.(V)= 26,5 + 2,48(0–6)= 11,62 кДж/моль ( 2,77 ккал/моль)
15.
Переводим в теплоту отнесенную к 1 кг вещества. Для этого используемформулу:
кДж
Q(
) 1000
кДж
моль
Q(
)
кг
M
где М – молекулярная масса
вещества.
Таким образом теплота образования 1 кг ДНТ при постоянном объеме:
11,62 1000
Qобр.( v )
63,8 кДж / кг
182
16.
Пример 4: Рассчитать теплоту взрыва 1 моля 1,3,5-тринитробензола приводе парообразной, при следующей реакции взрывного превращения:
NO2
1,5H2O + 4,5CO + 1,5N2 + 1,5C
O2N
NO2
а) Поскольку нам не дана теплота образования вещества, то сначала
определяем ее исходя из теплоты сгорания. Для этого строим треугольник
Гесса:
17.
исходя из закона Гесса:1 2
1 3
2 3
Qобр Qобр .ПС Qсг
Поскольку в треугольнике в положении 3 находятся продукты сгорания,
то используется значение теплоты образования воды при жидком состоянии
Q1-3обр.ПС= 6·Qобр.(р)(CO2) + 1,5·Qобр(.р)(H2Oж)
18.
Qобр.(р)(CO2) = + 393,5 кДж/моль;Qобр(.р)(H2Oж) = +285,8 кДж/моль
Q1-3обр.ПС= 6·393,5 + 1,5·285,8= 2361 + 428,7=2789,7 кДж/моль
Теплоту сгорания определяем по методу Караша.
Число перемещающихся электронов N=4a+b–p=4·6 + 3 – 3=24.
В формуле присутствуют следующие группы, на которые делаются
тепловые поправки: ∆(С–NO2)= +54,4 кДж/моль
Q2-3сг=108,9·24 + 3·54,4 = 2613,6 + 163,2 = 2776,8 кДж/моль
(662,8 ккал/моль)
Q1-2обр.(р)=2789,7 – 2776,8 = 12,9 кДж/моль
Теплота образования рассчитана при постоянном давлении.
19.
б) Далее определяем теплоту взрыва на основании теплотыобразования. Для этого снова строим треугольник Гесса, в котором в
положении 3 находятся продукты взрыва:
2 3
1 3
1 2
Qвзр Qобр .ПВ Qобр
20.
Q1-3обр.ПВ= 1,5·Qобр(.р)(H2Oпар) + 4,5·Qобр.(р)(CO) ++ 1·Qобр.(р)(N2) + 1·Qобр.(р)(С)
Q1-3обр.ПВ= 1,5·241,8 + 4,5·110,5 + 1·0 + 1·0 = 859,95 кДж/моль
Q2-3взр.(р)=859,95 – 12,9 = 847,05 кДж/моль
Переводим в значение теплоты при постоянном объеме, с учетом
перехода из начального положения 2 в конечное положение 3 (т.е. n2 = 7,5
моль , n1 = 0 моль):
Q2-3взр.(V)= 847,05 + 2,48·(7,5 – 0)= 865,65 кДж/моль
















 Химия
Химия








