Похожие презентации:
Поверхностные явления. Классификация и свойства дисперсных систем
1.
Федеральное государственное бюджетное образовательноеучреждение высшего образования
«Кемеровский государственный медицинский
университет»
Министерства здравоохранения Российской Федерации
(ФГБОУ ВО КемГМУ Минздрава России)
Кафедра фармацевтической и общей химии
ХИМИЯ
Поверхностные явления. Адсорбционные процессы и
равновесие на подвижных и неподвижных границах
раздела. Классификация и свойства дисперсных
систем
Пинчук Людмила Григорьевна
д-р с.-х. наук, профессор
2024
2.
Рассматриваемые вопросы1. Поверхностные явления. Адсорбция,
поверхностная энергия, поверхностное
натяжение, поверхностно активные
вещества.
2. Адсорбция неэлектролитов, ионная
адсорбция.
3. Биологическая роль адсорбции,
строение биологических мембран.
4. Дисперсные системы, классификация,
виды устойчивости, диализ
3.
1. Поверхностные явления –процессы, на границе раздела
фаз, в межфазном поверхностном
слое, возникающие при
взаимодействии сопряженных
фаз, имеющих различный состав и
строение.
Поверхность раздела фаз –
граничная область между фазами
4.
Адсорбция (лат. ad - на, при; sorbeo-поглощаю) - вид сорбции, связаный
с увеличением концентрации
растворенного вещества (абсорбат)
у поверхности раздела двух фаз
вследствие нескомпенсированности
сил межмолекулярного
взаимодействия.
Десорбция - процесс, обратный
адсорбции
5.
Сорбция – гетерогенный процесссамопроизвольного поглощения
твёрдым телом или жидкостью веществ
из окружающей среды.
Сорбент твёрдое тело или жидкость,
поглощающие вещества.
Сорбат - поглощаемое вещество.
Сорбция: - обратимая
- необратимая.
При обратимой на границе раздела фаз
устанавливается равновесие
6.
Поверхностная энергия избыток энергии, возникающейна границе раздела фаз, за
счет нескомпенсированности
сил межмолекулярного
взаимодействия.
Адсорбция - экзотермический
процесс
7.
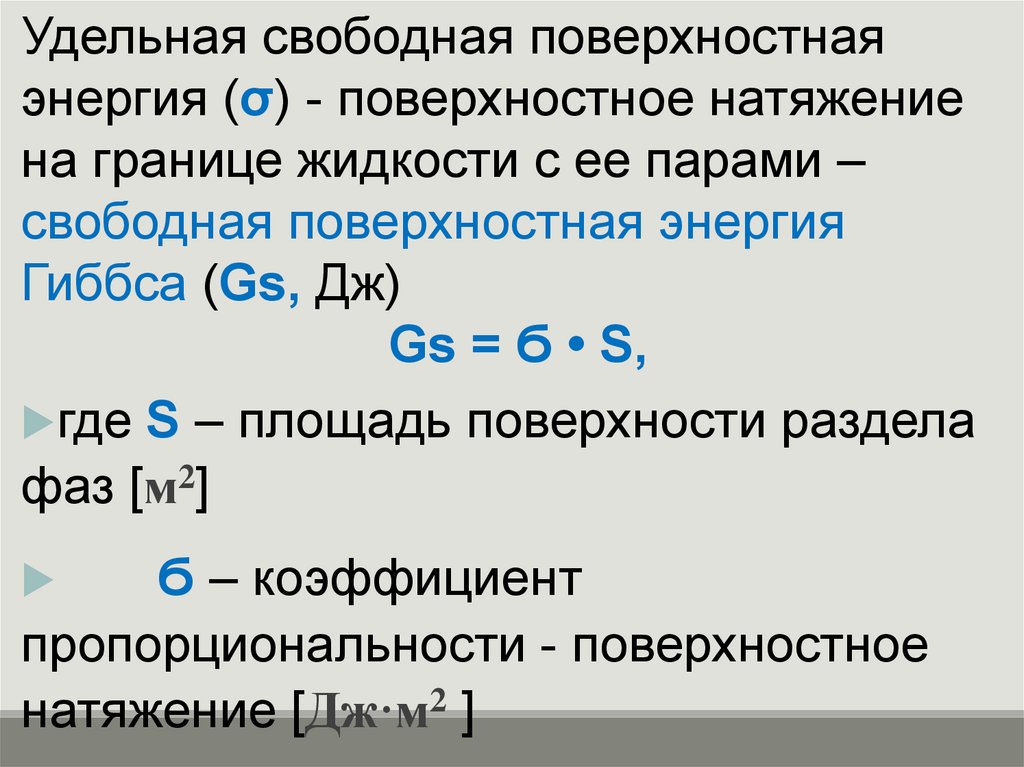
Удельная свободная поверхностнаяэнергия (σ) - поверхностное натяжение
на границе жидкости с ее парами –
свободная поверхностная энергия
Гиббса (Gs, Дж)
Gs = Ϭ • S,
где S – площадь поверхности раздела
фаз [м2]
Ϭ – коэффициент
пропорциональности - поверхностное
натяжение [Дж·м2 ]
8.
Поверхностное натяжение (Ϭ) на поверхности раздела фаззависит от:
- природы растворителя;
- температуры;
- давления газовой фазы;
- природы и концентрации
растворенного вещества
9.
Изотерма поверхностногонатяжения – зависимость
поверхностного натяжения
растворов от концентрации
растворенного вещества при
постоянной температуре
10.
Поверхностно-активные вещества(ПАВ) - понижают поверхностное
натяжение растворителя
(органические спирты, кислоты,
амины, фенолы).
Поверхностно – инактивные вещества
(ПИВ) – повышают поверхностное
натяжение (сильные электролиты).
Поверхностно-неактивные вещества
(ПНВ) - не изменяют поверхностное
натяжение (сахароза и др.)
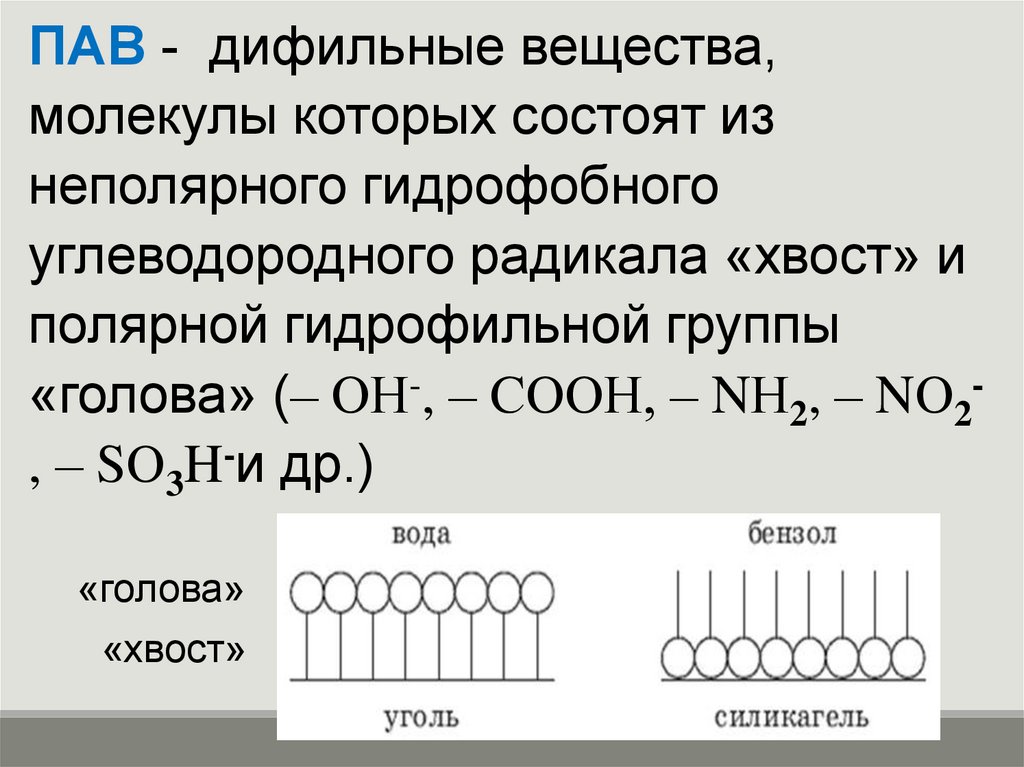
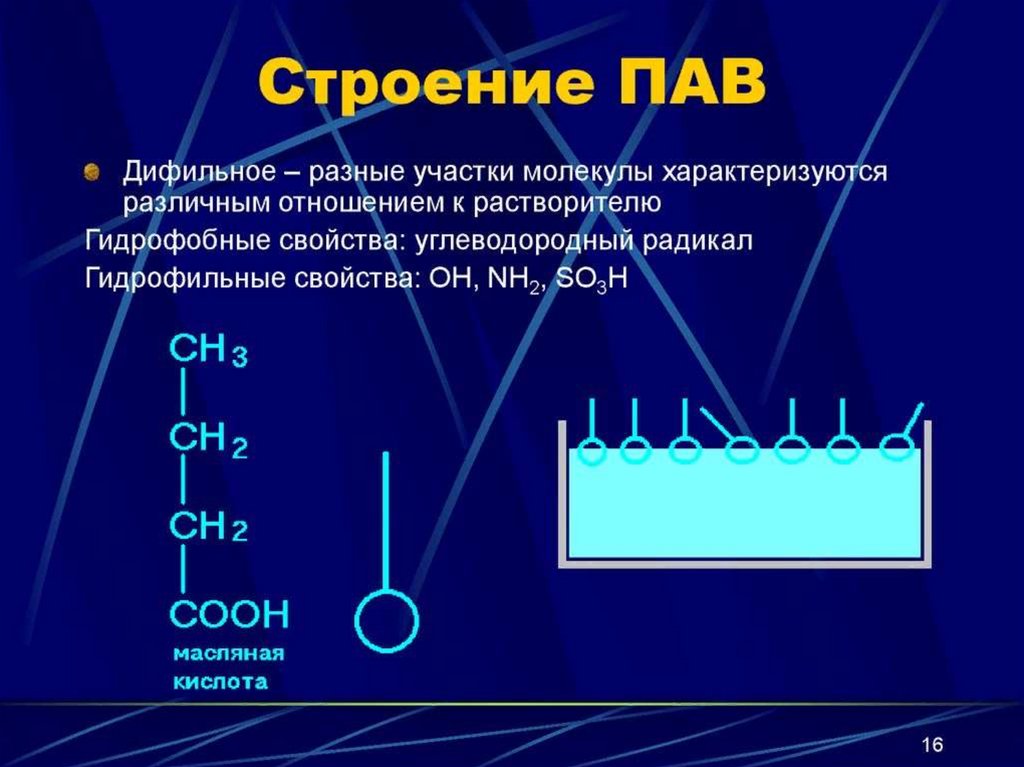
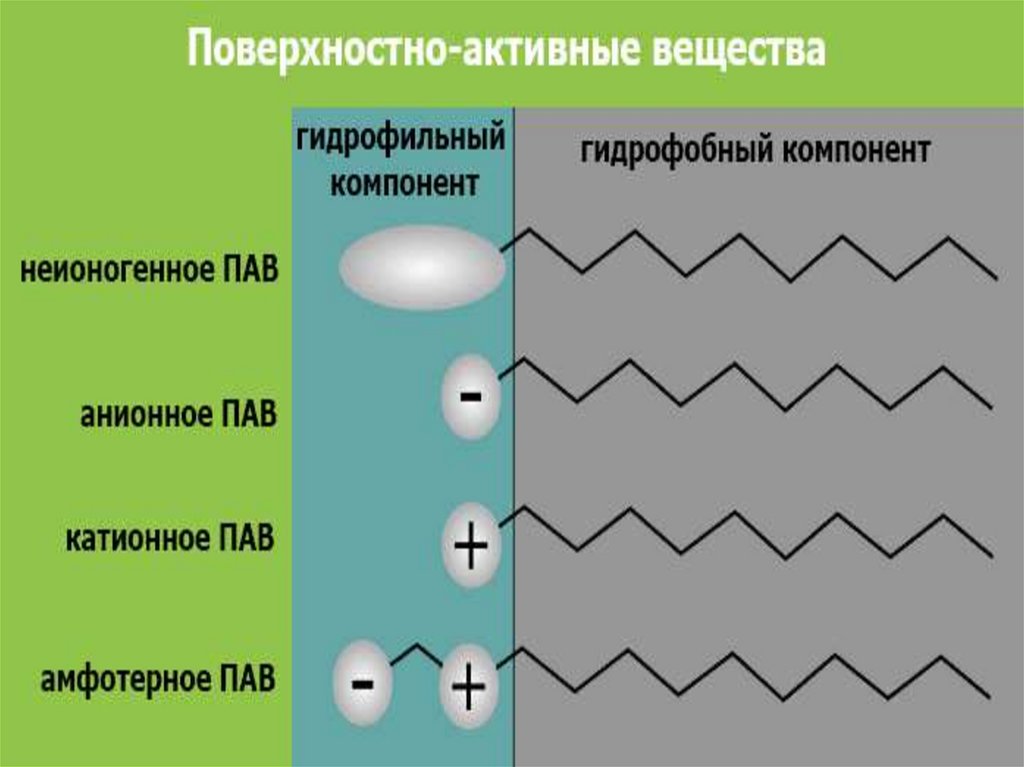
11.
ПАВ - дифильные вещества,молекулы которых состоят из
неполярного гидрофобного
углеводородного радикала «хвост» и
полярной гидрофильной группы
«голова» (– ОН-, – СООН, – NН2, – NО2, – SО3H-и др.)
«голова»
«хвост»
12.
13.
14.
15.
Правило Дюкло – Траубе:△ поверхностная активность
веществ одного и того же
гомологического ряда при
увеличении углеводородной
цепи на группу –СН2–
возрастает в 3,2 раза;
△ увеличением растворимости
вещества
16.
17.
II. Адсорбция неэлектролитов(адсорбируются молекулы) – молекулярная
адсорбция. Зависит от:
● природы растворителя - чем лучше среда
растворяет адсорбтив , тем слабее
адсорбция;
● степени дисперсности адсорбента: чем
выше дисперсность, тем больше удельная
поверхность, тем сильнее адсорбция;
● концентрации адсорбтива в растворе;
● температуры: с повышением
температуры адсорбция уменьшается;
● природы адсорбента и адсорбтива
18.
Адсорбция из растворов сильныхэлектролитов - ионная адсорбция
Характеризуется:
● высокой избирательностью - на твёрдом
адсорбенте преимущественно
адсорбируются ионы , входящие в
состав адсорбента , или имеющие общую
с адсорбентом группу;
● многозарядные ионы адсорбируются
сильнее однозарядных;
● при одинаковых зарядах легче
адсорбируются ионы с большим радиусом
19.
Ионообменная адсорбция - процесс, вкотором адсорбент и раствор обмениваются
между собой в эквивалентных количествах
одноименно заряженными ионами.
Иониты - вещества, замещающие ионы на
одноимённо заряженные. Различают:
● Катиониты - замещаются катионы
● Аниониты - замещаются анионы
Применение медицине: при
консервировании крови (удаление ионов
Са2+); беззондовой диагностике кислотности
желудочного, кишечного сока; детоксикации
организма
20.
III. Биологическая мембрана –жидкостно мозаичная модель:
бислой фосфолипидов, в
отдельных местах насквозь
пронизан молекулами белков
(интегральные белки) - поры,
через которые проходят
водорастворимые вещества
21.
22.
Биологическая роль адсорбции● усвоение вещества в организме
начинается с адсорбции;
● при катализе субстрат адсорбируется
на поверхности фермента;
● адсорбционная терапия для удаления
токсинов из пищеварительного тракта
(энтеросорбция), из крови
(гемосорбция);
● взаимодействие лекарственных
препаратов с рецепторами биомембран;
● Хроматография
23.
IV. Дисперсные системы гетерогенная системы, вкоторых одно вещество в
раздробленном (дисперсном)
состоянии - дисперсная фаза
(ДФ) равномерно распределено
в массе (обьеме) другого
вещества - дисперсионная
среда (ДС)
24.
Классификация:По агрегатному состоянию ДС
● аэрозоли - газообразная (дым, смог,
туман);
● лиозоли - жидкая (пены, эмульсии
(молоко), суспензии);
● солидозоли - твердая (пемза, сплавы).
По размеру частиц ДФ:
● истинные растворы;
● грубодисперсные системы;
● коллоидные растворы
25.
Истинные растворы (ионномолекулярные системы)а < 10 -9 м
● устойчивы,
● прозрачны,
● фильтруются,
● пропускают свет,
● не видимы в ультрамикроскоп
26.
Грубодисперсные системыА > 10 -7 м
● неустойчивы,
● непрозрачны,
● не проходят через бумажный
фильтр,
● рассеивают и отражают свет,
- видимы в обычный микроскоп
27.
Коллоидные растворы-9
-7
а = 10 - 10 м
● относительно устойчивы,
● прозрачны,
● фильтруются,
● рассеивают свет (конус
Тиндаля),
● видимы в ультрамикроскоп
28.
Гидрофильные коллоиды структурная единица ДФ молекула ВМС (однородные,гомогенные).
Гидрофобные коллоиды структурная единица ДФ мицелла - состоит из
● агрегата,
● потенциалопределяющих ионов,
● противоионов
29.
Агрегат электронейтраленадсорбирует на поверхности ионы из
раствора - потенциалопределяющие
ионы, по правилу Фаянса – Панета –
Пескова: ионы, которые:
● входят в состав агрегата;
● должны быть в реакции в избытке;
● способны достраивать
кристаллическую решетку агрегата;
● образуют малорастворимое
соединение с ионами агрегата
30.
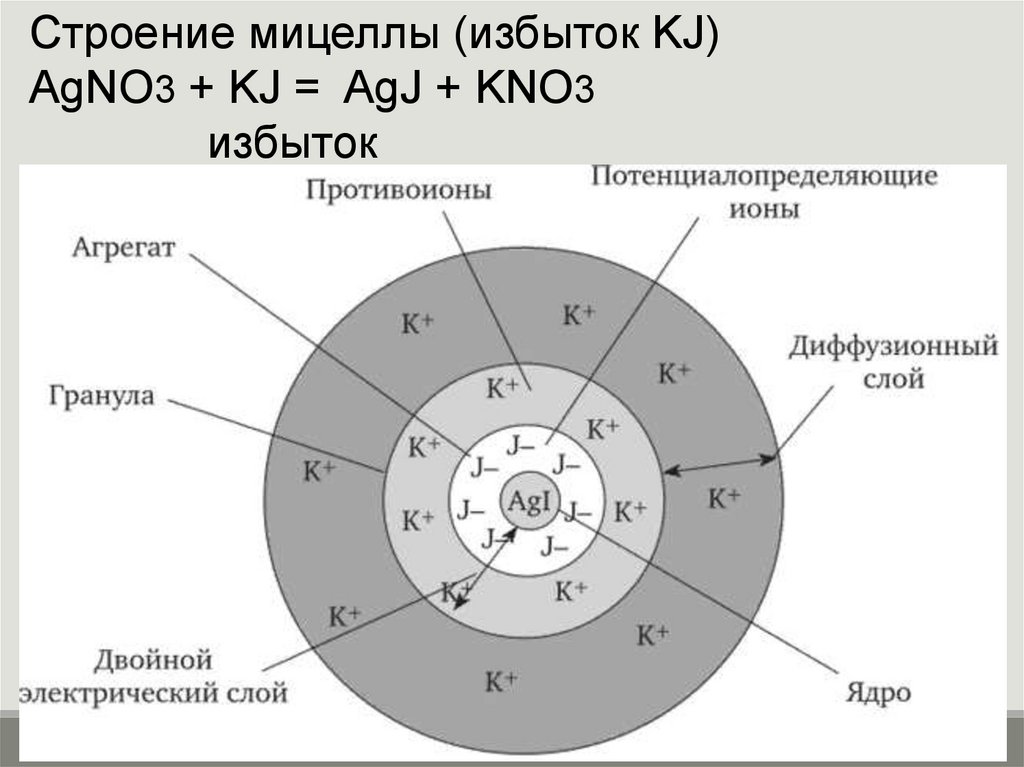
Строение мицеллы (избыток KJ)АgNO3 + KJ = AgJ + KNO3
избыток
31.
Строение мицеллы (избыток АgNO3)где m - количество молекул (атомов), образующих
агрегат; n - число потенциалопределяющих ионов;
(n – x) - число противоионов адсорбционного слоя;
x – число противоионов в диффузной части двойного
электрического слоя;
– заряд коллоидной частицы (гранулы)
32.
Строение мицеллы золяВаСl2 + Na2SO4 = BaSO4 + 2NaCl
избыток
33.
Методы получения коллоидовДиспергационные - измельчение крупных
частиц (размол, набухание,
диспергирование ультразвуком и
электрическим током). Пептизация –
расщепление агрегатов на частицы под
влиянием пептизаторов.
Конденсационные - укрупнение частиц
(замена растворителя, конденсация из
паров, химическая конденсация - реакции
ионного обмена, окислительновосстановительные, гидролиза)
34.
Пептизация - электролиты,адсорбируясь на
поверхности коллоидных
частиц, способствуют
растворению осадка с
образованием золя
35.
Коллоидные растворы неустойчивые системы, вследствиебольшой межфазной поверхности.
Устойчивость дисперсных систем
способность сохранять свое
состояние и свойства неизменными
с течением времени.
Виды устойчивости:
● кинетическая (седиментационная)
● агрегативная
36.
Кинетическая (седиментационная) способность частиц ДФ оставаться вовзвешенном состоянии за счет броуновского
движения, энергии теплового движения,
диффузии.
Агрегативная - способность сохранять
степень дисперсности, противостоять
агрегации частиц ДФ. При нарушении частицы ДФ образуют агрегаты, достигающие
размеров, при которых сила тяжести
превышает энергию теплового движения. ДФ
оседает или всплывает в зависимости от
соотношения плотностей ДФ и ДС
37.
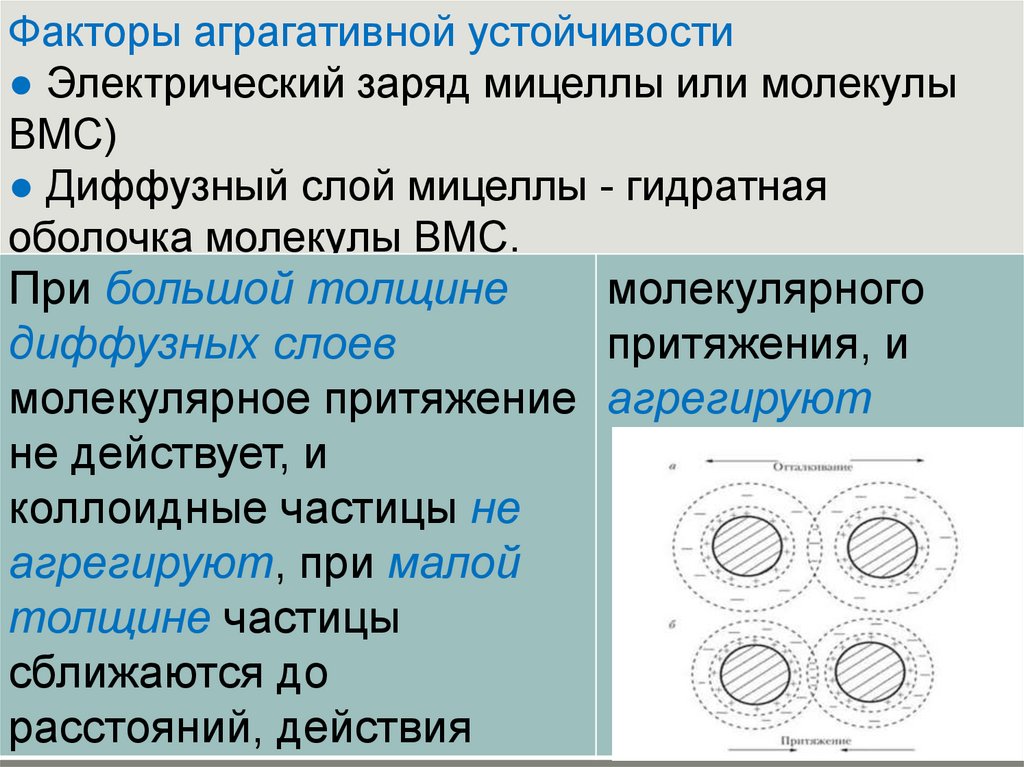
Факторы аграгативной устойчивости● Электрический заряд мицеллы или молекулы
ВМС)
● Диффузный слой мицеллы - гидратная
оболочка молекулы ВМС.
При большой толщине
молекулярного
диффузных слоев
притяжения, и
молекулярное притяжение агрегируют
не действует, и
коллоидные частицы не
агрегируют, при малой
толщине частицы
сближаются до
расстояний, действия
38.
Коагуляция (от лат. "coagulatio" свертывание, сгущение) следствиеагрегации коллоидных частиц.
Факторы, взывающие коагуляцию:
● концентрирование дисперсной
фазы,
● диализ,
● механическое воздействие,
● изменение температуры,
● различные виды излучения,
● добавление электролитов
39.
Порог коагуляции - количественнаяоценка зависимости коагуляции от
электролита: минимальное
количество электролита,
добавление которого к
коллоидному раствору, вызывает
явную коагуляцию - помутнение
раствора или изменение его
окраски
40.
Правило Шульце-Гарди:● коагуляцию коллоидных растворов
вызывают ионы, имеющие знак заряда,
противоположный заряду гранул;
● коагулирующее действие ионов тем
сильнее, чем выше заряд иона –
коагулянта;
● соотношение коагулирующей
способности различно заряженных
ионов однозарядные: двухзарядные:
трехзарядные = 1 : 26 : 36
41.
42.
43.
44.
45.
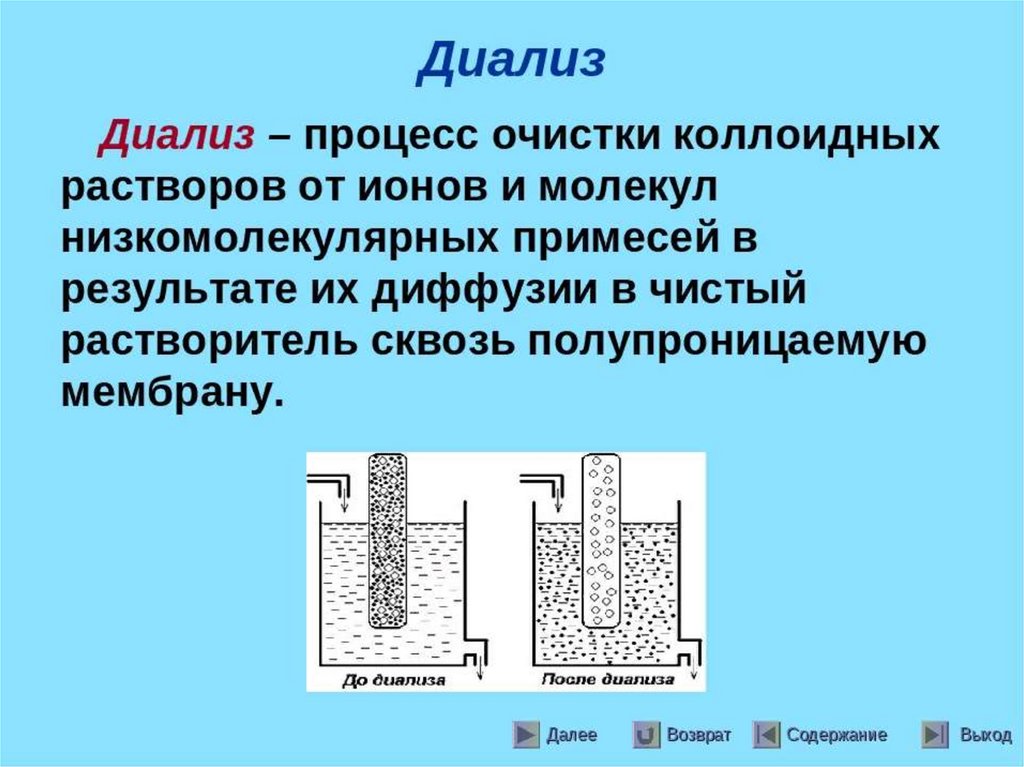
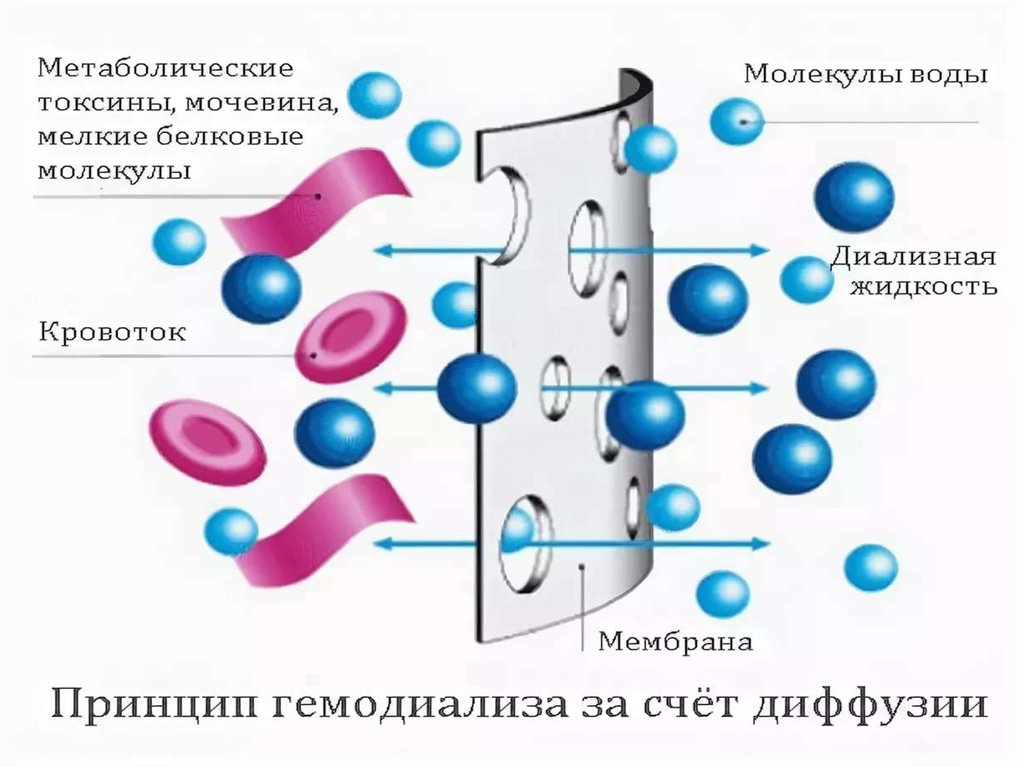
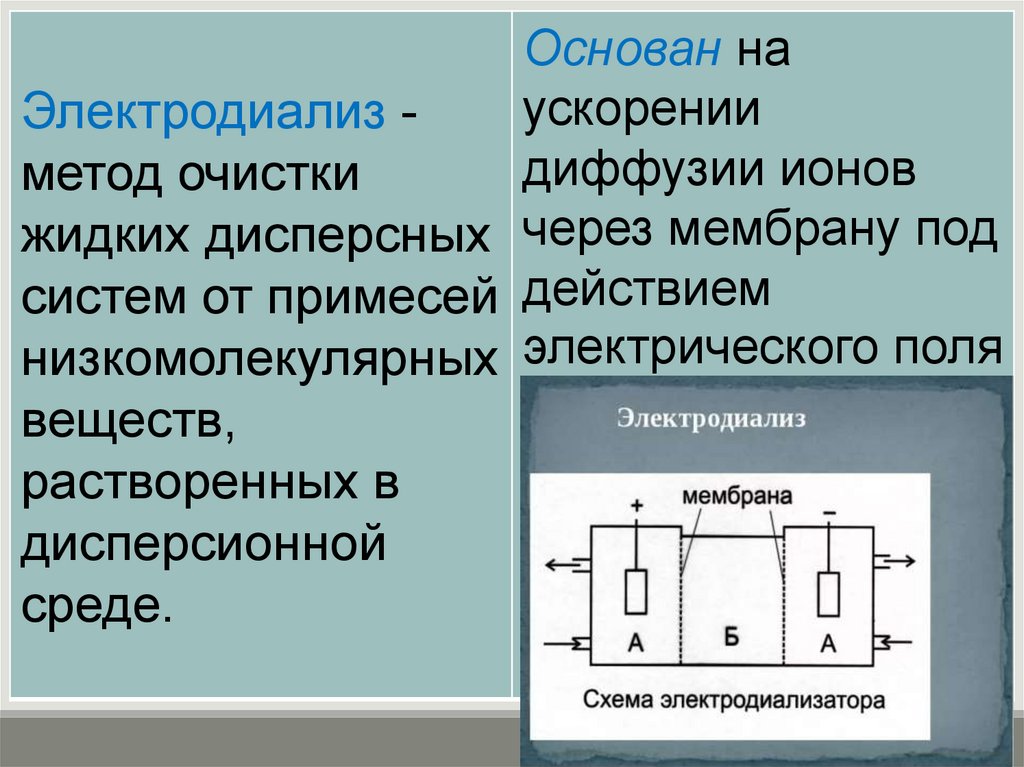
Основан наускорении
Электродиализ диффузии ионов
метод очистки
жидких дисперсных через мембрану под
систем от примесей действием
низкомолекулярных электрического поля
веществ,
растворенных в
дисперсионной
среде.
46.
БЛАГОДАРЮЗА ВНИМАНИЕ!





































 Химия
Химия