Похожие презентации:
Соединения щелочных металлов
1.
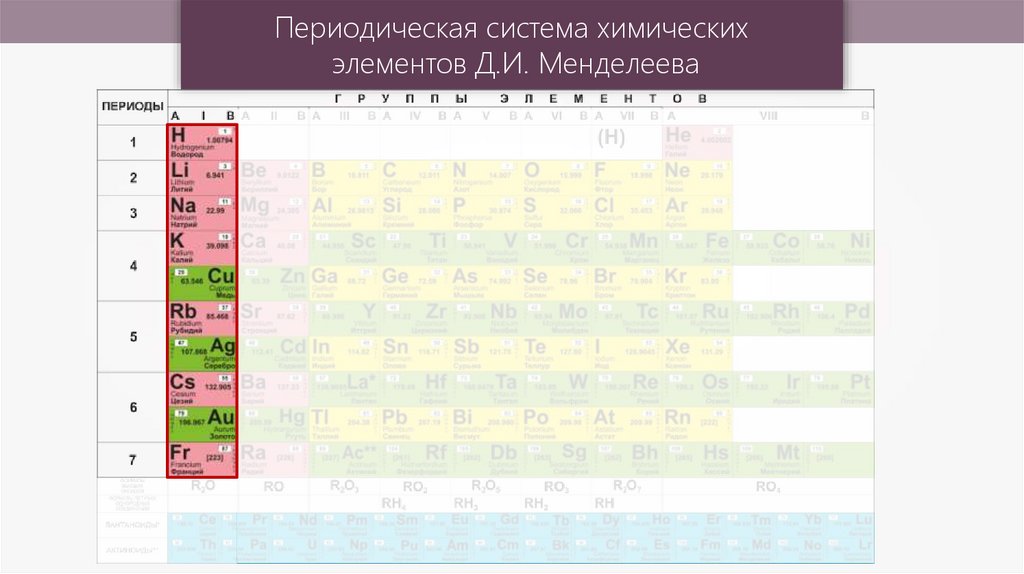
Периодическая система химическихэлементов Д.И. Менделеева
2. Тест по теме «Щелочные металлы»
1. К щелочным металлам не относится:а) рубидий;
б) цезий
в) калий;
г) медь.
2. Электронная формула 1s2 2s2 2p6 3s2 3p6 4s1 соответствует элементу:
а) литию; б) натрию
в) калию; г) меди
3. Радиус атома у элементов I группы главной подгруппы с увеличением заряда ядра:
а) изменяется периодически;
в) не изменяется;
б) увеличивается;
г) уменьшается.
4. Щелочные металлы проявляют очень сильные:
а) окислительные свойства;
в) восстановительные свойства;
б) амфотерные свойства;
г) нейтральные свойства.
5. Во всех своих соединениях щелочные металлы проявляют степень окисления:
а) +1;
б) +3;
в) +2; г) +4.
6. К физическим свойствам щелочных металлов не относится:
а) серебристо-белые;
в) хорошие электропроводники;
б) мягкие и легкие;
г) тугоплавкие.
7. При взаимодействии элементов I группы главной подгруппы с водой образуется:
а) кислота;
в) оксид и выделяется водород;
б) щелочь и выделяется водород;
г) соль .
8. При взаимодействии кислорода со щелочными металлами пероксид образуется только с:
а) литием;
в) цезием
б) натрием;
г) рубидием.
9. Натрий и калий хранят в керосине, потому что они:
а) имеют резкий запах;
в) легко окисляются на воздухе;
б) очень легкие;
г) сильные окислители
3. ПРОВЕРИМ ТЕСТ
Ответы:1- г
2-в
3-б
4-в
5-а
6-г
7-б
8-б
9-в
Самоконтроль:
• нет ошибок – «5»,
• 1,2 ошибки – «4»,
• 3,4 ошибки – «3»,
• более – «2»
4.
5.
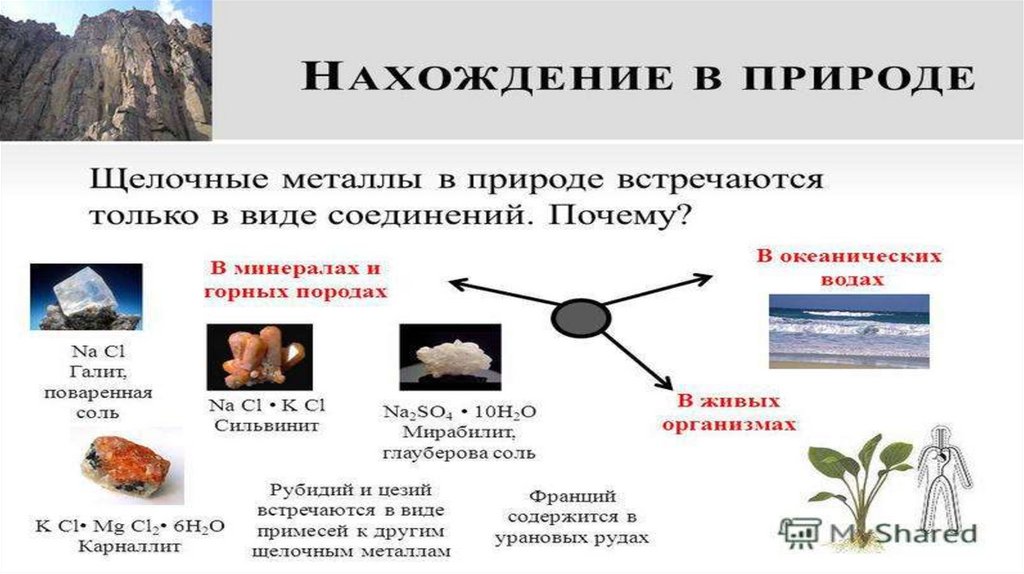
Соединения щелочных металловГалит
Сильвинит
6. «Соединения щелочных металлов»
оксидыГидроксиды
соли
7.
Общая формула оксидовщелочных металлов:
Оксиды ЩМ – твердые
вещества белого цвета,
хорошо растворимые в воде.
Как основные оксиды
реагируют с водой,
кислотными оксидами,
кислотами, амфотерными
оксидами и гидроксидами
М2O
основный
8.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВЗакончите уравнения реакций
Na2O + H2O →
Na2O + CO2 →
Na2O + H2SO4 →
Na2O + ZnO →
9.
Общая формула гидроксидовщелочных металлов:
МOH
Твердые белые вещества, хорошо растворимые в воде. Процесс
растворения сопровождается выделением достаточного количества
теплоты. Это- щелочи.
10.
Щелочи – хорошо растворимые основанияГидроксид натрия
11. Химические свойства щелочей. Щелочи взаимодействуют с кислотными оксидами, кислотами, солями, амфотерными оксидами и
гидроксидамиЗапишите уравнения реакций
КОН + CO2→
КОН+ H2SO4 →
КОН + FeCl3→
КОН + Al(OH)3→
12. Щелочи и их применение. Запишите техническое название щелочи и ее применение
Формуласоединения
Название
систематическое
NaOH
Гидроксид натрия
KOH
Гидроксид калия
Применение
техническое
13. КОН
Гидроксид калия (едкий кали)Применяют при производстве жидкого мыла
14.
NaOHЕдкий натр применяется в огромном множестве отраслей промышленности
и для бытовых нужд:
Каустик применяется в целлюлозно-бумажной промышленности.
В производстве бумаги, картона, искусственных волокон, древесно-волоконных плит
15.
Для омыления жиров при производстве мыла, шампуня и другихмоющих средств
16.
В качестве агента для растворения засоров канализационныхтруб в виде сухих гранул или в составе гелей. Гидроксид натрия
дезагрегирует засор и способствует лёгкому продвижению его
далее по трубе.
17. Применение
Формуласоединения
NaOH
KOH
Название
систематическое
Применение
техническое
Гидроксид натрия Едкий натр,
каустическа
я сода,
каустик
Гидроксид калия Едкое кали
Очистка
нефтепродуктов,
бумажная
и
текстильная
промышленность, производство
мыла и волокон
Производство жидкого мыла
18. Соли щелочных металлов и их применение Запишите техническое название соли и ее применение
Формуласоединения
NaHCO3
NaCl
Na2CO3 * 10H2O
K2CO3
Na2SO4 * 10H2O
Название
систематическое
Гидрокарбонат натрия
Хлорид натрия
Кристаллогидрат карбоната
натрия
Карбонат калия
Кристаллогидрат сульфата
натрия
Применение
техническое
19.
хлоридыNaCl
Хлорид натрия – поваренная соль
Древнегреческий поэт Гомер, назвал поваренную соль «божественной». В те далекие времена она
ценилась выше золота. Из-за месторождений соли происходили военные столкновения, а нехватка
соли у населения вызывала «соляные бунты»
Поваренную соль применяют при производство химических веществ:
соляной кислоты, гидроксида натрия
хлора, соды, для консервирования,
приправа к пище, производство мыла, в медицине
20. Соли щелочных металлов и их применение
Формуласоединения
NaHCO3
NaCl
Na2CO3 * 10H2O
K2CO3
Na2SO4 * 10H2O
Название
систематическое
Применение
техническое
Гидрокарбонат натрия
Пищевая сода
Пищевая промышленность, медицина
Хлорид натрия
Поваренная соль
Кристаллогидрат карбоната
натрия
Карбонат калия
Кристаллическая
сода
Поташ
Производство
соляной
кислоты,
мыла,
гидроксида натрия, хлора, натрия, соды. Для
консервирования, приправа к пище
Производство стекла, бумаги, мыла
Кристаллогидрат сульфата
натрия
Глауберова соль
Производство жидкого мыла,
стекла, удобрение
Производство соды, стекла,
средство
тугоплавкого
слабительное
21.
Соли щелочных металловХлорид натрия
22. Задача:
Когда человека мучает изжога, он пользуется раствором питьевой соды.Вычислить массу соды, требуемой для нейтрализации 1,02г соляной кислоты,
вызвавшей повышенную кислотность желудка.
Ответ: 2,34г
Дано:
m (HCl) = 1,02г
Найти:
m(NaHCO3) = ?г
Решение:
NaHCO3 + HCl → NaCl + H2O+ CO2
n(HCl)=m/M =1,02/ 36,5=0,02795 моль
n(NaHCO3) = 0,02795 моль
m(NaHCO3) = 0,02795 моль* 84 = 2,3478г
23. Выполните задание
Na→Na2O2 → Na2O→X→Na2СO3↓
↓
NaOH
NaCl
24.
Na→ Na2O2 →Na2O→ NaOH→Na2CO3→NaCl↓
NaOH
2Na + 2H2O = 2NaOH+ Н2
2Na + O2 = Na2O2
2Na + Na2O2 = 2Na2O
Na2O + H2O = 2NaOH
CO2 + 2NaOH = Na2CO3 + Н2О
Na2CO3 + 2HCl = 2NaCl + Н2О + CO2
25.
26.
27. ДОМАШНЕЕ ЗАДАНИЕ
• Параграф14 упр. 1,5


























 Химия
Химия








