Похожие презентации:
Щелочные металлы и их соединения. 9 класс
1. 9 класс
ЩЕЛОЧНЫЕМЕТАЛЛЫ
И ИХ
СОЕДИНЕНИЯ
2. ДЕВИЗ
«Никакоеусвоение,
воспроизведение
и применение
знаний без
запоминания
невозможно!»
3.
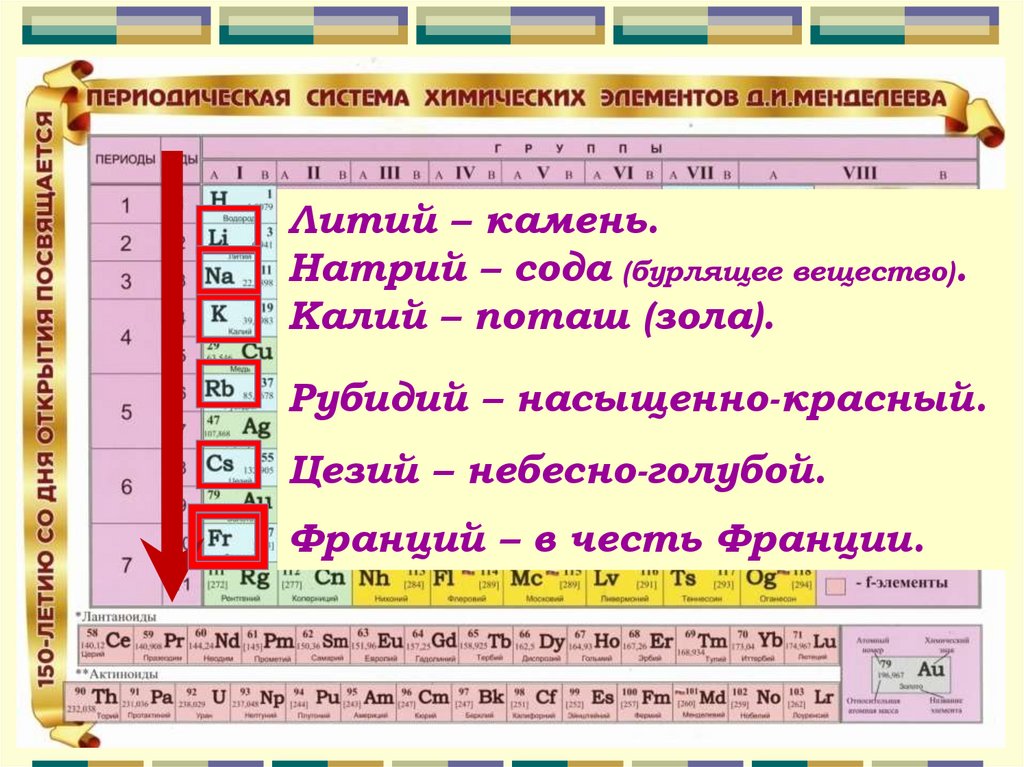
Литий – камень.Натрий – сода (бурлящее вещество).
Калий – поташ (зола).
Рубидий – насыщенно-красный.
Цезий – небесно-голубой.
Франций – в честь Франции.
4.
ЩЕЛОЧНЫЕ МЕТАЛЛЫэто металлические элементы I-А
группы (I группы, главной подгруппы):
Li (литий), Na (натрий), K (калий), Rb
(рубидий), Cs (цезий), Fr (франций).
как простые вещества – это очень
активные металлы.
свое название они получили в
следствие того, что при
взаимодействии с водой сами металлы,
их оксиды, пероксиды и гидриды
образуют сильные основания – щёлочи.
наибольшее значение имеют натрий
и калий.
5.
КРАТКАЯ ИСТОРИЧЕСКАЯ СПРАВКАНатрий и калий были
открыты английским
учёным (физик, химик,
агрохимик, изобретатель,
один из основателей
электрохимии) Гемфри
Дэви в октябре 1807 года
путём электролиза.
Гемфри Дэви называл:
натрий – Sodium
калий – Potassium
6.
НАТРИЙ И КАЛИЙ В ПРИРОДЕИз-за высокой активности в природе
встречаются только в виде соединений.
Натрий
Калий
NaCl галит, поваренная
KCl сильвин
или каменная соль
NaCl ∙KCl сильвинит
NaCl ∙KCl сильвинит
KCl ∙MgCl2 ∙6H2O
Na2SO4 ∙10H2O мирабилит
карналлит
или глауберова соль
K2O ∙Al2O3∙6SiO2
ортоклаз или
полевой шпат
7.
NaK
8.
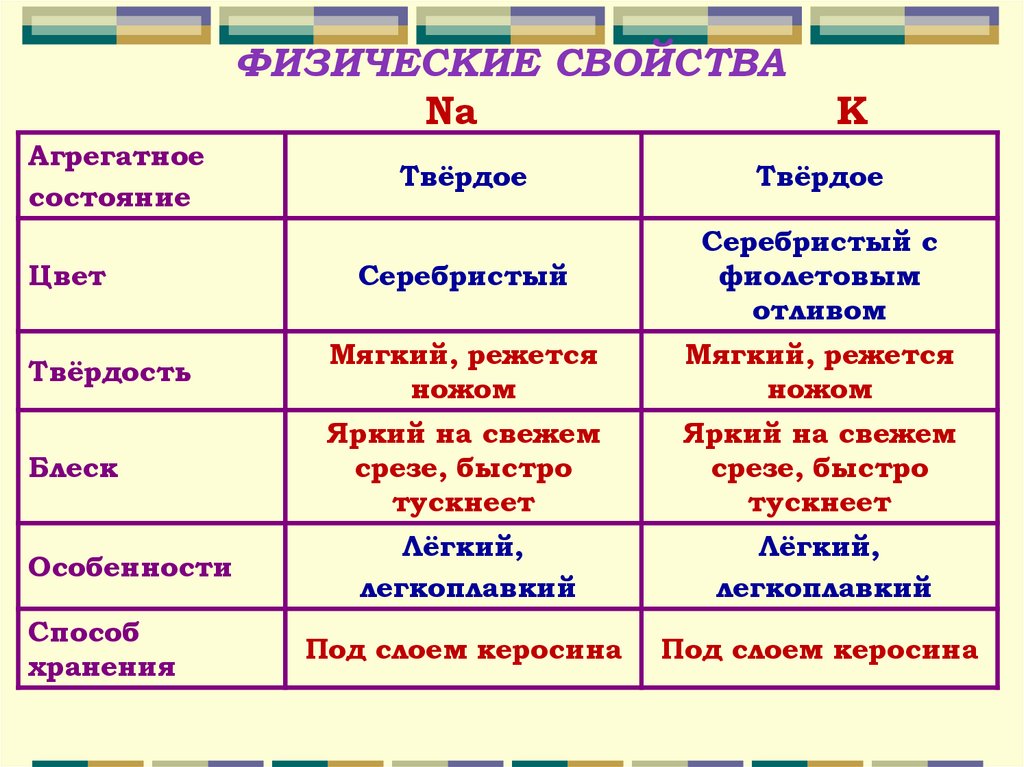
ФИЗИЧЕСКИЕ СВОЙСТВАNa
Агрегатное
состояние
K
Твёрдое
Твёрдое
Серебристый
Серебристый с
фиолетовым
отливом
Твёрдость
Мягкий, режется
ножом
Мягкий, режется
ножом
Блеск
Яркий на свежем
срезе, быстро
тускнеет
Яркий на свежем
срезе, быстро
тускнеет
Лёгкий,
легкоплавкий
Лёгкий,
легкоплавкий
Под слоем керосина
Под слоем керосина
Цвет
Особенности
Способ
хранения
9.
ХИМИЧЕСКИЕ СВОЙСТВАNa – натрий
K – калий
2Na + O2 → Na2O2
К + O2 → КO2
Оксид натрия получают
при сплавлении по
реакции:
Na2O2 + 2Na → 2Na2O
Также образуется
2К + O2 → К2O2
2Na + Сl2 → 2NaCl
2К + Сl2 → 2КCl
2Na + S → Na2S
2К + S → К2S
2Na + Н2 → 2NaH
2К + Н2 → 2КH
2Na+ 2H2O → 2NaOH + H2↑
2К + 2H2O → 2КOH + H2↑
пероксид натрия
надпероксид калия
пероксид калия
10.
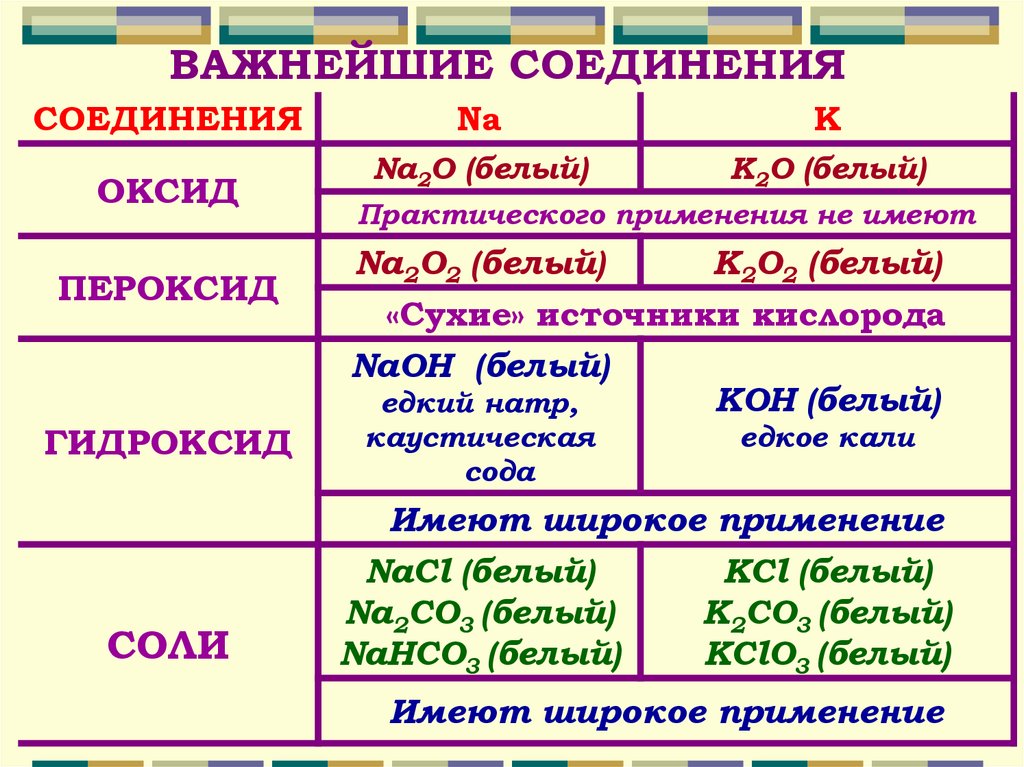
ВАЖНЕЙШИЕ СОЕДИНЕНИЯСОЕДИНЕНИЯ
ОКСИД
ПЕРОКСИД
ГИДРОКСИД
СОЛИ
Na
K
Na2O (белый)
K2O (белый)
Практического применения не имеют
Na2O2 (белый)
К2O2 (белый)
«Сухие» источники кислорода
NaOH (белый)
KOH (белый)
едкий натр,
каустическая
сода
едкое кали
Имеют широкое применение
NaCl (белый)
KCl (белый)
Na2CO3 (белый)
K2CO3 (белый)
NaНСO3 (белый)
KClO3 (белый)
Имеют широкое применение
11.
СОЕДИНЕНИЯ НАТРИЯ В БЫТУПИЩЕВАЯ СОЛЬ
NaCl
СОДА
СОДА
ПИЩЕВАЯ ТЕХНИЧЕСКАЯ
NaHCO3
Na2CO3
СОДА КАУСТИЧЕСКАЯ
или ЕДКИЙ НАТР
NaOH
12. 9 класс
ЩЕЛОЧНЫЕМЕТАЛЛЫ
И ИХ
СОЕДИНЕНИЯ









 Химия
Химия








