Похожие презентации:
Витамины. Наука о витаминах (витаминология)
1. ВИТАМИНЫ
2.
Наука о витаминах (витаминология) как самостоятельнаянаука выделилась сравнительно недавно. Еще 150 лет назад
люди думали, что нормальное развитие организма
поддерживается употреблением в пищу только белков,
жиров и углеводов
Русский ученый Лунин (1880 г) развил учение о витаминах (новая
веха в «питании»). Он ставил опыты на мышах, добиваясь обратимых
симптомов дефицита . Его труды были забыты.
Спустя 22 года (1912 год) Ф. Гопкинс повторил опыты Лунина, за
что получил Нобелевскую премию.
1912 год - польский ученый Функ из оболочек риса выделил
органическое вещество, содержащее аминогруппу (витамины-амины
жизни).
1922 год-Зелинский доказал наличие связи витаминов с АЦ
ферментов (коферментная функция).
3.
• ВИТАМИНЫ – природные органические соединениянеобходимые
в
небольших
количествах
для
жизнедеятельности организма, но не синтезирующиеся в нём
или образующиеся в недостаточных количествах. Они
являются
незаменимыми пищевыми факторами В
организме витамины, как правило, модифицируются
в
биологически
активные
соединения
(коферменты,
простетические группы, гормоны) или непосредственно
участвуют в регуляции химических процессов. Необходимо
регулярное поступление витаминов с пищей.
Недостаточность витамина в организме (гипо-) или его
отсутствие (авитаминоз) приводит к патологии. Если
авитаминоз не лечить он может закончиться фатально.
Гипервитаминоз также может привести к патологии.
4.
ВИТАМИНЫ относят к разным группам химическихсоединений, и их изначально классифицировали по
способности растворяться в растворителях. По этому
признаку
их
разделили
на
две
группы,
водорастворимые и жирорастворимые витамины.
Водорастворимые
витамины
хорошо
растворяется в воде. В большинстве своем они не
аккумулируются в организме и при избыточном их
поступлении выводятся с мочой.
Жирорастворимые
витамины
хорошо
растворяются
в
неполярных
растворителях,
триацилглицеролах и практически не растворимы в
воде, некоторые из них способны аккумулироваться
в организме.
5.
ВИТАМИНЫ СИНТЕЗИРУЮТСЯ:-зелеными растениями;
-микроорганизмами ( в ЖКТ);
ОБЩИЕ ЧЕРТЫ :
• они могут синтезируются в организме только
некотырые и только в небольшом количестве
• не накапливаются?! Некоторые
накапливаются
• не являются источниками энергии
• не включаются в структуру тканей.
6. Классификация
• Водорастворимые витамины группы В (В1,В2, В3, В5, В6, Н, Вс, В12, В15), С и Р
• Жирорастворимые витамины (А,Д,Е,К)
• Витаминоподобные соединения (убихинон,
ПААБК,липоевая кислота,карнитин и др.)
7.
Классификация витаминов:Водорастворимые витамины:
-витамин В 1 ( тиамин);
-витамин В2 ( рибофлавин);
-витамин В5 (пантотеновая кислота)
-витамин В3 (РР ,никотинамид, ниацин);
-витамин В6 ( пиридоксин);
-витамин Н (биотин);
-витамин В12 (коболамин)
-витамин С (аскорбиновая кислота)
-витамин Вс (фолиевая кислота)
-витамин Р (биофлавоноиды, рутин)
8.
Жирорастворимые витамины:-витамин А( ретинол);
-витамин D(кальциферолы);
-витамин Е( токоферол);
-витамин К( нафтохиноны);
Витаминоподобные вещества:
-холин;
-инозит;
-пирролохинолинохинон (хинопротеины)
-витамин В15 (пангамовая кислота) ;
-липоевая к-та;
-ПАБК;
-витамин F (линолевая, линоленовая, арахидоновая кислоты);
-убихинон (коэнзим Q);
-карнитин;
-коэнзим А.
9.
АнтивитаминыСТРУКТУРНЫЕ АНАЛОГИ ВИТАМИНОВ
-аналоги ПАБК - сульфаниламиды
-дикумарин, салициловая кислота, варфарин (антивитамины К);
-циклосерин (антивитамин В6);
-изониазид (антивитамин В6, РР);
-акрихин (антивитамин В2).
ВЫЗЫВАЮЩИЕ СТРУКТУРНУЮ МОДИФИКАЦИЮ ВИТАМИНОВ,
НАРУШАЮЩИЕ ВСАСЫВАНИЕ ИЛИ ТРАНСПОРТ
-тиаминазы I, II (распад В1);
-аскорбатооксидаза (распад С);
-авидин (связывание биотина)
10.
• АВИТАМИНОЗ- СОСТОЯНИЕ, ВОЗНИКАЮЩЕЕ ПРИПОЛНОМ ОТСУТСТВИИ В ПИЩЕ ИЛИ ПОЛНОЕ НАРУШЕНИЕ
УСВОЕНИЯ КАКОГО-ЛИБО ВИТАМИНА
• ГИПОВИТАМИНОЗ- СОСТОЯНИЕ, ВОЗНИКАЮЩЕЕ
ПРИ ПОНИЖЕННОМ СОДЕРЖАНИИ ИЛИ НЕПОЛНОМ
УСВОЕНИИ ВИТАМИНОВ ( ВСТРЕЧАЕТСЯ ЧАЩЕ).
• ГИПЕРВИТАМИНОЗ- СОСТОЯНИЕ, ВОЗНИКАЮЩЕЕ
ПРИ ПОСТУПЛЕНИИ ЧРЕЗМЕРНЫХ КОЛИЧЕСТВ ВИТАМИНОВ
11. Гиповитаминоз-недостаточное содержание витаминов в организме
Причины развития:Эндогенные:
Физиологические(беременность, период
лактации, интенсивная физическая нагрузка,
период роста)
Патологические
• нарушение превращения вит. в активную форму
или кофактор при поражении печени)
• использование антибактериальных средств
• дисбактериоз
• нарушение всасывания витаминов из кишечника
12.
• генетические нарушения в структуре ферментов• нарушения структуры транспортных белков
• период реконвалесценции
Экзогенные причины
• низкое содержание витаминов в пище
• нерациональное питание
• неправильное хранение и
неправильная кулинарная обработка продуктов
13.
Кофакторы:Кофермент
• не прочно связан с белковой частью фермента –
апоферментом
• участвует в формировании активного центра
• химически изменяется, а затем снова
высвобождается и подвергается регенерации в
последующей независимой реакции.
Простетическая группа
• прочно связана с апоферментом и во время
реакции комплекс не распадается.
14. Классификация коферментов по принадлежности к классу ферментов :
1. Коферменты оксидоредуктаз –никотинамидные, флавиновые, липоевая
кислота, убихинон и др.
2. Коферменты трансфераз – пантотеновые,
фолиевые, пиридоксиновые, кобамидные
15. Классификация коферментов по биологическим функциям :
• Коферменты, участвующие в переносеатомов водорода – НАД, НАДФ, ФМН,
ФАД, липоевая кислота
• Коферменты, участвующие в переносе
других групп – фолиевые, пантотеновые,
тиаминовые, пиридоксиновые, кобамидные,
биотиновые
16. ПОСТУПАЯ В ОРГАНИЗМ:
1. Витамины всасываются при участии белковпереносчиков (активный транспорт, внутреннийфактор Касла, липиды).
2. Транспортируются при участии транспортных
белков (ретинол СБ, хиломикроны).
3. Превращаются в тканях в активные формы
(витамин РР, Н, В2,D).
4. Участвуют в регуляции биохимических
процессов (коферментная функция).
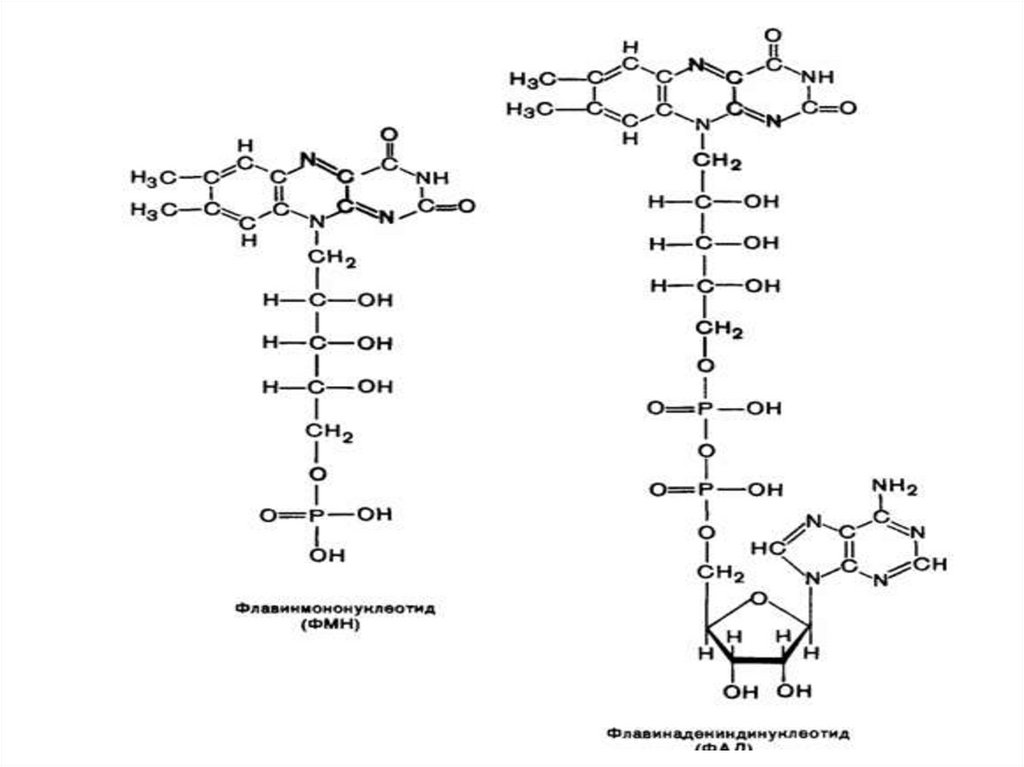
17. Флавиновые коферменты
• Чаще выполняют роль простетической группы,образуются на основе витамина В2 –
рибофлавина
• С продуктами питания рибофлавин поступает
преимущественно в составе ФМН и ФАД
связанных с белком
• После всасывания витамин поступает в печень,
почки, где происходит образование ФМН и ФАД
по схеме:
Рибофлавин +АТФ
ФМН + АДФ
ФМН + АТФ
ФАД + ФФн
18.
19.
В настоящее время известно 45 флавиновыхоксидоредуктаз
Флавиновые оксидоредуктазы:
1. Аэробные дегидрогеназы
2. Анаэробные дегидрогеназы
20. Аэробные дегидрогеназы
Катализируютудаление
водорода из
субстрата и используют в качестве
акцептора
водорода
кислород
и
искусственные акцепторы.
К ним относятся:
оксидазы L-аминокислот,
оксидазы D- аминокислот,
моноаминооксидаза ,
ксантиноксидаза и др.
21. Анаэробные дегидрогеназы
• Фермент НАДН-дегидрогеназа вкачестве кофактора содержит ФМН
НАДН ДГ является 1-м ферментом
дыхательной цепи (компонентом Fцикла)
• К ФАД-содержащим ферментам относится
сукцинатдегидрогеназа. При ее участии
идет 6-я реакция цикла Кребса
22.
• Флавиновые коферменты участвуют в- переносе электронов и протонов в
дыхательной цепи
- окислительном декарбоксилировании
пирувата и α-кетоглутарата
- окислении сукцината, глицерол-3-фосфата,
жирных кислот в митохондриях, окислении
биогенных аминов и других реакциях.
23. Недостаточность рибофлавина Впервые картина авитаминоза В2 получена Н.И.Луниным (1880)
• Недостаточность рибофлавина приводит кснижению содержания его коферментных
форм в тканях, прежде всего ФМН. При этом
уменьшается потребление кислорода тканями,
что лежит в основе генерализованной
клеточной гипоксии.
• Клиническими проявлениями дефицита
витамина В2 является поражение эпителия
слизистых, кожи и роговицы глаза.
Отмечается сухость слизистых губ, полости
рта.
24. Никотинамидные коферменты
• Никотинамидные кофакторы образуются вклетке на основе ниацина (витамин B3, PP,
антипеллагрический). В природе ниацин
встречается в виде никотиновой кислоты и
никотинамида, которые поступают в
организм человека с продуктами питания.
25. Биосинтез НАД из никотинамида происходит в две стадии:
1стадия – протекает в цитоплазме клеток :Никотинамид + Фосфорибозилпирофосфат
Никотинамид-мононуклеотид + H4P2O7
2 стадия – протекает в ядрах, митохондриях
клеток:
Никотинамид-мононуклеотид + АТФ
НАД+ + H4P2O7
26.
• НАДФ образуется из НАД при участии НАДкиназы цитоплазмы по схеме:НАД+ + АТФ = НАДФ+ + АДФ
• Все участие ниацина в регуляции биохимических
процессов осуществляется через НАД и НАДФ.
27. Биологическая роль
• В настоящее время известно более 300реакций, катализируемых при участии НАД
или НАДФ зависимых ферментов.
• Эти ферменты относятся к анаэробным
дегидрогеназам, т.е. не передают атомы
водорода от субстрата на кислород, а
акцептирует их в окислительной цепи
другой фермент
28.
Анаэробные ДГ:• Глицерол-3-фосфат-дегидрогеназа
• Лактатдегидрогеназа
• Глюкозо-6- фосфатдегидрогеназа
Монооксигеназы:
принимают участие, например, в окислении
аминокислот, оксикислот, полиизопреноидных
соединений (сквален-эпоксидаза – фермент синтеза
холестерина), в обезвреживании токсических
соединений и др.
29.
• НАД и НАДФ (НАДН2, НАДФН2) являются коферментамимногих дегидрогеназ, действующих на всех этапах
окисления или синтеза субстратов в клетке:
- окисления углеводов
- жирных кислот, глицерина
- аминокислот
- на этапе превращения субстратов в цикле Кребса
- в монооксигеназных реакциях
- синтезе жирных кислот, холестерина
- стероидных гормонов
- окислении неполярных веществ природного и чужеродного
происхождения
30.
• НАД участвует в качестве субстрата ДНКлигазной реакции. НАД служит источником АДФ• НАД и НАДФ являются также
аллостерическими эффекторами ферментов
энергетического обмена
- НАДH регулирует активность цитратсинтазы
- НАД - кофермент изоцитрат и
малатдегидрогеназы,фосфоэнолпируваткар
боксикиназы, пируваткарбоксилазы.
- НАДH является для этих ферментов
аллостерическим ингибитором, регулирующим
скорость окислительных превращений в цикле
Кребса и интенсивность глюконеогенеза
31. Недостаточность ниацина
- встречается, где продуктами питания являетсякукуруза и недостаточно употребление мяса
и рыбы.
- может быть при использовании препаратов,
обладающих антивитаминным действием – 3пиридинсульфоновой кислоты и 3ацетопиридина.
- приводит к развитию заболевания –
пеллагры:
симметричный дерматит, диарея, деменция
32. Липоевая кислота (витамин N)
• Источником липоевой кислоты являются дрожжи,мясные продукты, молоко.
• Липоевая кислота, поступая в ткани, связывается
ковалентно с NН2-группой лизина активного
центра апоферментов «липоевых» ферментов.
• Липоевая кислота выполняет роль простетической
группы наряду с ТПФ и НS-KoA в сложной
мультиферментной пируват- и α-кетоглутаратдегидрогеназной системах окислительного
декарбоксилирования
33.
• Недостаточность липоевой кислоты.У человека не описана, но как лечебный
препарат липоевую кислоту и липоамид
используют в детской практике при
лечении острого и хронического
гепатитов, легкой форме сахарного
диабета, гипотрофии.
34. Тиаминовые коферменты
• Тиаминовые коферменты образуются наоснове витамина В1
• Источники тиамина – хлеб из муки грубого
помола, зародыши злаковых культур,
пивные дрожжи, горох, фасоль, а также
мясные продукты – печень крупного рогатого
скота, сердце, кроме того, витамин В1 может
синтезироваться микрофлорой кишечника.
• Суточная потребность в тиамине взрослого
человека составляет 1-3 мг.
35.
• С продуктами питания тиамин поступает вформе тиаминпирофосфата – ТПФ
• В пищеварительном тракте он гидролизуется
при участии кишечных пирофосфатаз с
образованием свободного тиамина, который
путем простой диффузии всасывается в
тонком кишечнике
• Всосавшийся витамин с кровью воротной
вены поступает в печень и др.ткани, где
фосфорилируется
36.
• Фосфорилирование тиамина идет вмитохондриях, микросомах, цитозоле
клеток при участии
тиаминпирофосфокиназ:
Тиамин + АТФ
ТПФ+АТФ
ТПФ+АМФ
ТТФ+АДФ
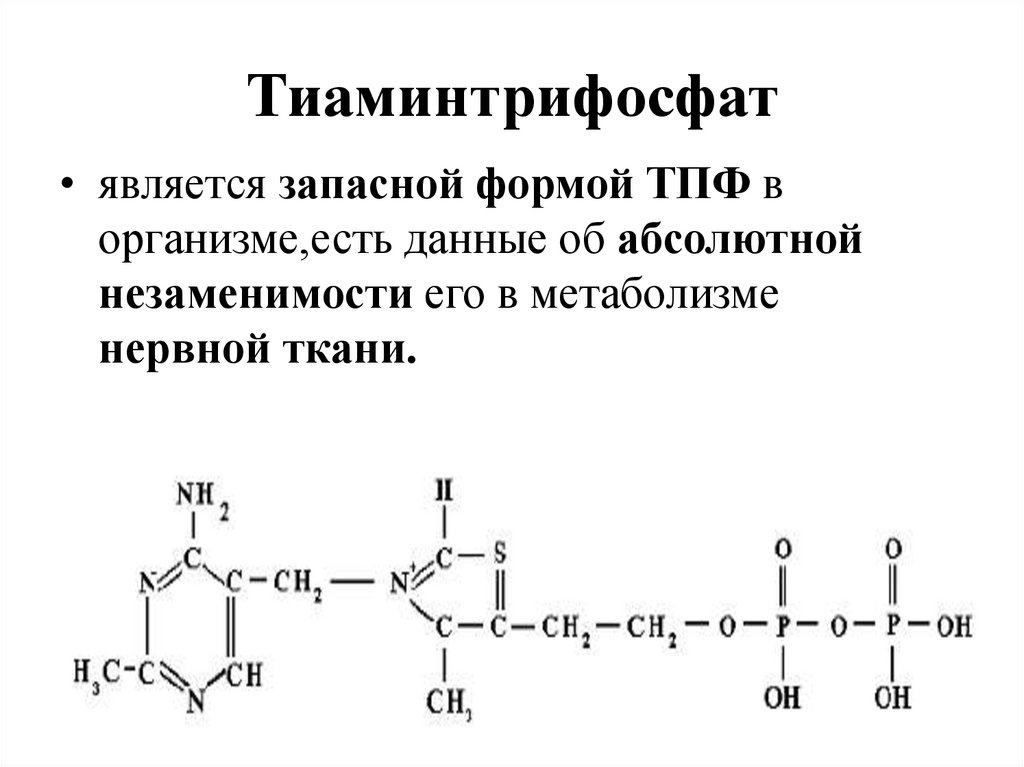
37. Тиаминтрифосфат
• является запасной формой ТПФ ворганизме,есть данные об абсолютной
незаменимости его в метаболизме
нервной ткани.
38.
ТПФ – кофермент 25 ферментов,участвующих в:
• окислительном декарбоксилировании кетокислот в карбоновых кислот
• декарбоксилировании кетокислот с
образованием альдегидов и СO2;
• транскетолазной реакции
неокислительного образования
пентозофосфатов (рибозо-5фосфат) в ГМФ
пути
39.
Недостаточность тиаминаБолезнь бери-бери, проявляется нарушениями
метаболизма и функций пищеварительной,
сердечно-сосудистой и нервной систем
У хронических алкоголиковэнцефалопатический синдром ВерникеКорсакова
Тиаминзависимая мегалобластная анемия
У кормящих матерей образуется
кардиотоксический метаболит-γ-окси-αкетоглутарат, вызывающий остановку сердца у
детей
40. Пиридоксиновые коферменты Источником пиридоксиновых коферментов служит пиридоксин (витамин B6). Он объединяет три родственных
витамина:41.
Источником витамина для человека служаткишечные бактерии и пища.
Богаты витамином B6 зерновые, бобовые, мясные
продукты, рыба.
Суточная потребность в нем взрослого человека 2-3
мг.
Всасывание витамина В6 происходит в кишечнике
простой диффузией.
В тканях происходит превращение в коферменты-
пиридоксальфосфат и пиридоксаминофосфат
В их синтезе участвуют флавиновые ферменты
42. Коферментные формы витамина В6
43.
• пиридоксаль-5-фосфат – активная форма витаминаВ6.
• Он входит в состав ферментов почти всех классов:
оксидоредуктаз, трансфераз, гидролаз, лиаз и
изомераз.
• с участием витамина В6 протекает множество
реакций:
Трансаминирование
-декарбоксилирование
Окисление биогенных аминов
Обмен триптофана
Обмен серусодержащих аминокислот
Синтез гема
Фосфоролитический распад гликогена и др.
44. Недостаточность пиридоксина
Дефицит витамина В6 у взрослых проявляетсяразвитием
себорейного дерматита, стоматита, глоссита.
Специфические признаки – гипохромная анемия и
судороги
Причиной недостаточности витамина может быть:
• кишечная инфекция т.к. он может синтезироваться
только при участии микрофлоры кишечника
• нарушение превращения его в активную форму
при патологии печени
45.
•при длительном лечениипротивотуберкулезным препаратом
изониазидом, который является антагонистом
пиридоксаля.
•у детей это может быть следствием
недостаточности витамина в период
внутриутробной жизни из-за гиповитаминоза
у матери, страдающей ранним токсикозом.
Сопровождается повышенной возбудимостью
центральной нервной системы и
периодическими судорогами
46. Пантотеновая кислота (витамин B3)
Пантотеновая кислота – сложное соединение,состоящее из - аланина и 2, 4-диокси-3, 3диметилмасляная кислоты.
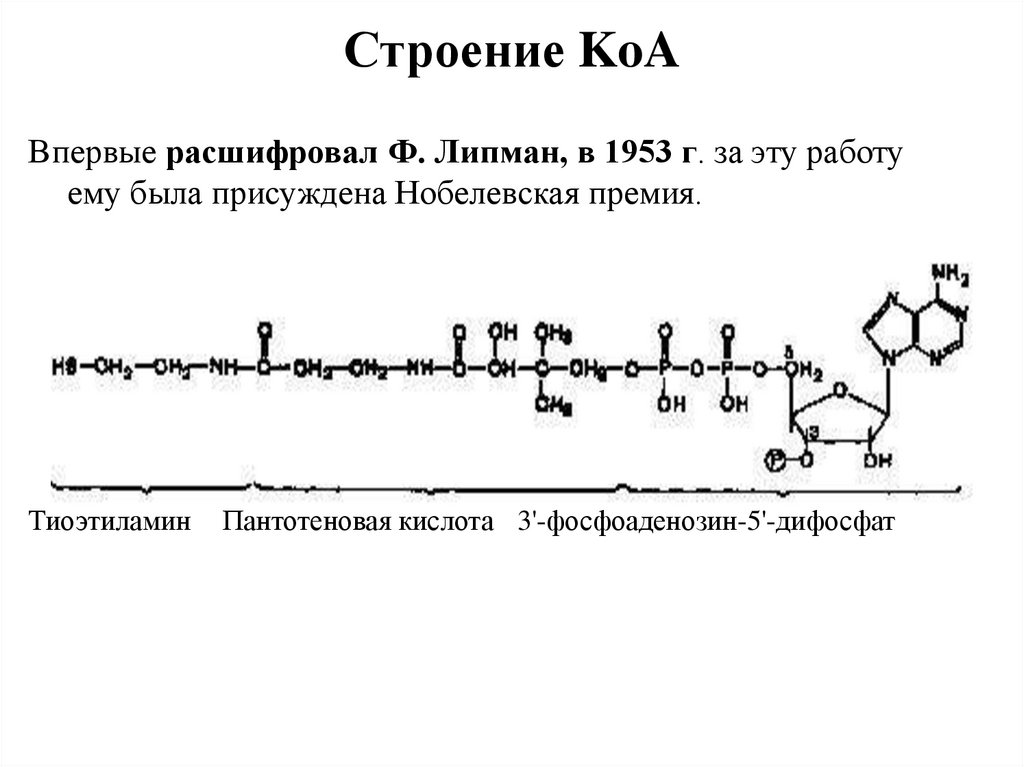
47. Строение KoA
Впервые расшифровал Ф. Липман, в 1953 г. за эту работуему была присуждена Нобелевская премия.
Тиоэтиламин
Пантотеновая кислота 3'-фосфоаденозин-5'-дифосфат
48. Биологическая роль
Пантотеновая кислота выполняет свою рольв составе коэнзима А – основного
кофермента клетки
Функция коэнзима А заключается:
в акцептировании кислотных радикалов
и реакциях переноса их на различные
метаболиты тканевого обмена углеводов,
жиров и аминокислот.
49.
При участии KoA образуются различные ацильныепроизводные:
ацетил-КоА, бутирил-КоА, малонил-КоА,
ацетоацетил-КоА, сукцинил-КоА и др.
Участие ацетил-КоА в других реакциях:
окислении до конечных продуктов
синтезе жирных кислот
синтезе холестерина и других стероидных соединений
синтезе кетоновых тел
образовании цитрата
синтезе ацетилхолина
синтезе ацетилглюкозаминов, необходимых для
образования гиалуроновой кислоты
реакциях ацетилирования биогенных аминов (их
обезвреживание) и др.
50.
Сукцинил-КоА используется в реакции субстратногофосфорилирования ГДФ с образованием ГТФ в цикле
Кребса (катализируется сукцинил-КоА-синтетазой).
Сукцинил-КоА используется также на синтез аминолевуленовой кислоты, необходимой для синтеза гема
гемопротеидов (катализируется синтетазой- аминолевуленовой кислоты).
Малонил-КоА необходим для синтеза жирных кислот.
Другие коферменты пантотеновой кислоты – 4фосфопантотеин и дефосфо-КоА
Дефосфо-КоА – кофермент цитратлиазы
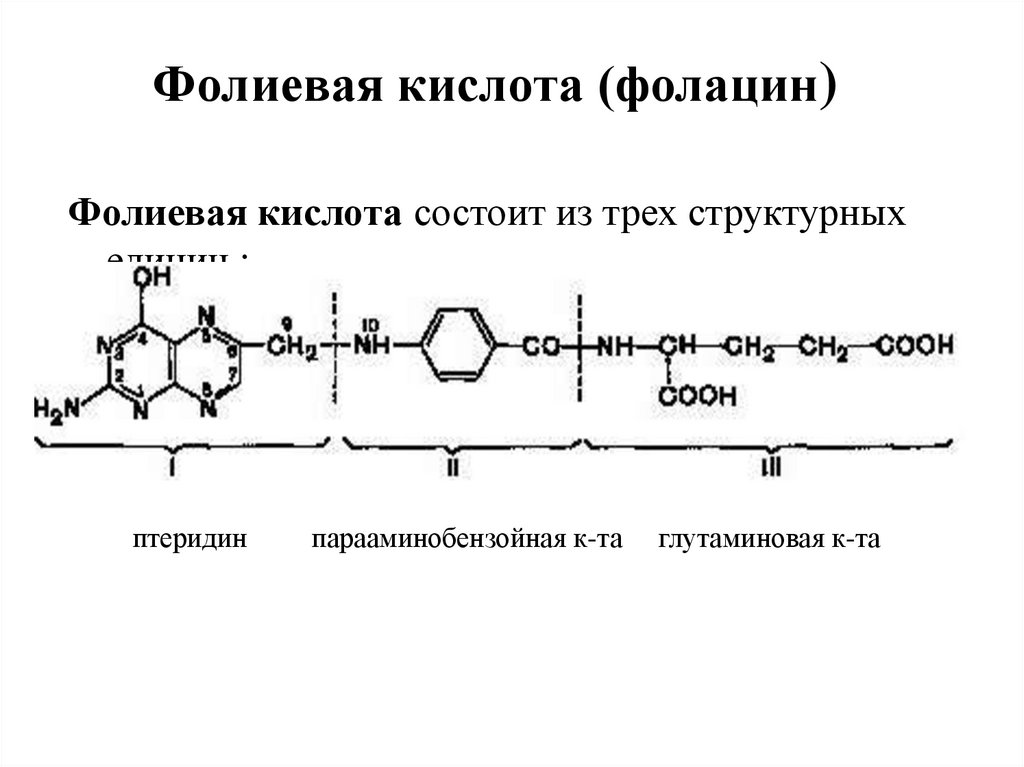
51. Фолиевая кислота (фолацин)
Фолиевая кислота состоит из трех структурныхединиц :
птеридин
парааминобензойная к-та
глутаминовая к-та
52.
• В крови основная часть фолацина (87%)содержится в эритроцитах, а остальная – в
плазме.
• Депонируется фолацин в печени, почках и
слизистой кишечника.
• Из организма выводится с мочой, калом и потом
• У беременных фолиевая кислота к плоду
поступает через плаценту и к концу беременности
содержание ее в плазме и эритроцитах плода выше,
чем у матери.
53.
Биологическая рольКоферментную функцию фолиевая кислота
выполняет в форме: N5-формил-ТГФК, Nl0фopмuл-TГФK, N5, N10-метенил-ТГФК, N5, N10метилен-ТГФК, и N5-метил-ТГФК и она
заключается в переносе одноуглеродных остатков,
таких как:
Н–С=О
СН2ОН
формил оксиметил
–СН3
метил
–СН2– –СН= НС=NH
метилен
метенил
формимино
54. Примеры реакций:
• Синтез пуриновых нуклеотидов• Синтез пиримидиновых нуклеотидов:
УМФ+(СН3)ТГФК
ТМФ
• Синтез аминокислот:
Глицин +ТГФК(сн2он)
Серин
Гомоцистеин+ N5-СН3 - ТГФК
метионин + ТГФК
55.
Недостаточность витамина ВсТканевые запасы фолатов исчерпываются в течение 3-6 месяцев
При недостатке фолиевой кислоты развивается мегалобластная
(макроцитарная) анемия (подавляется синтез нуклеотидов):
•снижение количества эритроцитов
• снижение содержания в них гемоглобина
•увеличение размера эритроцитов.
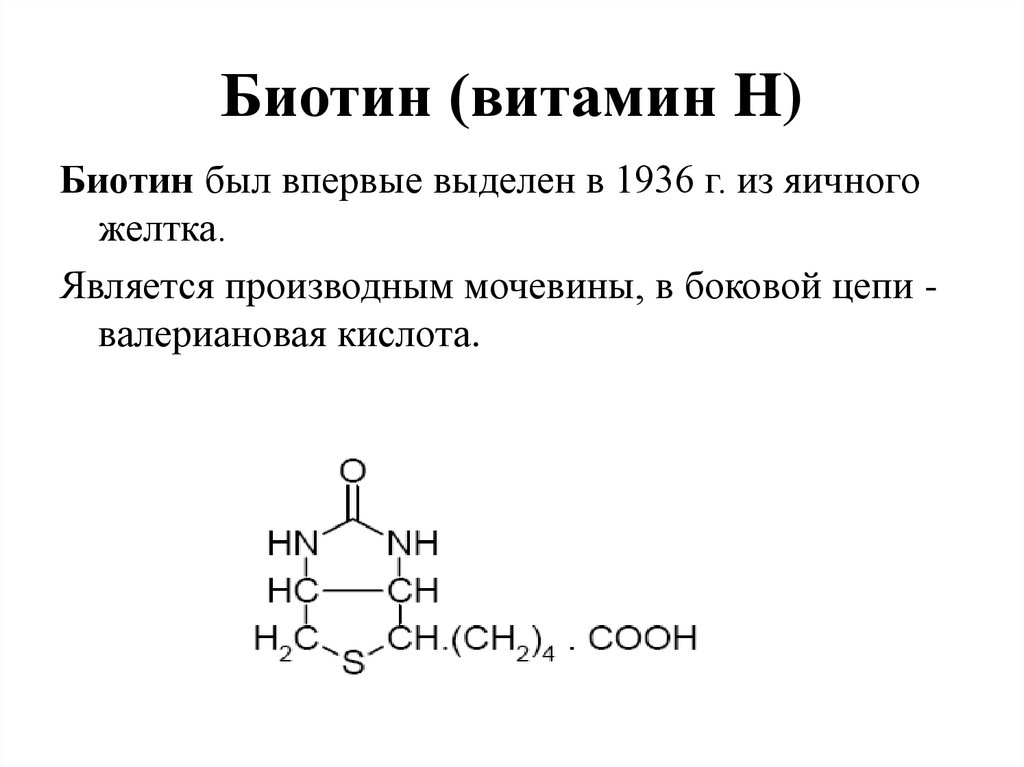
56. Биотин (витамин H)
Биотин был впервые выделен в 1936 г. из яичногожелтка.
Является производным мочевины, в боковой цепи валериановая кислота.
57.
Потребность в биотине у человека покрывается восновном за счет биосинтеза его кишечными
бактериями, небольшая часть поступает с пищей.
Суточная потребность взрослого человека в биотине
составляет 150 – 200 мкг.
Активная форма биотина - биоцитин
58. По типу катализируемых реакций делятся на две группы:
• К первой группе относятся реакциикарбоксилирования, которые сопряжены с
расщеплением АТФ и сопровождаются
образованием в качестве промежуточного продукта
активной формы углекислоты –
карбоксилированного биотина, который служит
донором карбоксильных групп:
RH + НСОз¯ + АТФ
R-COOH + АДФ + H3PO4
59.
• Ко второй группе относятся реакциитранскарбоксилирования
Реакции протекают в присутствии
биотиновых
коферментов без участия АТФ. В этих
реакциях карбоксилирование одного
субстрата всегда сопряжено с
декарбоксилированием другого вещества:
R1–COO– + R2H R1H + R2–COO–
60. Кобамидные коферменты Витамин В12 - цианкобаламин(антианемический витамин)
1849 г. Аддисон впервые описал особую формуанемии
1868 г. она была подробно исследована Бирмером,
поэтому и получила название анемия АддисонБирмера
1955 г. – Ходжкин расшифровала структуру В12
методом
рентгенографической
кристаллографии.
Получена Нобелевская премия.
Структура витамина В12 была описана в 1958 году
Баркером и получила название кобаламин
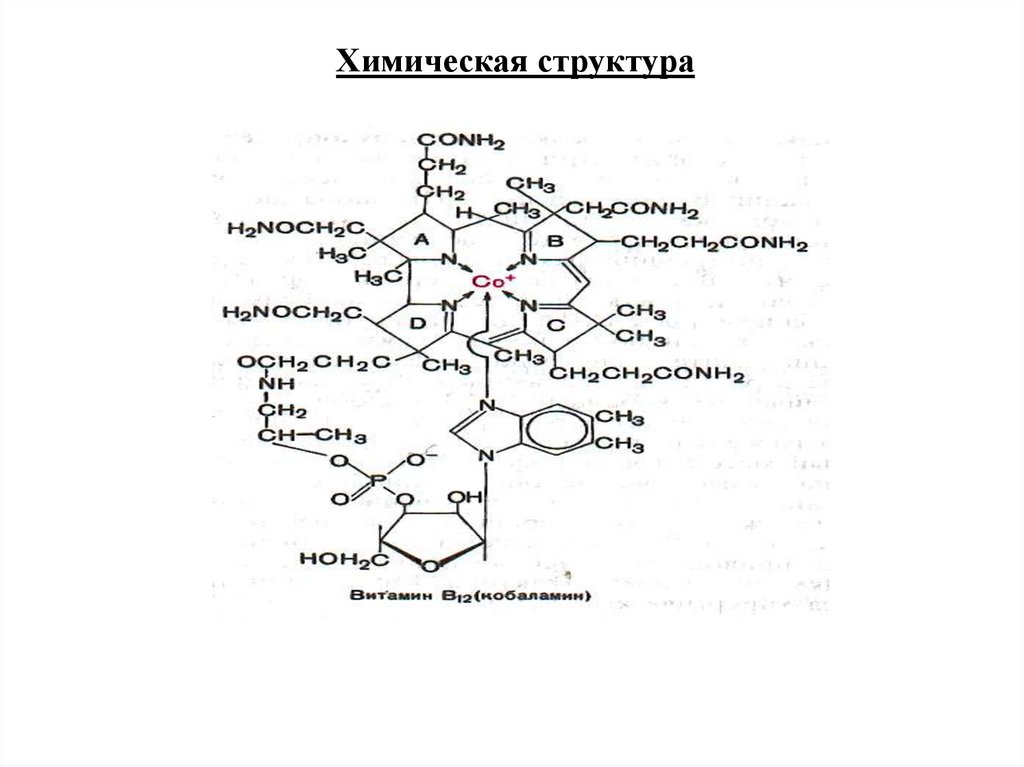
61.
Химическая структура62.
Метаболизм• Всасывание кобаламинов идет в желудке при
участии внутреннего фактора, или фактора
Кастла, который продуцируется обкладочными
клетками.
• Внутренний фактор Кастла – гликопротеин
• В печени и в почках витамин превращается в
коферментные формы:
- метил кобаламин (метил-В12 )
- дезоксиаденозил кобаламин (ДА-В12 )
63. Биологическая роль
Реакции с участием кобамидных коферментовусловно разделяют на две группы:
• К первой группе относятся реакции
трансметилирования, катализируемые
ферментами, коферментом которых является
метилкобаламин, как промежуточный переносчик
метильной группы. Примерами реакций
трансметилирования служат реакции синтеза
метионина, образование метана, синтез ацетата.
64.
Реакции трансметилирования при участииметилкобаламина – биосинте метионина из
гомоцистеина.
65.
Ко второй группе относятся превращения, в которыхнепосредственно участвует ДА-В12
ДА-В12 является коферментом метилмалонил-КоА-мутазы, катализирующей
превращение метилмалонил-КоА в сукцинил-КоА:
66.
ДА-В12 участвует и в восстановлении рибонуклеотидов вдезоксирибонуклеотиды
SH
Рибонуклеотиды +
SH
Рибонуклеотидредуктаза
D-рибонуклеотид +
(ДА-В12)
тиоредоксин
Кобаламины облегчают депонирование и образование
коферментных форм фолиевой кислоты и т.о. участвуют в
синтезе ДНК, пролиферации кроветворных клеток.
Биохимические эффекты кобаламидов проявляются в усилении
анаболических процессов: повышается накопление гликогена,
увеличивается содержание альбуминов, проявляется
гепатозащитное действие, нормализуется липидный обмен,
снижается содержание холестерина.
S
S
67.
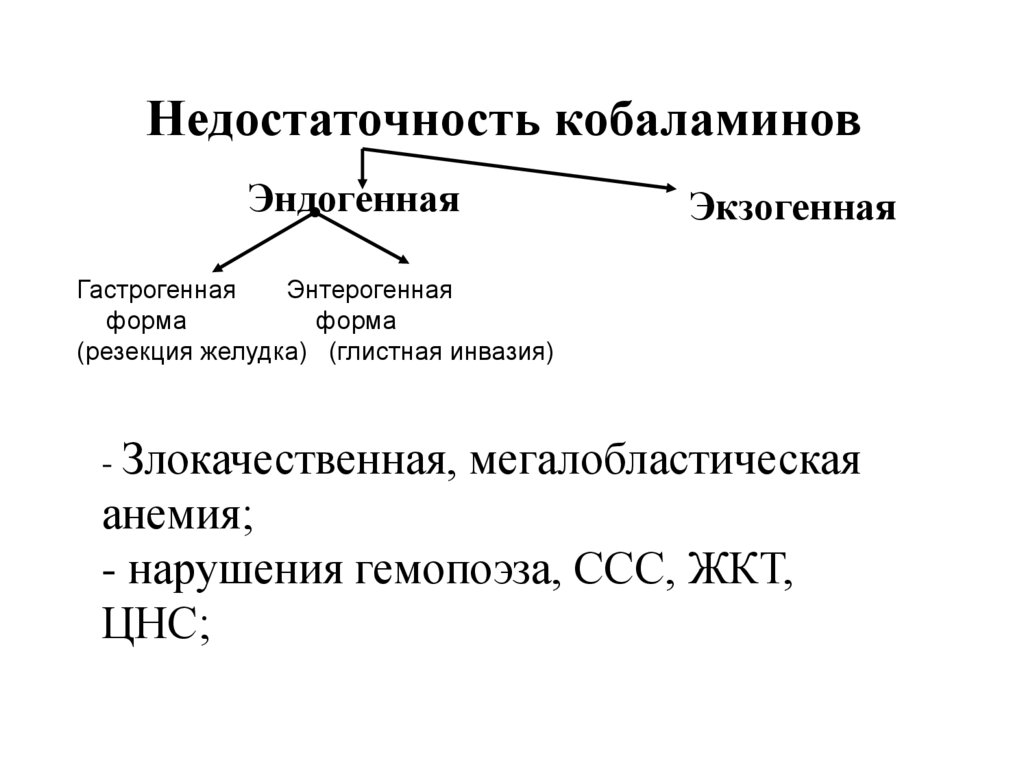
Недостаточность кобаламиновЭндогенная
Экзогенная
Гастрогенная
Энтерогенная
форма
форма
(резекция желудка) (глистная инвазия)
- Злокачественная, мегалобластическая
анемия;
- нарушения гемопоэза, ССС, ЖКТ,
ЦНС;
68.
Витамин С - аскорбиновая кислота(антицинготный, антискорбутный)
Авитаминоз С (цинга, скорбут) был известен с древних времен.
Первое подробное описание скорбута было сделано в XIII
столетии Жуанвилем
В начале XIX столетия русский патолог Пашутин В.В писал,
что предохраняющим от цинги веществом является
органическое соединение с очень высокой активностью, что
человек не способен к синтезу этого вещества.
Химическая природа витамина расшифрована венгерским
биохимиком Сент-Джорди (1933).
69.
Распространение витамина СИсточником витамина С являются свежие овощи,
фрукты, плоды, ягоды.
В продуктах животного происхождения есть
витамин С в печени крупного рогатого скота, почках,
сердце, а также в молоке.
Суточная доза витамина С 75-100 мг.
70.
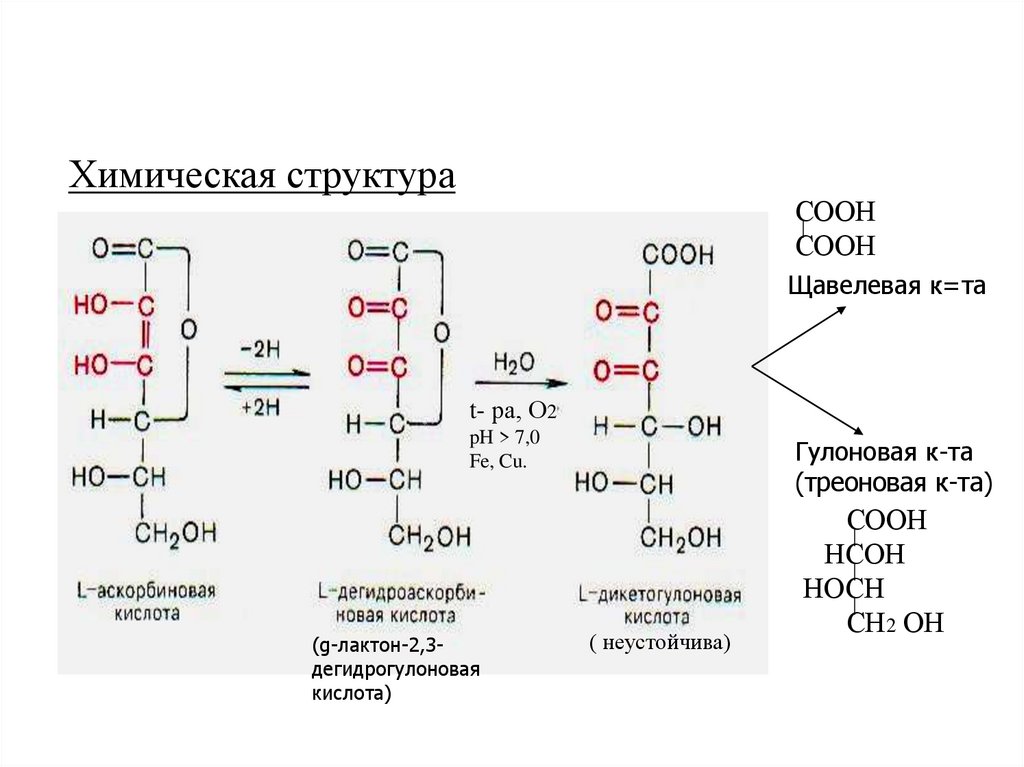
Химическая структураСООН
СООН
Щавелевая к=та
t- ра, О2
pH > 7,0
Fe, Cu.
(g-лактон-2,3дегидрогулоновая
кислота)
Гулоновая к-та
(треоновая к-та)
( неустойчива)
СООН
НСОН
НОСН
СН2 ОН
71. Участие витамина С в обмене:
• Гидроксилирование остатков пролина и лизина в молекулепроколлагена (катализируется гидроксилазами, имеющими
в активном центре атомы Fe++ .В качестве кофермента
используется аскорбат (витамин С)
• В синтезе кортикостероидов, половых гормонов, гормонов
щитовидной железы
• В биосинтезе катехоламинов
• В восстановлении фолиевой кислоты в ТГФК
• В распаде гемоглобина
• В окислительно-восстановительных реакциях
• Природный сильнейший антиоксидант для защиты клеток
от активных форм О2.
72.
Недостаточность витамина С• общее недомогание,
• боли в мышцах,
• кровоизлияние в слизистые, в десны,
• расшатывание и выпадение зубов.
• повышение восприимчивости к инфекционным
заболеваниям
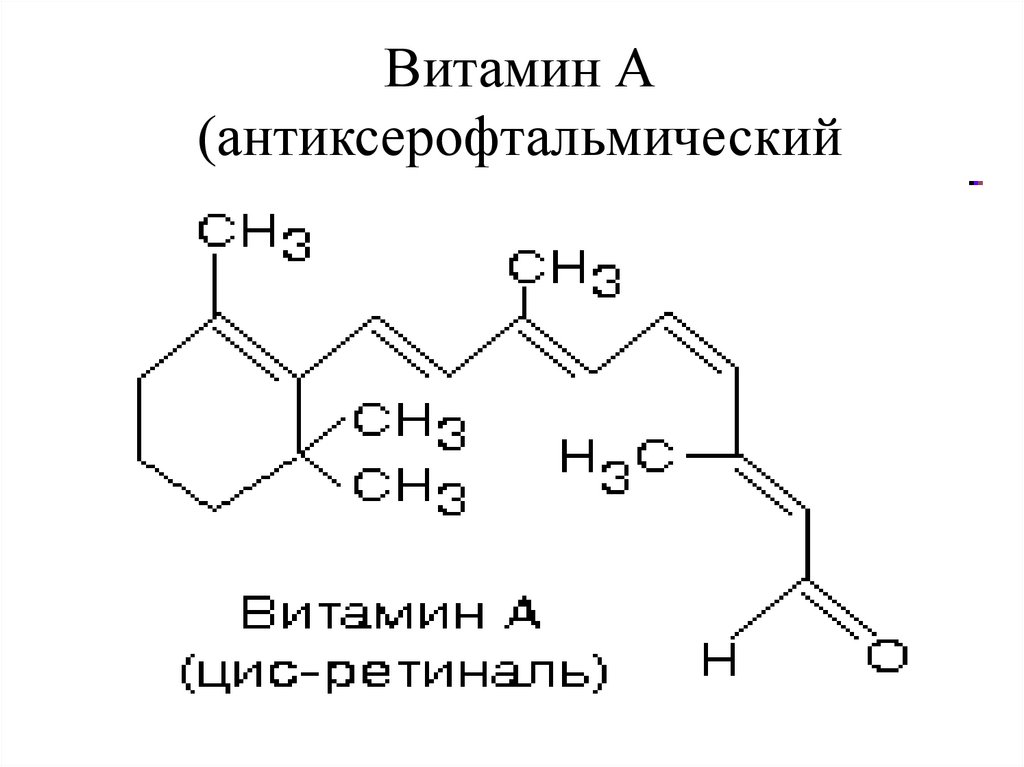
73. Витамин А (антиксерофтальмический
74. Витамин А (содержание в продуктах, мкг/г)
жир печени трески---------------------------------------65-375жир печени палтуса-------------------------------------25000
печень барана---------------------------------------------200
желток яйца------------------------------------------------25-150
масло сливочное-------------------------------------------2-125
мясо -----------------------------------------------------------1,2-12,5
молоко--------------------------------------------------------0,2-4,5
листья петрушки------------------------------------------100
абрикосы-----------------------------------------------------50-100
тыква---------------------------------------------------------50
картофель---------------------------------------------------0,2-0,3
морковь------------------------------------------------------80-120
томаты--------------------------------------------------------12-15
Суточная норма 1-2,5 мг
75.
Метаболизм витамина А• В крови витамин А соединяется с ретинол-связывающим
протеином (РСП), который образуется в печени (не
связанный с этим белком - токсичен). Далее комплекс
витамин А-РСП соединяется с транстерритином, который
препятствует фильтрации витамина в почках.
• На поверхности клеток-мишений в тканях располагаются
рецепторы к РСП, которые отщепляют витамин А от
белкового комплекса и переносят в цитоплазму клетки.
Ретиноевая кислота поступает внутрь клетки путем
липидной диффузии без участия рецепторов.
• В печени он окисляется до ретиноевой кислоты, а затем до
окси- и эпоксиретиноевой кислоты, которые в виде
глюкуронидов выделяются с желчью.
76. Биологическая роль
• ретиналь – обеспечивает работу световоспринимающихструктур сетчатки;
• ретинол – участвует в росте и дифференцировке тканей,
работе репродуктивной системы, активации рецепторов
тиреоидных гормонов и витамина D, тормозит апоптоз
эпителиальных клеток;
• ретиноевая кислота – обеспечивает рост и
дифференцировку лимфоцитов, определяющих иммунный
ответ; а также усиление апоптоза эпителиальных клеток
снижая барьернаую функцию кожи,слизистых
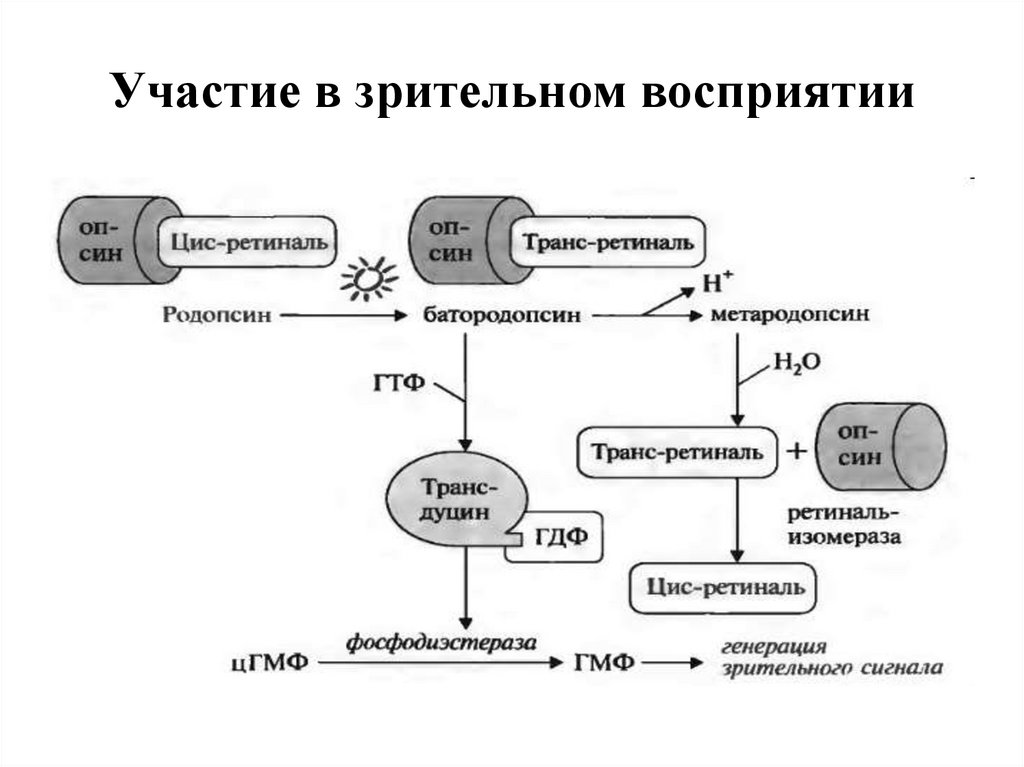
77. Участие в зрительном восприятии
78. Участие в зрительном восприятии
79.
ГИПОВИТАМИНОЗ:• куриная слепота у взрослых
• ксерофтальмия(сухость оболочек глаза)
• кератомаляция(распад роговицы
• иммунодефицит, повышенная восприимчивость к
инфекции
ГИПЕРВИТАМИНОЗ:
• кахексия
• выпадение волос
• головные боли
• потеря аппетита
• остеопороз
• пороки развития плода
80. Витамин Д
81. Витамин Д (содержание в продуктах, мкг/г)
жир печени скумбрии---------------------------------1500жир печени карпа--------------------------------------250
жир печени камбалы----------------------------------50-100
печень трески-------------------------------------------1,5
яйцо куриное---------------------------------------------0,013-0,05
молоко-----------------------------------------------------0,001
белые грибы---------------------------------------------0,088
Шампиньоны--------------------------------------------0,02-0,063
СУТОЧНАЯ НОРМА:
10-25 мкг – дети;
5 мкг – взрослые.
82.
83. Биохимические функции витамина D3
• Усиление образования Са-связывающегобелка (активирует экспрессию гена)
• Усиление всасывания органического
фосфата
• Индукция синтеза щелочной фосфатазы,
Са-зависимой АТФ-азы, цитратсинтетазы,
обеспечивающих гомеостаз Са и Р
• Участник системы: паратгормон,
тиреокальциотонин, кальцитриол
84.
Нарушения обменаГИПОВИТАМИНОЗ:
Гипокальциемия(недостаток солнечного света, нарушения
всасывания в кишечнике Са, хр. почечная недостаточность)
рахит у детей( позднее прорезываеие зубов, нарушается
костеобразование, незаращение родничка и др.)
остеомаляция, остеопороз у взрослых (усиливается
вымывание Са2+ из организма)
• судороги , тетания
ГИПЕРВИТАМИНОЗ:
Гиперкальциемия
• избыточное отложение солей Са в тканях лёгких, почек,
сердца, сосудов (кальцификация)
• остеопороз
• мочекаменная болезнь
85.
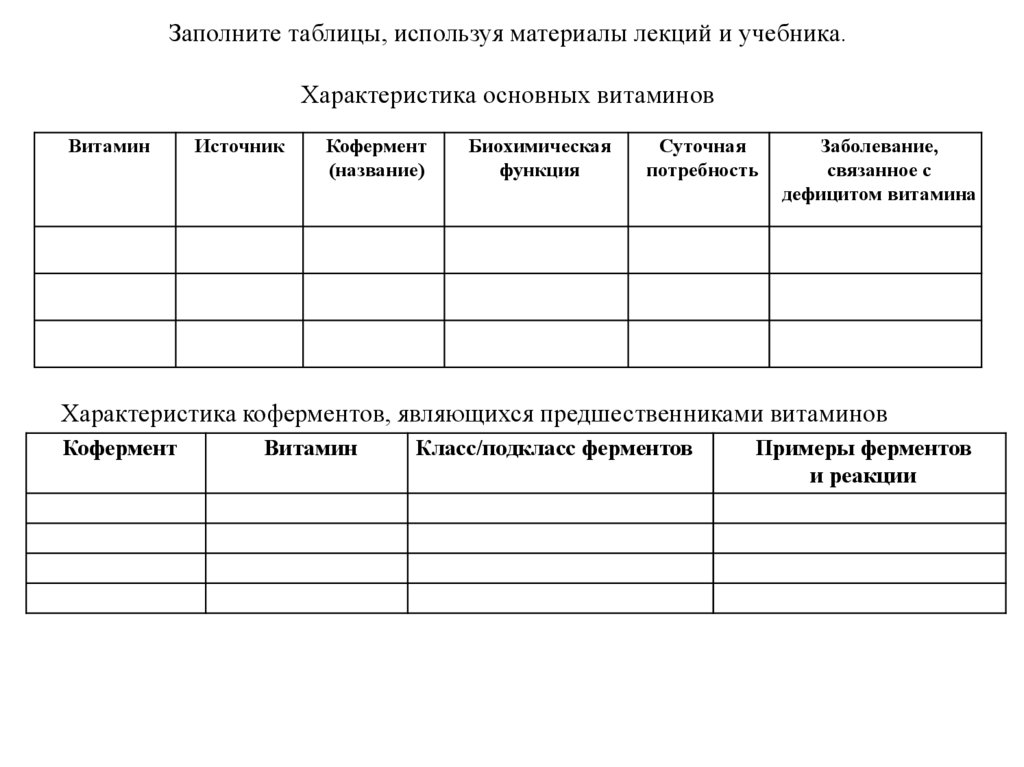
Заполните таблицы, используя материалы лекций и учебника.Характеристика основных витаминов
Витамин
Источник
Кофермент
(название)
Биохимическая
функция
Суточная
потребность
Заболевание,
связанное с
дефицитом витамина
Характеристика коферментов, являющихся предшественниками витаминов
Кофермент
Витамин
Класс/подкласс ферментов
Примеры ферментов
и реакции











































































 Биология
Биология








