Похожие презентации:
Электрохимия, электроды
1.
ОБЩАЯ ХИМИЯ(лекция 11)
«Электрохимия, электроды »
2.
д.х.н., профессоркафедры общей химии
Конюхов Валерий Юрьевич
VK id2476227
3.
План лекций4.
Электрохимия• Типы электрохимических процессов. Окислительно-восстановительные системы.
Двойной электрический слой, скачок потенциала на межфазной границе.
Электродный потенциал. Уравнение Нернста. Зависимость электродного потенциала
от материала электродов и состава раствора. Электрохимический ряд напряжения.
Стандартный электрод сравнения.
Классификация электродов: металлические, неметаллические, окислительновосстановительные, газовые электроды (водородный, кислородный) и электродные
реакции, протекающие на них.
Ионоселективные электроды.
Химические источники тока: обратимые, необратимые, концентрационные.
Гальванический элемент, аккумулятор, разовые источники тока, топливный элемент.
Устройство и принцип действия.
Электродвижущая сила.
Электролиз. Последовательность электродных процессов для водных растворов
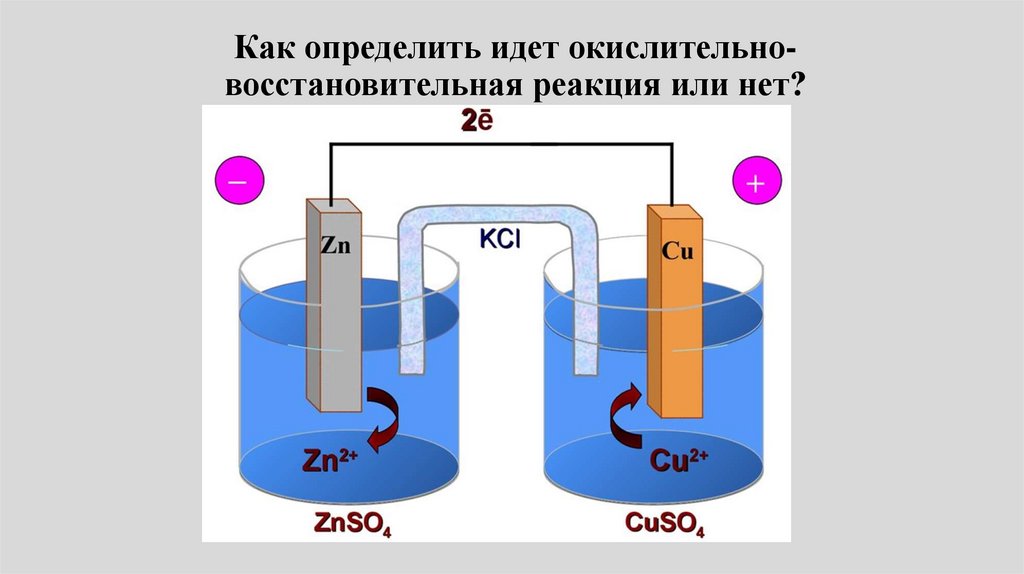
электролитов. Перенапряжение.
Основные виды коррозии металлов. Электрохимическая коррозия. Коррозия
металлов и проблема надежности. Методы защиты от коррозии.
5.
Тема 17. КОНТРОЛЬНЫЕ ВОПРОСЫПО КУРСУ ХИМИИ
(для подготовки к экзамену и выполнения
итогового домашнего задания)
1.Двойной электрический слой, электродный потенциал,
гальванический элемент, электродвижущая сила. Уравнение
Нернста.
2.Электролиз водных растворов. Потенциалы водородного и
кислородного электродов, их зависимость от рН среды.
Перенапряжение. Последовательность разряда ионов на
катоде и аноде.
3.Коррозия
металлов.
Виды
коррозии.
Специфика
электрохимической коррозии. Примеры коррозии в системах
цинк–медь, железо–цинк. Методы защиты от коррозии.
6.
Тема 15. ЭЛЕКТРОХИМИЯ1. Электрохимические процессы. Гальванический элемент.
2. Двойной электрический слой. Электродный потенциал.
3. Электродный потенциал (относительный). Стандартный водородный электрод.
4. Электроды первого рода. Уравнение Нернста для электродов первого рода (металлических и
неметаллических электродов).
5. Электроды второго рода, уравнение Нернста для электродов второго рода, примеры электродов.
6. Окислительно-восстановительные электроды. Уравнение Нернста. Влияние рН среды на
потенциалы окислительно-восстановительного электрода.
7. Конструкция и электродные процессы водородного и кислородного электродов, зависимость их
потенциалов от рН среды.
8. Химические и концентрационные электрохимические цепи (гальванические элементы), расчет ЭДС
цепей по уравнению Нернста.
9. Электролиз. Законы Фарадея. Примеры металлов, получаемых электролизом водных растворов.
Реакции электролиза.
10. Факторы, определяющие последовательность разряда ионов при электролизе?
11. Перенапряжение и факторы, которые определяют его величину.
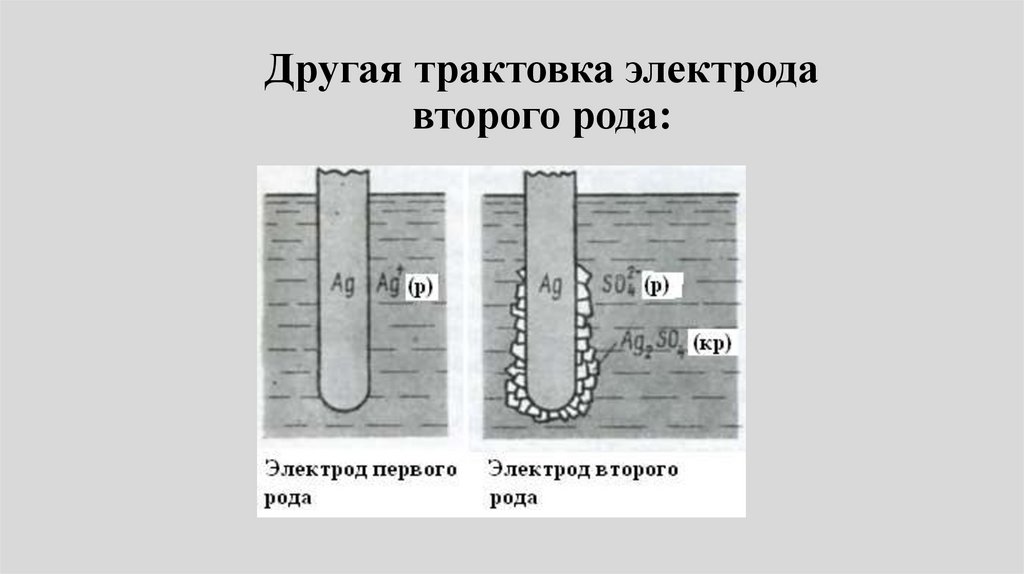
12. Электрохимическая коррозия на примере систем Fe–Cu и Fe–Sn.
13. Защита металлов от коррозии.
7.
Список литературы1. Н.В. Коровин. Общая химия. М.: Высшая школа.
2014.
2. Н.С.Ахметов. Общая и неорганическая химия –
М.:ВШ, 2012.
3. Н.Л. Глинка «Общая химия» М.: Изд. «Химия»,
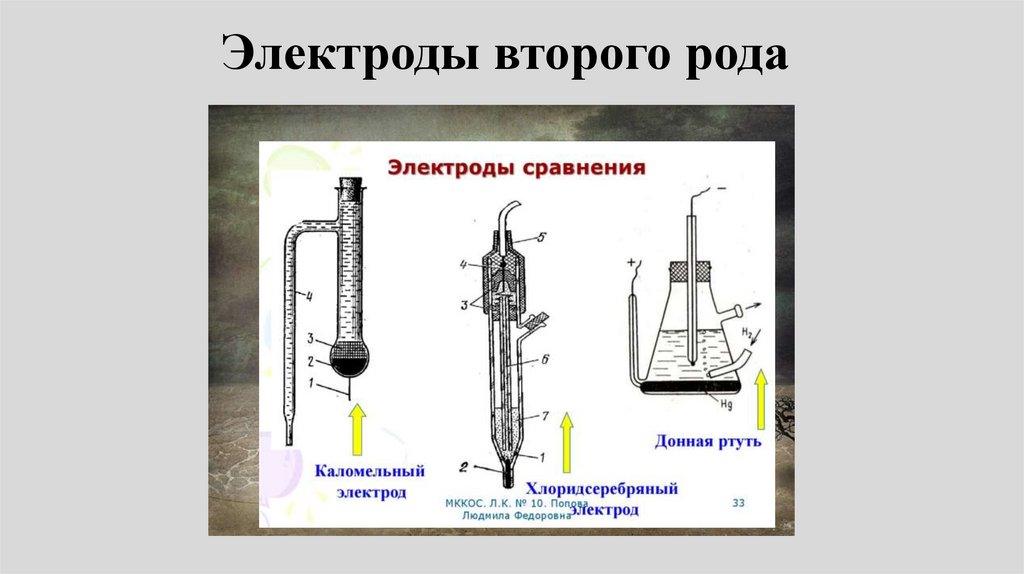
2002.
4. Жукова Т.В., Глаголева М.А., Липанова Н.В.,
Сергиевский В.В., Сорока И.В. Общая химия
(основные понятия, примеры, задачи). М.: МИФИ,
2008.
5. Сергиевский В.В., Ананьева Е.А., Жукова Т.В.,
Звончевская М.Ф., Кучук Ж.С., Котыхова О.А.
Неорганическая химия: учебное пособие для
внеаудиторной работы. М.: МИФИ, 2007.
8.
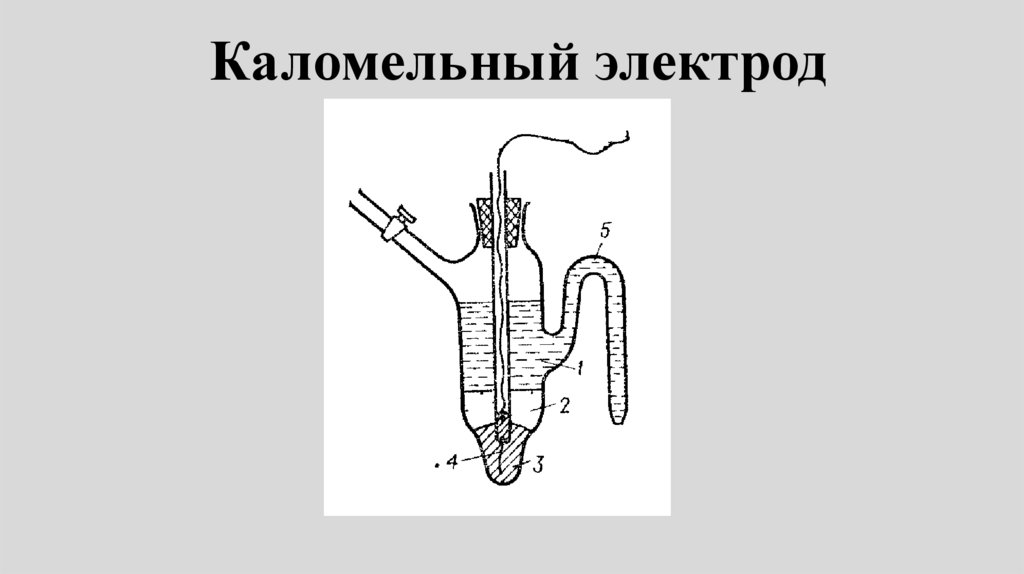
Литература• Общая химия лабораторные работы
(под редакцией Е.А. Ананьевой) М.:
МИФИ, 2010.
• Сборник тестов и задач по курсу
химии. НИЯУ МИФИ. М.: 2014.
• Общая и неорганическая химия (под
редакцией А.Ф. Воробьева).
• Т. 1 и 2. М.: Академкнига. 2004.
9.
Повторение – мать учения!10.
Скачки потенциалов на границераздела фаз
11.
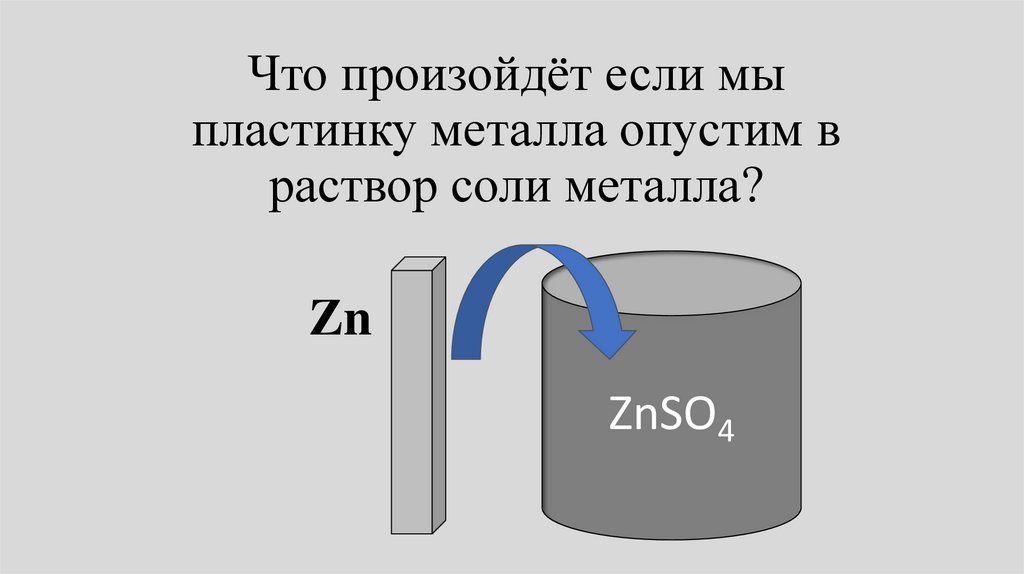
Что произойдёт если мыпластинку металла опустим в
раствор соли металла?
Zn
ZnSO4
12.
• В общем случае химический потенциалметалла Zn,М в фазе металла отличается от
химического потенциала металла в
растворе Zn,L. Потенциалы начнут
выравниваться.
• При этом в зависимости от соотношения
Zn,М и Zn,L либо металл будет
растворяться, либо ионы металла будут
разражаться и высаживаться на пластине.
13.
• По мере протекания процессапроисходит разделение зарядов.
Одна фаза (например, раствор)
заряжается положительно, другая
(металл) отрицательно (и
наоборот).
• Образующиеся заряды тормозят
переход ионов и, наконец,
остановят его.
14.
•Т. о. при контакте металла ираствора происходит заряжение
контактирующих фаз (металл –
прилегающий раствор) зарядами
различного знака и образуется
ДЭС.
15.
За счёт разделения зарядов награнице раздела фаз возникает
двойной электрический
(ионный) слой (ДЭС).
16.
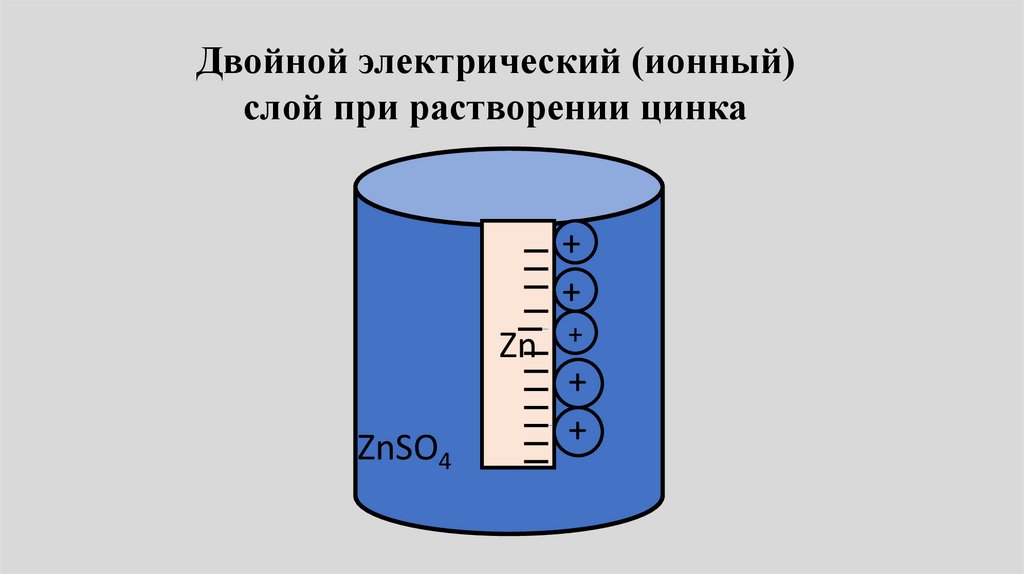
Двойной электрический (ионный)слой при растворении цинка
+
+
Zn
+
ZnSO4
+
++
+
17.
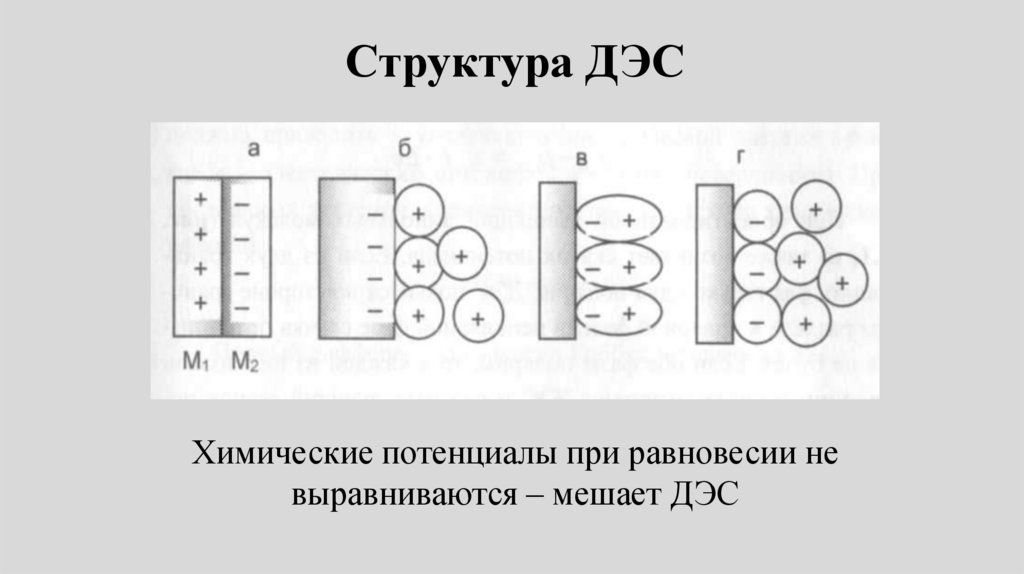
Структура ДЭСХимические потенциалы при равновесии не
выравниваются – мешает ДЭС
18.
• Там где образуется заряд возникаетпотенциал.
• Пространственное разделение
зарядов приводит к разности
потенциалов
• (скачку потенциала).
19.
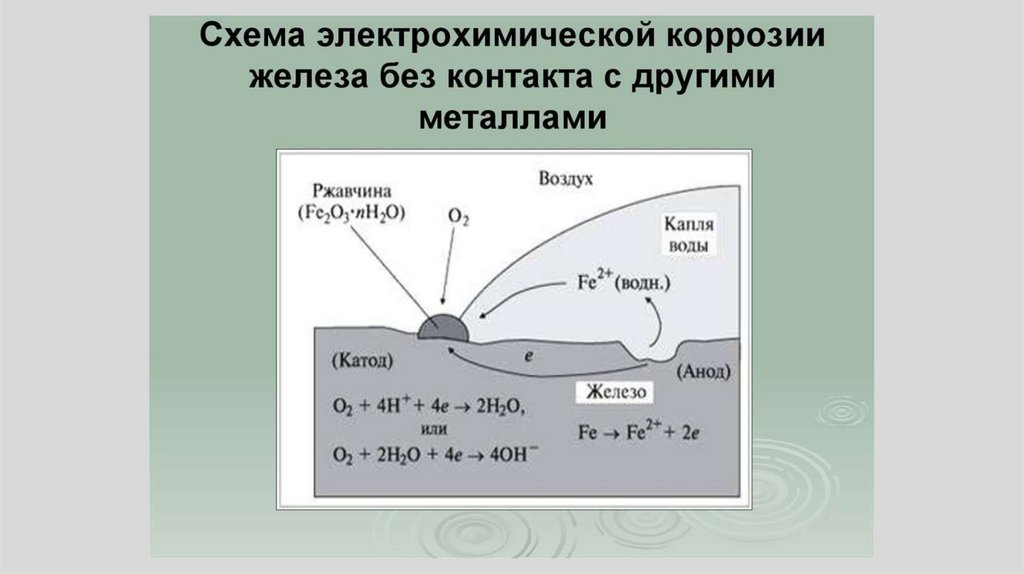
На границе раздела фазвозникает скачек потенциала
M L= M L
гальвани-потенциал
20.
• Гальвани - потенциал нельзя рассчитатьи измерить, так как по определению
электрический заряд не должен
химически взаимодействовать с фазами,
что неосуществимо,
• При этом его взаимодействие с фазами
различно, т.к. фазы имеют разный
химический состав.
21.
•Металл, опущенный в растворсобственной соли, с ДЭС и
скачком потенциалов на
границе раздела фаз
•- электрод.
22.
• 1. Металл, погруженный в раствор солиэтого металла. Например,
металлическая медь в растворе
сульфата меди:
• CuSO4 Cu или Cu2+ Cu
• Границу раздела фаз изображают
вертикальной чертой.
• Это электрод первого рода
23.
• Из электродов составляютэлектрохимические системы (цепи) –
гальванические элементы.
• Электрохимическая система служит для
осуществления взаимного превращения
электрической и химической форм энергии.
• На электродах цепи протекают
электродные реакции (полуреакции), в
цепи протекает токообразующая реакция.
24.
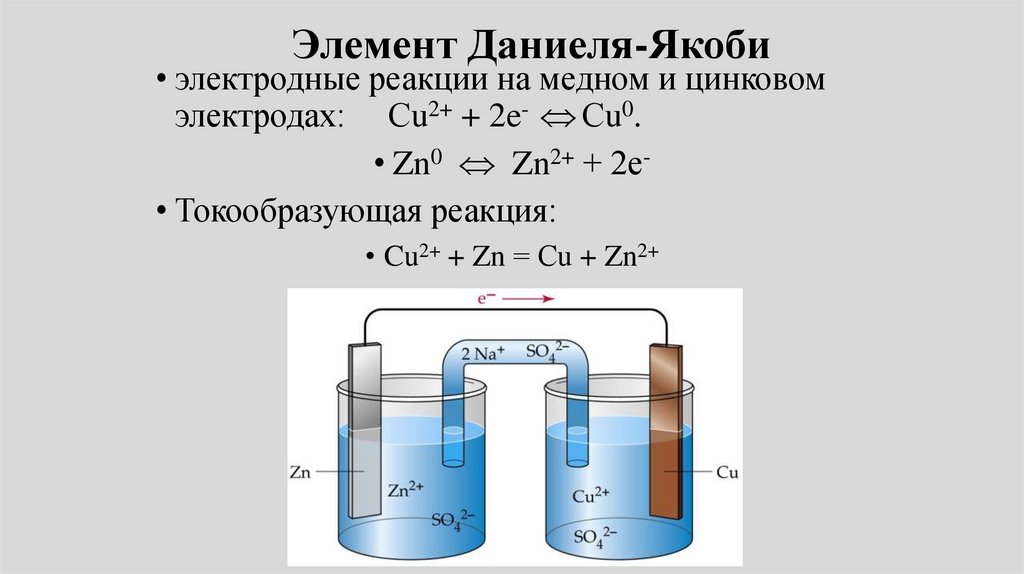
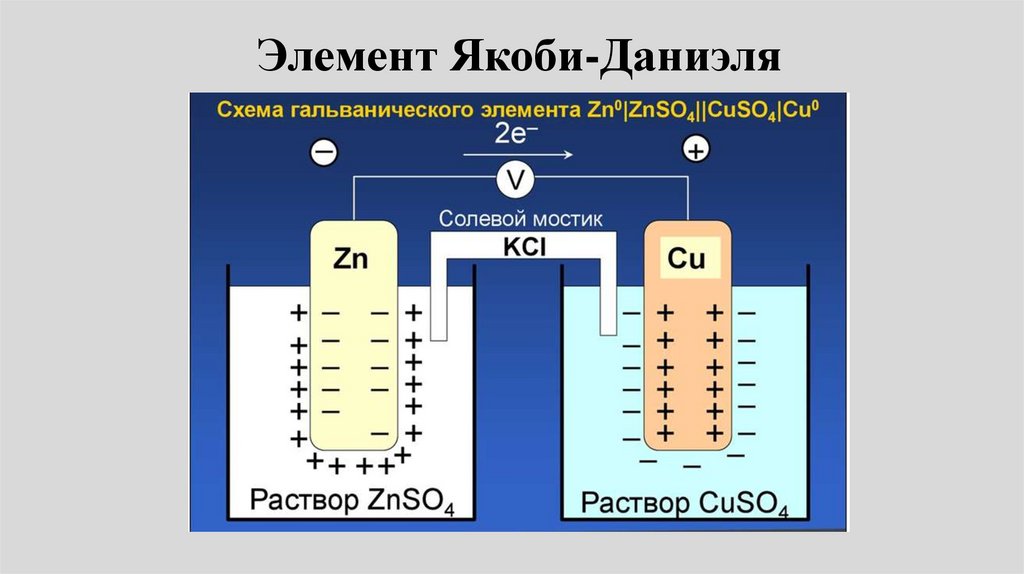
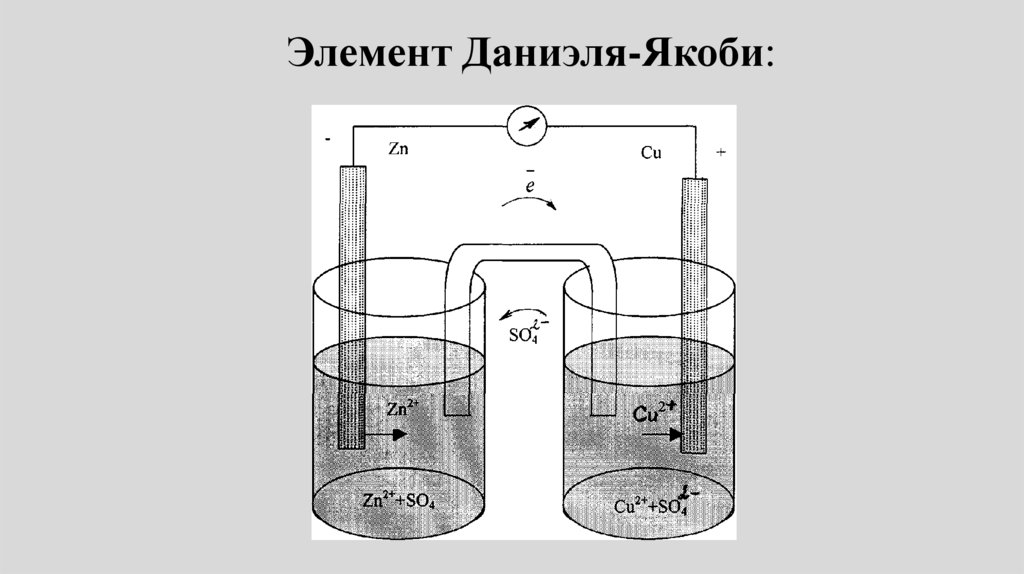
• Пример: Электрохимическая цепьДаниэля – Якоби состоит из
цинковой пластинки, погруженной в
водный раствор ZnSО4, (цинковый
электрод) и медной пластинки,
погруженной в водный раствор
CuSО4 (медный электрод), растворы
контактируют через мембрану или
солевой мостик.
25.
Элемент Даниеля-Якоби• электродные реакции на медном и цинковом
электродах: Сu2+ + 2e- Сu0.
• Zn0 Zn2+ + 2е• Токообразующая реакция:
• Cu2+ + Zn = Сu + Zn2+
26.
• Электролиты могут контактироватьчерез пористую перегородку
(диафрагму) (б) или при помощи
солевого мостика U-образной
трубки, заполненной раствором
электролита с близкими
подвижностями ионов (КСl, NH4NO3),
иммобилизованном агар-агаром (в).
27.
• При разомкнутой цепи видимыеизменения в системе не происходят.
• При замкнутой цепи Даниэля-Якоби
происходит непрерывный процесс
растворения цинка
• Zn Zn2+ + 2е• и непрерывный процесс осаждения
меди
• Сu2+ + 2e- Сu.
28.
• Электрод, на котором происходитвосстановление, называют катодом
(знак +)(правый электрод).
• Сu2+ + 2e- Сu.
• Электрод, на котором происходит
окисление, - анодом (знак -)
• (левый электрод),
• Zn Zn2+ + 2е-
29.
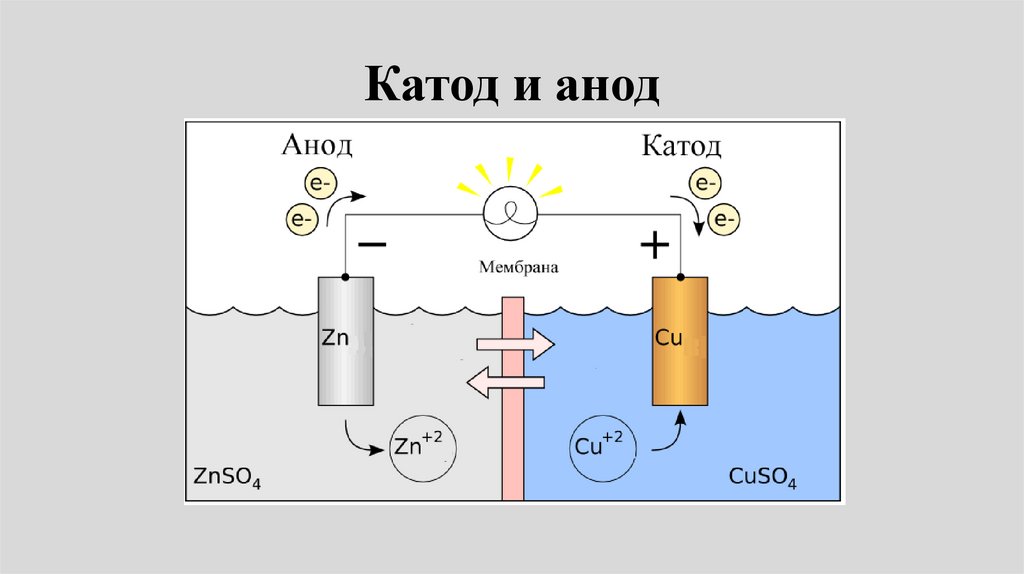
Катод и анод30.
•Электрохимическую цепь(гальванический элемент)
принято записывать так, чтобы
анод (-) находился слева.
•На аноде протекает реакция
окисления:
2+
•Zn = Zn + 2e
31.
•Катод (+) должен находитсясправа.
•На катоде протекает реакция
восстановления:
•Cu2+ + 2e- = Cu
32.
•Электродные реакции на обоихэлектродах обычно записывают как
реакции восстановления:
•Сu2+ + 2е- = Сu
2+
•Zn + 2e = Zn
•Cu2+ + Zn = Сu + Zn2+
33.
• Общая реакция (токообразующаяреакция) в гальваническом элементе
записывается как разность между
реакциями, протекающими на
правом и левом электродах:
• Правый электрод: Сu2+ + 2е- = Сu0
• Левый электрод: Zn2+ + 2е- = Zn0
• Общая реакция :
• Cu2+ + Zn = Сu + Zn2+.
34.
• Гальвани - потенциал (междуконтактирующими фазами) нельзя
рассчитать и измерить. А знать
потенциалы для различных расчетов
очень хочется!!!!
• Как быть?
• Придумали измерять потенциалы
электродов (разность потенциалов)
относительно электрода (стандартного),
потенциал которого приняли за 0.
35.
•Выбрали в качестве левогоэлектрода некий стандартный
электрод сравнения, его
электродный потенциал при
всех температурах приняли за
нуль.
•Что это за электрод? Кто знает?
36.
• Стандартный водородныйэлектрод это водородный
электрод с активностью ионов Н+
(Н3О+) в растворе, равной 1, и
парциальным давлением
газообразного водорода, равным 1
атм.
• На водородном электроде
протекает реакция:
• Н+ + e- 1/2Н2,
• и его потенциал принимается
равным нулю при любой
температуре.
37.
• Измеряют ЭДС цепи, составленной изэтого стандартного электрода (слева)
и исследуемого электрода (справа).
• Измеренную ЭДС считают
электродным потенциалом
(условным электродным
потенциалом) исследуемого
электрода.
38.
• Согласно конвенции Международногосоюза по чистой и прикладной химии
(IUPAC, 1953 г.), электродный
потенциал Е это ЭДС цепи,
составленной из исследуемого электрода
L| M (справа) и стандартного
водородного электрода (слева):
39.
• Обычно в качестве электродовсравнения используют не
водородный электрод, а электроды
с постоянным Е:
• хлорид-серебряный, каломельный,
ртутно-сульфатный и ртутнооксидный электроды.
40.
Термодинамическаятеория ЭДС
41.
• При равновесном режиме работыгальванического элемента (ток в
цепи I 0) может быть получена
максимально возможная полезная
работа электрическая работа:
• rG = Wmax = n F E
• F – число Фарадея – 96500 К/моль
42.
• Химическую реакцию,сопровождающуюся переходом электронов
между молекулами двух участвующих в
реакции веществ можно записать в виде:
1Ox1 2 Red 2 1Red1 2 Ox 2 (1)
где Ох – окисленная форма, Red –
восстановленная форма, например:
Сu2+ + Zn = Сu +Zn2+
43.
• В электрохимической цепи эта реакцияразбивается на два электродных процесса или
две окислительно-восстановительные
полуреакции:
Ox1 n1e Red1 (а)
Ox 2 n 2e Red 2 (б)
2+ + 2е = Сu0
Сu
Например:
Zn2+ + 2e = Zn0
На самом деле вторая реакция – реакция окисления
Zn = Zn2+ + 2e- , но принято записывать обе реакции как реакции
восстановления.
44.
•Для реакции (1), протекающей вэлектрохимической цепи
постоянных температуре и
давлении, максимальная полезная
работа W max равна:
r G RT ln K a RT i ln ai
Wmax
(2)
45.
46.
С другой стороны максимальная полезнаяработа, совершаемая обратимой
электрохимической цепью равна
электрической работе:
r G n F E (3)
Wmax
Объединяя (2) и (3), получаем:
RT
RT
E
ln Ka
i ln ai (4)
n F
n F
47.
Первое слагаемое правой части уравнения(4) при заданных Р и Т - величина
постоянная.
Это – стандартная ЭДС электрохимической
цепи (Е°) - при активности каждого
участвующего в реакции вещества, равной
единице:
RT
E
ln Ka
nF
0
48.
С учетом (4) получаем:RT
E E
i ln ai
nF
0
(5)
Для реакции (1) уравнение (5) имеет вид:
1
2
a
a
RT
Re
d
0
1 Ox 2
E E
ln 1 2
nF aOx1 aRe d 2
- уравнение Нернста (1890)
(6)
49.
Так как электрохимический процесс (1)представляет собой разность двух
электродных процессов, то и ЭДС можно
представить разностью двух электродных
потенциалов соответственно:
1
Re d1
1
Ox1
a
RT
0
E1 E1
ln
n F a
пр
2
Re d 2
2
Ox2
RT a
E2 E
ln
n F a
лев
0
2
a
RT
Re d1
0
E1
ln
n1F aOx1
RT aRe d2
E
ln
n2 F aOx2
0
2
50.
• где Е01 и Е02 стандартные потенциалыэлектродов, а n1 1 = n2 2 = n.
• В общем виде потенциал электрода
можно записать через активности всех
веществ, участвующих в электродном
процессе:
RT
Ei E
i ln ai
n F
0
i
(7)
уравнение Нернста для электродного
потенциала
51.
В общем виде выражение для ЭДС:1
Re d1
1
Ox1
RT a
E ( E1
ln
n F a
0
RT a
) ( E2
ln
n F a
0
E1 E2
пр
2
Re d 2
2
Ox2
лев
- уравнение Нернста (1890)
)
52.
Элемент Якоби-Даниэля53.
20
2
0
Cu 2е Cu
Zn 2е Zn
Напоминаю, что на самом деле цинк окисляется, но так принято
записывать как реакцию восстановления:
E ЕCu 2 ЕZn 2 ( E
0
Cu 2
(E
0
Zn 2
RT aCu 0
ln
)
2 F a Cu2
RT aZn 0
ln
)
2 F aZn 2
Активности чистых металлов:
aCu 0 aZn 0 1
54.
Окончательно Е элемента Даниэля –Якоби как разница двух
электродных потенциалов:
E ЕCu 2 ЕZn 2 ( E
0
Cu 2
(E
0
Zn 2
RT
ln аCu 2 )
2F
RT
ln aZn 2 )
2F
55.
Для всей токообразующей реакции:2
Cu Zn Cu Zn
где
0
0
2
a
RT
0
Сu 2
Е E
ln
2 R aZn 2
E E
0
0
Cu 2
RT mCu 2
0
E E
ln
2F mZn 2
E
0
Zn 2
- для сильно
разбавленных
растворов
56.
Стандартный электродныйпотенциал
57.
• Стандартный электродный потенциал Еравен ЭДС цепи, составленной из
стандартного водородного электрода (слева)
и исследуемого электрода (справа) в
стандартном состоянии (т.е. при активности
потенциалопределяющих ионов в растворе,
равной 1).
58.
• Стандартные электродные потенциалы иотвечающие им электродные реакции
восстановления сведены в справочники
(табулированы).
• Знак стандартного электродного потенциала
означает, что потенциал данного электрода
более положителен или более
отрицателен, чем потенциал стандартного
водородного электрода.
59.
• Например, стандартные электродныепотенциалы цинкового и медного
электродов определяются как ЭДС
цепей:
• Cu | Pt | Н2 Н+ ¦¦ Zn2+ | Zn | Cu,
• Сu | Pt | Н2 H+ ¦¦ Cu2+ | Cu
• и равны Е°(Zn2+/ Zn) = 0,760 В и
• Е°(Cu2+/ Cu) = + 0,340 В при 298 К.
60.
• Зная значения стандартныхпотенциалов, можно рассчитать
стандартную ЭДС гальванического
элемента.
• Например, для элемента ДаниэляЯкоби стандартная ЭДС равна:
61.
• На электроде с более положительнымстандартным электродным потенциалом
протекает реакция восстановления
(присоединение электронов):
• М1Z+ + z e М1,
• а на электроде с более отрицательным
стандартным электродным потенциалом
протекает реакция окисления (отдача
электронов):
• М2 z e М2 Z+
62.
Электроды первого рода63.
• Электроды первого рода –электрохимическая система, состоящая из
электронного проводника (металла или
металлоида), погруженного в раствор,
содержащий его ионы.
• Условное изображение электрода
(электронный проводник - металл):
• MZ+ M
• Электродная реакция:
• MZ+ + ze- M
• Вертикальная черта – граница раздела фаз.
64.
• В электродах первого родавосстановленной формой является
металл электрода, а окисленной
формой - ионы этого металла
(простые или комплексные).
65.
• Электроды первого рода обратимыпо катиону, это означает что их
потенциал является функцией
активности катиона.
• Примерами электродов первого рода
являются электроды элемента
Даниэля-Якоби:
• Zn2+ Zn Cu2+ Cu
66.
Элемент Даниэля-Якоби:67.
Схемаэлектрохимическо
й цепи,
химическая
реакция и
уравнение для
электродного
потенциала
электродов 1-го
рода:
68.
Cu Pt | H 2 H ||Mz
M ze M
0
z
M Сu
z
0
M H 2 M zH
2
z
1 / 2H 2 H e z
RT
RT aM
RT
0
EМ Z |M ln K a ln
EМ Z |M ln aM z
zF
zF aM Z
zF
n=z
69.
• Общая формула для потенциалаэлектрода первого рода:
RT
Е E
ln ai
zi F
0
Е0 - стандартный потенциал, zi - заряд
потенциалопределяющих ионов, ai активность потенциалопределяющих ионов
в растворе.
70.
Электроды второго рода71.
• Электрод второго рода этоэлектрохимическая система,
состоящая из металла, покрытого
слоем его малорастворимого
соединения (соли, оксида или
гидроксида) и погруженного в
раствор хорошо растворимого
электролита, содержащий тот же
анион, что и малорастворимое
соединение электродного металла.
72.
Схема, электродная реакция и потенциалэлектрода второго рода:
z
A | M A | M
M A ne M A
z
n z z
Если вещество МА:
E z
A
E
/ MA / M
Пример:
0
z
A / MA / M
RT
ln a A z (1)
nF
AgCl e Ag Cl
73.
Другая трактовка электродавторого рода:
74.
Постарайтесь понять трактовкуэлектрода второго рода:
75.
• Электрод второго рода можнорассматривать как электрод первого
рода, обратимый относительно катиона:
• Mz+ + ze M,
• у которого активность Mz+ определяется
растворимостью МА.
Электродный потенциал тогда равен
ЕM z / M E
0
M z / M
RT
ln aM z (2)
zF
76.
• В простейшем случае, для соединения МАактивность катиона равна:
• аMz+ = L/aAz(3)
• L – произведение растворимости
(активностей) МА.
• Подстановка (3) в (2) дает выражение для
электродного потенциала:
ЕM z / M E
0
M z / M
RT
RT
(4)
ln L
ln a Az
zF
zF
77.
• Сопоставление выражений (1) и (4)дает:
Е
0
A z / MA / M
E
0
M z / M
RT
ln L
zF
Из сопоставления потенциалов
соответствующих электродов первого и
второго рода можно найти произведение
растворимости малорастворимых
соединений.
78.
Хлорсеребряный электрод79.
• Губчатое серебро, покрытое осадкомхлорида серебра в растворе хлорида
калия:
Ag | AgCl | Cl
AgCl e Ag Cl
ECl / AgCl / Ag E
0
Cl / AgCl / Ag
RT
ln a
Cl
F
80.
Каломельный электрод81.
• Каломельный электрод представляетсобой ртуть, покрытую пастой из
смеси каломели со ртутью,
находящуюся в контакте с раствором
хлорида калия:
Hg | Hg 2Cl2 | Cl
82.
• Электродная реакция сводится квосстановлению каломели до
металлической ртути и аниона
хлора:
1/ 2Hg 2Cl2 e Hg Cl
Электродный потенциал:
ECl / Hg Cl / Hg E
2
2
0
Cl / Hg 2Cl 2 / Hg
RT
ln aCl
F
83.
• Е электрода определяется активностьюионов хлора aCl-, поэтому концентрация
KCl в растворе должна быть точно
известна.
• Наиболее часто употребляют в качестве
электродов сравнения каломельные
электроды c концентрацией KCl: 0,1; 1,0
и насыщенный раствор
В табл. 79 на стр.146 даны точные
значения Е каломельного электрода при
указанных концентрациях KCl
84.
• Каломельный, ртутно-сульфатный,ртутно-оксидный и хлорсеребряный
электроды получили широкое
распространение в качестве
электродов сравнения.
• Они могут быть использованы для
определения произведения
растворимости малорастворимых
соединений.
85.
Окислительновосстановительные электроды86.
• Окислительно-восстановительныеэлектроды (редокс-электроды) –
электрохимические системы,
состоящие из инертного проводника
(обычно Pt), погруженного в раствор,
содержащий и окисленную, и
восстановленную формы вещества.
87.
• Окислительно-восстановительныеэлектроды принципиально отличаются
других тем, что катионы и анионы,
изменяя свой заряд, не выделяются на
электродах и не появляются в растворе
в результате ионизации материала
электрода.
• Материал электрода не принимает
участия в реакции, он инертный (Pt)
88.
• Окислительно-восстановительныеэлектроды можно разделить на простые
и сложные.
• Для простых окислительновосстановительных электродов
электродная реакция сводится к
перемене зарядов ионов без изменения
их состава. Например:
3
Fe e Fe
2
89.
• Если обозначить окисленные ионыOx, а восстановленные Red, то
написанные выше реакции можно
выразить общим уравнением:
Ox ne Red
Red, Ox | Pt - схема записи и потенциал
ERеd ,Ox E
0
Rеd ,Ox
RT aOx
ln
nF aRеd
90.
• В сложных ред-окс электродах протекаетреакция с изменением заряда реагирующих
частиц и их состава.
• В таких реакциях обычно участвуют ионы
Н3О+, OН и молекулы воды.
4
2
MnO 8H 5e Mn 4 H 2O
4
2
MnO , Mn , H | Pt
91.
Как определить идет окислительновосстановительная реакция или нет?92.
Например:• Будет ли идти реакция
• SnCl4 + 2FeCl2 = SnCl2 + + 2FeCl3?
• Здесь SnCl4 окислитель и восстанавлявается, а
FeCl2 – восстановитель и окисляется.
• Мы имеем две полуреакции, осуществим их в
гальваническом элементе, состоящем из двух ОВ
электродов:
• Правый – катод, на нем должна идти реакция
восстановления: Sn4+ +2e Sn2+ . Стандартный
электродный потенциал такого электрода:
• Е°(Sn4+/ Sn2+) = +0,15 В.
• Левый – анод, на нем должна идти реакция
окисления: Fe2+ 1е Fe3+
• Е°(Fe3/Fe2+) = +0,77 В
93.
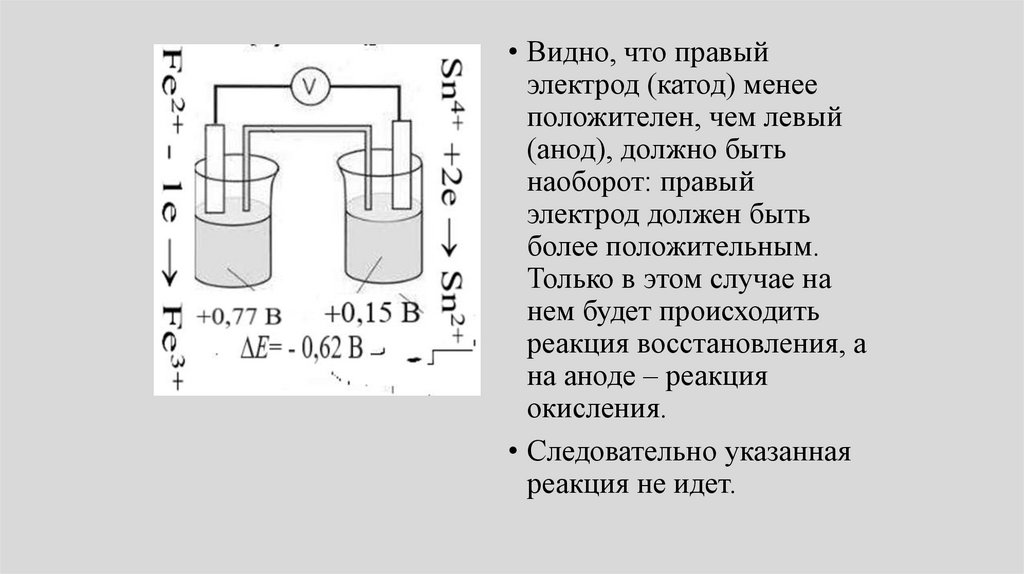
• Видно, что правыйэлектрод (катод) менее
положителен, чем левый
(анод), должно быть
наоборот: правый
электрод должен быть
более положительным.
Только в этом случае на
нем будет происходить
реакция восстановления, а
на аноде – реакция
окисления.
• Следовательно указанная
реакция не идет.
94.
Как это дают в курсе общей химии• Пример 7. Будет ли идти реакция
• SnCl4 + 2FeCl2 = SnCl2 + 2FeCl3?
• Решение. В таблице находим
• Е°(Sn4+/ Sn2+) = +0,15 В,
• Е°(Fe3/Fe2+) = +0,77 В.
• Оказалось, что исходный окислитель SnCl4
слабее, чем образующийся окислитель FeCl3.
Реакция самопроизвольно идти не может.
95.
• Условием состояния равновесия является равенство потенциаловокислительно-восстановительных пар, участвующих в реакции.
• Напишем реакцию в общем виде
Для обеих пар окислитель-восстановитель:
ERеd ,Ox E
0
Rеd ,Ox
RT aOx
ln
nF aRеd
ERеd ,Ox E
0
Rеd ,Ox
RT aOx
ln
nF aRеd
В состоянии равновесия Е равны друг другу
n F (E02 - E01) = RTlnKa
96.
• Е°1 — стандартный редокс потенциал пары,содержащей исходный окислитель, Е°2 —
стандартный редокс потенциал пары,
содержащей исходный восстановитель. Если
Е°1 > Е°2 , то константа равновесия больше
единицы, и равновесие сдвинуто вправо.
• Если разность электродных потенциалов
превышает 0,2 В, то реакция протекает
практически необратимо.
97.
Определение термодинамическиххарактеристик реакций,
протекающих в гальваническом
элементе
98.
•Зная стандартную ЭДСгальванического элемента,
0
можно рассчитать rG и
константу равновесия
протекающей в элементе
реакции:
0
0
• rG = n F E = RTlnKa
99.
• Измеряя ЭДС элемента при несколькихтемпературах, можно определить (дЕ/дТ)
- температурный коэффициент ЭДС, зная
который, можно рассчитать rS и rН
реакции, протекающей в гальваническом
элементе:
• rS = n F (дЕ/дТ)P
• rH = rG + T rS
100.
Электролиз101.
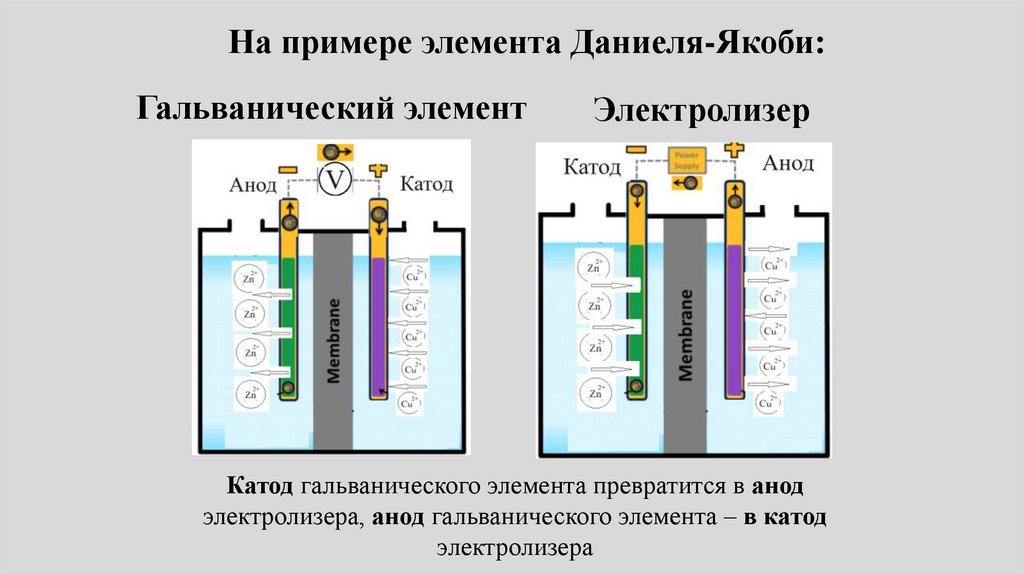
Если внешняя разность потенциалов,подаваемая на гальванический элемент,
превысит равновесную, то он
превратится в электролизер!
Катод гальванического элемента превратится в
анод электролизера, анод гальванического
элемента – в катод электролизера
102.
На примере элемента Даниеля-Якоби:Гальванический элемент
Электролизер
Катод гальванического элемента превратится в анод
электролизера, анод гальванического элемента – в катод
электролизера
103.
• Под действием внешнего электрического поля(разности потенциалов на электродах) пошла
термодинамически запрещенная реакция:
• Сu0 + Zn2+ = Cu2+ + Zn0
• Вода является очень устойчивым к разложению
веществом, но и она может быть разложена на простые
вещества электролизом:
2Н2О 2Н2 + О2
Это окислительно-восстановительная реакция, не идущая
самопроизвольно. Требуется принудительный отрыв электронов
от кислорода и перенос их к водороду. На это затрачивается
энергия поля (совершается электрическая работа).
104.
Электролиз – процесс превращенияэлектрической энергии в химическую.
Процесс синтеза или разложения веществ с
помощью электрического тока.
Реализация несамопроизвольных ОВР:
В гальваническом элементе протекает
самопроизвольная реакция rG < 0, если
ЭДС > 0.
105.
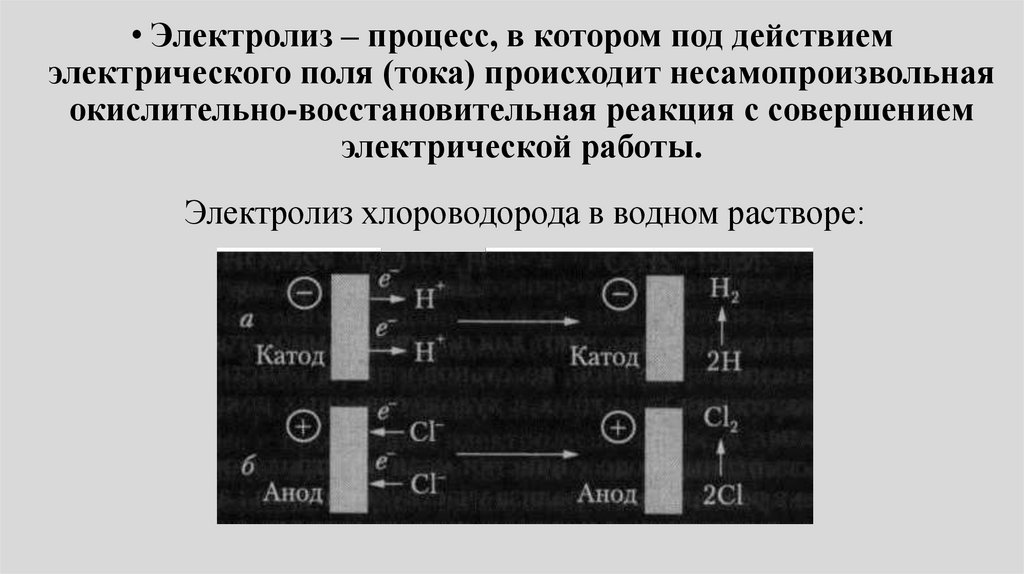
• Электролиз – процесс, в котором под действиемэлектрического поля (тока) происходит несамопроизвольная
окислительно-восстановительная реакция с совершением
электрической работы.
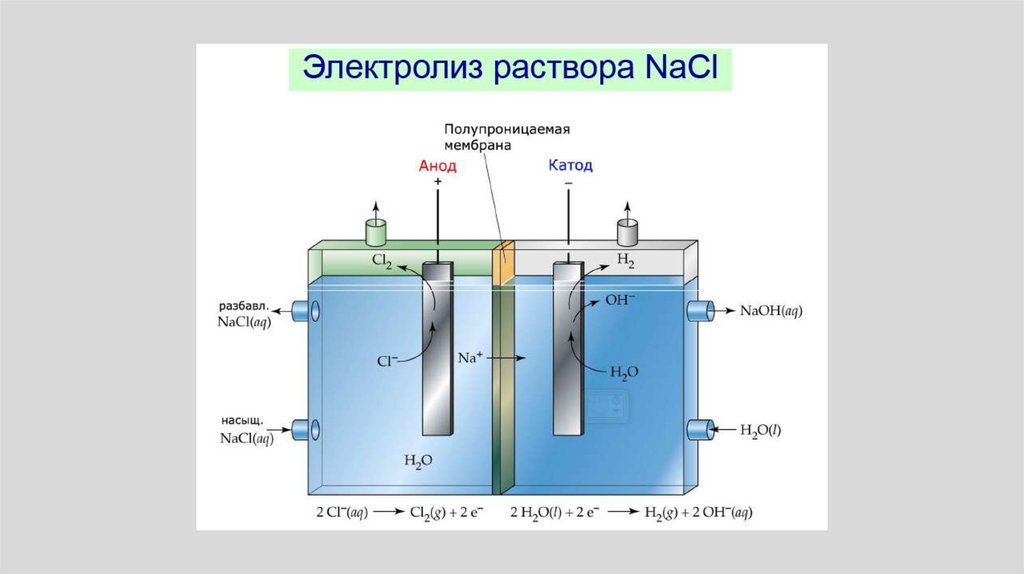
Электролиз хлороводорода в водном растворе:
106.
Электролиз хлороводорода в водном растворе• Ионы водорода (Н+) движутся к катоду (-) и получают от него
электроны (восстанавливаются). Атомы водорода соединяются в
молекулы, и из электролита вблизи катода выделяется
газообразный водород.
• Ионы хлора (Cl-) движутся к аноду (+) и отдают электроны
(окисляются). Атомы хлора тоже соединяются в молекулы, и
выделяется газообразный хлор.
• Как и в случае гальванического элемента на аноде протекает
реакция окисления, на катоде протекает реакция
восстановления.
107.
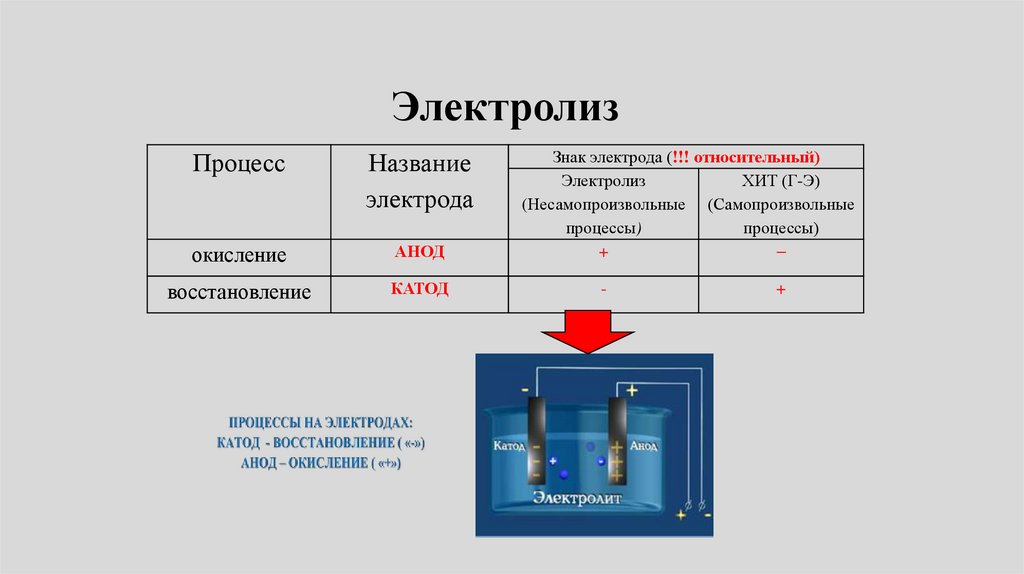
ЭлектролизПроцесс
Название
электрода
окисление
АНОД
восстановление
КАТОД
Знак электрода (!!! относительный)
Электролиз
ХИТ (Г-Э)
(Несамопроизвольные (Самопроизвольные
процессы)
процессы)
+
-
+
108.
109.
110.
Электролиз и электролизеры• Устройство для электролиза называется
электролизером или электролизной ячейкой.
• Это ёмкость с раствором или расплавом электролита и
опущенными в него электродами из металла или
графита.
• Катодом может служить металлический материал
ячейки (емкости). К электродам прикладывают
разность потенциалов от внешнего источника
постоянного тока. Отрицательный электрод катод
отдает электроны катионам в электролите и
восстанавливает их, т.е. – идет реакция
восстановления. Положительный электрод анод
отбирает электроны от анионов в электролите, окисляя
их – т.е. идет реакция окисления.
111.
• Обратимое осуществление процесса (I 0) означаетбесконечно медленное его протекание.
• Т.е. если на электроды электролизера подать разность
потенциалов, равную равновесной Е, то ток через
электролизер не пойдет, продукты электролиза не
получим.
• А электролиз применяют для получения химических
продуктов в многотоннажных производствах:
восстановления и очистки металлов, нанесения
защитных и художественных покрытий на металлы
• Т.е. такие реальные процессы должны происходить с
конечной скоростью (как можно быстрее).
• Для этого потенциал, прикладываемый к электродам
должен быть выше равновесной Е.
112.
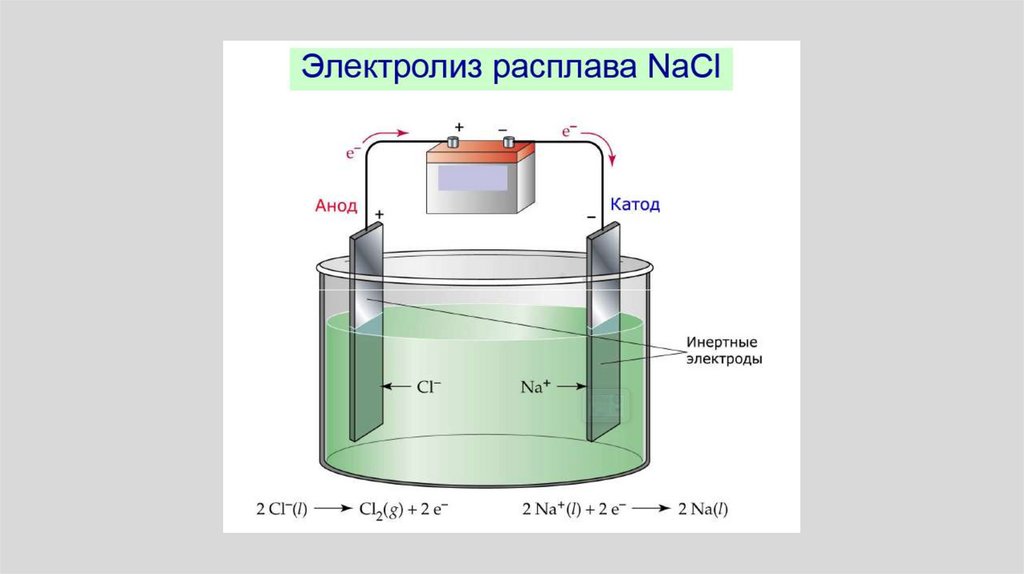
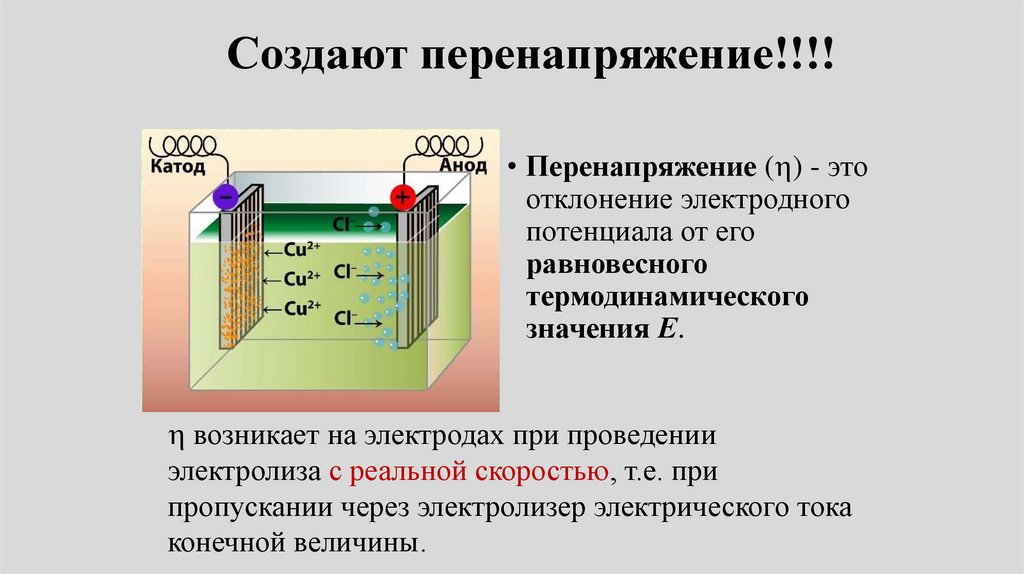
Создают перенапряжение!!!!• Перенапряжение ( ) - это
отклонение электродного
потенциала от его
равновесного
термодинамического
значения Е.
возникает на электродах при проведении
электролиза с реальной скоростью, т.е. при
пропускании через электролизер электрического тока
конечной величины.
113.
Перенапряжение обусловленополяризацией электрода
• Отклонение потенциала от равновесного под действием
внешнего потенциала (или при протекании тока)
вызывается электрохимической поляризацией
электрода.
• Исследование перенапряжения позволяет понять
механизмы электрохимических реакций в данной
системе (оно проводится с помощью потенциостатов с
использованием вращающегося дискового электрода).
114.
Природа поляризации• Поляризация связана с торможением тех или иных
процессов на электроде:
• диффузионное перенапряжение связано с
медленной диффузией ионов и др. веществ в зоне
электрода
• перенапряжение замедленного
разряда обусловлено медленностью собственно
электрохимической стадии разряда ионов на
электроде.
115.
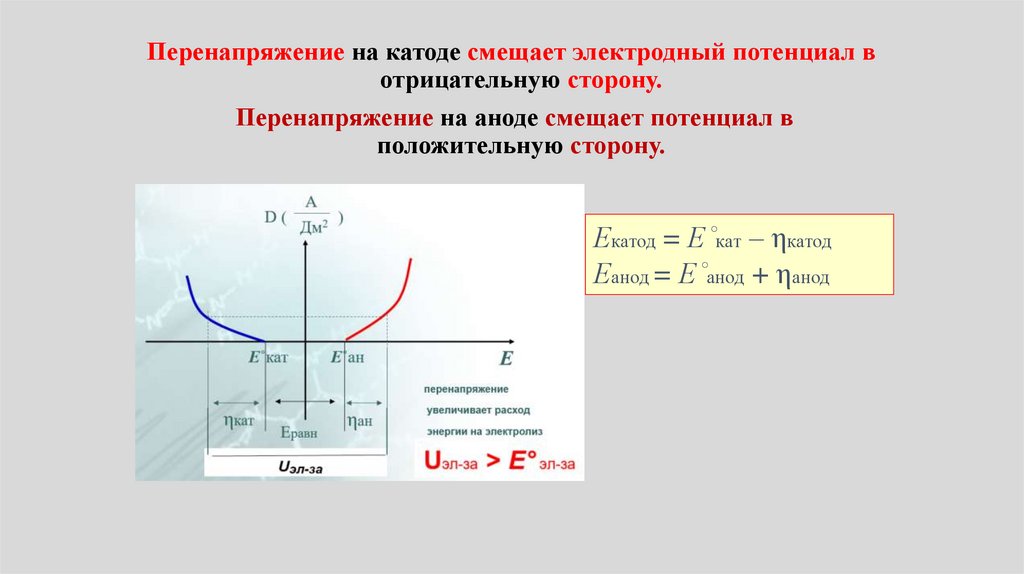
Потенциалы на электродах при электролизеЕ(катод) = Е˚кат – ηкатод
Е(анод) = Е˚анод + ηанод
Е˚катод стандартный (равновесный)
электродный потенциал на катоде ( )
Е˚анод – стандартный (равновесный) электродный
потенциал на аноде (+)
(!!! для упрощения не рассматриваем зависимость
Е от концентрации, считаем, что активности
потенциалопределяющих ионов равна 1)
ηкатод – перенапряжение на катоде
ηанод перенапряжение на аноде
116.
Перенапряжение на катоде смещает электродный потенциал вотрицательную сторону.
Перенапряжение на аноде смещает потенциал в
положительную сторону.
Екатод = Е˚кат – ηкатод
Еанод = Е˚анод + ηанод
117.
Перенапряжение и факторы, влияющие на η:η – перенапряжение отклонение потенциала
электрода от равновесного при протекании
через электрод конечного электрического тока
Перенапряжение отражает те дополнительные
энергетические затраты, которые необходимы для
преодоления
сопротивления
электролита
(поляризацию электродов) при конечной скорости
электролиза.
Зависит от:
1) Плотности или силы (плотности) тока (скорости
процесса);
2) Природы разряжающегося иона;
3) Материала электрода и состояния его поверхности;
4) Концентрации электролита.
118.
Плотность (сила) тока j. Скоростьпроцесса
А
j ( Дм2 )
Е˚кат
= а + b lgi
(уравнение Тафеля)
Чем больше плотность тока, тем выше
Е˚ан
Е
перенапряжение
ηкат
Е равн
Uэл-за
ηан
увеличивает расход
энергии на электролиз
Uэл-за > Е равн
119.
Природа разряжающегося иона• Металл, Меn+
Перенапряжение при выделении Ме минимально, им можно
пренебречь в расчетах.
• Неметалл, газообразные вещества
Т.к. неметалл, как правило, диэлектрик, то это приводит к
возникновению значительного η (поляризация), величина которого
зависит от природы разряжающегося иона и материала электрода.
Pt, O2
OH-
электрод
Pt, H2
Н2
электролит
H+
120.
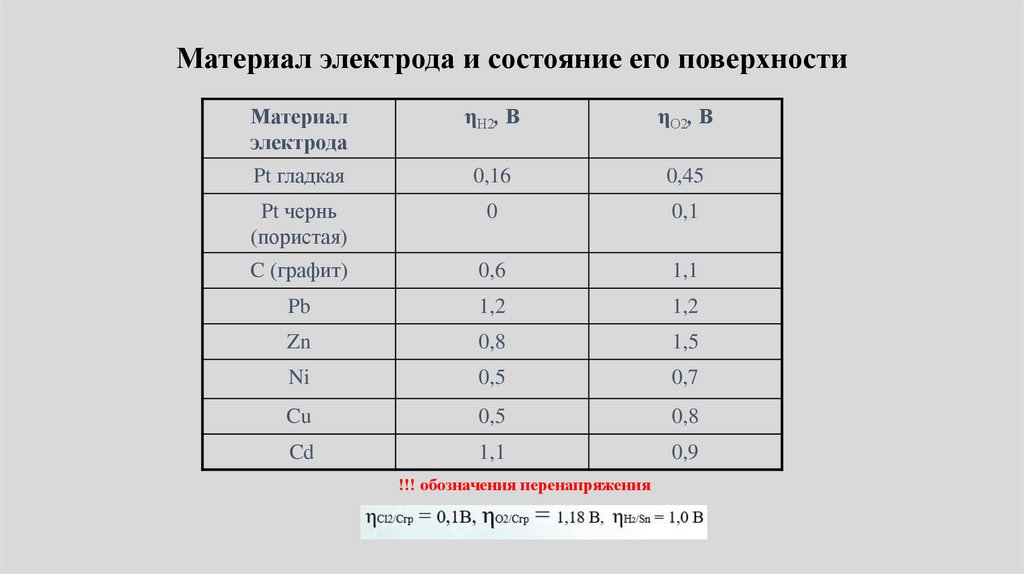
Материал электрода и состояние его поверхностиМатериал
электрода
ηН2, В
ηО2, В
Pt гладкая
0,16
0,45
Pt чернь
(пористая)
0
0,1
C (графит)
0,6
1,1
Pb
1,2
1,2
Zn
0,8
1,5
Ni
0,5
0,7
Cu
0,5
0,8
Cd
1,1
0,9
!!! обозначения перенапряжения
121.
Материал, нужный для решениязадач
ОПРЕДЕЛЕНИЕ ПРОДУКТОВ
ЭЛЕКТРОЛИЗА
По значению электродного потенциала
(Е ± η) – можно идентифицировать
продукты электролиза на электродах,
установить
основной
электродный
процесс из ряда конкурирующих с ним
процессов.
122.
Установление катодных и анодных процессовВ водных растворах электролитов одним из
конкурентов ионов, реагирующих на электродах
являются вода Н2О.
При конкурирующих процессах
на катоде ( ) в первую очередь происходит та
электродная реакция, которая имеет
больший (более положительный)
электродный потенциал (с учетом
перенапряжения),
на аноде (+) в первую очередь происходит та
электродная реакция, которая дает
меньший электродный потенциал (с
учетом перенапряжения).
123.
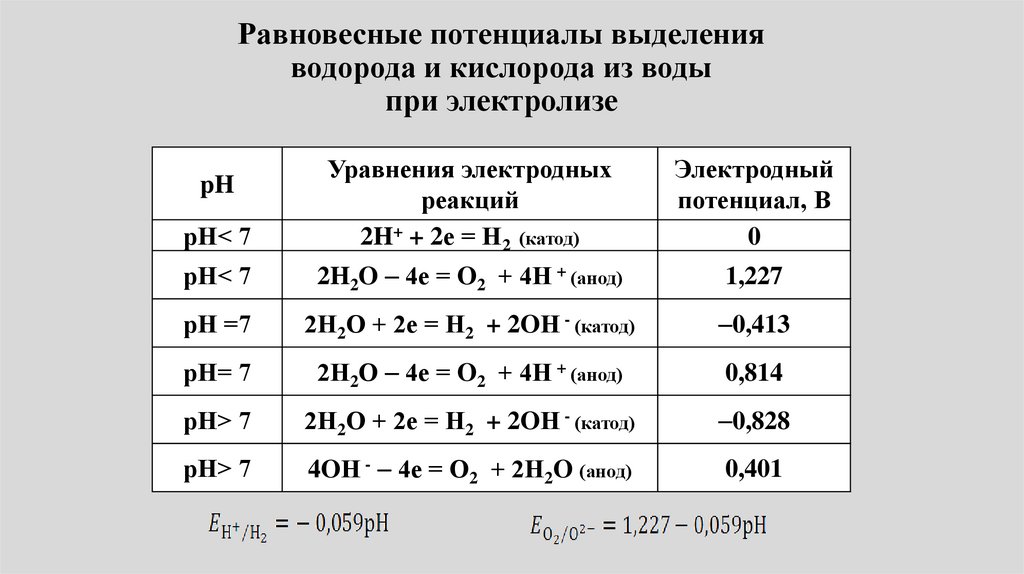
Равновесные потенциалы выделенияводорода и кислорода из воды
при электролизе
рН< 7
Уравнения электродных
реакций
2H+ + 2е = Н2 (катод)
Электродный
потенциал, В
0
рН< 7
2H2O 4е = O2 + 4Н + (анод)
1,227
рН =7
2Н2О + 2е = Н2 + 2OН - (катод)
0,413
рН= 7
2Н2О 4е = O2 + 4Н + (анод)
0,814
рН> 7
2Н2О + 2е = Н2 + 2OН - (катод)
0,828
рН> 7
4OН - 4е = О2 + 2Н2O (анод)
0,401
pH
124.
Пример 1125.
126.
Электролиз растворов солей с металлическимкатодом и инертным анодом
Пример 2.
Какие процессы протекают при электролизе раствора SnCl2 в кислой среде
(рН < 7) НCl? C(граф) – анод, Sn – катод,
I. SnCl2 → Sn2+ + 2ClН2О
Н+ + ОННСl → H+ + Cl-
II. Конкурирующие процессы на катоде:
(1) Sn2+ + 2e → Sn˚
ЕSn = Е˚Sn – ηSn/Sn = 0,14 В
(2) 2Н+ + 2е → Н˚2
ЕН2 = Е˚Н2 ηН2/Sn = 1,0 В
Е1 > Е2 => (1). На катоде из-за большого ηН2/Sn процесс
выделения Н2 не происходит.
III. Конкурирующие процессы на аноде:
(3) 2Cl- – 2e → Cl2
(4) 2H2O – 4e → O2 + 4H+
Е3 < Е2 => (3)
Е3 = Е˚Cl2 + ηCl2/C(гр.) = 1,46 В
E4 = Е˚O2 + ηO2/C(гр.) = 2,37 В
IV. Sn2+ + 2е + 2Сl- – 2e → Sn˚↓ + Cl2˚↑
127.
Электролиз растворов солей с металлическиманодом и катодом
Пример 3
Какие процессы происходят при электролизе раствора
СuCl2 в кислой среде (рН ≈ 0), если катод- Сu, анод- Сu
СuСl2 → Cu+2 + 2ClН2О
Н+ + ОНHCl → H+ + ClКонкурирующие процессы на катоде:
(1) Сu+2 + 2e → Cu˚
Е(1) = Е˚Cu2+/Cu = 0,34 В
(2) 2Н+ + 2е → Н˚2
Е(2) = ηН2/Cu = 0,5 В
Е1 > Е2 => (1)
128.
Конкурирующие процессы на аноде(3) 2Cl- – 2e → Cl2
(4) 2H2O – 4e → O2 + 4H+
!!! (5) Сu - 2e → Cu+2
Растворение анода
Е3 = Е˚Cl2 + ηCl2/Cu = 1,36 + 0,1=1,46 B
E4 = Е˚О2+ ηО2/Cu = 1,23 + 0,8 = 2,03 B
Е5 = Е˚Cu + ηCu/Cu = 0,34 B
Уравнение электролиза
Сu2+ + 2е + Cu˚– 2e → Cu˚↓ + Cu+2
оседает
на катоде
растворение
анода
129.
ВЫВОДЫ
1. Eсли материал анода инертный (графит или
платина), то при рассмотрении электролиза
учитывается конкуренция только растворенного
вещества и растворителя (примеры 1 и 2)
2. Если анод металлический, то среди конкурирующих
процессов необходимо учесть растворение самого анода
(пример 3).
3. При электролизе водных растворов галогенидов на
аноде в свободном виде будет выделяться галоген (кроме
фтора), т.к. потенциал выделения галогена на любом
электроде всегда меньше потенциала выделения O2 на
аналогичных электродах.
Eгалогенов< EО2 из воды
4. Щелочные и щелочноземельные металлы нельзя получить
электролизом из водных растворов из-за конкуренции воды на
катоде будет выделяться водород
130.
ЭЛЕКТРОЛИЗ. ВЫВОДЫ5. Изменяя величину перенапряжения, можно
управлять
процессом электролиза тем самым определять
состав продуктов.
Для этого нужно менять материал электрода или
плотность тока при электролизе (пример 2).
6. Потенциал разряда анионов оксокислот с учетом
перенапряжения больше 2.5 В и больше потенциала
выделения O2 из воды.
Ионы SO42- , PO43- , NO3- и т.п. при электролизе
из водных растворов не разряжаются,
т.к. EЭхОуn- > EО2 из воды !!!
131.
Очистка меди электролизом• Ели при электролизе участвует материал анода, то катодом
служит тонкая пластина чистого металла, а анодом слиток
металла (черновой - неочищенной) меди.
• На аноде атомы меди теряют электроны и переходят в раствор.
В электролите ионы меди движутся к катоду, получают с него
электроны и осаждаются на поверхности в виде чистого
металла.
• Анод постепенно растворяется, а на катоде наращивается чистая
медь. Некоторые примеси осаждаются на дно электролизера, а
другие остаются в электролите.
• На аноде и катоде идут противоположные процессы с одним и
тем же элементом, и в результате суммарная реакция при
очистке металла электролизом отсутствует.
132.
• Если материал анода участвует в реакцииокисления, то процесс называют электролизом с
активным анодом.
133.
Коррозия134.
Слово коррозия происходит от латинского«corrodere», что означает разъедать
Коррозией называется процесс
самопроизвольного разрушения
металлов под влиянием внешней среды .
Металлы составляют одну из основ
цивилизации на планете Земля.
135.
136.
С изделиями из железа мы на каждомшагу встречаемся в быту и знаем, как
много хлопот доставляют его
ржавление и сама ржавчина.
Ржавлением называют только
коррозию железа и его сплавов.
Другие металлы коррозируют, но не
ржавеют.
137.
• Различают коррозию химическую иэлектрохимическую.
138.
Химическая коррозия• Коррозия железа может быть описана
упрощенным уравнением:
4Fe + 3O2 + 2H2О = 2Fe2O3·H2О
ржавчина
• Алюминий – очень активный металл и
теоретически с водой должен был бы
взаимодействовать в соответствии с
уравнением:
2Al + 3H2О = Al2O3 + 3H2
Однако его поверхность покрывается плотной
пленкой оксида Al2O3, которая защищает металл
от воздействия воды и кислорода.
139.
Электрохимическая коррозия• Электрохимическая коррозия возникает при
соприкосновении металла или сплава металлов
с электропроводящей жидкостью, например
почвенной водой, водой в паровых котлах, и
особенно с различными реакционными
средами, главным образом в химической
промышленности.
• Достаточно присутствия тонкой пленки
жидкости на поверхности металла, чтобы
электрохимическая коррозия стала возможной.
140.
• Электрохимическая коррозия — разрушениеметалла, который находится в контакте с другим
металлом в присутствии электролита.
• При контакте двух металлов в процессе
электрохимической коррозии разрушается более
активный металл.
141.
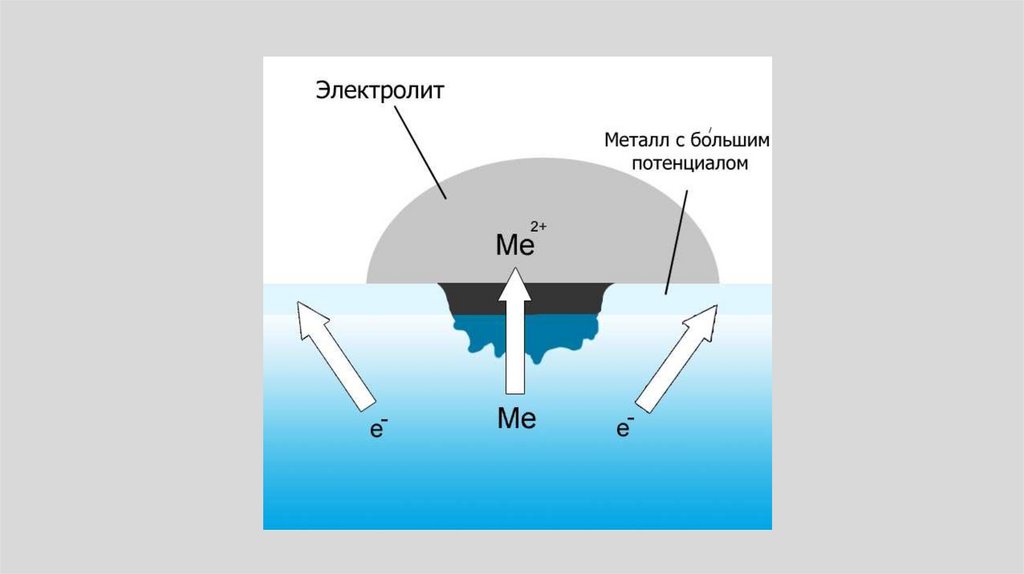
• Для объяснения коррозии Де-ла-Рив в 1830 г.выдвинул идею локальных (местных)
гальванических элементов, возникающих на
поверхности металлов, погруженных в
жидкость.
• Возникновение местного элемента проще всего
можно представить на примере контакта двух
металлов, каждый из которых находится в
соприкосновении с электропроводящей
жидкостью
142.
Типы электрохимической коррозии• 3 разновидности:
• щелевые поражения;
• питтинги;
• межкристаллическое повреждение.
143.
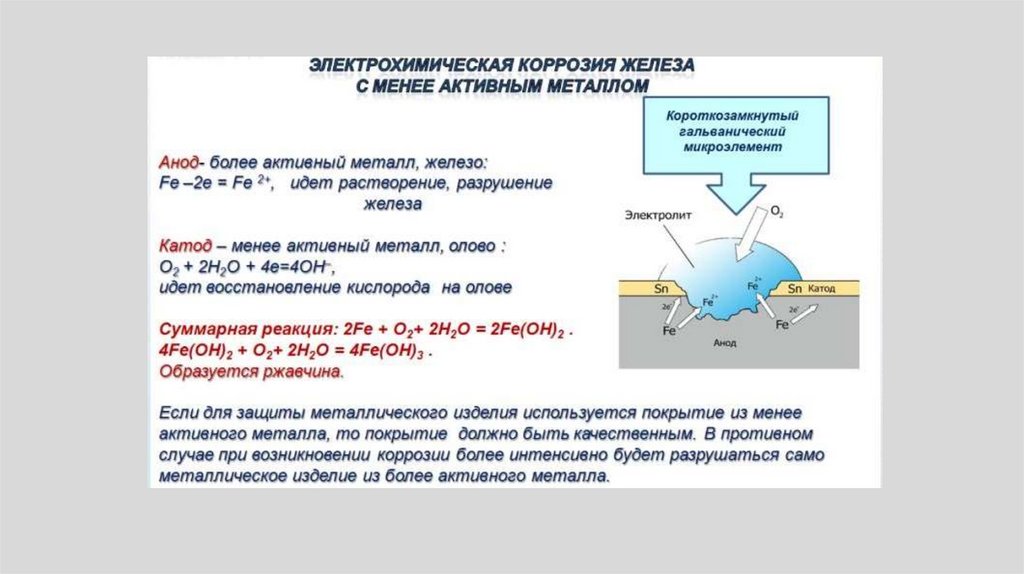
• Например, в случае контакта меди и железаобразуется накоротко замкнутый элемент,
растворимым полюсом которого является
железо, так как электроны переходят от
железа к меди.
• В природных растворах обычно содержатся
ионы H3O+ , Na+ , Mg2+ , Ca2+ , а также
растворенный кислород;
144.
• При контакте металлов электроны переходятот более электроотрицательного металла к
более электроположительному, вследствие
чего первый будет растворяться, а на втором
будут разряжаться ионы гидроксония или
восстанавливаться растворенный кислород.
• Это случай так называемой контактной
коррозии
145.
• Анодный процесс:• В случае коррозии железа:
• Fe → Fe2++ 2e-.
• ионы металла переходят в раствор.
• Катодный процесс
• Процесс зависит от свойств среды. В кислой среде
происходит водородная деполяризация
• 2H+ + 2e- → H2.
• В нейтральной среде – кислородная деполяризация:
• О2 + 2Н2О + 4е- 4ОН• С течением времени может происходить взаимное
замедление или ускорение анодного или катодного
процесса.
146.
147.
148.
149.
• Реальное существование местныхмикроэлементов было доказано
экспериментально Г.В. Акимовым, который
с помощью тонкого капилляра,
наполненного раствором, измерял
распределение потенциала вдоль
поверхности металла или сплава, причем
показал, что разности потенциалов между
отдельными частями поверхности обычно
равны нескольким милливольтам.
150.
• А.Н. Фрумкин развилэлектрохимическую теорию коррозии
металлов; он показал, что реакции
обуславливающие коррозию, могут
протекать при одном и том же
потенциале на одном и том же участке
поверхности металла.
151.
Эпоха Александра Фрумкина152.
• А.Н. Фрумкин доказал применимостьуравнения Гиббса к адсорбционным
явлениям (1919г), ввёл представление о
потенциале нулевого заряда (1927 г),
развил теорию электрокапиллярности,
и, объединив теорию Штерна и теорию
замедленного разряда Эрдей-Груз и
Фольмера, заложил основы кинетики
электрохимических реакций.
153.
Уехал друг. Еще в окне закат, чтонам пылал, не потускнел нимало,
а в воздухе пустом уже звенят
воспоминаний медленные жала.
Уехавшего комната полна его
движеньями и тишиною, и
кажется, когда взойдет луна, она
найдет его со мною…
Вера Михайловна Инбер (19901972)
154.
А.Н. Фрумкин иАмалия Обручева
в Карповском институте.
Конец 1920-х годов.
155.
156.
157.
158.
159.
Защита от коррозии160.
• Защита от коррозии основана насоздании защитных покрытий,
использовании электрохимических
методов, обработки электролита или
среды, использовании
антикоррозионных материалов
(пассивации металлов).
161.
Пассивация металлов• Если коррозия является процессом самопроизвольного
растворения металлов, то пассивирование связано с
потерей металлом этой способности. Следовательно, для
предохранения металла от коррозии необходимо
перевести его в пассивное состояние.
162.
В отличие от разбавленных,концентрированная серная, так же как и
концентрированная азотная кислоты, не
взаимодействует с железом.
Правильнее сказать, что кратковременное
взаимодействие происходит, но оно быстро
прекращается. Специалисты говорят, что в
крепких растворах этих кислот железо
пассивируется.
163.
• При пассивации на поверхности металлаобразуется сплошная и плотная оксидная
(реже хлоридная, сульфатная, фосфатная)
пленка толщиной в несколько десятков
нанометров.
164.
• Металлы можно перевести в пассивное состояниене только под действием окислителей, но и
электрохимически, подав на них положительный
потенциал.
• Способность металлов пассивироваться широко
используют для их защиты от коррозии.
• Устойчивыми к коррозии являются нержавеющие
стали, содержащие кроме железа, хром, никель,
марганец и малые добавки титана и ниобия.
• На изделиях из таких сплавов под действием
воздуха и воды возникает химически и
механически прочная окислительная пленка,
которая полностью пассивирует металл.
165.
Ингибиторы коррозии металлов• Ингибиторы – это вещества, способные в малых количествах
замедлять протекание химических процессов или останавливать
их. Название ингибитор происходит от лат. inhibere, что означает
сдерживать, останавливать.
• Применение ингибиторов – один из эффективных способов
борьбы с коррозией металлов в различных агрессивных средах.
166.
Создание защитных покрытий• Защитный антикоррозионный слой часто создают
путем нанесение сплошного слоя устойчивой
краски или другого металла.
• Лакокрасочные покрытия наиболее доступны для
широкого круга людей. Лаки и краски обладают
низкой газо- и паропроницаемостью,
водоотталкивающими свойствами и поэтому
препятствуют доступу к поверхности металла
воды, кислорода и содержащихся в атмосфере
агрессивных компонентов.
• Часто под лакокрасочный слой наносят слой
грунтовки.
167.
Использовании электрохимическихметодов
• В производственных условиях
используют также обработку изделий
переменным током в растворе фосфата
цинка.
• Фосфатные покрытия представляют
собой сетку плотносцепленных с
поверхностью фосфатов металлов,
защищающих его от коррозии.
168.
Итого• За долгий период интенсивной работы
металлургической промышленности выплавлено
огромное количество металла и переведено в изделия.
Этот металл постоянно коррозирует. Сложилась такая
ситуация, что потери металла от коррозии в мире уже
составляют около 30% от его годового производства.
Считается, что 10% прокорродировавшего металла
теряется (в основном в виде ржавчины) безвозвратно.
Возможно, в будущем установится баланс, при котором
от коррозии будет теряться примерно столько же
металла, сколько его будет выплавляться вновь.
• Из всего сказанного следует, что важнейшей проблемой
является поиск новых и совершенствование старых
способов защиты от коррозии.




























































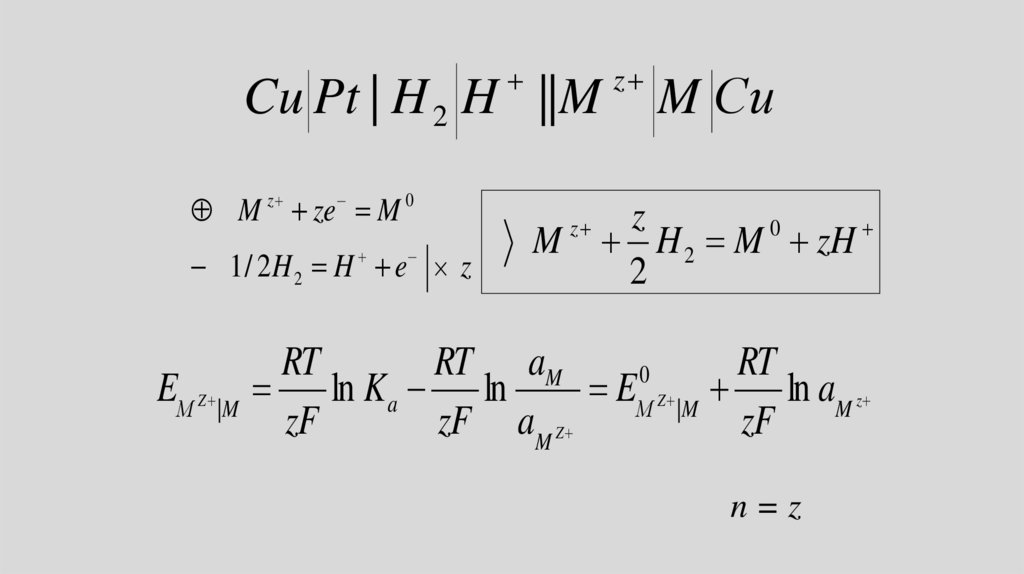




















































































 Химия
Химия








