Похожие презентации:
Электрохимия. Электроды. Гальванические цепи. Окислительно - восстановительные электроды
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙМЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Кафедра химии
Электрохимия. Основные понятия
электрохимии. Электроды. Гальванические
цепи. Окислительно-восстановительные
электроды
1. Электродный потенциал.
2. Строение ДЭС. Термодинамика ДЭС.
3. Уравнение Нернста.
4. Измерение величины электродных потенциалов.
Гальванические цепи.
5.Типы электродов.
Лектор:
Степанова Ирина Петровна, доктор биологических
наук, профессор, зав. кафедрой химии
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания об
основах электрохимии, возникновении
электродного потенциала, уравнении
Нернста, классификации электродов,
гальванических цепях.
РАЗВИВАЮЩАЯ: расширить кругозор
обучающихся на основе интеграции знаний,
развить логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать
формированию у обучающихся устойчивого
интереса к изучению дисциплины.
3.
ЭлектрохимияЭлектрохимия устанавливает
механизмы процессов и явлений,
протекающих на границе раздела фаз
с участием заряженных частиц, в том
числе и электрические явления в
живых организмах.
4.
Электрохимия5.
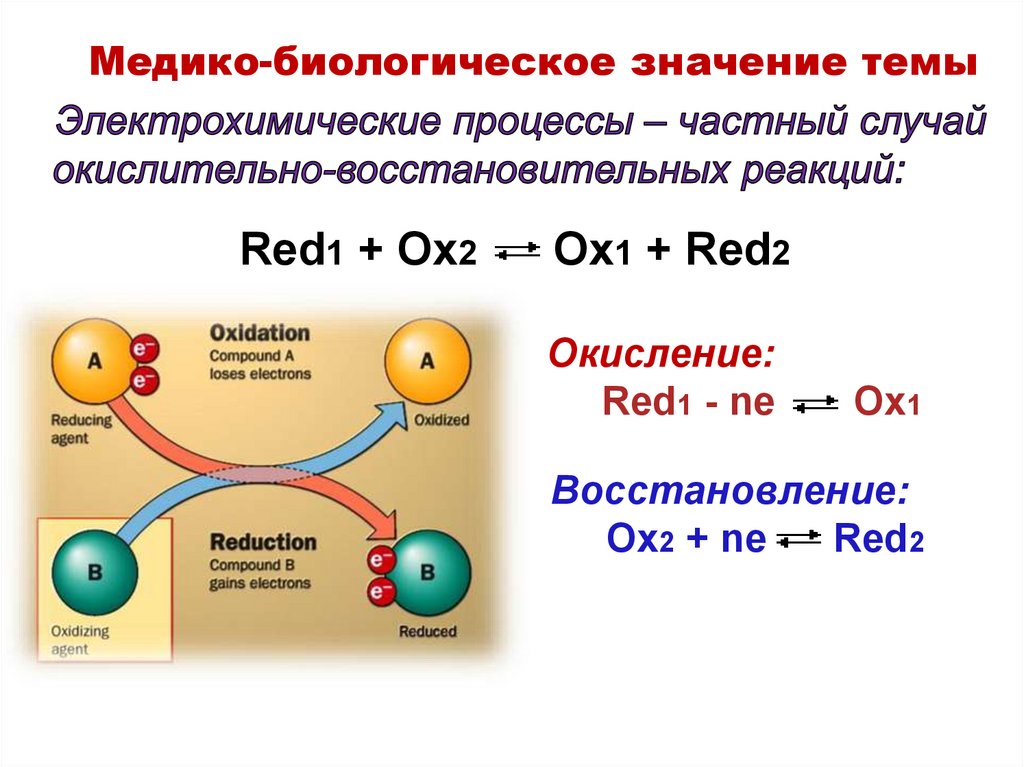
Медико-биологическое значение темыRed1 + Ox2
Ox1 + Red2
Окисление:
Red1 - ne
Ox1
Восстановление:
Ox2 + ne
Red2
6.
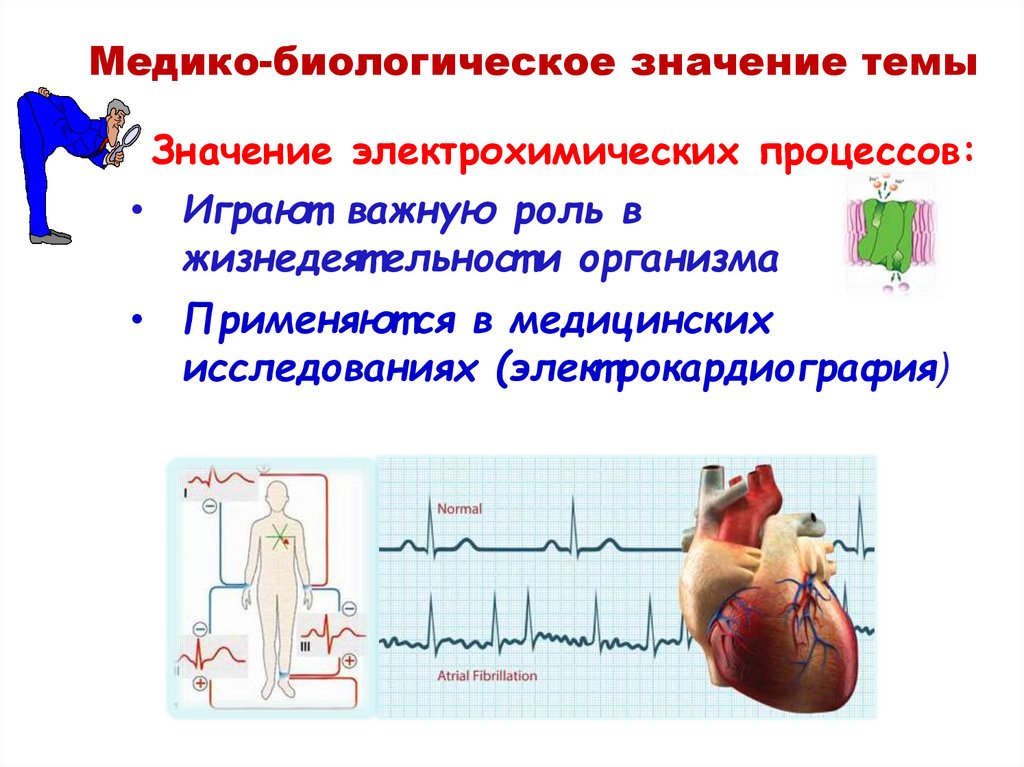
Медико-биологическое значение темыЗначение электрохимических процессов:
• Играют важную роль в
жизнедеят ельност и организма
• Применяют ся в медицинских
исследованиях (элект рокардиография)
7.
Медико-биологическое значение темыЗначение электрохимических процессов:
• Применяют ся в медико-биологических
исследованиях
8.
Медико-биологическое значение темыОкислительно-восстановительные
процессы являются необходимыми
звеньями в сложной цепи как анаболических,
так катаболических процессов.
Наибольшее значение
имеют процессы
биологического окисления.
9.
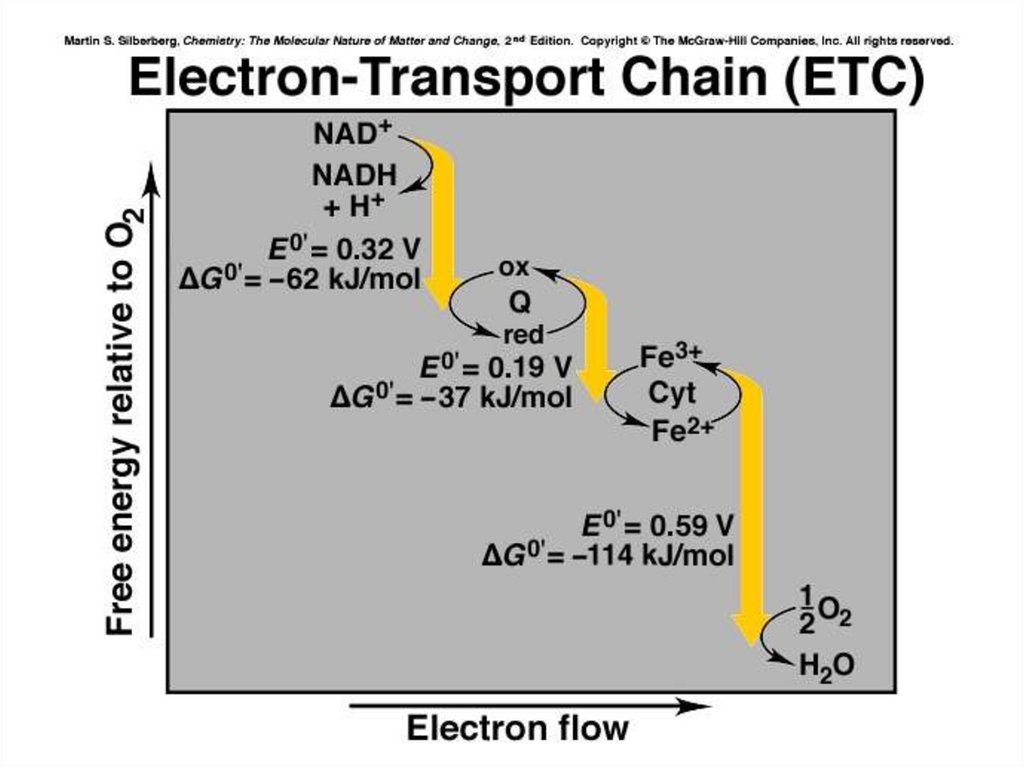
Медико-биологическое значение темы10.
Медико-биологическое значение темыНа трех таких стадиях
разность потенциалов больше
0,17 В. В этом случае
количество выделяющейся
энергии примерно
соответствует энергии,
необходимой для синтеза 1
молекулы АТФ.
11.
12.
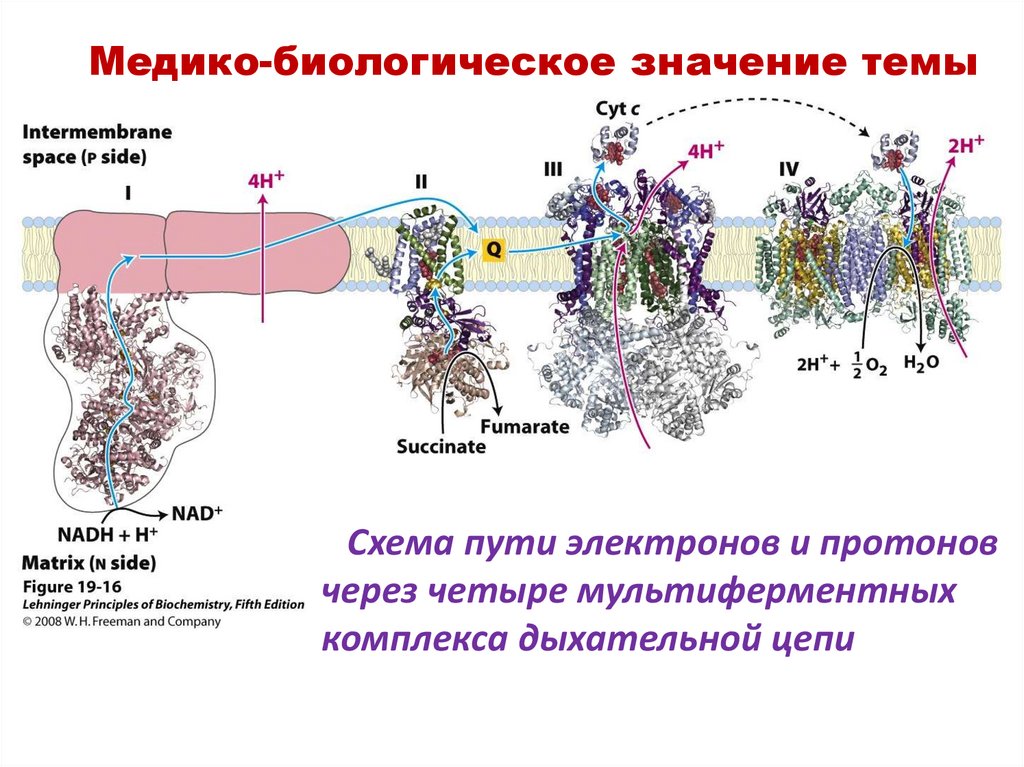
Медико-биологическое значение темыСхема пути электронов и протонов
через четыре мультиферментных
комплекса дыхательной цепи
13.
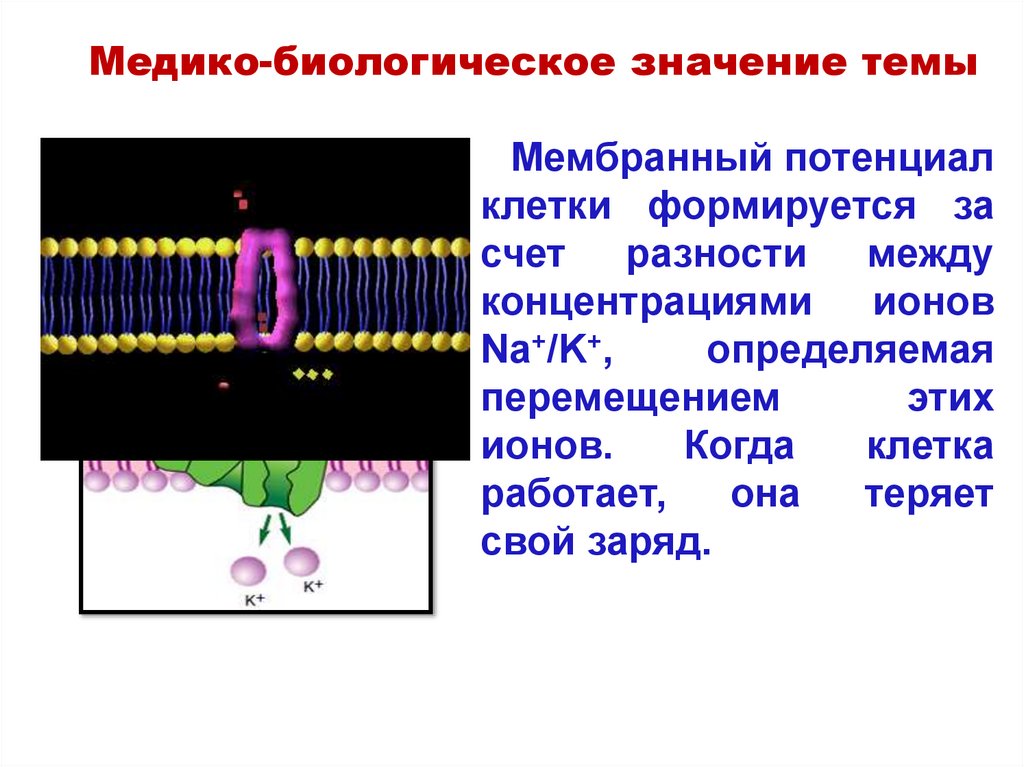
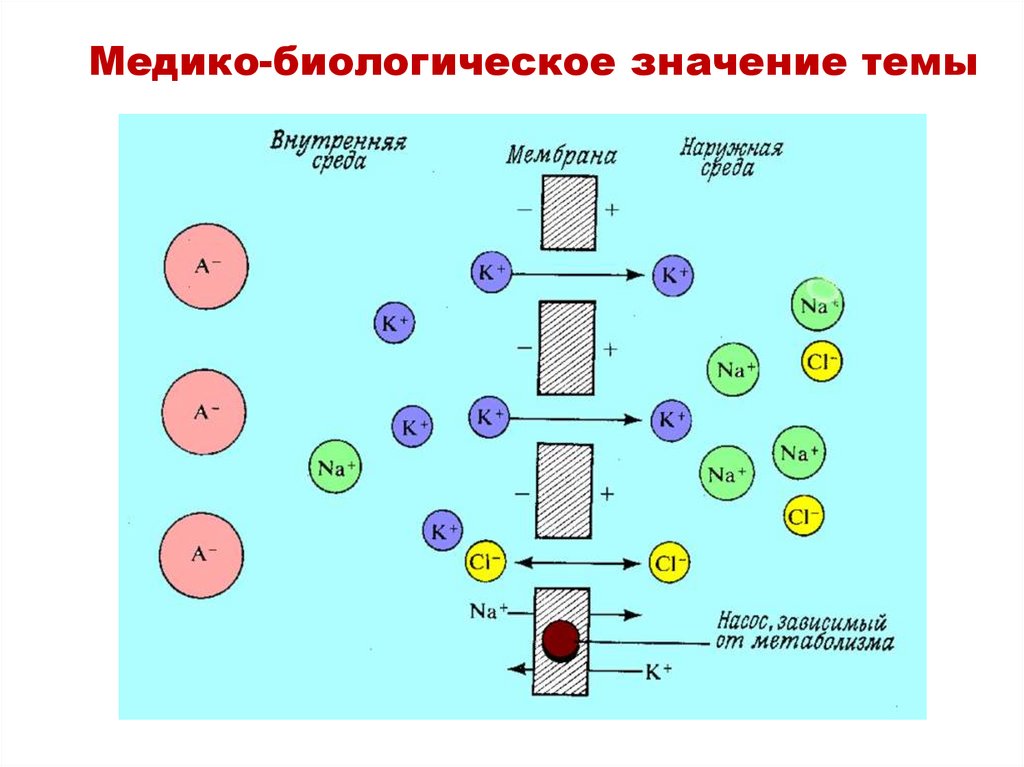
Медико-биологическое значение темыМембранный потенциал
клетки формируется за
счет разности между
концентрациями
ионов
Na+/K+,
определяемая
перемещением
этих
ионов.
Когда
клетка
работает,
она
теряет
свой заряд.
14.
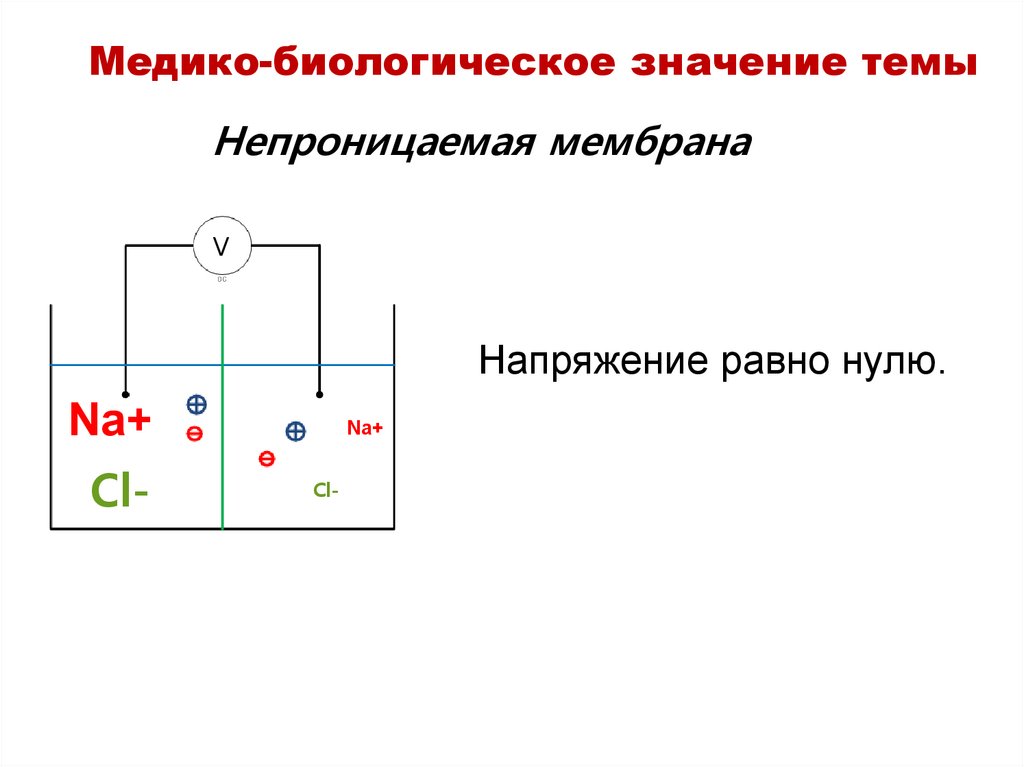
Медико-биологическое значение темыНепроницаемая мембрана
V
Напряжение равно нулю.
Na+
Cl-
Na+
Cl-
15.
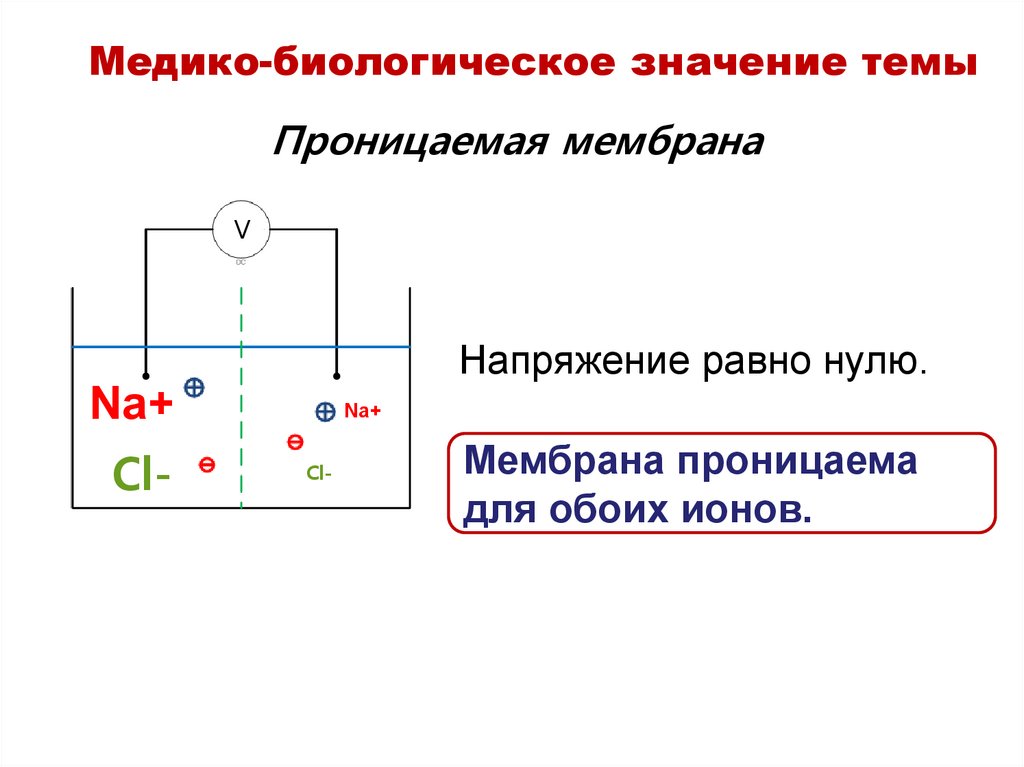
Медико-биологическое значение темыПроницаемая мембрана
V
Напряжение равно нулю.
Na+
Cl-
Na+
Cl-
Мембрана проницаема
для обоих ионов.
16.
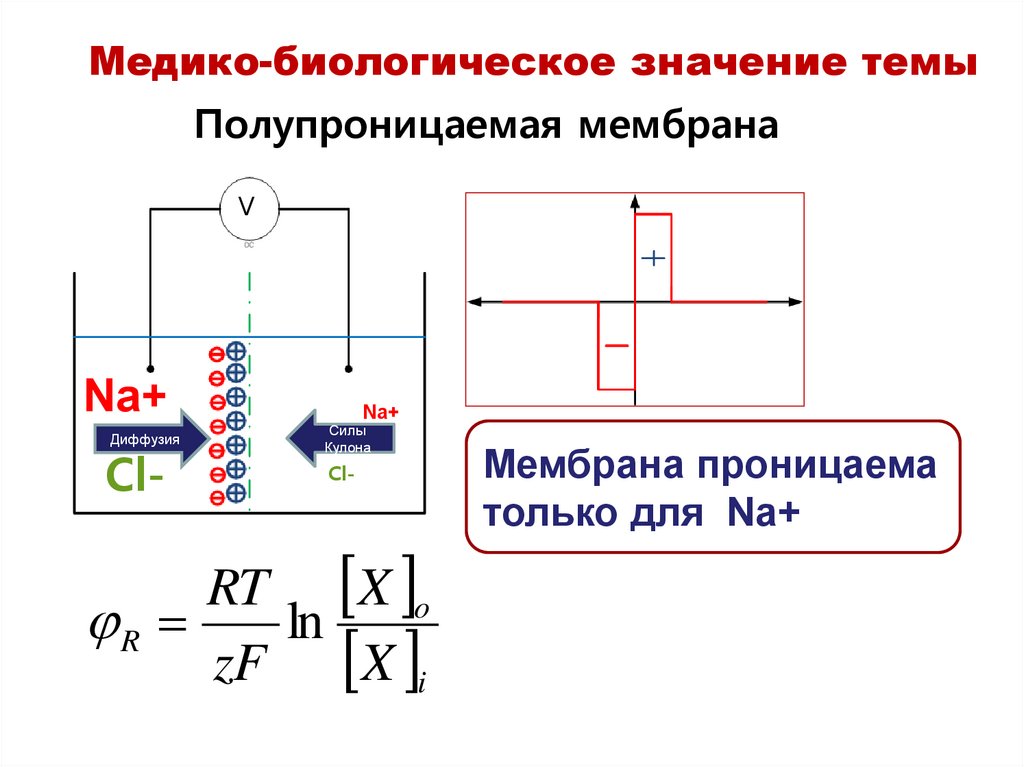
Медико-биологическое значение темыПолупроницаемая мембрана
V
Na+
Диффузия
Cl-
Na+
Силы
Кулона
Cl-
RT X o
R
ln
zF X i
Мембрана проницаема
только для Na+
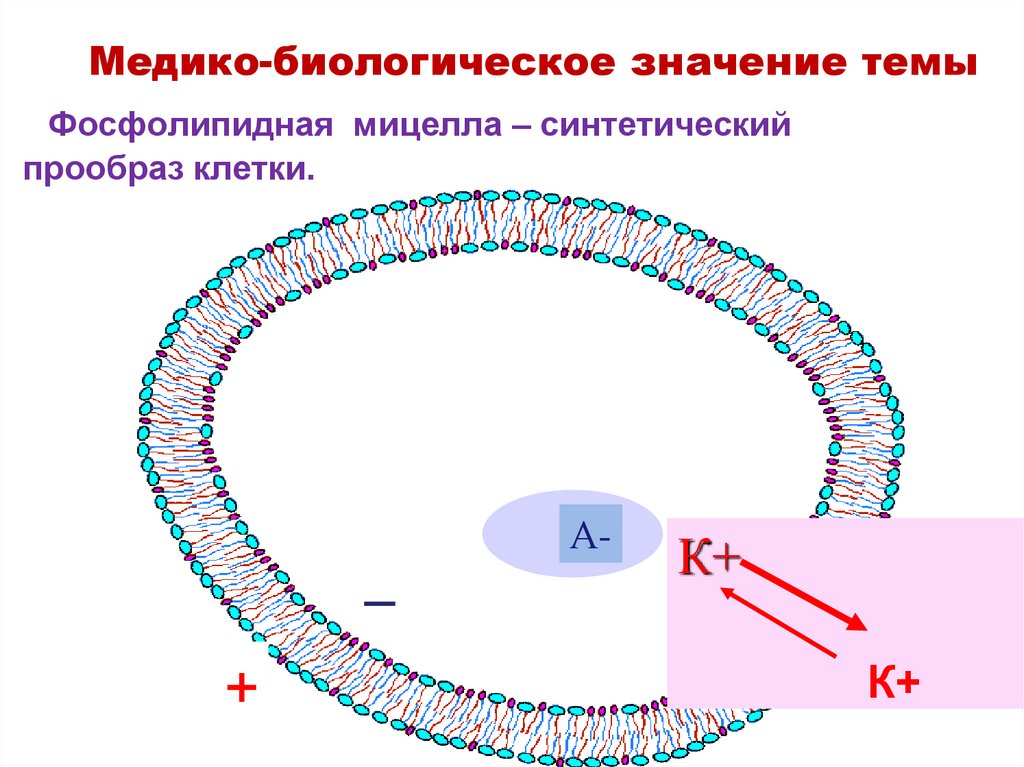
17. Фосфолипидная мицелла – синтетический прообраз клетки.
Медико-биологическое значение темыФосфолипидная мицелла – синтетический
прообраз клетки.
_
+
А-
К+
К+
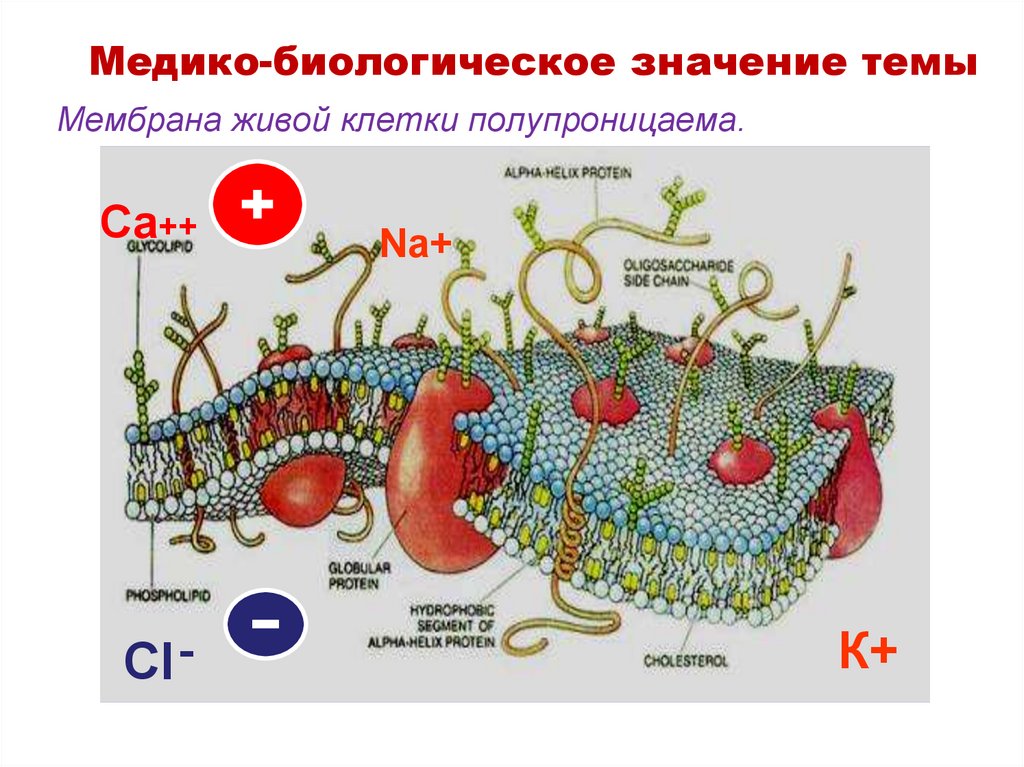
18. Мембрана живой клетки полупроницаема.
Медико-биологическое значение темыМембрана живой клетки полупроницаема.
Са++
Cl -
Na+
К+
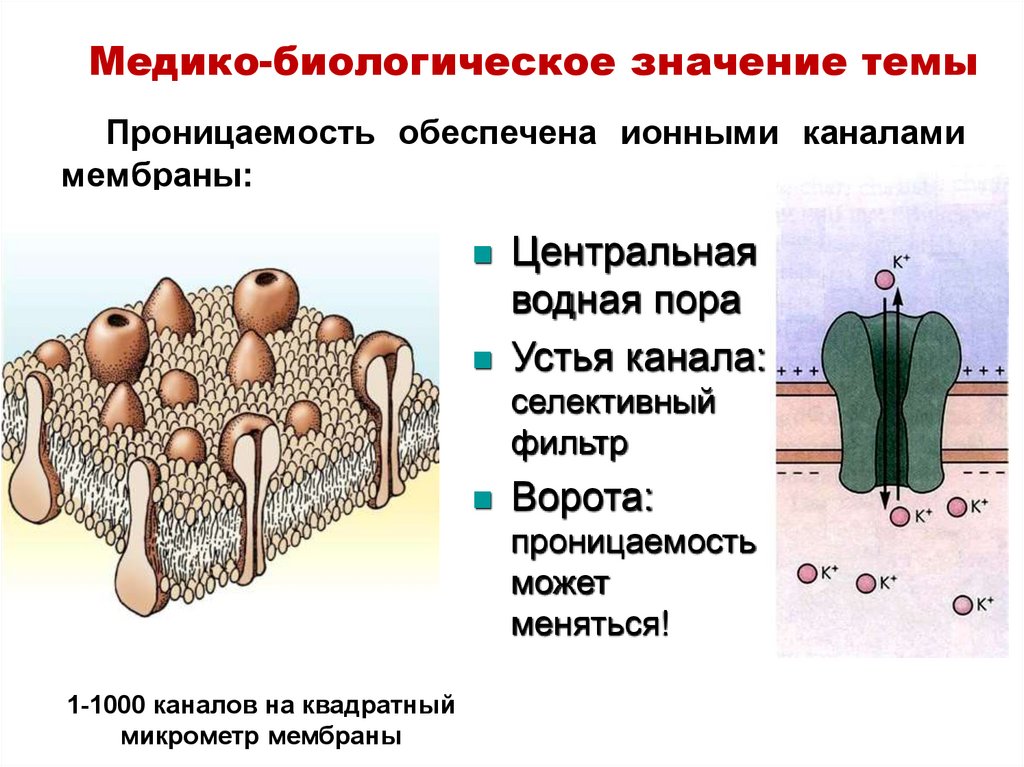
19. Проницаемость обеспечена ионными каналами мембраны:
Медико-биологическое значение темыПроницаемость обеспечена ионными каналами
мембраны:
Центральная
водная пора
Устья канала:
селективный
фильтр
Ворота:
проницаемость
может
меняться!
1-1000 каналов на квадратный
микрометр мембраны
20. Нобелевская премия 1991 г. в области физиологии и медицины
Эрвин Нейери
Берт Сакманн
«за открытия в области работы
одиночных ионных каналов»
21.
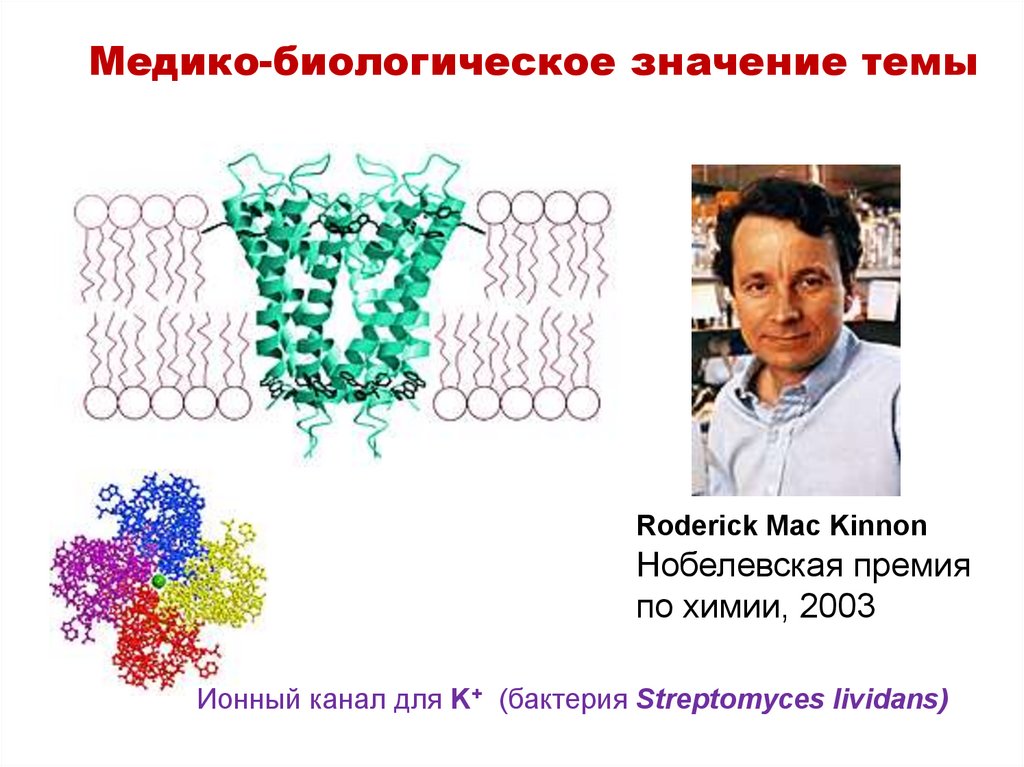
Медико-биологическое значение темыRoderick Mac Kinnon
Нобелевская премия
по химии, 2003
Ионный канал для K+ (бактерия Streptomyces lividans)
22.
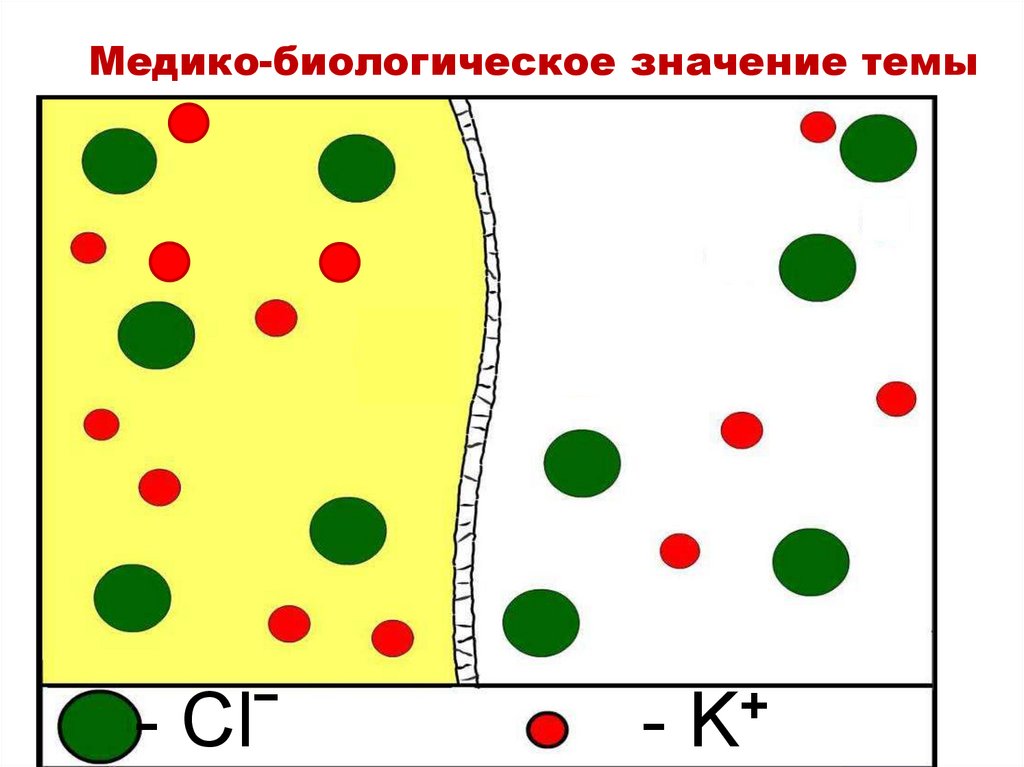
Медико-биологическое значение темы- Clˉ
+
-K
23.
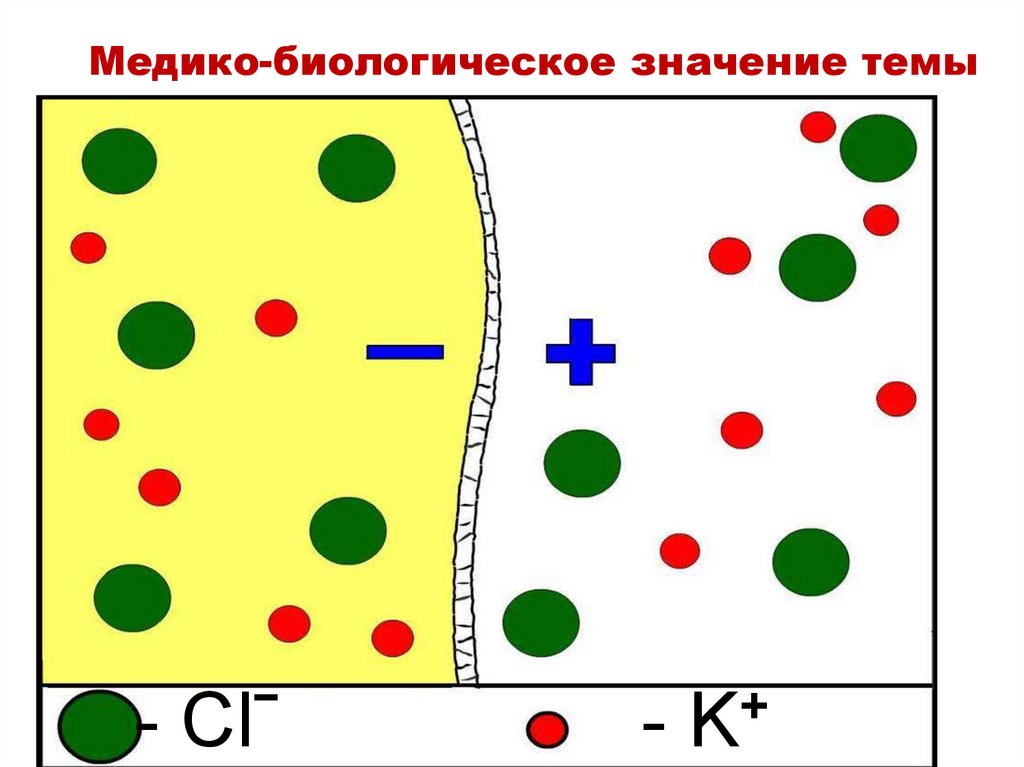
Медико-биологическое значение темы- Clˉ
+
-K
24.
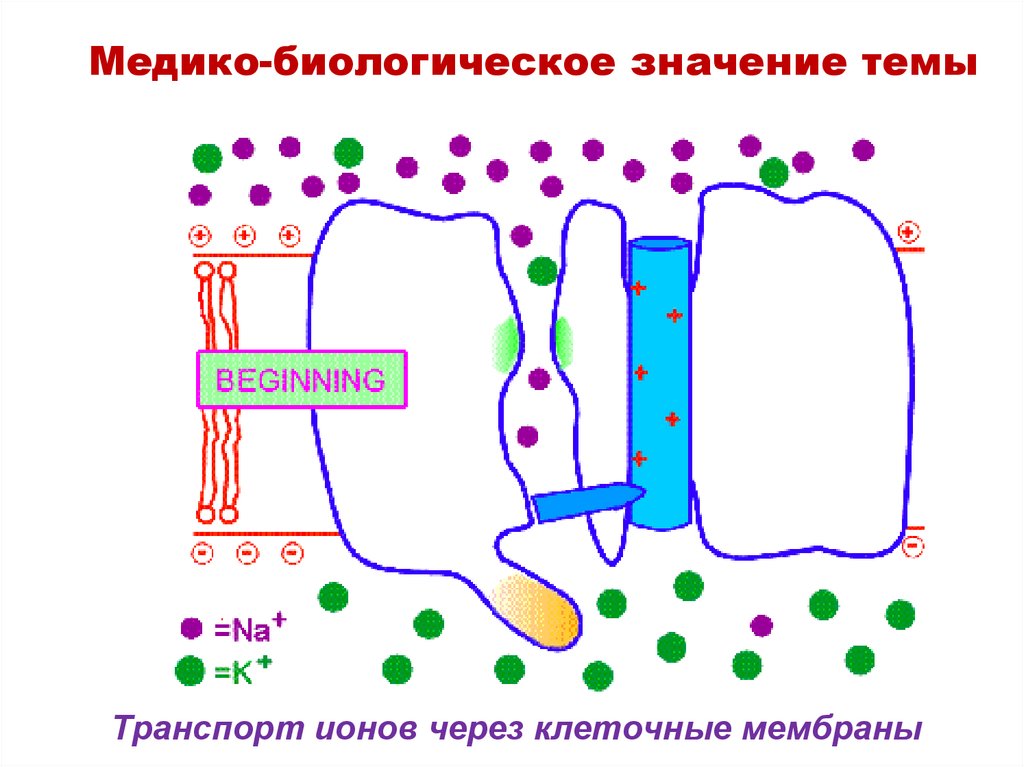
Медико-биологическое значение темы25. Транспорт ионов через клеточные мембраны
Медико-биологическое значение темыТранспорт ионов через клеточные мембраны
26.
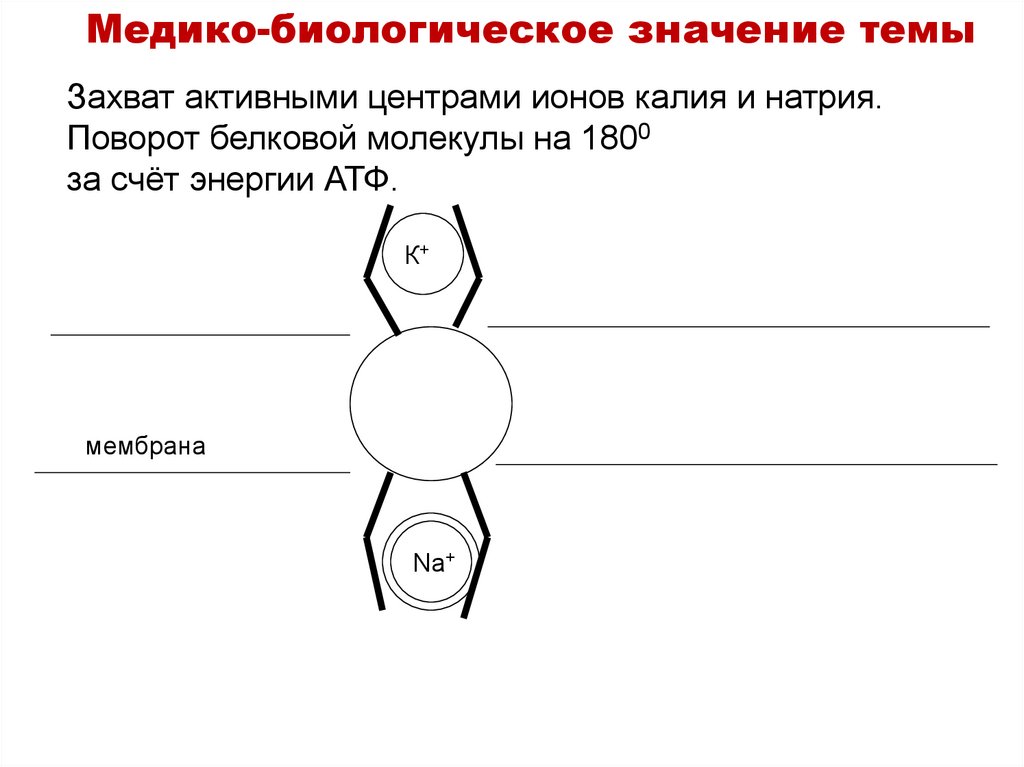
Медико-биологическое значение темыЗахват активными центрами ионов калия и натрия.
Поворот белковой молекулы на 1800
за счёт энергии АТФ.
К+
мембрана
Na+
27.
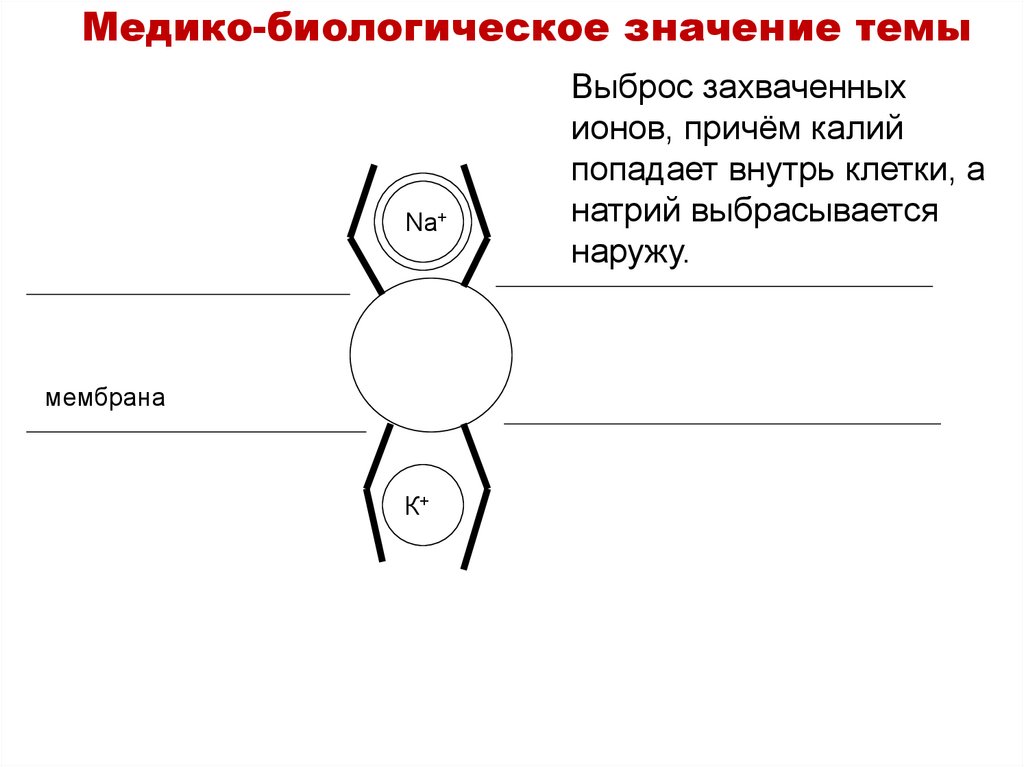
Медико-биологическое значение темыNa+
мембрана
К+
Выброс захваченных
ионов, причём калий
попадает внутрь клетки, а
натрий выбрасывается
наружу.
28.
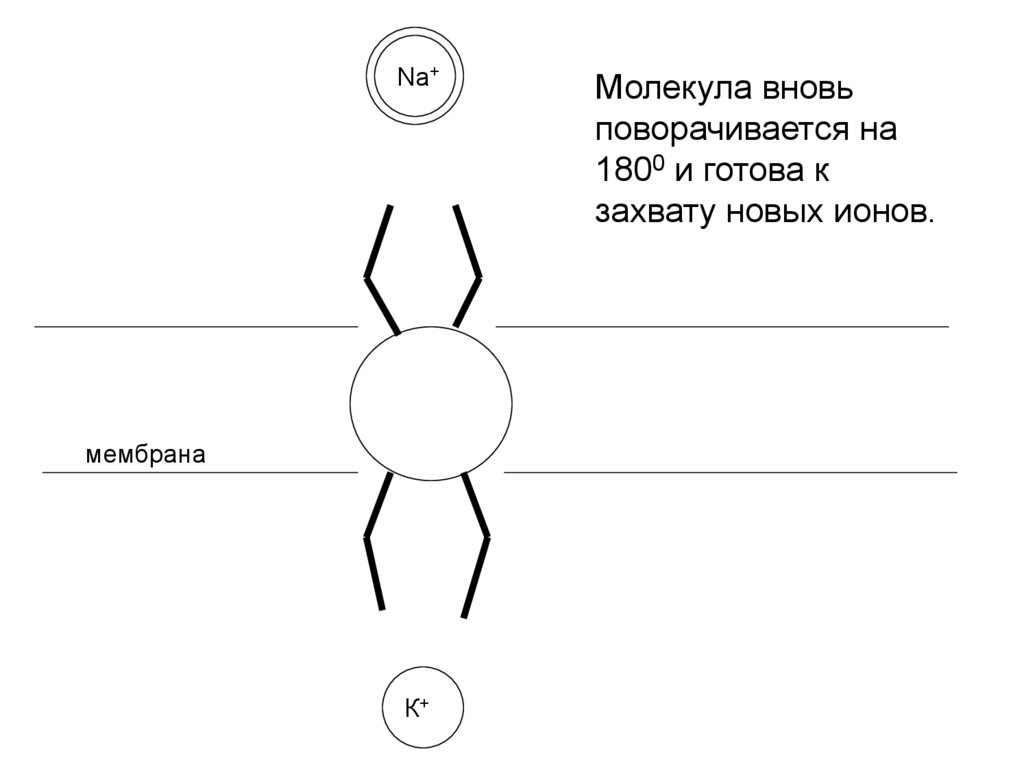
Na+мембрана
К+
Молекула вновь
поворачивается на
1800 и готова к
захвату новых ионов.
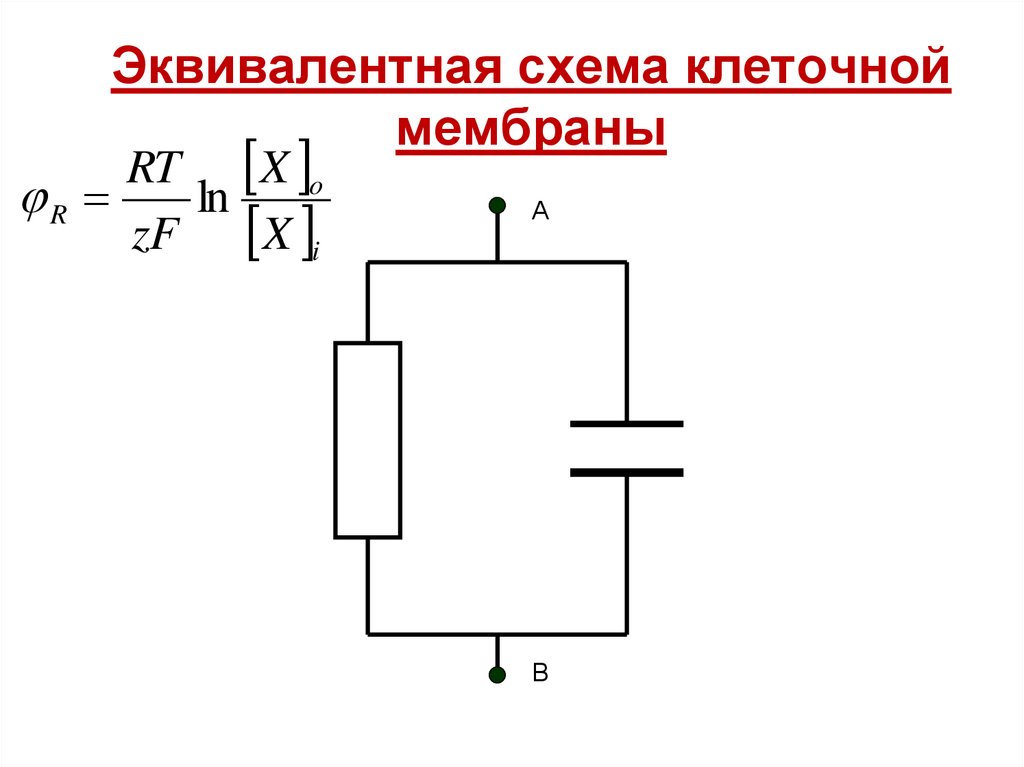
29. Эквивалентная схема клеточной мембраны
RT X oR
ln
zF X i
А
В
30.
Медико-биологическое значение темыЭлектрохимия – основа таких методов анализа, как
кондуктометрия, потенциометрия, полярография,
вольт- и амперометрия, широко применяемых в
контроле производств лекарственных веществ и в
анализе готовых фармакопейных препаратов.
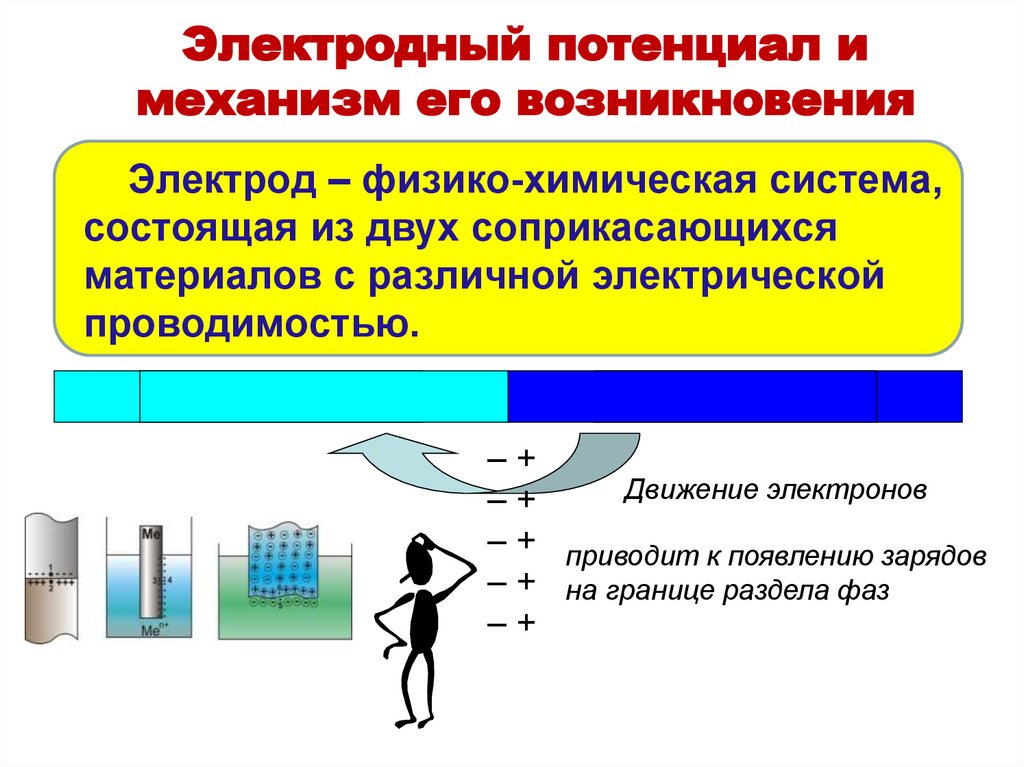
31. Электрод – физико-химическая система, состоящая из двух соприкасающихся материалов с различной электрической проводимостью.
Электродный потенциал имеханизм его возникновения
Электрод – физико-химическая система,
состоящая из двух соприкасающихся
материалов с различной электрической
проводимостью.
–+
Движение электронов
–+
– + приводит к появлению зарядов
– + на границе раздела фаз
–+
32.
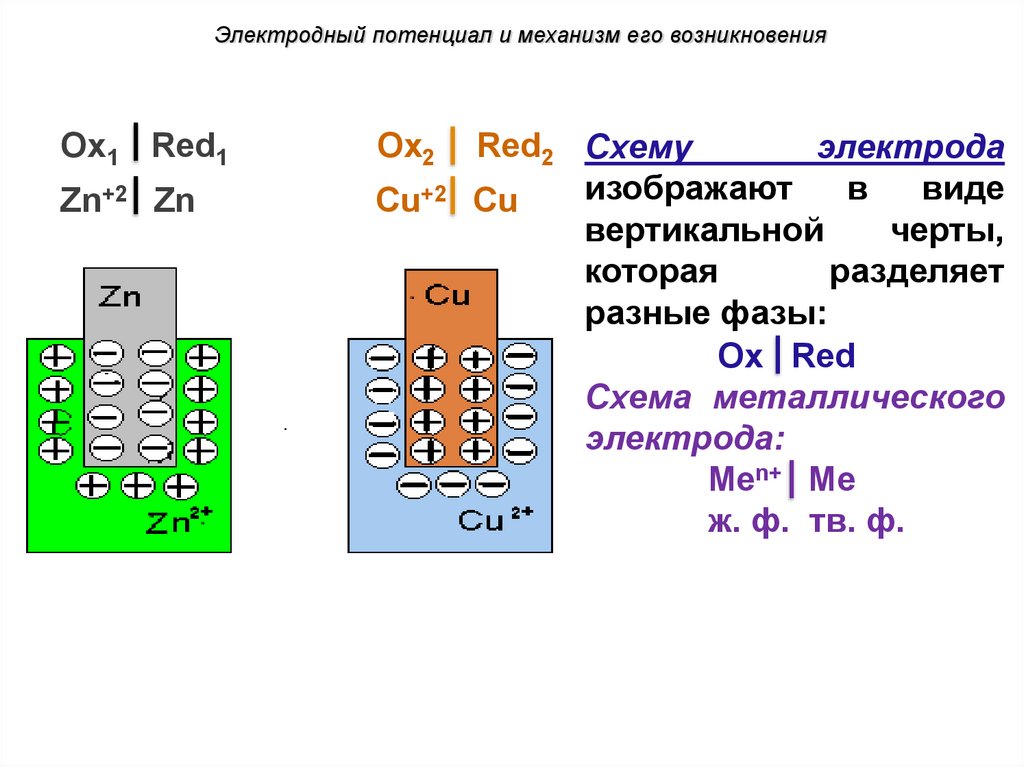
Электродный потенциал и механизм его возникновенияOx1 Red1
Ox2
Zn+2 Zn
Cu+2
Red2 Схему
электрода
изображают
в
виде
Cu
вертикальной
черты,
которая
разделяет
разные фазы:
Ox Red
Схема металлического
электрода:
Меn+ Me
ж. ф. тв. ф.
33.
Электродный потенциал и механизм его возникновенияНа границе раздела фаз возможны переходы
поверхностных частиц из одной фазы в другую,
если это сопровождается уменьшением свободной
энергии системы ( G).
В результате обмена заряженными частицами
создается избыток носителей электричества
данного знака по одну сторону и их недостаток по
другую сторону границы раздела фаз. В результате
возникает двойной электрический слой (ДЭС).
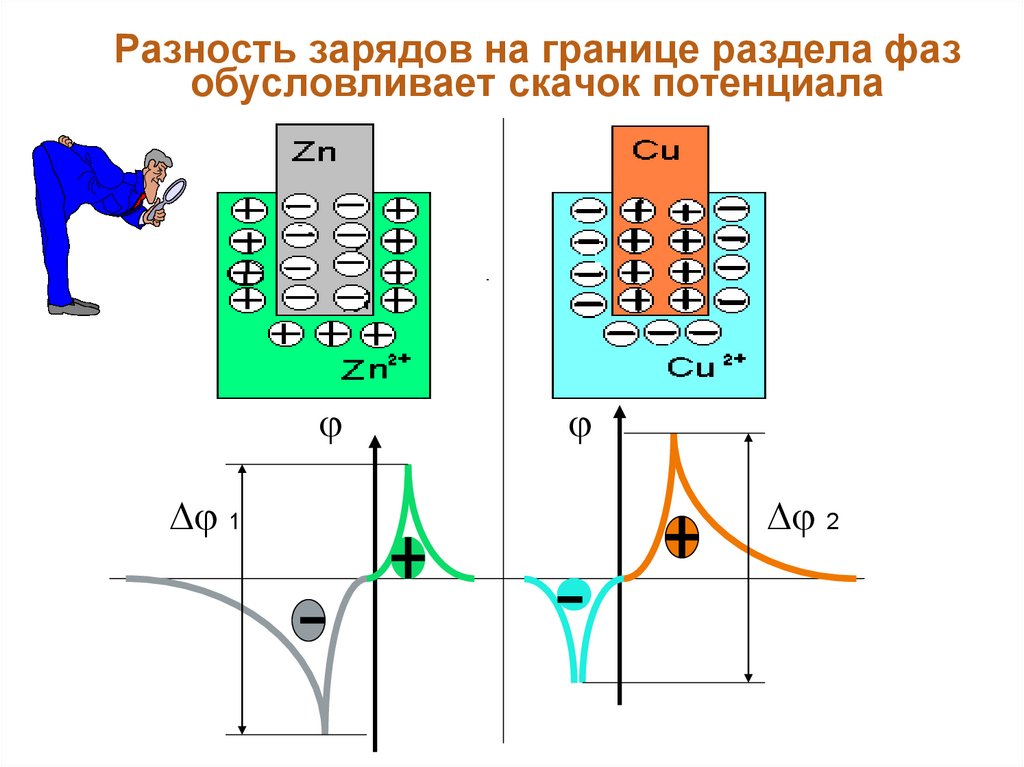
Разность зарядов на границе раздела фаз
обусловливает скачок потенциала.
34.
Электродный потенциал и механизм его возникновенияЭлектродным
потенциалом
( φ)
называют
максимальную
разность
потенциалов, возникающую на границе
раздела фаз в момент установления
равновесия.
35.
Электродный потенциал и механизм его возникновенияПри погружении металла в раствор его
одноименной соли, в системе металл –
раствор устанавливается равновесие:
Меn+ + ne-
Ме0
Данная реакция называется электродной
реакцией.
Ионы Меn+ – потенциалопределяющими
ионами (п. о. и.).
36.
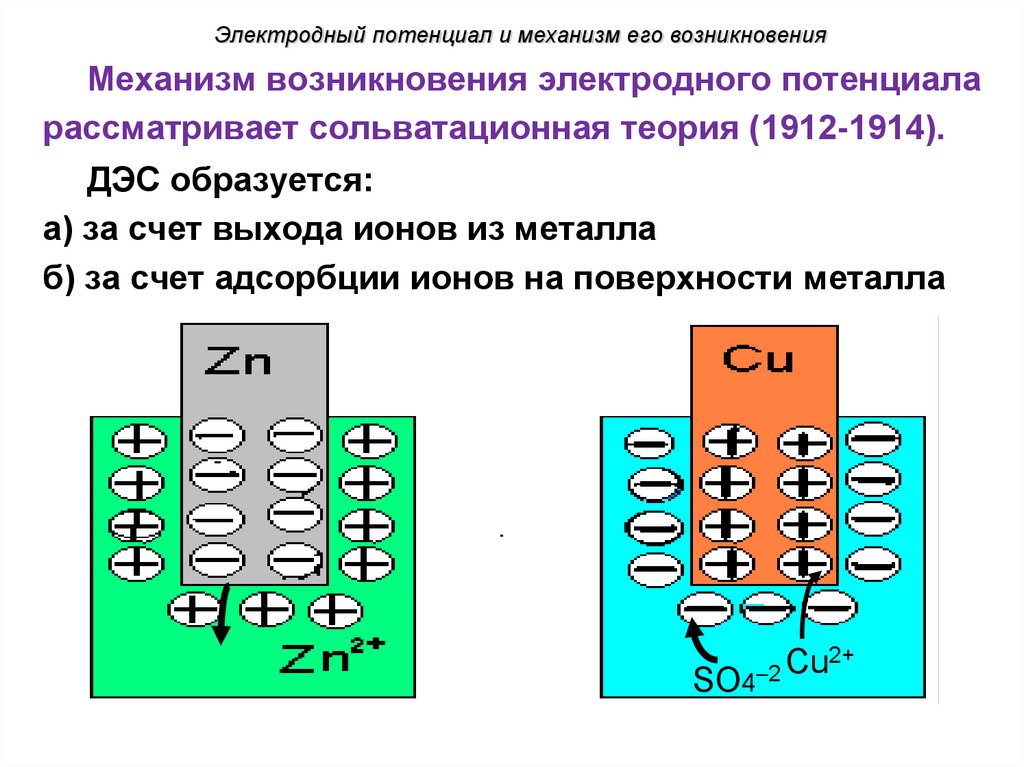
Электродный потенциал и механизм его возникновенияМеханизм возникновения электродного потенциала
рассматривает сольватационная теория (1912-1914).
ДЭС образуется:
а) за счет выхода ионов из металла
б) за счет адсорбции ионов на поверхности металла
Cu2+
2
SO4
37.
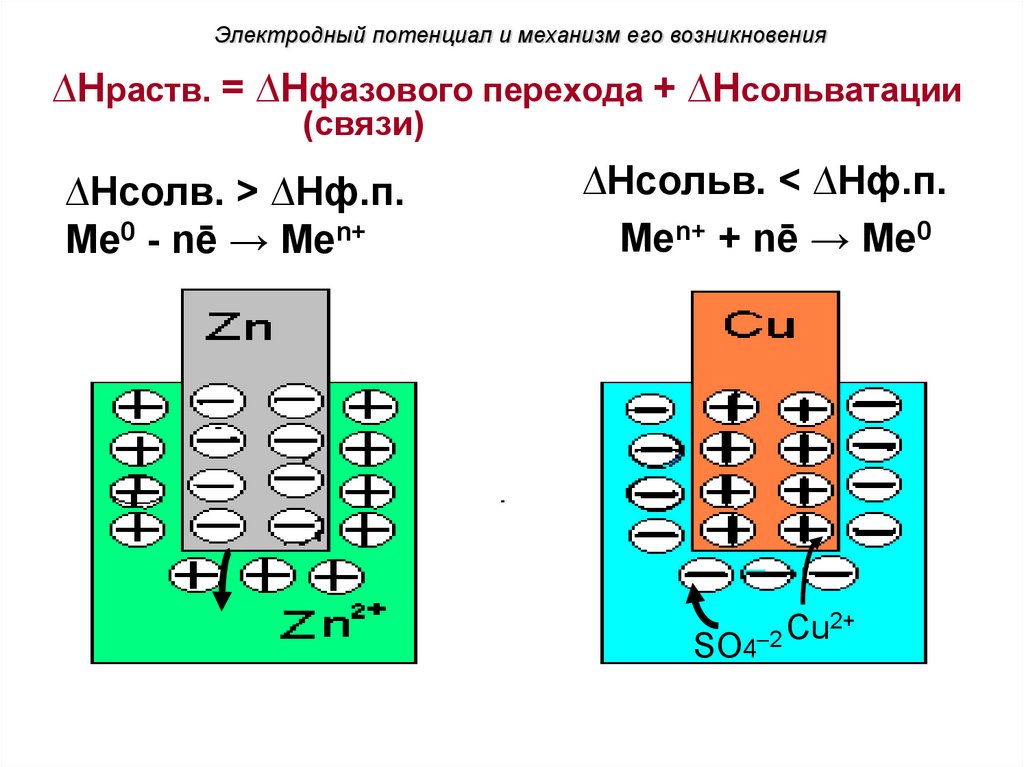
Электродный потенциал и механизм его возникновения∆Нраств. = ∆Hфазового перехода + ∆Нсольватации
(связи)
∆Нсолв. ˃ ∆Hф.п.
Ме0 - nē → Mеn+
∆Нсольв. ˂ ∆Hф.п.
Mеn+ + nē → Ме0
Cu2+
2
SO4
38.
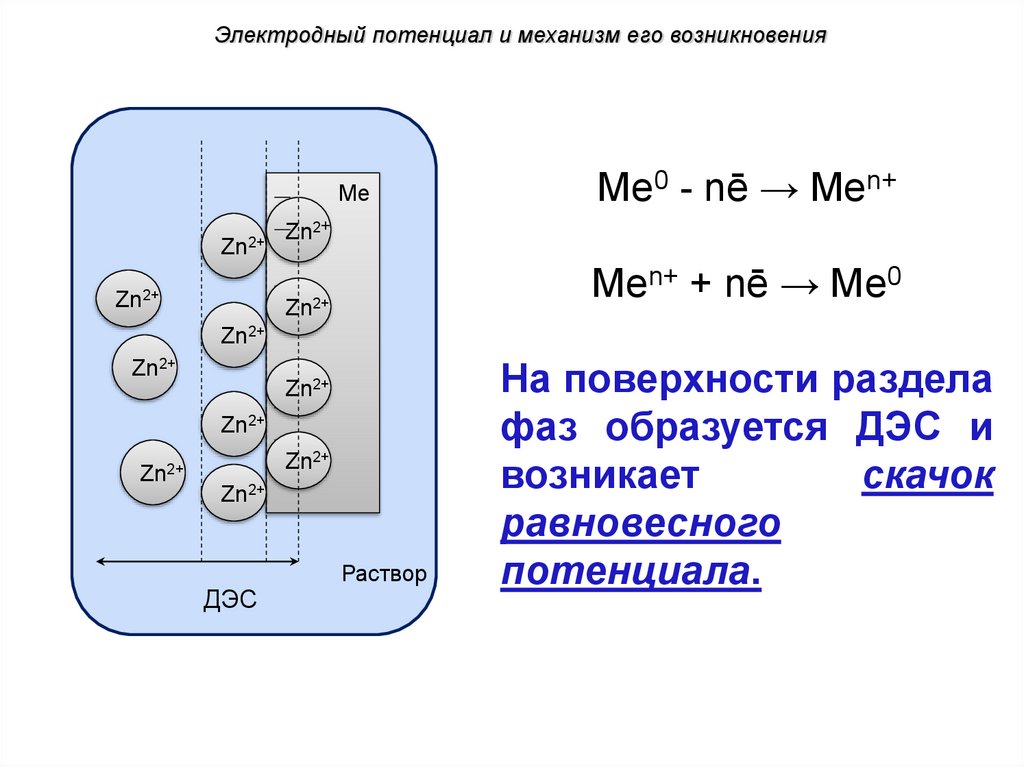
Электродный потенциал и механизм его возникновенияМе
Zn2+
Zn2+
Ме0 - nē → Mеn+
Zn2+
Mеn+ + nē → Ме0
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
ДЭС
Раствор
На поверхности раздела
фаз образуется ДЭС и
возникает
скачок
равновесного
потенциала.
39.
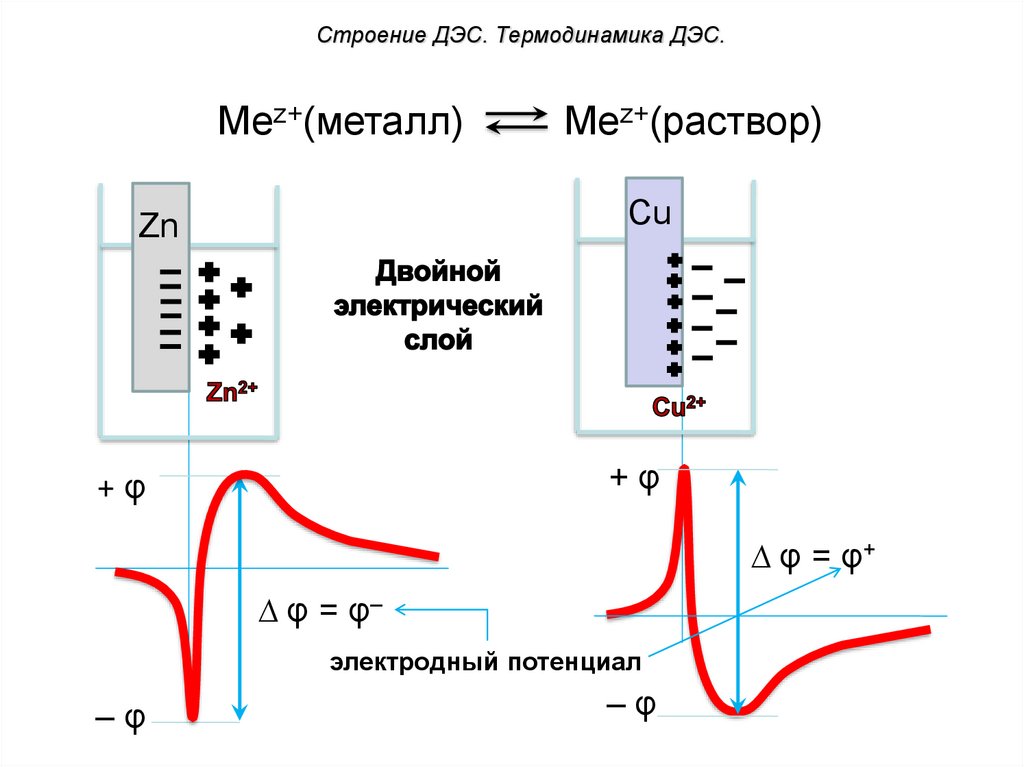
Строение ДЭС. Термодинамика ДЭС.Mez+(металл)
Mez+(раствор)
Cu
Zn
+φ
+φ
∆ φ = φ+
∆ φ = φ–
электродный потенциал
–φ
–φ
40. Возможны 2 случая возникновения электродного потенциала:
Электродный потенциал и механизм его возникновенияВозможны
2
случая
электродного потенциала:
возникновения
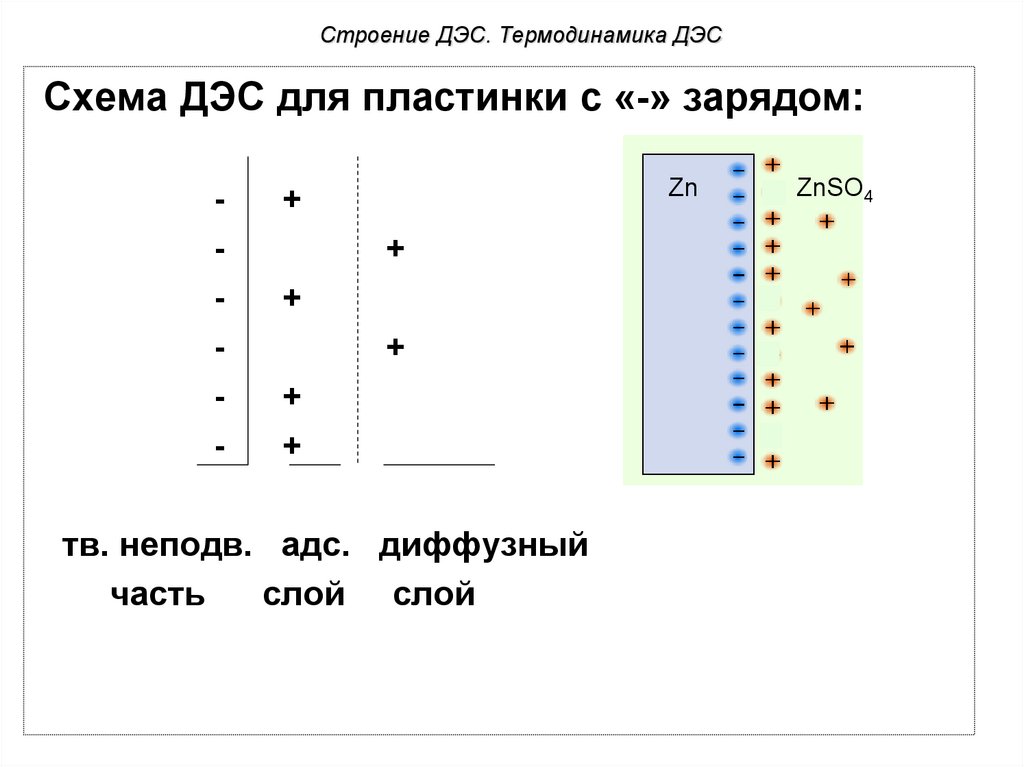
1) При погружении активного металла (Zn)
в раствор его соли (ZnSO4) равновесие электродной
No currentсмещается влево.
реакции
Протекает реакция:
Zn0 - 2e- → Zn2+,
т.к. энтальпия сольватации
(∆Нсолв.) ионов цинка больше,
чем энтальпия фазового
перехода (∆Нф.п.) ионов
узлов кристаллической
решетки, ∆Нсолв. > ∆Нф.п..
41.
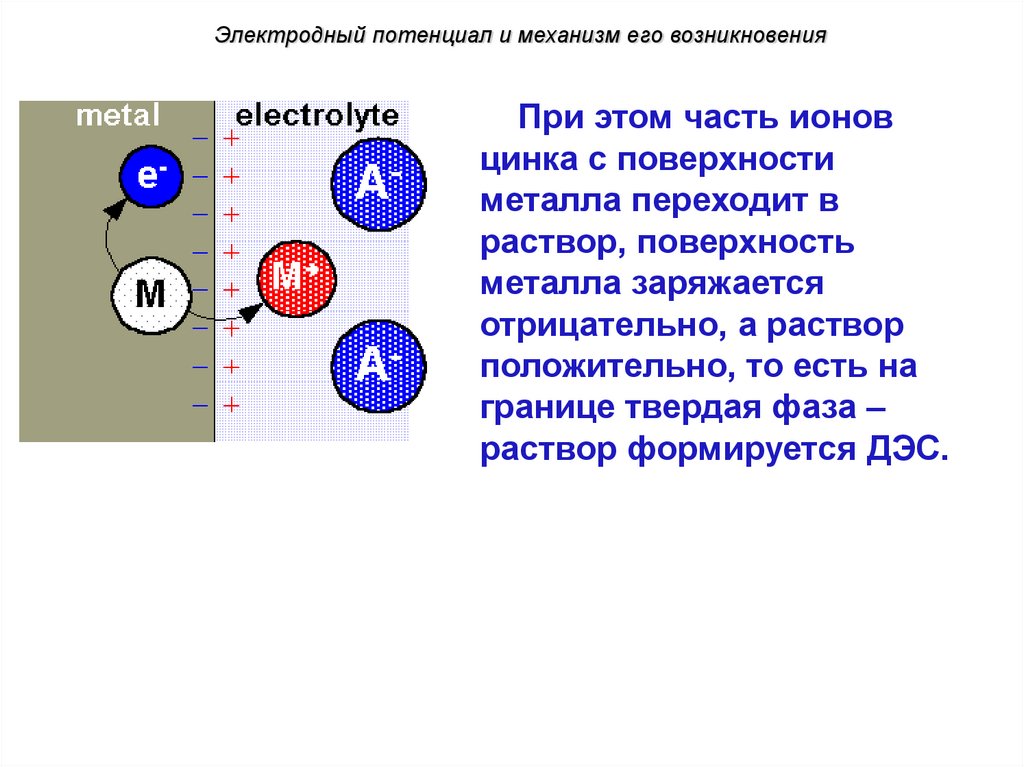
Электродный потенциал и механизм его возникновенияПри этом часть ионов
цинка с поверхности
металла переходит в
Noраствор,
current поверхность
металла заряжается
отрицательно, а раствор
положительно, то есть на
границе твердая фаза –
раствор формируется ДЭС.
42. 2) При погружении неактивного металла (Cu) в раствор его соли (CuSO4) равновесие электродной
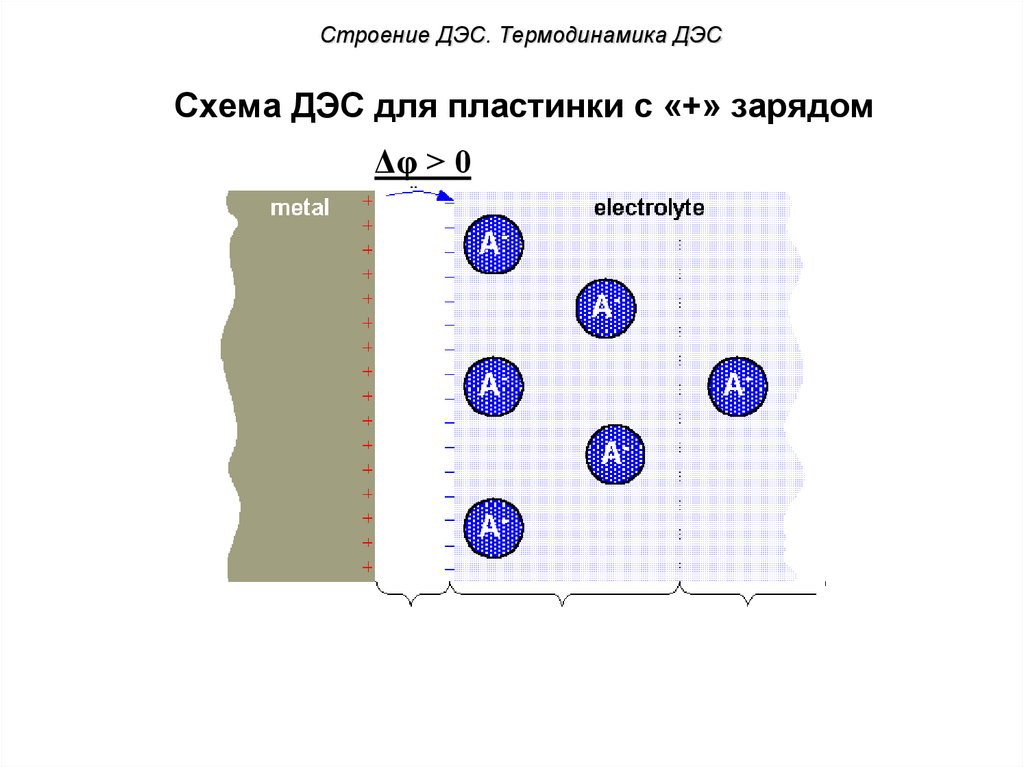
Электродный потенциал и механизм его возникновения2) При погружении неактивного металла (Cu) в
раствор его соли (CuSO4) равновесие электродной
реакции смещается вправо. На
электроде протекает процесс:
Cu2+No
+ current
2e- → Cu0.
В этом случае энтальпия
фазового перехода
поверхностных ионов узлов
кристаллической решетки
больше энтальпии сольватации
ионов меди: ∆Нф.п. > ∆Нсолв..
43.
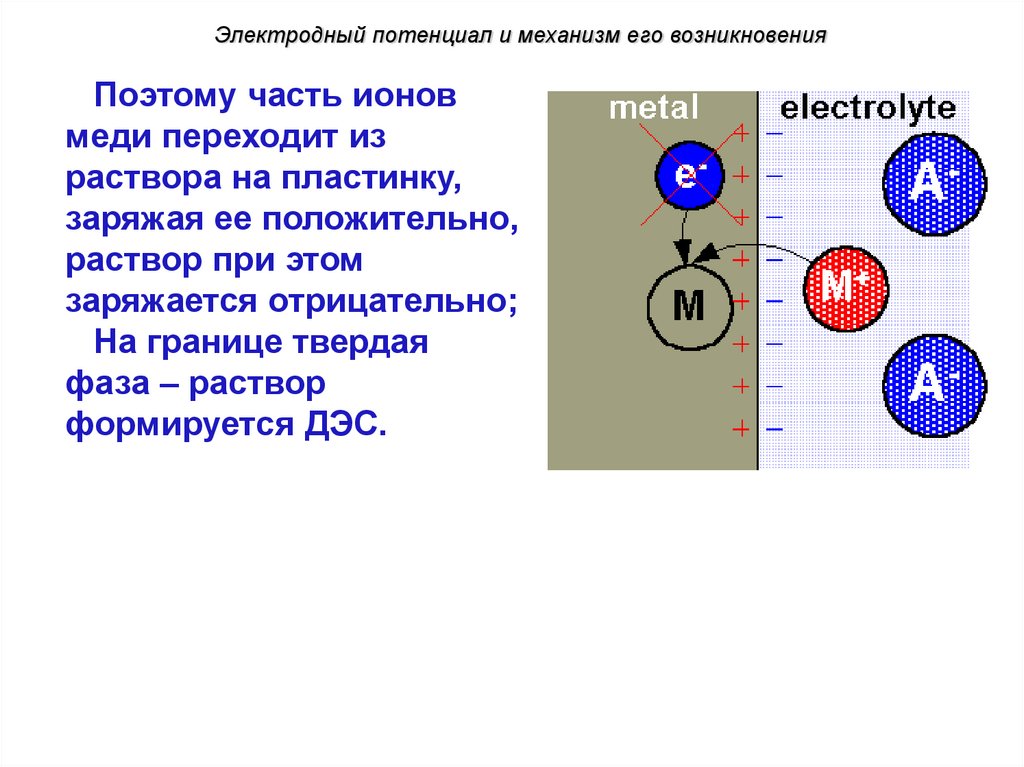
Электродный потенциал и механизм его возникновенияПоэтому часть ионов
меди переходит из
раствора на пластинку,
заряжая ее положительно,
раствор при этом
заряжается отрицательно;
На границе твердая
фаза – раствор
формируется ДЭС.
44.
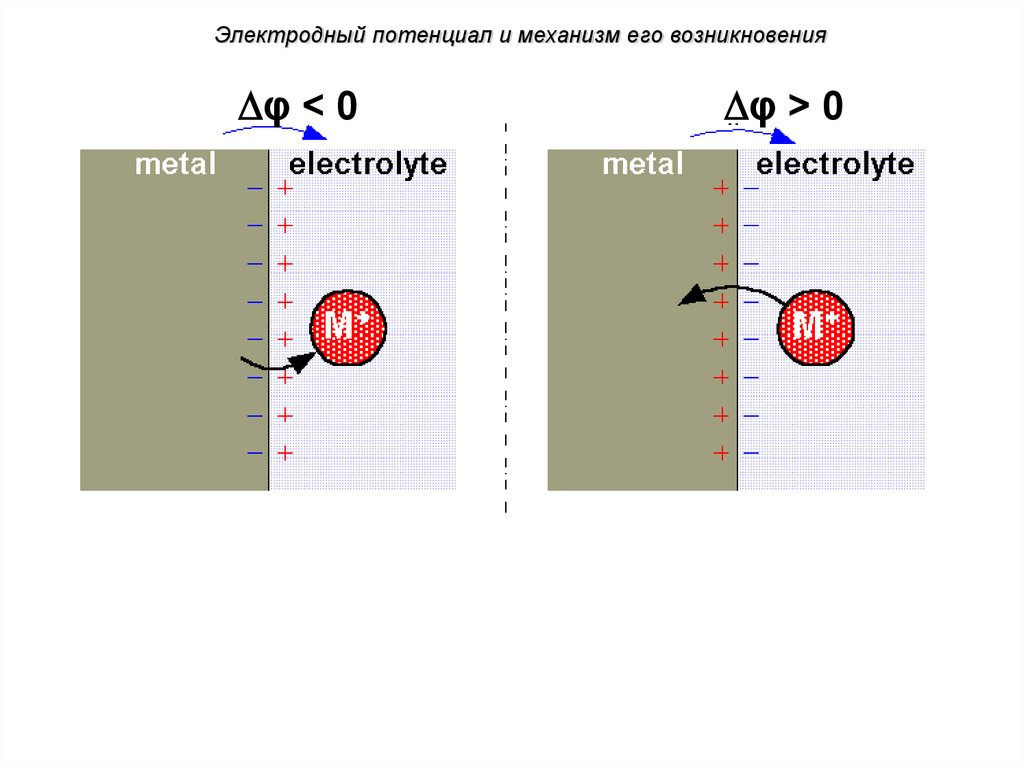
Электродный потенциал и механизм его возникновенияφ < 0
φ > 0
No current
45.
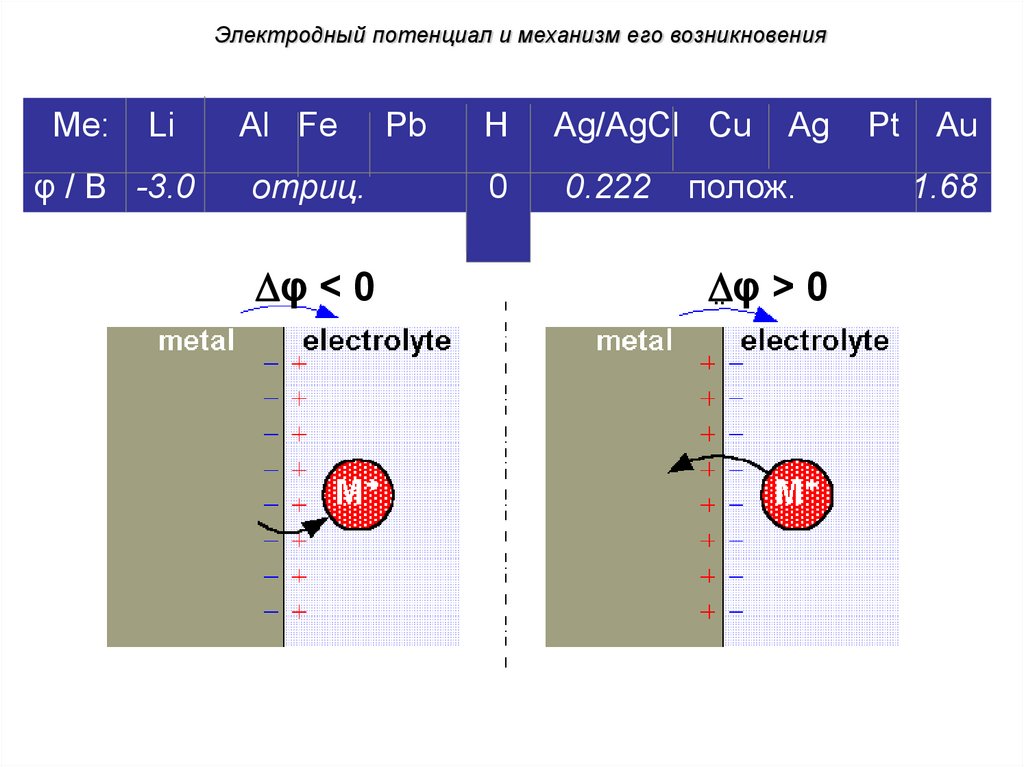
Электродный потенциал и механизм его возникновенияМе:
Li
φ / В -3.0
Al Fe
отриц.
φ < 0
Pb
H
Ag/AgCl Cu
No current
0
0.222
Ag
полож.
φ > 0
Pt
Au
1.68
46. Разность зарядов на границе раздела фаз обусловливает скачок потенциала
12
47.
Электродный потенциал и механизм его возникновенияСуществуют
возникновения
и
другие
механизмы
ДЭС,
например,
процесс
адсорбции адсорбата на поверхности адсорбента.
При помещении твердой фазы – хлорида серебра
AgCl – в раствор нитрата серебра AgNO3 на
поверхности
твердой
фазы
из
раствора
адсорбируются те ионы, которые входят в состав
кристаллической решетки, а именно ионы Ag+. При
этом твердая фаза заряжается положительно, а
раствор – отрицательно.
Таким образом, ДЭС может формироваться
за счет различных механизмов, в основе
которых
лежат
реакции
осаждения,
ионизации,
окисления-восстановления,
адсорбции и др.
48. Строение ДЭС по Штерну
ДЭС можно сравнить с конденсатором,одна обкладка которого – металл, другая –
слой противоположно заряженных ионов.
На
поверхности
металла
за
счет
электродных
процессов
возникает
электрический заряд, который определяется
потенциалопределяющими ионами (п.о.и.).
Эта часть ДЭС –
неподвижная или
стабильная.
49.
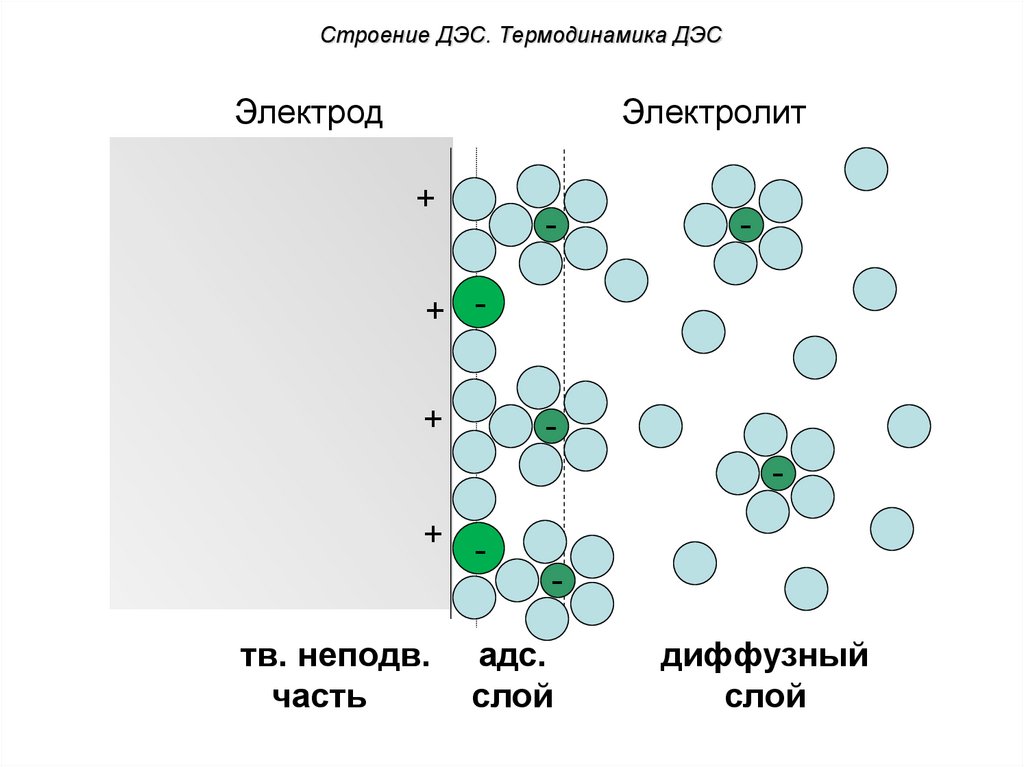
Строение ДЭС. Термодинамика ДЭСПодвижную часть ДЭС можно разделить
на две части:
1) Адсорбционный слой – состоит из
противоионов,
расположенных
на
расстоянии ионного радиуса от поверхности
металла. На него действуют в основном
электростатические силы притяжения.
2) Диффузный слой – состоит из ионов,
расположенных на расстоянии большем,
чем
ионный
радиус.
Они
свободно
перемещаются в растворе, в основном за
счет теплового движения.
50.
Строение ДЭС. Термодинамика ДЭСЭлектрод
Электролит
+
-
-
+ +
-
+ тв. неподв.
часть
-
адс.
слой
диффузный
слой
51.
Строение ДЭС. Термодинамика ДЭССхема ДЭС для пластинки с «-» зарядом:
-
Zn
+
+
+
+
+
+
тв. неподв. адс. диффузный
часть
слой слой
ZnSO4
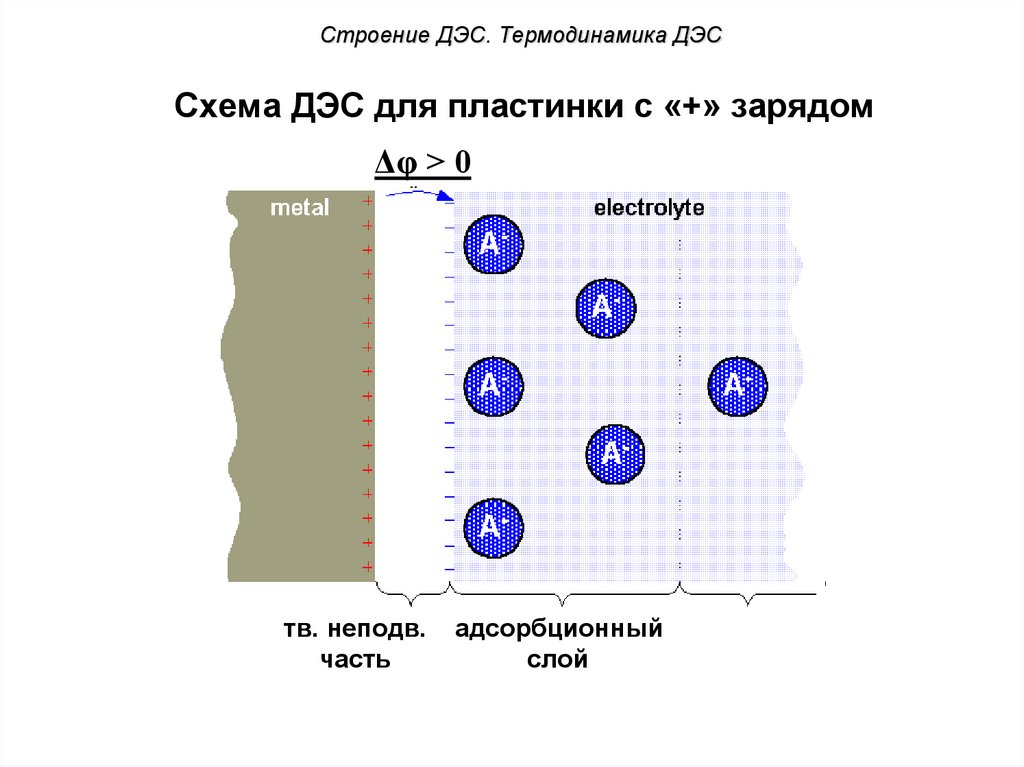
52. Схема ДЭС для пластинки с «+» зарядом
Строение ДЭС. Термодинамика ДЭССхема ДЭС для пластинки с «+» зарядом
Δφ > 0
?
?
?
53. Схема ДЭС для пластинки с «+» зарядом
Строение ДЭС. Термодинамика ДЭССхема ДЭС для пластинки с «+» зарядом
Δφ > 0
тв. неподв.
часть
?
?
?
54. Схема ДЭС для пластинки с «+» зарядом
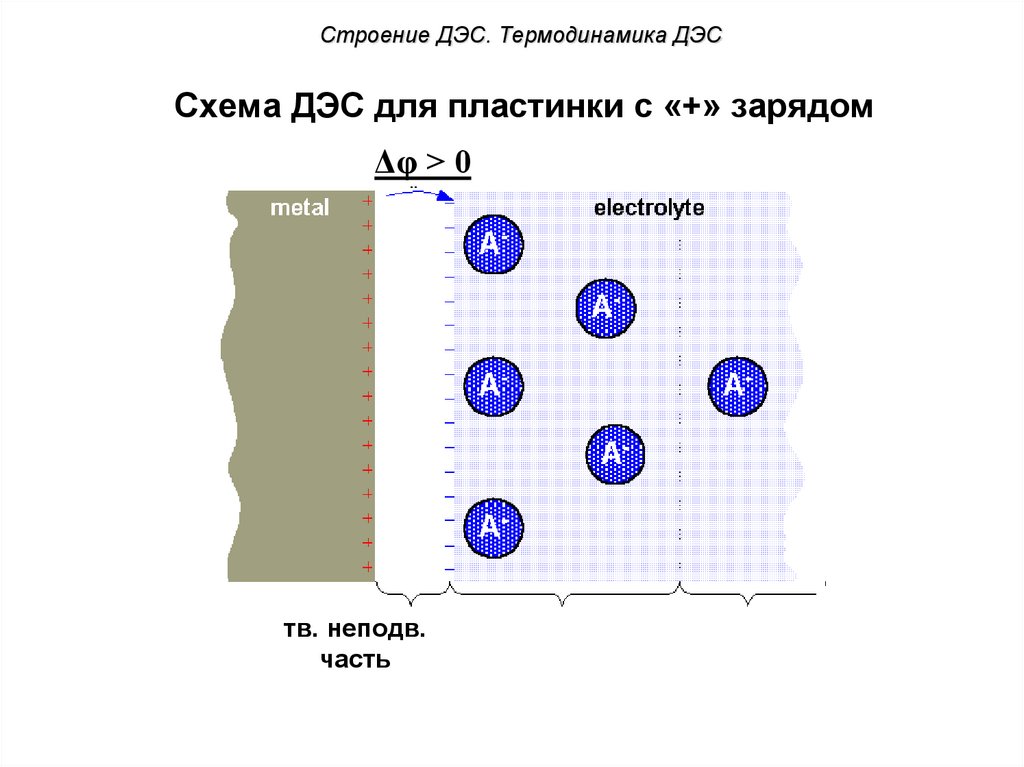
Строение ДЭС. Термодинамика ДЭССхема ДЭС для пластинки с «+» зарядом
Δφ > 0
тв. неподв.
часть
?
адсорбционный
слой
?
?
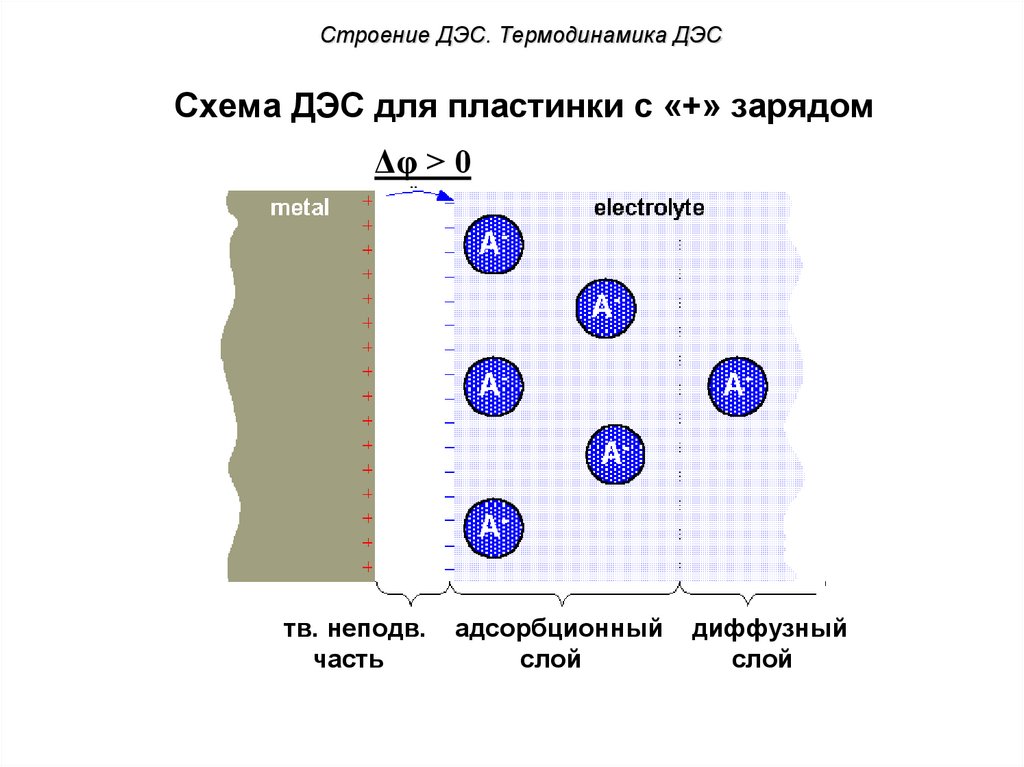
55. Схема ДЭС для пластинки с «+» зарядом
Строение ДЭС. Термодинамика ДЭССхема ДЭС для пластинки с «+» зарядом
Δφ > 0
тв. неподв.
часть
?
адсорбционный
слой
?
диффузный
слой
?
56.
Строение ДЭС. Термодинамика ДЭСОт величины электродного потенциала (φ) зависит
величина работы (А), которая совершается системой
при образовании ДЭС. Величину этой работы можно
выразить уравнением:
A n F
[кДж ·моль-1], где
A – работа, которую надо совершить, чтобы
перенести заряд с одной фазы на другую, кДж ·моль-1;
n – число электронов, участвующих в электродной
реакции (для металлических электродов совпадает с
зарядом иона);
F – число Фарадея = 96487 Кл · моль-1.
57.
Строение ДЭС. Термодинамика ДЭСВ
изобарно-изотермических
условиях
работа равна уменьшению энергии Гиббса:
A G, тогда
G n F
G
n F
58. Уравнение Нернста
Вольтер ГерманНернст (1864-1941)
Нобелевский лауреат
по химии (1920)
Нернст – Эйнштейн – Планк –
Миллиган – фон Лауэ
59.
Уравнение Нернста:RT
0
ln a КАТ
nF
RT
0
ln a АН
nF
φ – электродный потенциал [В],
φ0 – стандартный электродный потенциал характеризует природу электрода
(φ = φ0, если a(п.о.и.) = 1 моль ·дм-3);
R – универсальная газовая постоянная,
n – число электронов в электродной реакции,
F – число Фарадея,
a(п.о.и.) – активная концентрация
потенциалопределяющих ионов [моль · дм-3].
60.
Уравнение НернстаПри подстановке констант в выражение
и переводе натурального логарифма в десятичный
(ln= 2,3 ·lg), с учетом определенной температуры,
уравнение Нернста принимает рабочий вид.
Для 298 K уравнение Нернста имеет вид:
0,059
lg a КАТ
n
0
Для 291 K уравнение Нернста имеет вид:
0,058
lg aКАТ
n
0
61.
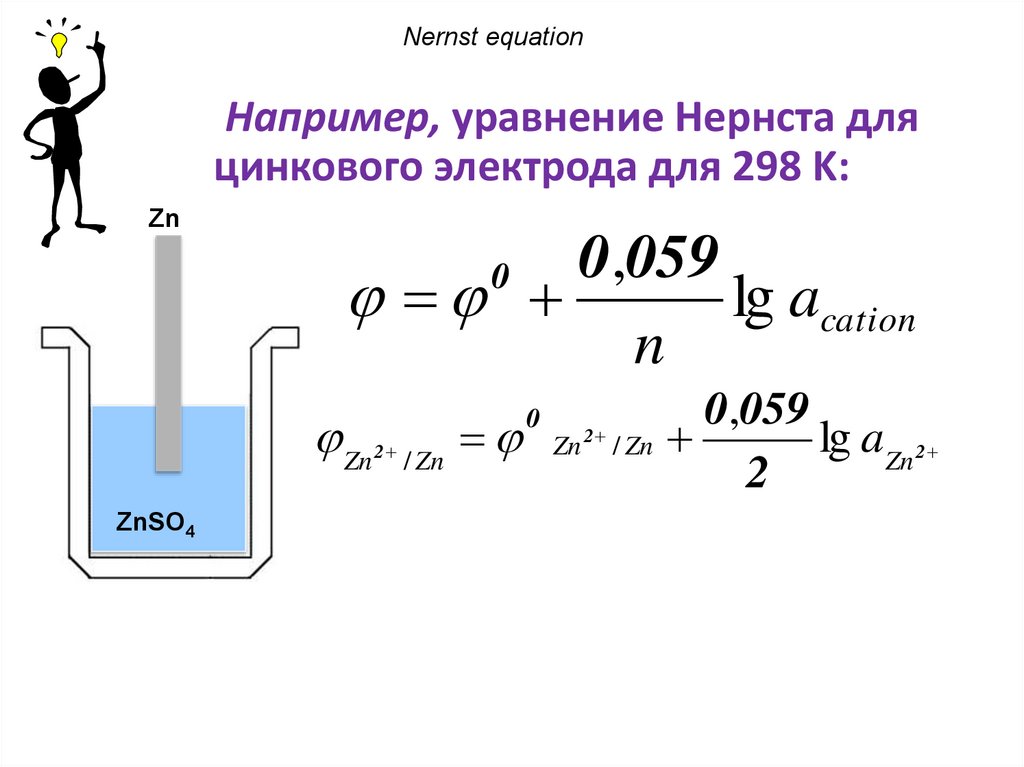
Nernst equationНапример, уравнение Нернста для
цинкового электрода для 298 K:
Zn
0,059
lg acation
n
0
0,059
Zn 2 / Zn Zn / Zn
lg aZn 2
2
0
ZnSO4
2
62.
Факторы, влияющие на величину электродногопотенциала
Природа металла: чем большей химической
активностью обладает металл, тем легче он
растворяется, тем отрицательнее
потенциал.
Активность ионов металла в растворе: чем
больше активность катионов в растворе, тем
положительнее потенциал.
Температура: с повышением температуры
потенциал становится более
положительным.
63.
Измерение величиныэлектродных потенциалов.
Гальванические цепи
Электродный потенциал нельзя измерить
непосредственно. Можно измерять только
разность
потенциалов
или
электродвижущую силу (E).
Для
этого
необходимо
собрать
гальваническую цепь из двух электродов.
64.
Измерение величины электродных потенциалов. Гальванические цепиГальванический элемент – это
электрохимическая система, состоящая
из двух электродов любого типа и в
которой
самопроизвольно
протекает
окислительно-восстановительная
реакция, энергия которой преобразуется
в электрическую энергию.
Гальванические
элементы –
химические источники
тока!
65.
Измерение величины электродных потенциалов. Гальванические цепиГальванические элементы:
электрохимические - источником
электрической энергии является
химическая реакция.
концентрационные - источником
электрической энергии служат
процессы выравнивания
концентраций растворов.
66. Измерение величины электродных потенциалов. Гальванические цепи
Схема гальванической цепи:(-) тв1 ж1
ж2 тв2 (+)
φ1
φ2
Правило «правого плюса»:
справа записывают более
электроположительный электрод (катод),
слева – более отрицательный (анод).
На
катоде
происходит
процесс
восстановления, на аноде – окисления.
67.
Расчет ЭДС гальванического элементаЭлектродвижущая сила (Е) –
это разность электродных потенциалов
катода и анода в разомкнутом ГЭ.
Е = φ(+) – φ(-)
Е>0[В]
68.
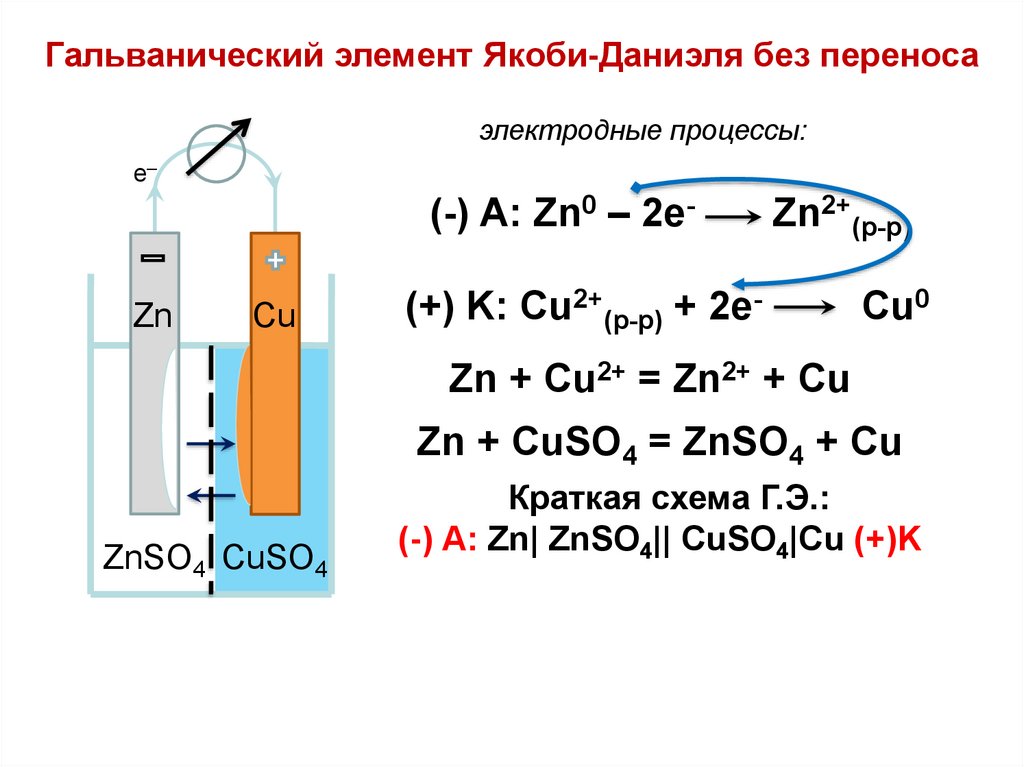
Гальванический элемент Якоби-Даниэля без переносаэлектродные процессы:
_
e
(-) A: Zn0 – 2eZn
Cu
Zn2+(р-р)
(+) K: Cu2+(р-р) + 2e-
Cu0
Zn + Cu2+ = Zn2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
ZnSO4 CuSO4
Краткая схема Г.Э.:
(-) А: Zn| ZnSO4|| CuSO4|Cu (+)K
69.
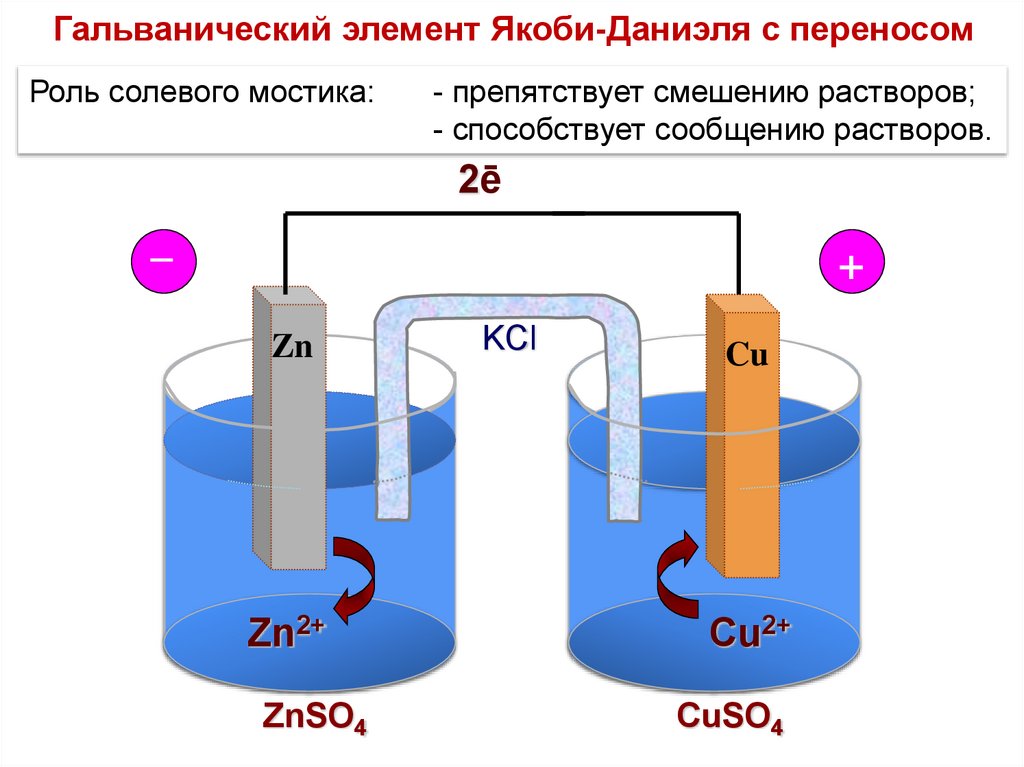
Гальванический элемент Якоби-Даниэля с переносомРоль солевого мостика:
- препятствует смешению растворов;
- способствует сообщению растворов.
2ē
_
+
Zn
Zn2+
ZnSO4
KCl
Cu
Cu2+
CuSO4
70.
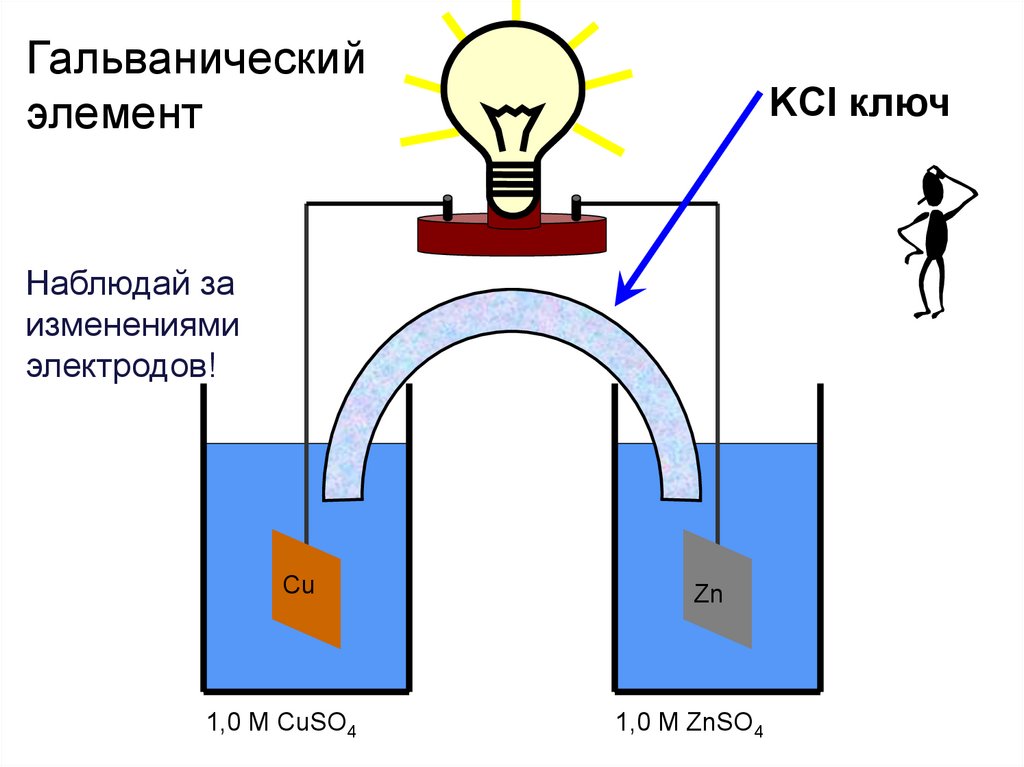
Гальваническийэлемент
KCl ключ
Наблюдай за
изменениями
электродов!
Cu
1,0 M CuSO4
Zn
1,0 M ZnSO4
71.
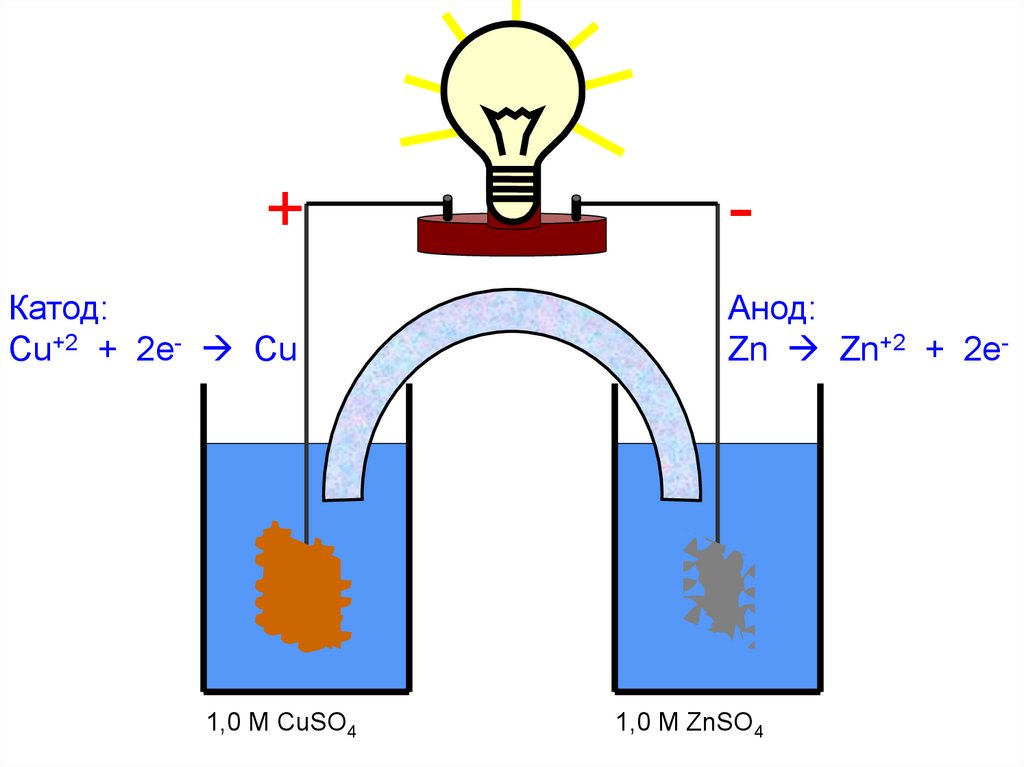
-+
Катод:
Cu+2 + 2e- Cu
Cu
1,0 M CuSO4
Анод:
Zn Zn+2 + 2e-
Zn
1,0 M ZnSO4
72.
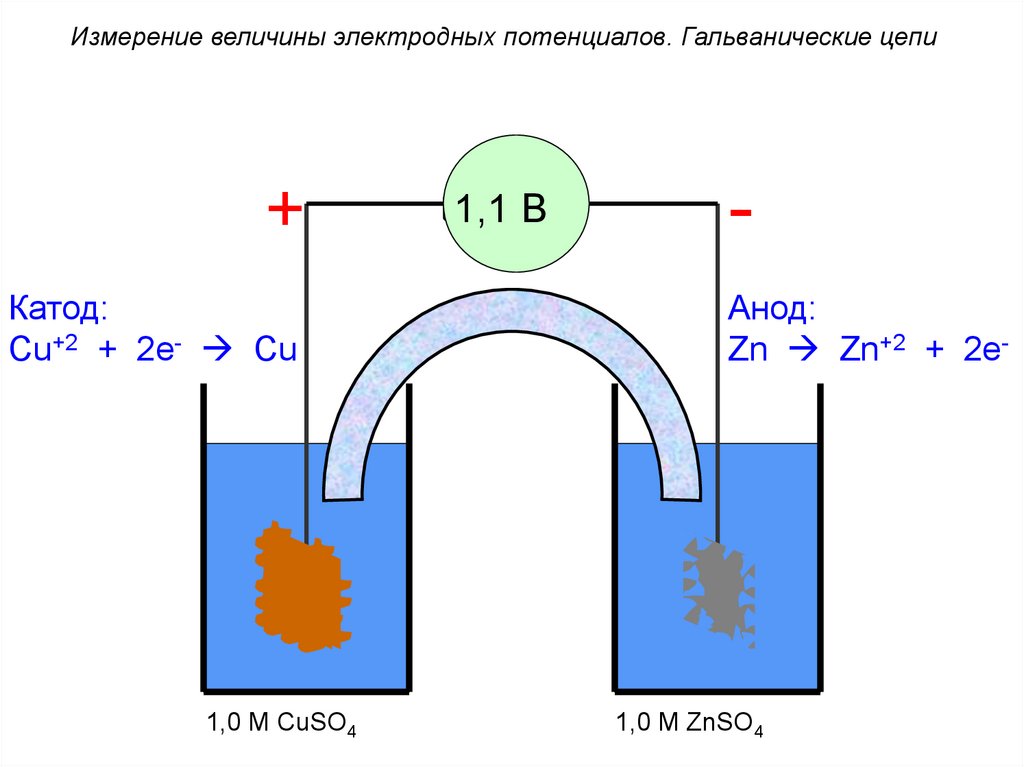
Измерение величины электродных потенциалов. Гальванические цепи+
-
1,1 В
Катод:
Cu+2 + 2e- Cu
Cu
1,0 M CuSO4
Анод:
Zn Zn+2 + 2e-
Zn
1,0 M ZnSO4
73.
Концентрационные ГЭ- это система из двух одинаковых электродов с
разными активностями вещества в растворах.
(–) Ag AgNO3 AgNO3 Ag (+)
ɑ1
ɑ2
a1 a2
Е зависит от разности активностей ионов в
растворах:
RT a2
E
ln
т.к. Δφ0 = 0
F
a1
74. Измерение величины электродных потенциалов. Гальванические цепи
Для измерения стандартных электродныхпотенциалов собирают гальваническую
цепь, состоящую из исследуемого
электрода и стандартного водородного
электрода, потенциал которого условно
принят за 0 В.
0
1
H / H
2 2
0,00 В
75. Измерение величины электродных потенциалов. Гальванические цепи
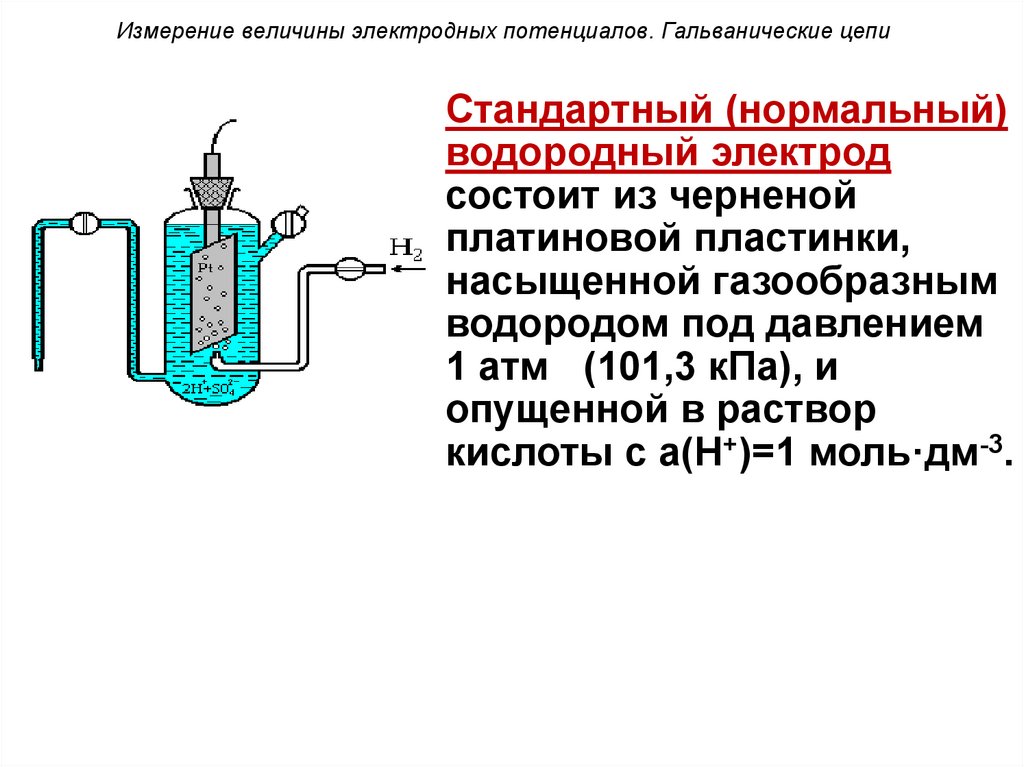
Стандартный (нормальный)водородный электрод
состоит из черненой
платиновой пластинки,
насыщенной газообразным
водородом под давлением
1 атм (101,3 кПа), и
опущенной в раствор
кислоты с a(Н+)=1 моль·дм-3.
76.
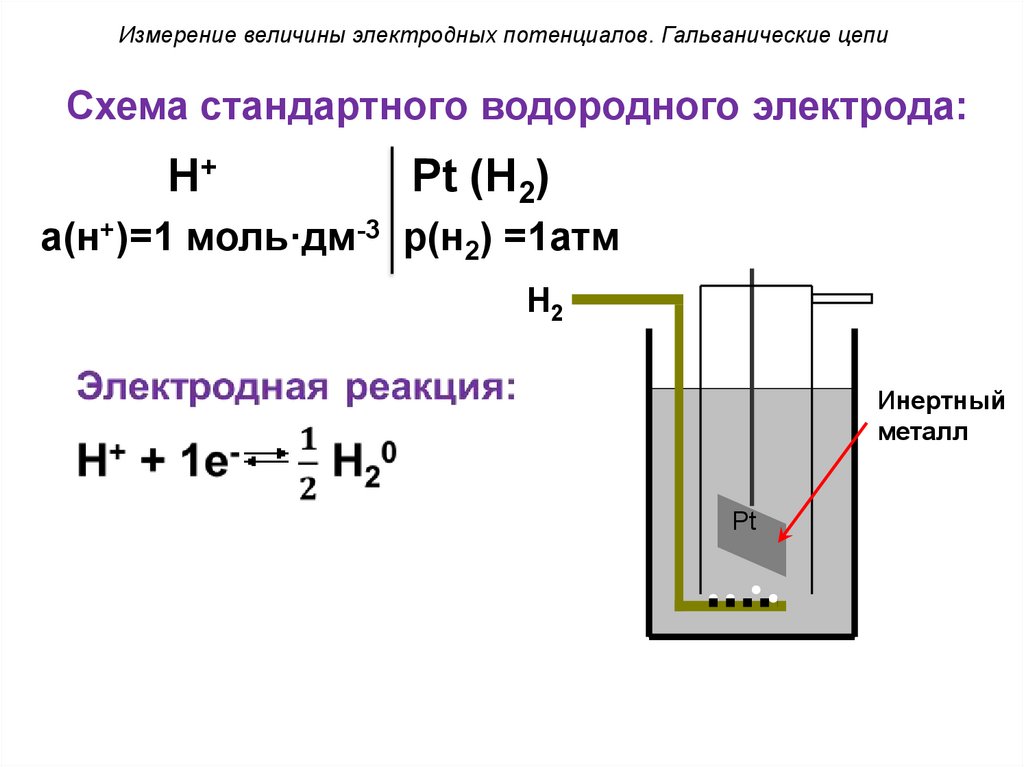
Измерение величины электродных потенциалов. Гальванические цепиСхема стандартного водородного электрода:
H+
Pt (H2)
a(н+)=1 моль·дм-3 p(н2) =1атм
H2
Инертный
металл
Pt
77. Измерение величины электродных потенциалов. Гальванические цепи
Уравнение Нернста (298К): 0,0590
lg a
H
H /1 / 2 H 2
1
H /1 / 2 H 2
0
0 В , тогда
Так как
H /1 / 2 H
2
0,059 lg a .
H
H /1 / 2 H 2
Так как
pH lg a , тогда
H
H /1 / 2 H 2
0,059 pH
Электродный потенциал водородного
электрода зависит от pH.
78. Измерение величины электродных потенциалов. Гальванические цепи
Пример: цепь с цинковым электродомЕ = φ(+) – φ(-)
79.
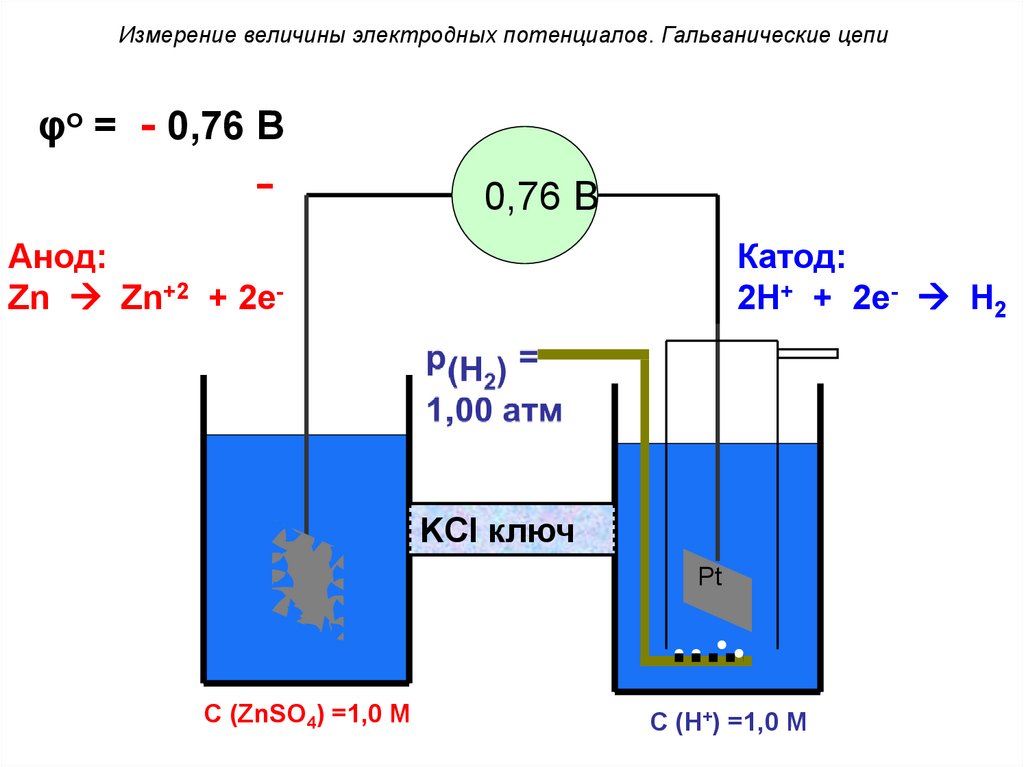
Измерение величины электродных потенциалов. Гальванические цепиφo = - 0,76 В
-
0,76 В
Анод:
Zn Zn+2 + 2e-
Катод:
2H+ + 2e- H2
KCl ключ
Zn
С (ZnSO4) =1,0 M
Pt
С (H+) =1,0 M
80.
Измерение величины электродных потенциалов. Гальванические цепиПример: цепь с медным электродом
Е = φ(+) – φ(-)
81.
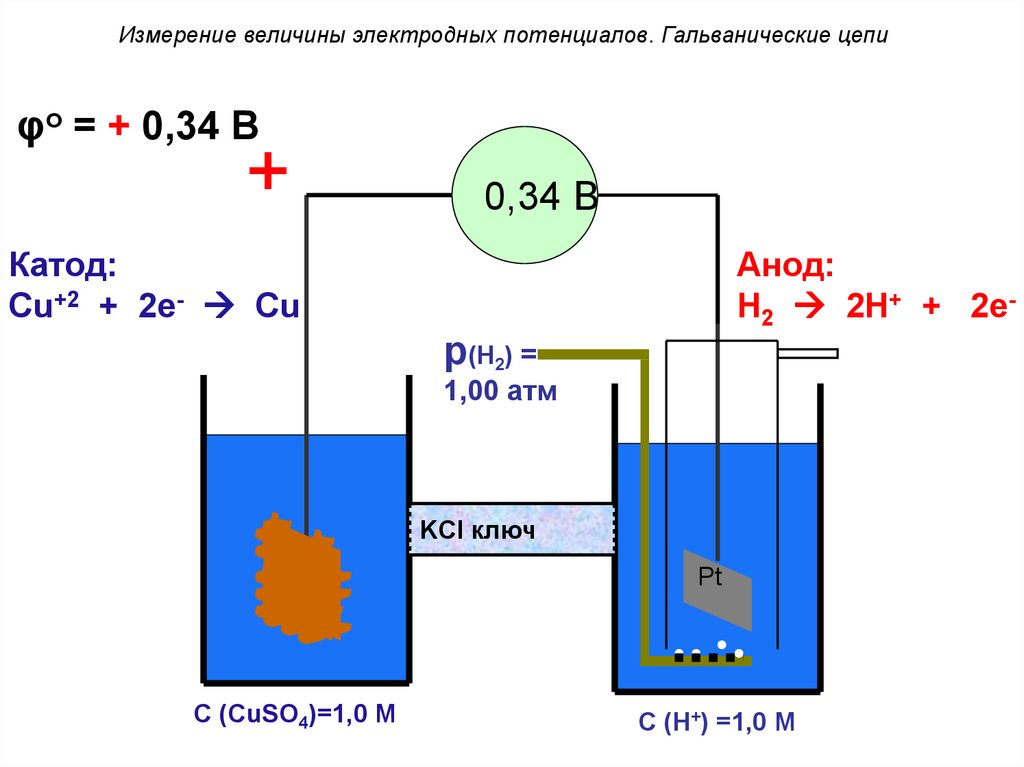
Измерение величины электродных потенциалов. Гальванические цепиφo = + 0,34 В
+
0,34 В
Катод:
Cu+2 + 2e- Cu
Анод:
H2 2H+ + 2e-
p(H2) =
1,00 атм
KCl ключ
Cu
Pt
C (CuSO4)=1,0 M
С (H+) =1,0 M
82. Измерение величины электродных потенциалов. Гальванические цепи
Металлы располагают в порядке сниженияих активности в электрохимический ряд
напряжений металлов.
Al+3 + 3e- Al
φo = - 1,66 В
Zn+2 + 2e- Zn
φo = - 0,76 В
2H+ + 2e- H2
φo = 0,00 В
Cu+2 + 2e- Cu
φo = + 0,34 В
Ag+ + e- Ag
φo = + 0,80 В
Увеличение активности
Измерение величины электродных потенциалов. Гальванические цепи
83.
Электрохимический ряд напряжений металловАктивные
Средней активности
Уменьшение химической активности
металла
Увеличение электродного потенциала
Усиление окислительных свойств
Мало-активные
84.
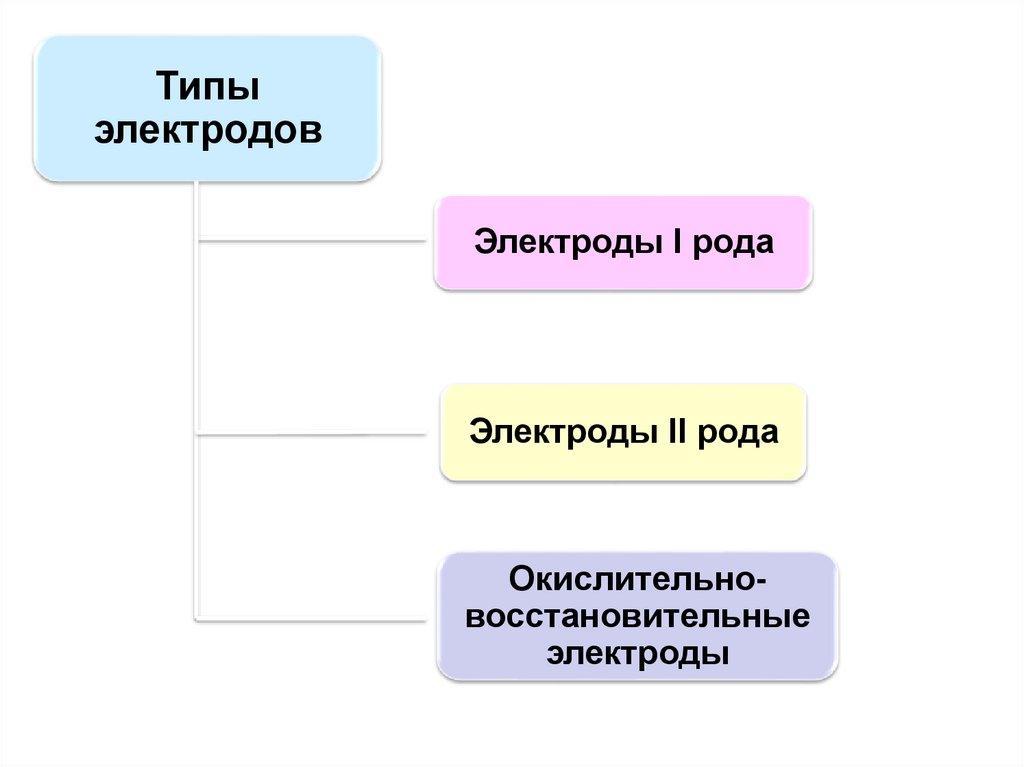
Типыэлектродов
Электроды I рода
Электроды II рода
Окислительновосстановительные
электроды
85.
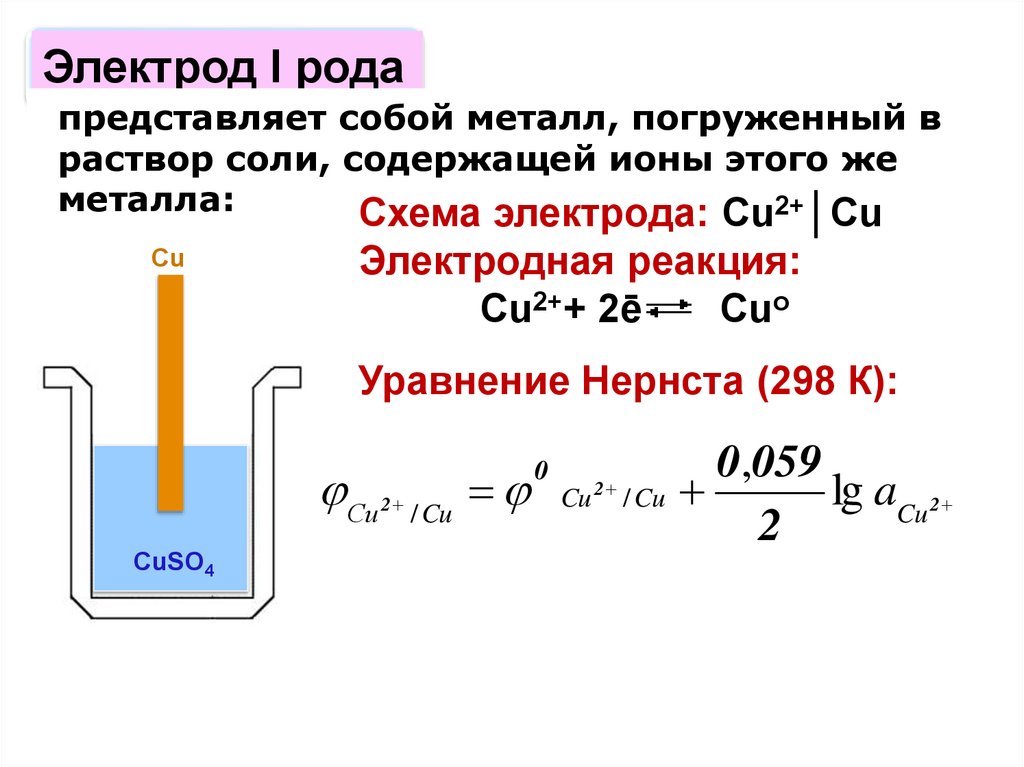
Электрод I родапредставляет собой металл, погруженный в
раствор соли, содержащей ионы этого же
металла:
Схема электрода: Cu2+│Cu
Cu
Электродная реакция:
Cu2++ 2ē
Cuo
Уравнение Нернста (298 К):
0
,
059
Сu 2 / Cu Cu 2 / Cu
lg aCu 2
2
0
CuSO4
86.
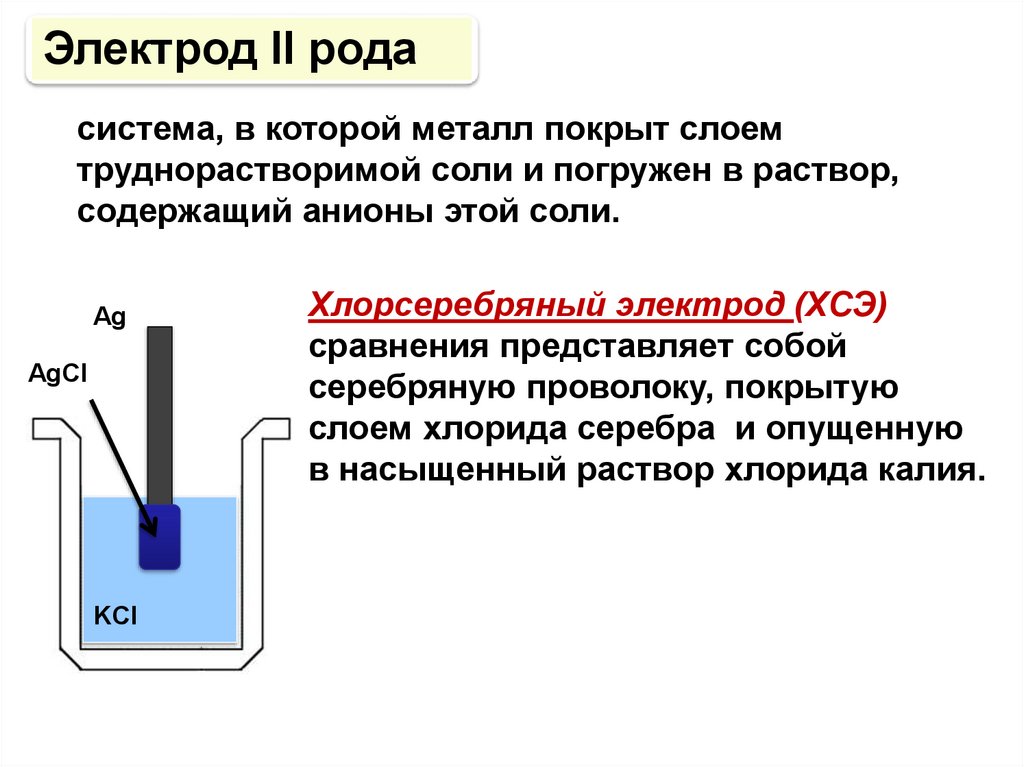
Электрод II родасистема, в которой металл покрыт слоем
труднорастворимой соли и погружен в раствор,
содержащий анионы этой соли.
Аg
AgCl
KCl
Хлорсеребряный электрод (ХСЭ)
сравнения представляет собой
серебряную проволоку, покрытую
слоем хлорида серебра и опущенную
в насыщенный раствор хлорида калия.
87.
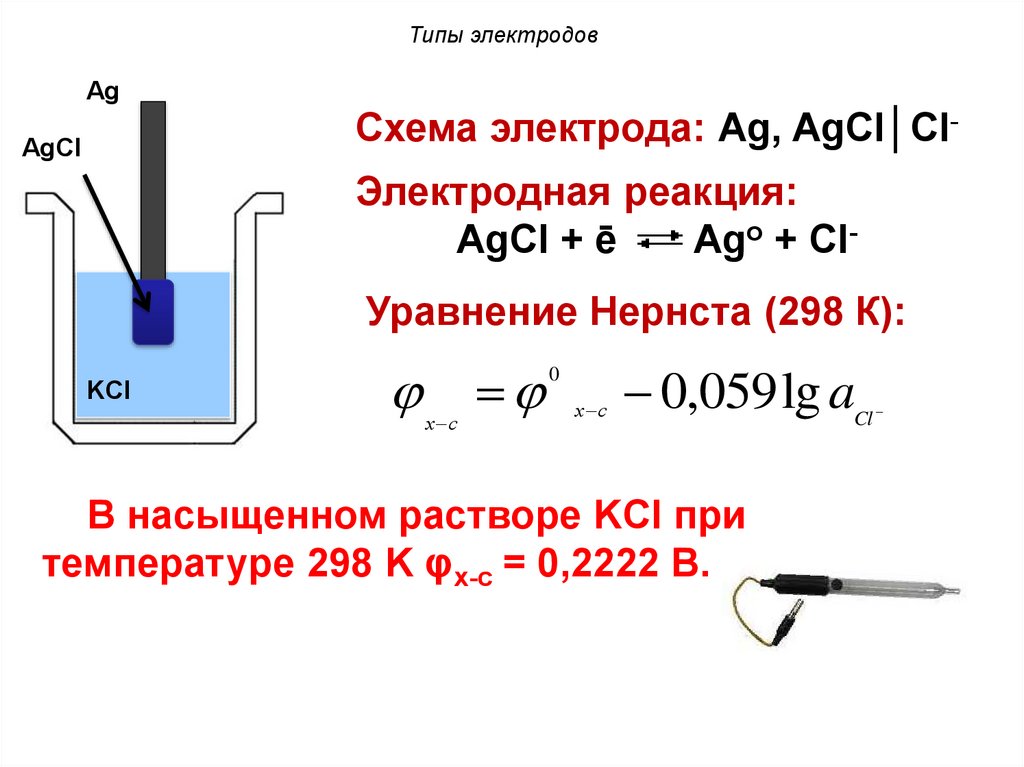
Типы электродовАg
Схема электрода: Ag, AgCl│Cl-
AgCl
Электродная реакция:
AgCl + ē
Ago + ClУравнение Нернста (298 К):
KCl
х с
0
х с
0,059 lg a
В насыщенном растворе KCl при
температуре 298 K φx-c = 0,2222 В.
Cl
88.
Окислительно-восстановительныйэлектрод
Раствор, содержащий одновременно
окисленную и восстановленную формы
вещества, называют окислительновосстановительной (red-ox) системой.
Инертный токопроводящий металл
(например, платина или иридий),
погруженный в red-ox систему, образует
red-ox-электрод.
89. Окислительно-восстановительные электроды
Инертныйметалл
выполняет
роль
посредника в осуществлении переноса
электронов
между
окисленной
и
восстановленной
формами
вещества,
являясь
донором
или
акцептором
электронов (донором – по отношению к
окисленной форме, акцептором – по
отношению к восстановленной форме).
90. Окислительно-восстановительные электроды
Red-ox-электроды делятся на простыеи сложные.
В простых электродах для
осуществления электродной реакции ox и
red формы обмениваются только
электронами.
91. Окислительно-восстановительные электроды
Уравнение Нернста-Петерса:RT aox
ln
nF ared
0
Уравнение Нернста-Петерса для Т 298 К:
0,059 aox
lg
n
ared
0
92.
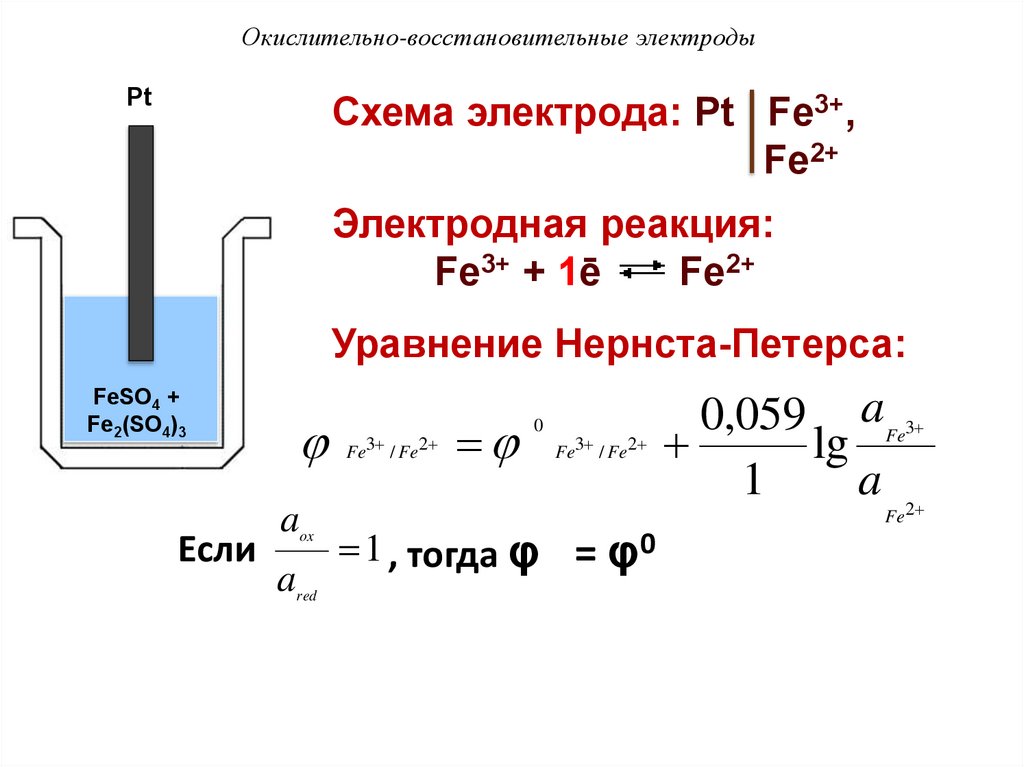
Окислительно-восстановительные электродыPt
Схема электрода: Pt Fe3+,
Fe2+
Электродная реакция:
Fe3+ + 1ē
Fe2+
Уравнение Нернста-Петерса:
FeSO4 +
Fe2(SO4)3
Если
a
a
ox
red
Fe3 / Fe2
0
Fe3 / Fe2
1 , тогда φ = φ0
0,059 a
lg
1
a
Fe3
Fe2
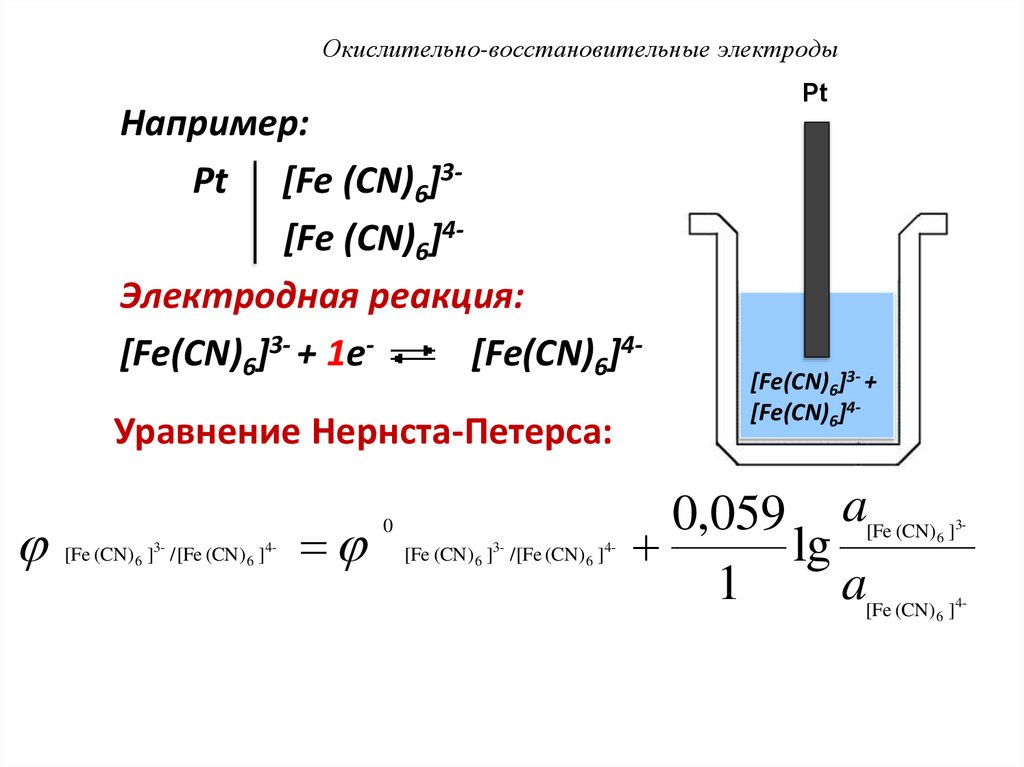
93. Окислительно-восстановительные электроды
Например:Pt [Fe (CN)6]3[Fe (CN)6]4Электродная реакция:
[Fe(CN)6]3- + 1e[Fe(CN)6]4Уравнение Нернста-Петерса:
[Fe (CN) 6 ]3- /[Fe (CN) 6 ]4-
0
[Fe (CN) 6 ]3- /[Fe (CN) 6 ]4-
Pt
[Fe(CN)6]3- +
[Fe(CN)6]4-
0,059 a
lg
1
a
[Fe (CN) 6 ]3-
[Fe (CN) 6 ]4-
94. Окислительно-восстановительные электроды
Всложных
электродах
в
осуществлении электродной реакции
помимо
окисленной
и
восстановленной форм принимают
участие ионы среды (H+ или OH-).
95. Окислительно-восстановительные электроды
PtСхема сложного электрода:
Pt MnO4-, H+
Mn2+
Электродная реакция:
MnO4– + 8H+ + 5e–
Mn2+ + 4H2O
Уравнение Нернста-Петерса (Т = 298К):
MnO4– +
H+ + Mn2+
8
0
,
059
a
(
MnO
)
a
(
H
)
2
0
2
4
(MnO 4 , H /Mn ) ( MnO 4 , H /Mn )
lg
2
5
a ( Mn )
Таким образом, в уравнение Нернста-Петерса
для сложного red-ox электрода, помимо
активностей окисленной и восстановленной
форм, входит концентрация ионов среды.
96.
Типыэлектродов по
назначению
Электроды сравнения
Электроды
определения
97.
Электроды сравненияВодородный электрод сложен по конструкции и его
потенциал зависит от трудно контролируемых
факторов, поэтому на практике применяют более
простые электроды.
Электроды сравнения – электроды,
потенциалы
которых
известны,
постоянны и воспроизводимы.
98. Электроды сравнения
В медико-биологических исследованиях вкачестве электрода сравнения широко
используют хлорсеребряный электрод.
В насыщенном растворе KCl при
температуре 298 K φx-c = 0,2222 В.
99.
Электроды определения(мембранные электроды)
Основные
требования
к
электродам
определения
–
специфичность,
селективность, высокая чувствительность
к концентрации определенных ионов.
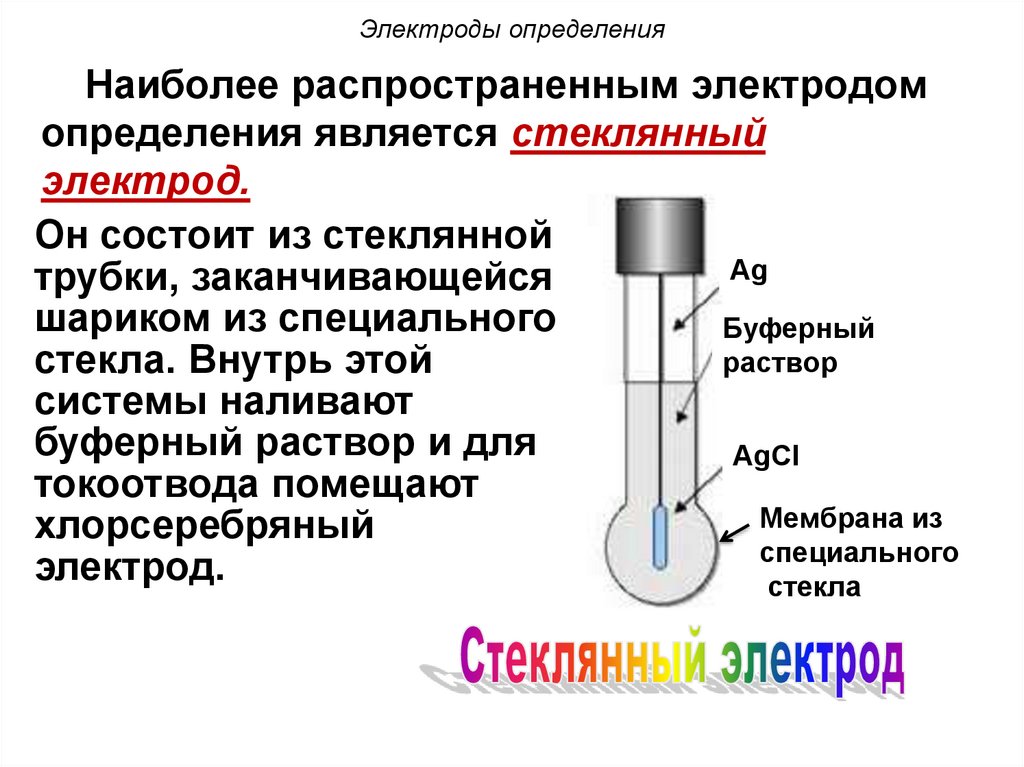
100. Электроды определения
Наиболее распространенным электродомопределения является стеклянный
электрод.
Он состоит из стеклянной
Ag
трубки, заканчивающейся
шариком из специального
Буферный
раствор
стекла. Внутрь этой
системы наливают
буферный раствор и для
AgCl
токоотвода помещают
Мембрана из
хлорсеребряный
cпециального
электрод.
стекла
101. Электроды определения
Потенциал, возникающий на х.с.электроде, остается постоянным и не
влияет на потенциал, возникающий между
поверхностью стекла и исследуемым
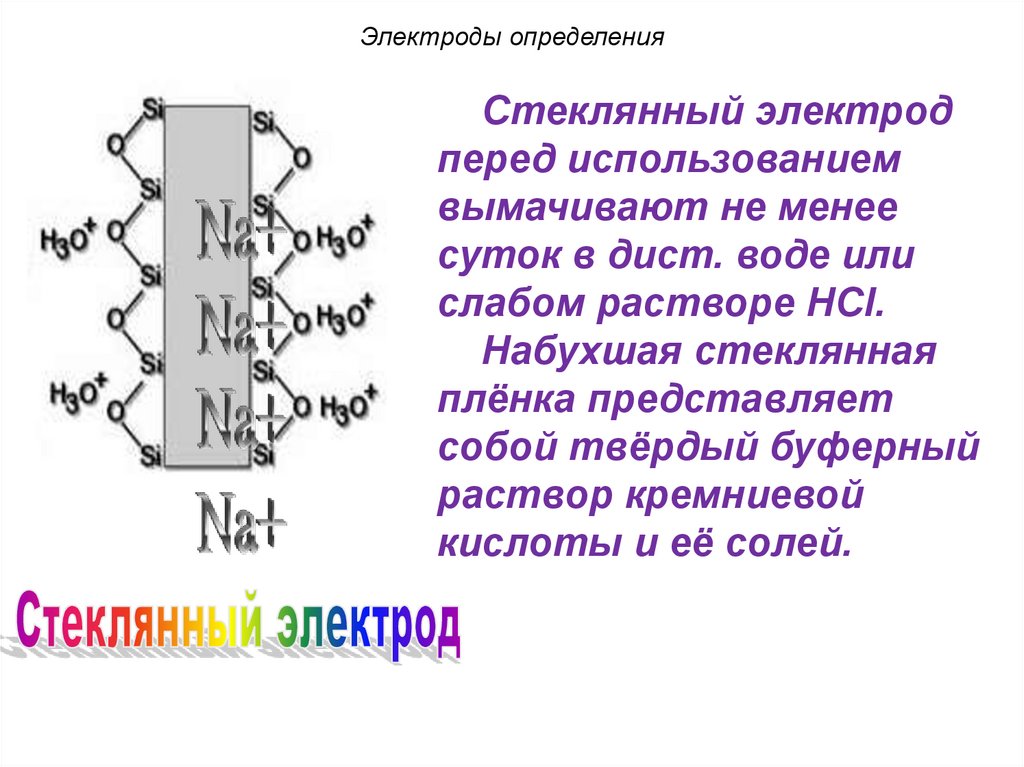
раствором.
Схема электрода:
стекл. электрод H+ – ?
Электродная реакция:
Na+(стекло) + H+(р-р)
Na+(p-p) + H+(стекло)
Li+(стекло) + H+(р-р)
Li+(p-p) + H+(стекло)
102. Электроды определения
При помещении стеклянного электрода враствор в поверхностный слой стекла из
раствора интенсивно проникают ионы
водорода, вытесняя ионы Nа+ или Li+ ,
содержащиеся в стекле.
Ионы водорода распределяются между
стеклом и раствором и на границе раздела
фаз возникает разность потенциалов.
Т. к. переход ионов водорода в стекло
зависит от концентрации их в растворе, то
потенциал стеклянного электрода
зависит от рН раствора.
103. Электроды определения
Активность ионов водорода в стекле можносчитать постоянной, а уравнение Нернста для
стеклянного электрода имеет вид:
стeкл
стекл
0
стекл
0
стекл
0,059 lg a
0,059 pH
Н
104.
Электроды определенияСтеклянный электрод
перед использованием
вымачивают не менее
суток в дист. воде или
слабом растворе НСI.
Набухшая стеклянная
плёнка представляет
собой твёрдый буферный
раствор кремниевой
кислоты и её солей.
105. Ионоселективные электроды
Ионоселективные электроды – этоэлектроды, проявляющие селективное
действие относительно тех или иных ионов.
C их помощью стало возможным наблюдать
за изменением ионного состава биологических
жидкостей в динамике, а также получать
информацию о внутриклеточном изменении
концентрации ионов Na+, К+, Сa2+, СI- и т.д.
106. Электроды определения
В настоящее времячисло ионоселективных
электродов с четко
выраженной
селективностью к
определенным ионам
составляет более 20,
например калиевый
электрод, натриевый
электрод и др.
107. Вопросы для самоконтроля
1. Как формируется ДЭС?2. Охарактеризуйте уравнение Нернста.
3. По каким признакам классифицируются
электроды?
108.
БЛАГОДАРЮ ЗАВАШЕ ВНИМАНИЕ!



















































 Химия
Химия








