Похожие презентации:
Бор. Общая характеристика элементов IIIa группы
1.
Урок 3III группа
B (бор)
Al (алюминий)
2.
БорСреди элементов IIIa группы один лишь бор относится к неметаллам. Представляет собой
аморфное кристаллическое вещество красного или темного цвета, может быть
бесцветным.
Общая характеристика элементов IIIa группы
От B к Tl (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса,
металлических, основных, восстановительных свойств. Уменьшается
электроотрицательность, энергия ионизация, сродство к электрону.
Оксид бора проявляется кислотные свойства, алюминий и галлий - типичные амфотерные
элементы, у соединений индий и таллия преобладают основные свойства.
3.
Электронныеконфигурации у данных
элементов схожи, так
как они находятся в
одной группе (главной
подгруппе!), общая
формула ns2np1:
•B - 2s22p1
•Al - 3s23p1
•Ga - 4s24p1
•In - 5s25p1
•Tl - 6s26p1
4.
Природныесоединения
В природе бор
встречается в
виде минералов:
•Na2B4O7*10H2O
- бура
•H3BO3 - сассолин
5.
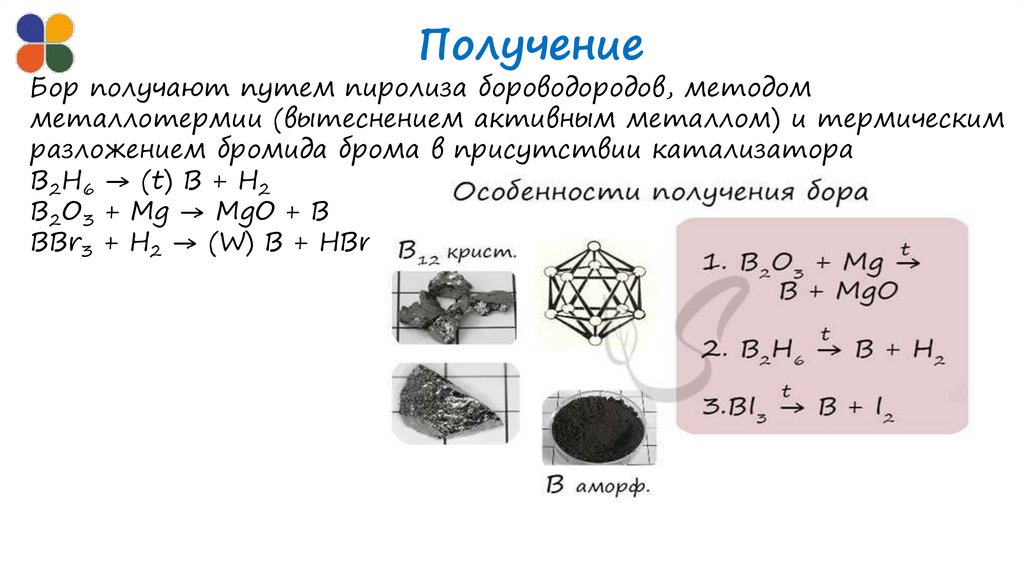
ПолучениеБор получают путем пиролиза бороводородов, методом
металлотермии (вытеснением активным металлом) и термическим
разложением бромида брома в присутствии катализатора
B2H6 → (t) B + H2
B2O3 + Mg → MgO + B
BBr3 + H2 → (W) B + HBr
6.
Химические свойства1.Реакции с фтором
Необходимо заметить, что бор довольно инертный неметалл. При
комнатной температуре без нагревания он реагирует только со
фтором:
B + F2 → BF3↑
2.Реакции с неметаллами
При нагревании бор реагирует с другими галогенами, азотом,
фосфором, углеродом и кислородом.
B + Cl2 → BCl3
B + N2 → BN
B + P → BP
B + C → B4C
B + O2 → B2O3
7.
3.Восстановительныесвойства
При сильном нагревании
бор способен
восстановить кремний
из его оксида:
SiO2 + 4B → Si + B2O3
4Окраска пламени
Ионы бора окрашивают
пламя в оттенки
зеленого цвета.
8.
Оксид и гидроксид бораОксид и гидроксид бора (борная кислота) проявляют
кислотные свойства.
B2O3 + H2O → H3BO3 (борная кислота)
H3BO3 + KOH → K2B4O7 + H2O
9.
АлюминийАлюминий является самым распространенным металлом в земной коре. Свойства алюминия
позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается
штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой
электро- и теплопроводностью.
Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние
2 электрона s-подуровня распариваются, и один электрон
переходит на p-подуровень.
10.
Природные соединенияВ природе алюминий
встречается в виде минералов:
•Al2O3 - корунд
•3BeO*Al2O3*6SiO2 - берилл
(аквамарин - примесь Fe и
изумруд - примесь Cr2O3)
•Al2O3*Cr2O3 - красный рубин
•Al2O3 с примесью Fe+2/Fe+3/Ti
•Al2O3*H2O - боксит
Получение
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3AlF6).
Галлий, индий и таллий получают схожим образом - методом электролиза их
оксидов и солей.
Al2O3 → (t) Al + O2 (в расплаве криолита - Na3AlF6)
11.
Химические свойства1Реакции с неметаллами
При комнатной температуре реагирует с
галогенами (кроме фтора) и кислородом,
покрываясь при этом оксидной пленкой.
Al + O2 → Al2O3 (снаружи Al покрыт
оксидной пленкой - Al2O3)
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в
реакции с фтором, серой, азотом и
углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)
2.Реакции с кислотами и щелочами
Алюминий проявляет амфотерные свойства
(греч. ἀμφότεροι - двойственный), вступает в
реакции как с кислотами, так и с
основаниями.
Al + HCl → AlCl3 + H2
Al + H2SO4(разб.) → Al2(SO4)3 + H2↑
Al + H2SO4(конц.) → (t) Al2(SO4)3 + SO2↑ + H2O
Al + HNO3(разб.) → (t) Al(NO3)3 + N 2O + H2O
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
(тетрагидроксоалюминат натрия; поскольку
алюминий дан в чистом виде - выделяется
водород)
При прокаливании комплексные соли не
образуются, так вода испаряется:
Na[Al(OH)4] → (t) NaAlO2 + H2O
12.
3 Реакция с водойПри комнатной температуре
не идет из-за образования
оксидной пленки - Al2O3 - на
воздухе. Если разрушить
оксидную пленку нагреванием
раствора щелочи или
амальгамированием
(покрытием металла слоем
ртути) - реакция идет.
Al + H2O → (t) Al(OH)3 + H2↑
4 Алюминотермия
Алюминотермия (лат. Aluminium + греч. therme
- тепло) - способ получения металлов и
неметаллов, заключающийся в восстановлении их
оксидов алюминием. Температуры при этом
процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr,
Mn, Ca, Ti, V, W.
Fe2O3 + Al → (t) Al2O3 + Fe
Cr2O3 + Al → (t) Al2O3 + Cr
MnO2 + Al → (t) Al2O3 + Mn
13.
Оксид алюминияОксид алюминия получают в ходе взаимодействия с кислородом - на воздухе алюминий
покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое
основание, легко разлагается на оксид и воду.
Al + O2 → Al2O3
Al(OH)3 → (t) Al2O3 + H2O↑
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + H2SO4 → Al2(SO4)3 + H2O
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Al2O3 + NaOH → (t) NaAlO2 + H2O (алюминат натрия)
Al2O3 + Na2O → (t) NaAlO2
14.
Гидроксид алюминияГидроксид алюминия получают в ходе реакций обмена между растворимыми солями
алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок
- гидроксид алюминия.
AlBr3 + LiOH → Al(OH)3↓ + LiBr
Al(NO3)3 + K2CO3 → KNO3 + Al(OH)3↓ + CO2 (двойной гидролиз: Al(NO3)3 гидролизуется по
катиону, K2CO3 - по аниону)
Al2S3 + H2O → Al(OH)3↓ + H2S↑
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие
нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание - Li3[Al(OH)6] гексагидроксоалюминат лития)
15.
Блиц-опрос по теме Бор1. Оксид бора III является
А-Основным
Б-Кислотным
В-Амфотерным
Г- Основанием
2. Количество
электронов на внешнем
уровне у элементов IIIa
группы:
А-Два
Б-Три
В-Четыре
Г-Пять
3. Кристаллическая
решетка бора
А-Молекулярная
Б-Ионная
В-Атомная
Г-Металлическая
Борная кислота является
А-Двухосновной
Б-Трехосновной
В-Одноосновный
Г-Трехкислотной
4. Ионы бора
окрашивают пламя в
... цвет
А-Зеленый
Б -Красный.
В-Фиолетовый
Г- Синий
Д/з- составьте 10 тестовых заданий по теме №3
16.
Спасибо за урок!Вы на одну ступень
ближе к мечте















 Химия
Химия








