Похожие презентации:
Химия р-элементов V группы. Общая характеристика элементов. Лекция 15
1.
Лекция 15. Химия р-элементов V группы. Общая характеристика элементов. Сравнениесвойств и реакционной способности элементов подгруппы
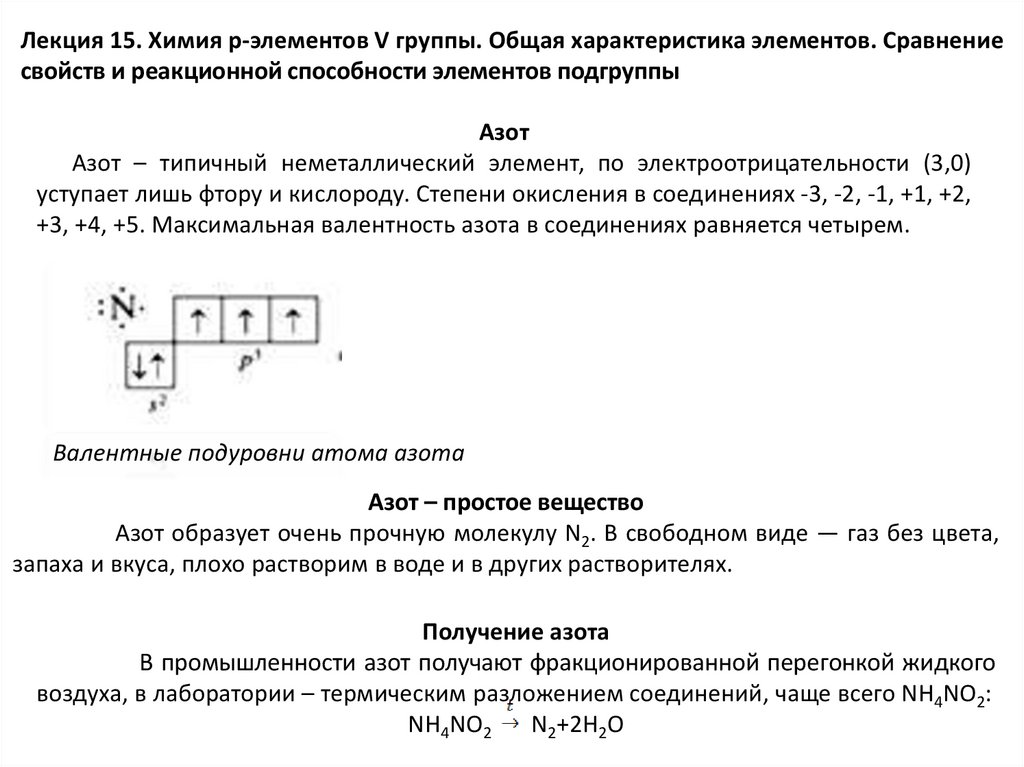
Азот
Азот – типичный неметаллический элемент, по электроотрицательности (3,0)
уступает лишь фтору и кислороду. Степени окисления в соединениях -3, -2, -1, +1, +2,
+3, +4, +5. Максимальная валентность азота в соединениях равняется четырем.
Валентные подуровни атома азота
Азот – простое вещество
Азот образует очень прочную молекулу N2. В свободном виде — газ без цвета,
запаха и вкуса, плохо растворим в воде и в других растворителях.
Получение азота
В промышленности азот получают фракционированной перегонкой жидкого
воздуха, в лаборатории – термическим разложением соединений, чаще всего NH4NO2:
NH4NO2
N2+2H2O
2.
Химические свойства азотаХимически пассивен, не реагирует с кислотами, щелочами, серой, с
галогенами (кроме фтора).
Незначительно взаимодействует с H2 и O2 при комнатной температуре при
действии электрического разряда:
N2+3H2→2NH3
N2+O2→2NO
Взаимодействие с галогенами (непосредственно только со фтором)
Взаимодействие с углеродом (образование дициана):
N2+2Cграфит
C2N2
Взаимодействие с металлами (образование нитридов):
3Mg+N2
Mg3N2
Взаимодействие с гидридами:
3LiH+N2
Li3N+NH3
Взаимодействие с карбидами:
N2+CaC2
Ca(CN)2
3.
Соединения азотаСоединения азота со степенью окисления азота – 3
Нитриды
Как упомянуто выше, при высоких температурах азот окисляет многие
металлы и неметаллы, образуя нитриды:
3Mg+N2
Mg3N2
2B+N2
2BN
3H2+N2
2NH3
Основные нитриды: Li3N, Na3N, Mg3N2
Гидролизуются с образованием аммиака и гидроксида:
Li3N+3H2O→3LiOH+NH3
Амфотерные нитриды: AlN
Кислотные нитриды: Si3N4, P3N5, S4N4, Cl3N
Нитриды галогенов – эндотермические соединения, в свободном состоянии
выделен только Cl3N, легко разлагающийся со взрывом.
Cl3N+3H2O→3HClO+NH3
BN, AlN, Si3N4, Ge3N4 – твердые полимерные вещества с высокими температурами
плавления (2000 – 3000 оС), могут образовывать смешанные нитриды:
Li3N+AlN→Li3AlN2
4.
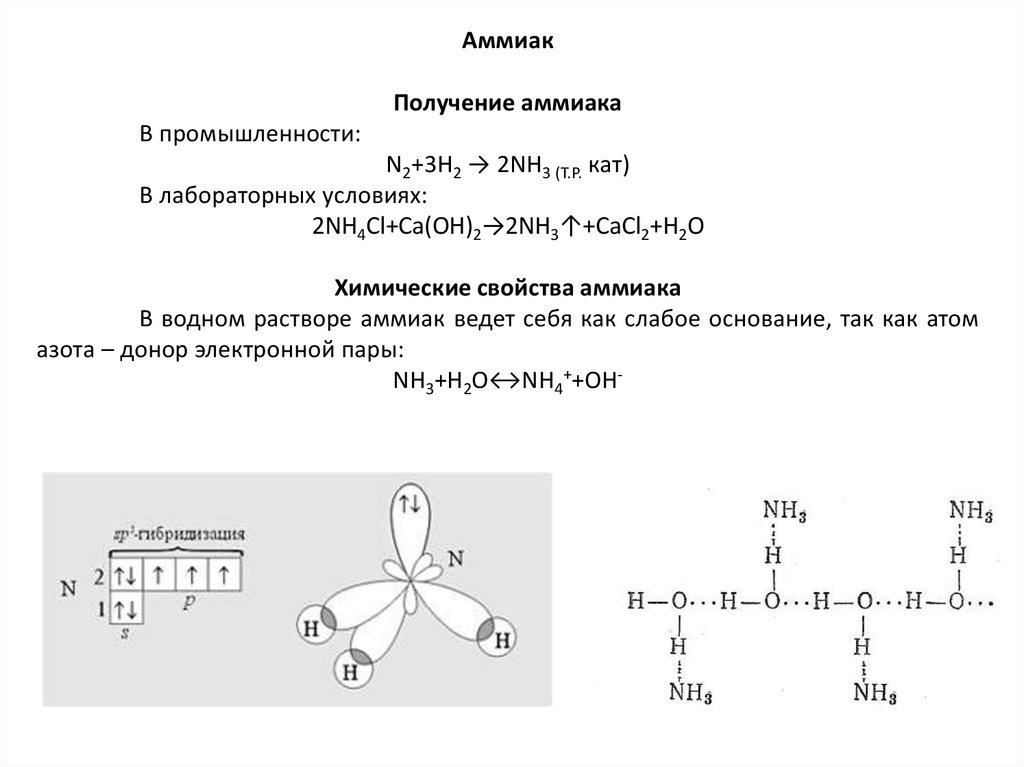
АммиакПолучение аммиака
В промышленности:
N2+3Н2 → 2NН3 (T.P. кат)
В лабораторных условиях:
2NH4Cl+Ca(OH)2→2NH3↑+CaCl2+H2O
Химические свойства аммиака
В водном растворе аммиак ведет себя как слабое основание, так как атом
азота – донор электронной пары:
NH3+H2O↔NH4++OH-
5.
Взаимодействие с кислотами:NH3+HCl→NH4Cl
Реакции комплексообразования:
Сu2++4NH3→[Cu(NH3)4]2+
Восстановительные свойства аммиака:
3СuO+2NH3→3Cu+N2+3H2O
6.
Азотистая кислотаПолучение
Азотистую кислоту можно получить при растворении оксида азота (III) N2O3
в воде:
N2O3 + H2O ↔ 2HNO2
Также она получается при растворении в воде оксида азота (IV) NO2:
2NO2 + H2O ↔ HNO2 + HNO3
Химические свойства
В водных растворах существует равновесие:
2HNO2 ↔ N2O3 + H2O ↔ NO↑ + NO2↑ + H2O
При нагревании раствора азотистая кислота распадается с выделением NO и
NO2:
3HNO2 ↔ HNO3 + 2NO↑ + H2O.
Легко вытесняется более сильными кислотами из солей:
H2SO4 + NaNO2 → NaHSO4 + HNO2
7.
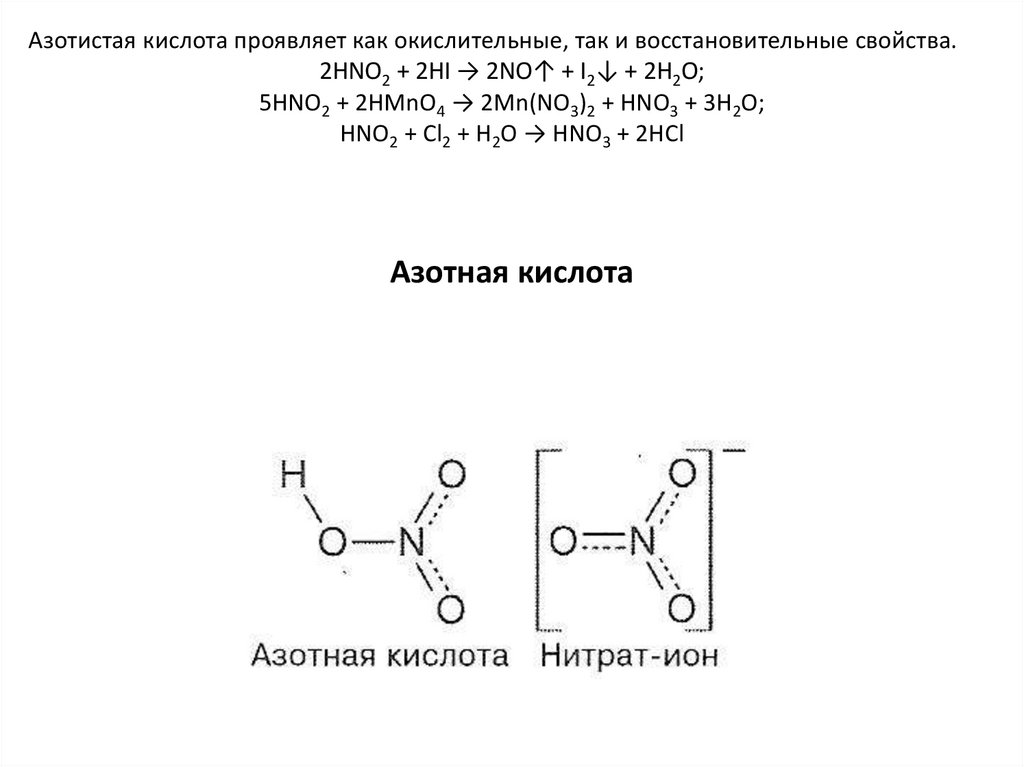
Азотистая кислота проявляет как окислительные, так и восстановительные свойства.2HNO2 + 2HI → 2NO↑ + I2↓ + 2H2O;
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O;
HNO2 + Cl2 + H2O → HNO3 + 2HCl
Азотная кислота
8.
Химические свойства азотной кислотыВысококонцентрированная HNO3 имеет обычно бурую окраску вследствие
происходящего на свету процесса разложения:
а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
9.
Разбавленная HNO3б) с металлами, стоящими в ряду напряжений левее водорода:
Au + HNO3 ≠
Pt + HNO3 ≠
Fe + HNO3 КОНЦ ≠
Al + HNO3 КОНЦ ≠
Cr + HNO3 КОНЦ ≠
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO
или NO2:
10.
и сложные вещества, например:Нитраты
Соли азотной кислоты — нитраты — при нагревании необратимо
разлагаются, продукты разложения определяются катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
2NaNO3 = 2NaNO2 + O2
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
в) нитраты металлов, расположенных в ряду напряжений правее меди:
2AgNO3 = 2Ag + 2NO2 + O2
г) нитрат аммония:
NH4NO3 = N2O + 2H2O
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + H2O — при сплавлении твердых веществ
Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO3 + 2H2O — при сплавлении.
Цинк и алюминий в щелочном растворе восстанавливают нитраты до
NH3:
11.
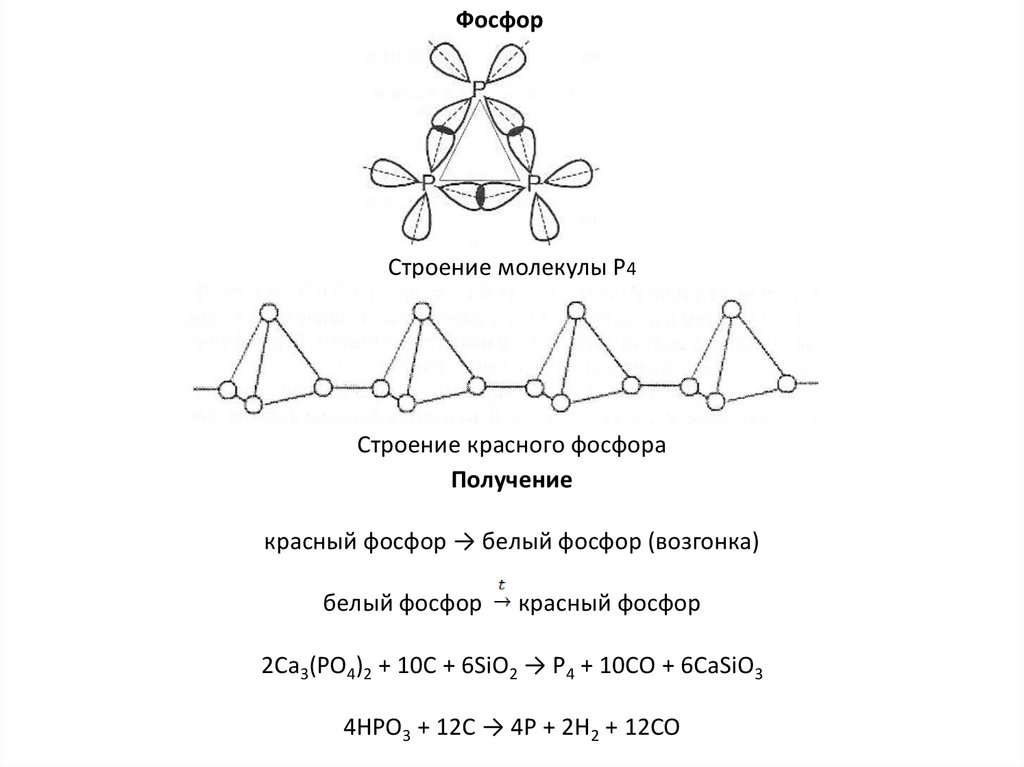
ФосфорСтроение молекулы Р4
Строение красного фосфора
Получение
красный фосфор → белый фосфор (возгонка)
белый фосфор
красный фосфор
2Ca3(PO4)2 + 10C + 6SiO2 → P4 + 10CO + 6CaSiO3
4HPO3 + 12C → 4P + 2H2 + 12CO
12.
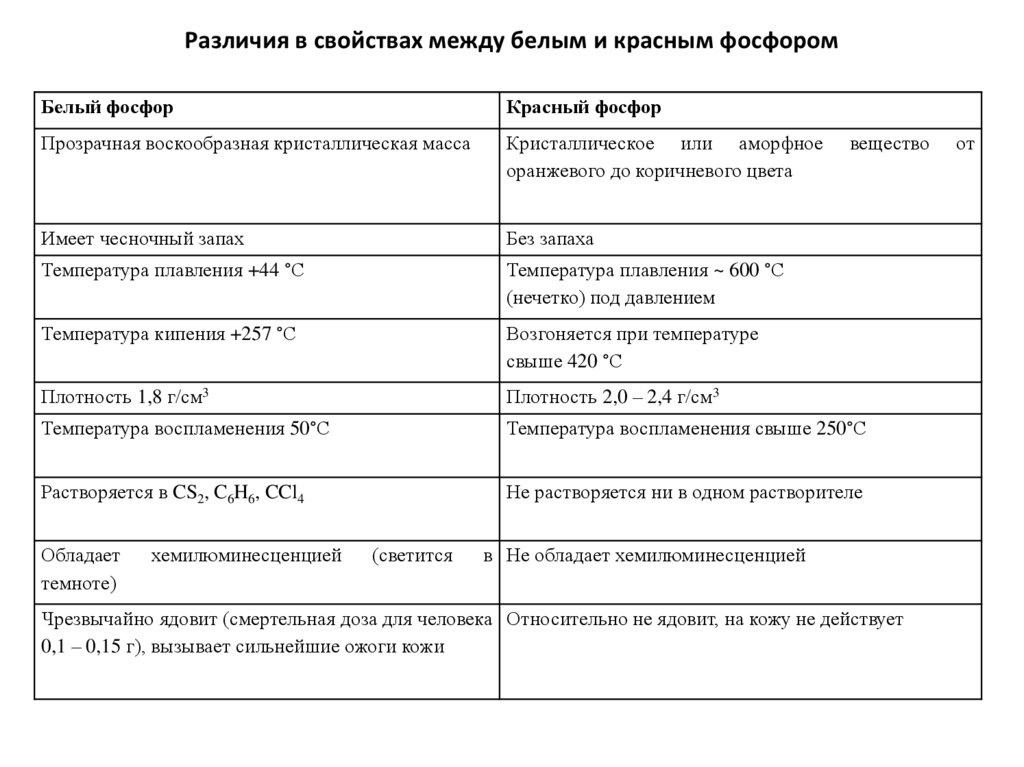
Различия в свойствах между белым и красным фосфоромБелый фосфор
Красный фосфор
Прозрачная воскообразная кристаллическая масса
Кристаллическое или аморфное
оранжевого до коричневого цвета
Имеет чесночный запах
Без запаха
Температура плавления +44 °С
Температура плавления ~ 600 °С
(нечетко) под давлением
Температура кипения +257 °С
Возгоняется при температуре
свыше 420 °С
Плотность 1,8 г/см3
Плотность 2,0 – 2,4 г/см3
Температура воспламенения 50°С
Температура воспламенения свыше 250°С
Растворяется в CS2, C6H6, CCl4
Не растворяется ни в одном растворителе
Обладает
темноте)
хемилюминесценцией
(светится
вещество
в Не обладает хемилюминесценцией
Чрезвычайно ядовит (смертельная доза для человека Относительно не ядовит, на кожу не действует
0,1 – 0,15 г), вызывает сильнейшие ожоги кожи
от
13.
Взаимодействие с водой8Р + 12Н2О = 5РН3 + 3Н3РО4 (фосфорная кислота).
Взаимодействие со щелочами
4Р + 3KOH + 3Н2О → РН3 + 3KН2РО2
Восстановительные свойства
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO;
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
6P + 5KClO3 → 5KCl + 3P2O5
14.
Соединения со степенью окисления фосфора – 3Фосфиды
Mg3P2+6H2O→3Mg(OH)2+2PH3↑
Фосфин
2P2H4+7O2→2P2O5+4H2O
2PH3+4О2→P2O5+3H2O
ФОСФОРНЫЕ КИСЛОТЫ
Получение фосфорной кислоты:
Ca3(PO4)2(кр)+3H2SO4(р-р)→2H3PO4(рр)+3CaSO4(кр)
Соли фосфористой кислоты – сильные восстановители
NaH2PO2+NiCl2+H2O→H3PO3+Ni+NaCl+HCl
H3PO3+2AgNO3+H2O→H3PO4+2Ag↓+2HNO3
15.
HPO3+H2O→H3PO42H3PO4
3H3PO4
H4P2O7
H5P3O10
Галогениды фосфора
2P + 3Cl2 → 2PCl3
PCl3 + Cl2 → PCl5
PCl5↔PCl3+Cl2
Все галогениды, кроме PF3 и PF5 полностью гидролизуются с образованием
кислородных кислот фосфора и галогеноводородов:
PCl5+H2O→POCl3+2HCl
POCl3+3H2O→H3PO4+3HCl
16.
Подгруппа мышьякаСтепени окисления As, Sb и Bi равны
– 3, +3, +5
Химические свойства мышьяка
Взаимодействие с кислородом:
2As+3O2→2As2O3
Взаимодействует с галогенами:
2As+3Cl2→2AsCl3
Взаимодействует с серой:
As
As2S3,As2S5,As4S4
17.
As2S3+3Na2S→2Na3AsS32Na3AsS3+6HCl→6NaCl+As2S3+3H2S
2As+3Zn → Zn3As2
3As+5HNO3+2H2O→3H3AsO4+5NO↑
2As+6KOH→2K3AsO3+3H2↑
Реакция Марша (качественная реакция на мышьяк)
As2O3+6Zn+12HCl→2AsH3+6ZnCl2+3H2O (AsH3 – арсин)
2AsH3 → 2As+3H2↑
As2O3
As2O3 – амфотерный оксид
2As2O3+H2Oхол.→2HAsO2 (метамышьяковистая кислота, соли – метаарсениты )
2As2O3+H2Oгор.→H3AsO3 (мышьяковистая кислота, соли – арсениты)
As2O3+6NaOHконц.→2Na3AsO3+3H2O
As2O3+6НCl→2AsCl3+3H2O
As2O5
As2O5 – кислотный оксид
As2O5+3H2O→2H3AsO4(мышьяковая кислота, соли – арсенаты )
As2O5+6NaOH→2Na3AsO4+3H2O
18.
Сурьма и ее соединенияВзаимодействие с кислородом:
2Sb+3O2→2Sb2O3
Sb2O3 – амфотерный оксид, образующий при взаимодействии со щелочами
метасурьмянистую (HSbO2) или сурьмянистую (H3SbO3 или Sb(OH)3) кислоты. Соли
кислот соответственно называются метастибиты и стибиты.
Взаимодействует с галогенами:
2Sb+3Cl2→2SbCl3
Взаимодействует с серой:
Sb Sb2S3,Sb2S5
19.
Взаимодействует с некоторыми металлами:2Sb+3Mg →Mg3Sb2
Взаимодействует с кислотами-окислителями:
2Sb+10HNO3конц.→Sb2O5+5NO2↑+10H2O
В отличии от мышьяка с кислородными кислотами может образовывать
соли:
2Sb+6H2SO4конц.→Sb2(SO4)3+3SO2↑+3H2O
Sb2O5 – кислотный оксид, образующий сурьмяную кислоту (Sb2O5•nH2O),
существующую в нескольких формах:
H[Sb(OH)6] – гексагидроксосурьмяная кислота
HSbO3 – метасурьмяная кислота
H3SbO4 – ортосурьмяная кислота
Соли сурьмяной кислоты – стибаты или антимонаты
Со щелочами непосредственно не взаимодействует (взаимодействует
только в присутствии окислителей)
По аналогии с мышьяком, образующим арсин, сурьма в тех же условиях
образует стибин SbH3 – летучий ядовитый газ, легко разлагающийся на Sb и H2.
Mg3Sb2+6HClразб.→3MgCl2+2SbH3↑
2SbH3 → 2Sb+3H2↑
20.
Соли сурьмы (III), в водном растворе подвергаются гидролизу с образованиемосновных солей (оксосолей):
SbCl3 + 2H2O = Sb(OH)2Cl
Sb(OH)2Cl = SbOCl + H2O
Висмут и его соединения
Висмут – красно-белый металл.. Степени окисления в соединениях – 3, +3,
+5. Устойчивая степень окисления +3.
21.
Химические свойстваВзаимодействие с кислородом:
2Bi+3O2 → Bi2O3
Взаимодействие с галогенами:
2Bi+3Cl2 → 2BiCl3
Для солей висмута, как и для солей сурьмы характерно образование основных
солей:
Bi(NO3)3+H2O→BiONO3+2HNO3
Взаимодействие с серой:
2Bi+3S → Bi2S3
Сплавляется со многими металлами:
2Bi+3Mg → Mg3Bi2
При гидролизе висмутидов образуется висмутин:
Mg3Bi2+6HCl→3MgCl2+2BiH3↑
Взаимодействие с кислотами:
Bi+4HNO3разб.→Bi(NO3)3+NO↑+2H2O
Со щелочами – не взаимодействует
22.
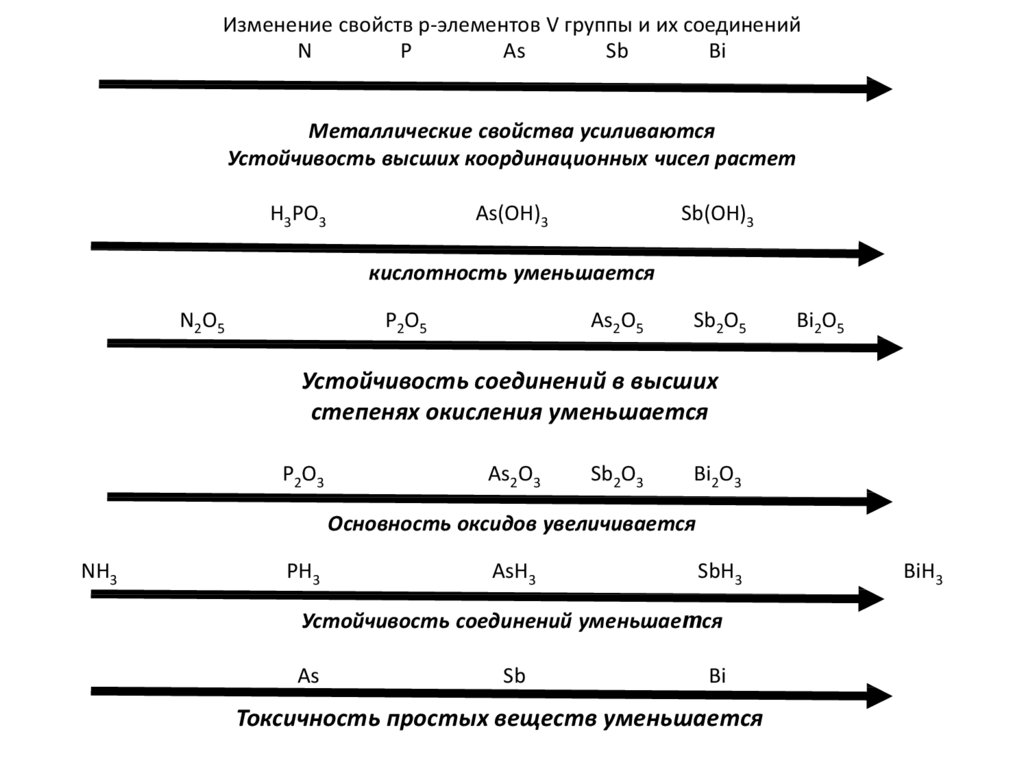
Изменение свойств р-элементов V группы и их соединенийN
P
As
Sb
Bi
Металлические свойства усиливаются
Устойчивость высших координационных чисел растет
H3PO3
As(OH)3
Sb(OH)3
кислотность уменьшается
N2O5
P2O5
As2O5
Sb2O5
Bi2O5
Устойчивость соединений в высших
степенях окисления уменьшается
P2O3
As2O3
Sb2O3
Bi2O3
Основность оксидов увеличивается
NH3
PH3
AsH3
SbH3
Устойчивость соединений уменьшается
As
Sb
Bi
Токсичность простых веществ уменьшается
BiH3
















 Химия
Химия