Похожие презентации:
Методы диагностики инфекционных заболеваний
1. Методы диагностики инфекционных заболеваний
УРАЛЬСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТКАФЕДРА МИКРОБИОЛОГИИ, ВИРУСОЛОГИИ И ИММУНОЛОГИИ
Методы диагностики
инфекционных заболеваний
2. Методы для in vitro диагностики
• Прямые исследования– Микроскопические методы
– Культуральные методы
– Молекулярно-генетические методы
– Иммунологические (серологические) методы на
обнаружение антигенов
• Непрямые исследования
– Иммунологические (серологические) методы на
обнаружение антител
– IGRA (Interferon-gamma release assays) тесты
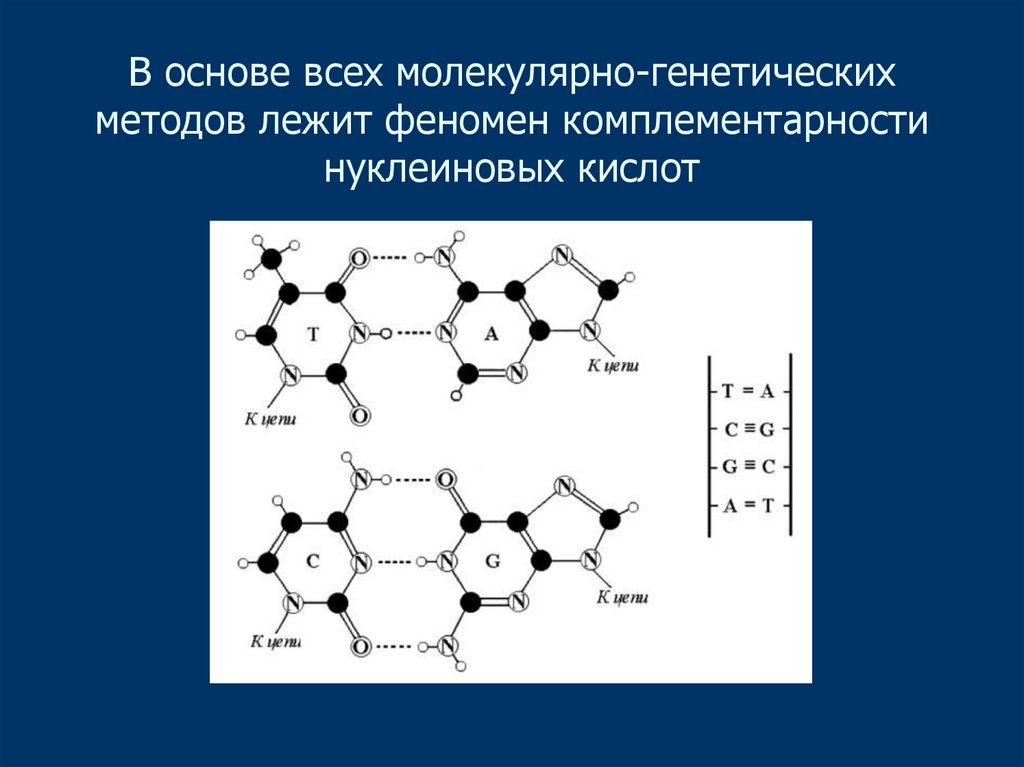
3. В основе всех молекулярно-генетических методов лежит феномен комплементарности нуклеиновых кислот
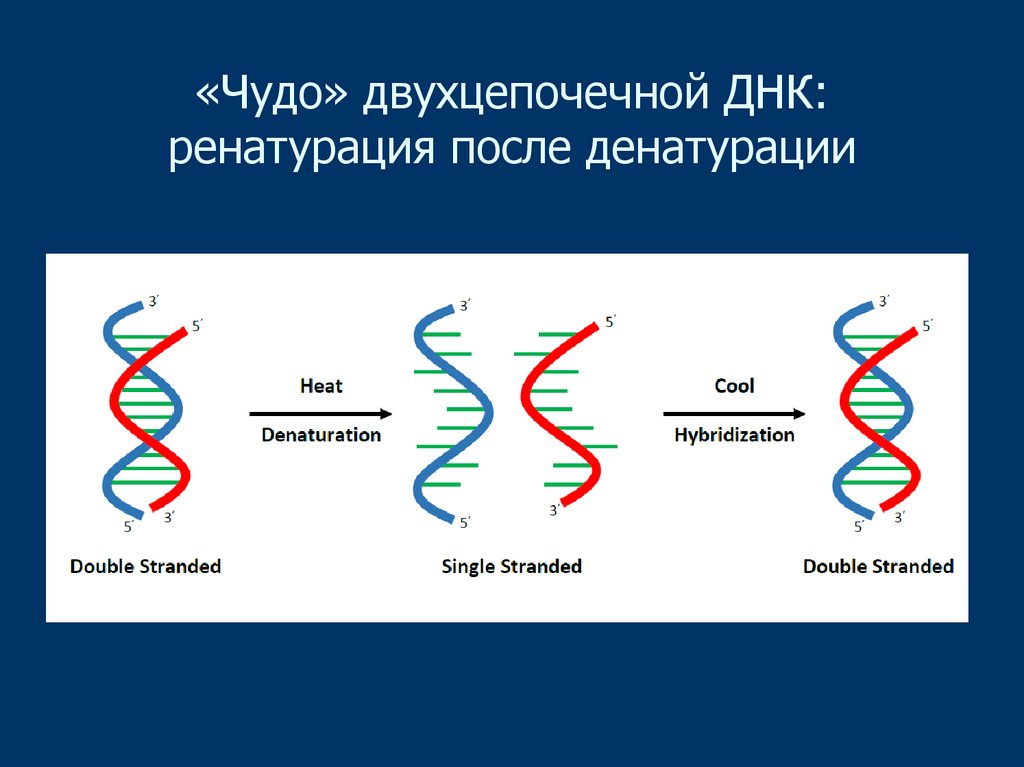
4. «Чудо» двухцепочечной ДНК: ренатурация после денатурации
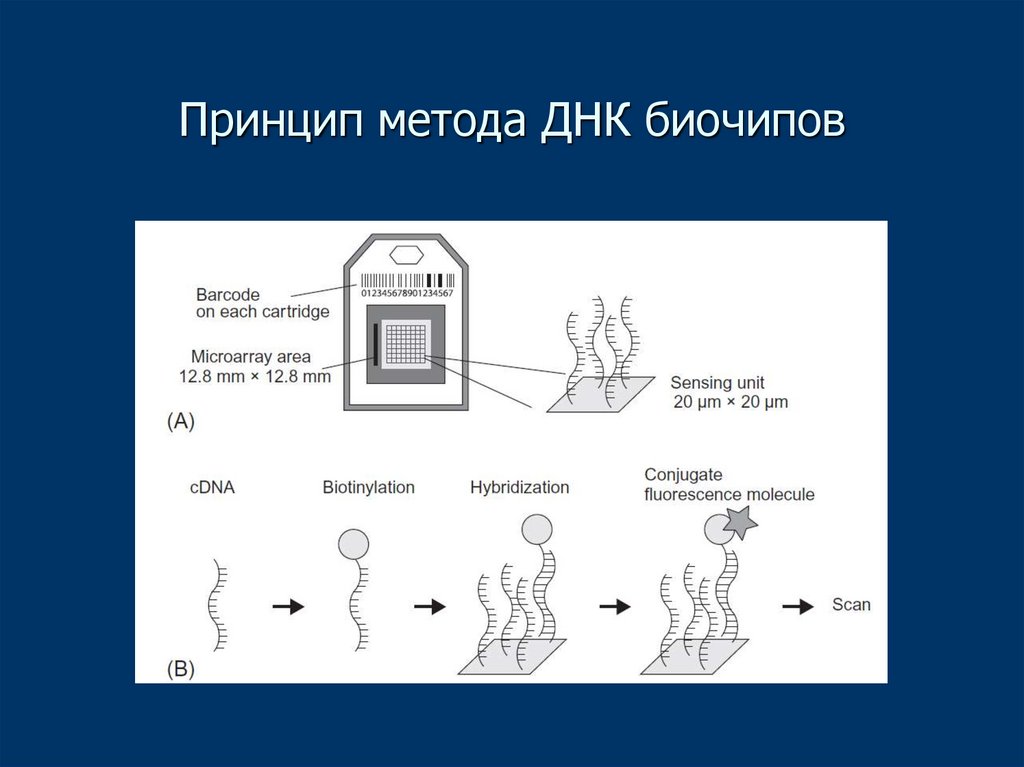
5. Молекулярно-генетические методы
• ДНК биочипы (гибридизация) определяют наличиеспецифических участков ДНК или РНК в образце
• Полимеразная цепная реакция (ПЦР) накапливает и
определяет наличие специфического участка ДНК в
образце (предварительное накопление целевого
участка ДНК увеличивает чувствительность
исследования)
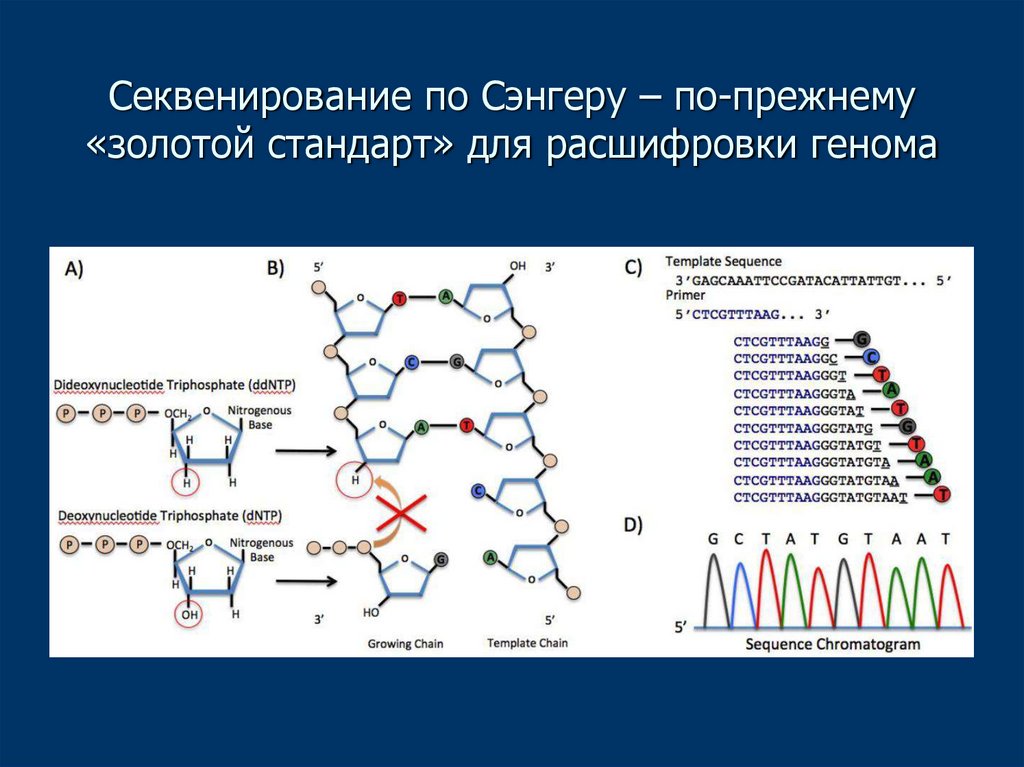
• Секвенирование ДНК определяет последовательность
нуклеотидов в целевом участке ДНК
6. Принцип метода ДНК биочипов
7. Пример биочипа после проведения исследования
– Иногда используется длядиагностики инфекционных
заболеваний (например,
Определение чувствительности
Mycobacterium tuberculosis к
изониазиду и рифампицину)
– В основном применяются для
изучения экспрессии
микробных генов
8. Секвенирование по Сэнгеру – по-прежнему «золотой стандарт» для расшифровки генома
9. Полимеразная цепная реакция (ПЦР)
10.
Kary Mullisамериканский биохимик
1944-2019
Принцип метода
ПЦР был
разработан Кэри
Муллисом
в 1983г.
В 1993 г. ученый
был удостоен
Нобелевской
премии в области
химии.
11.
Основные этапы1. Выделение (экстакция) ДНК или РНК из исследуемого
образца
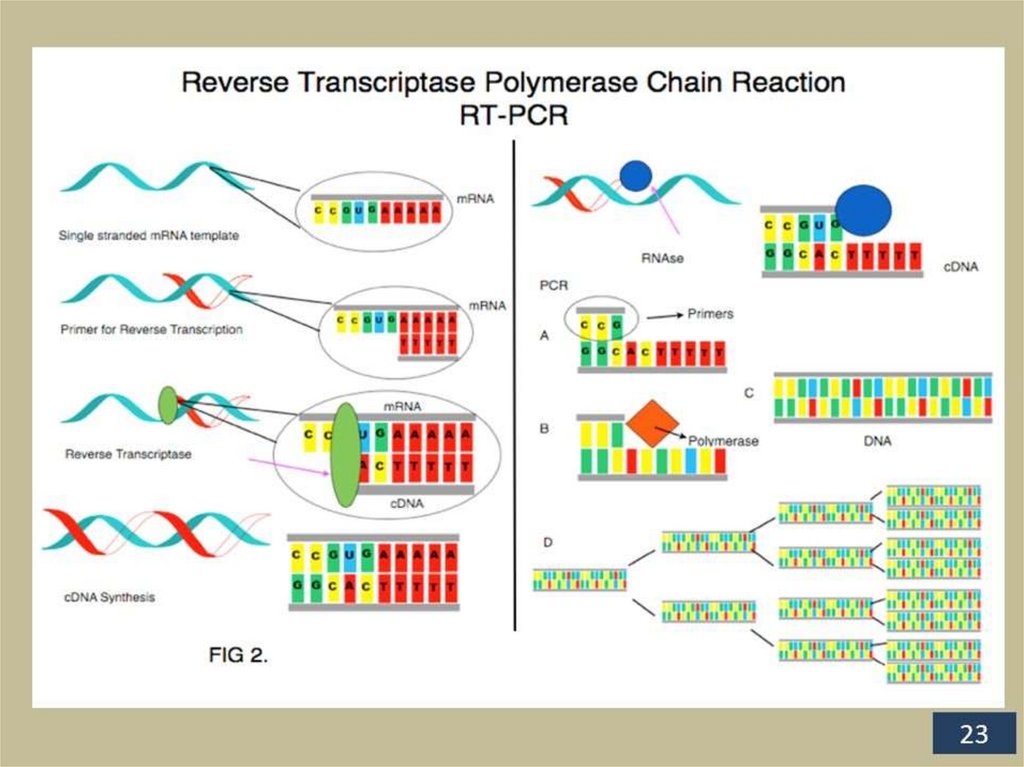
2. Проведение обратной транскрипции для получения
комплементарной ДНК (кДНК) если используется РНК
3. Амплификация (накопление) целевого участка ДНК
4. Детекция амплифицированного целевого участка ДНК
12. Оборудование для ПЦР: амплификатор, центрифуга с пробирками типа Эппендорф, термостат для пробирок, пробирки для ПЦР
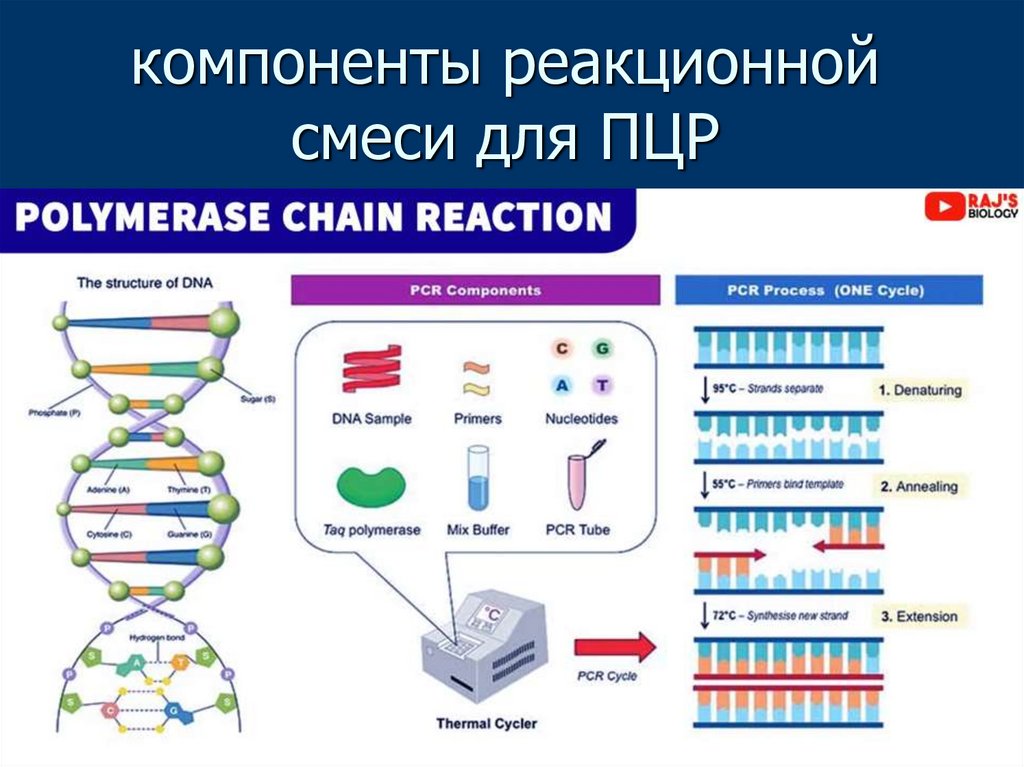
13. компоненты реакционной смеси для ПЦР
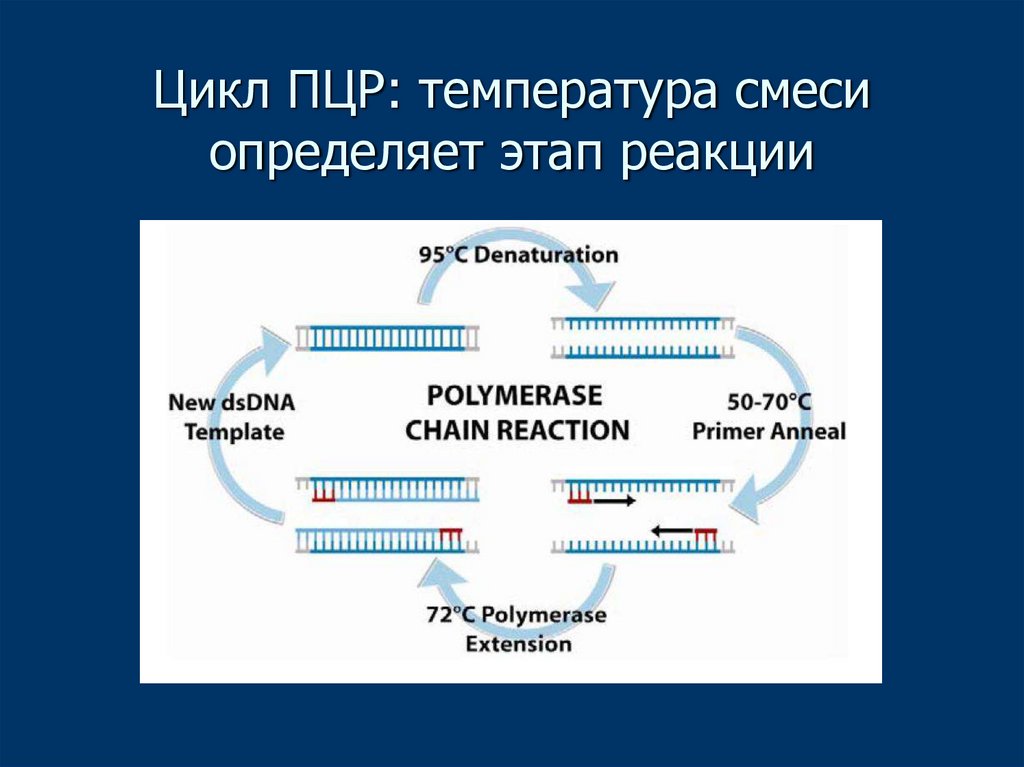
14. Цикл ПЦР: температура смеси определяет этап реакции
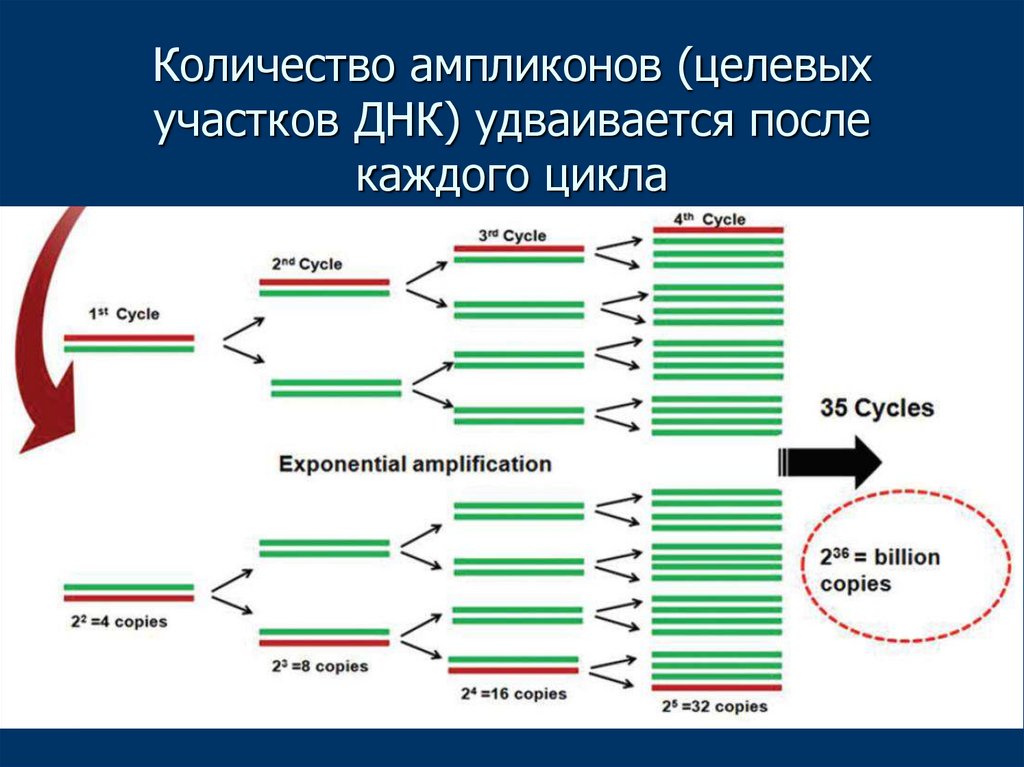
15. Количество ампликонов (целевых участков ДНК) удваивается после каждого цикла
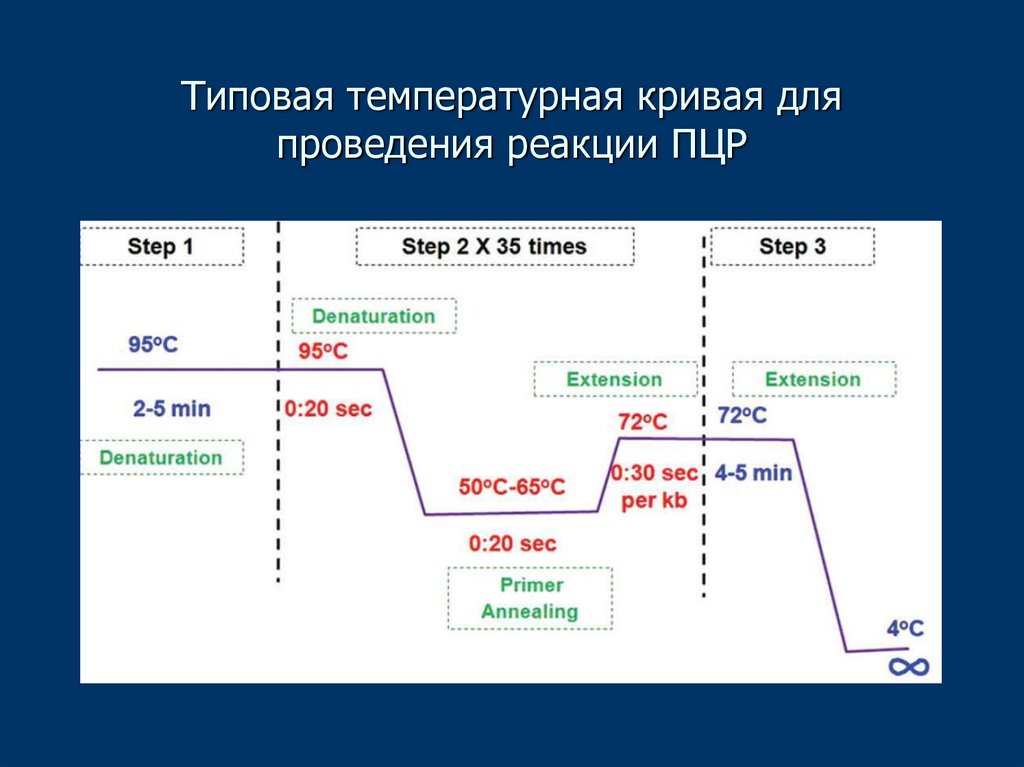
16. Типовая температурная кривая для проведения реакции ПЦР
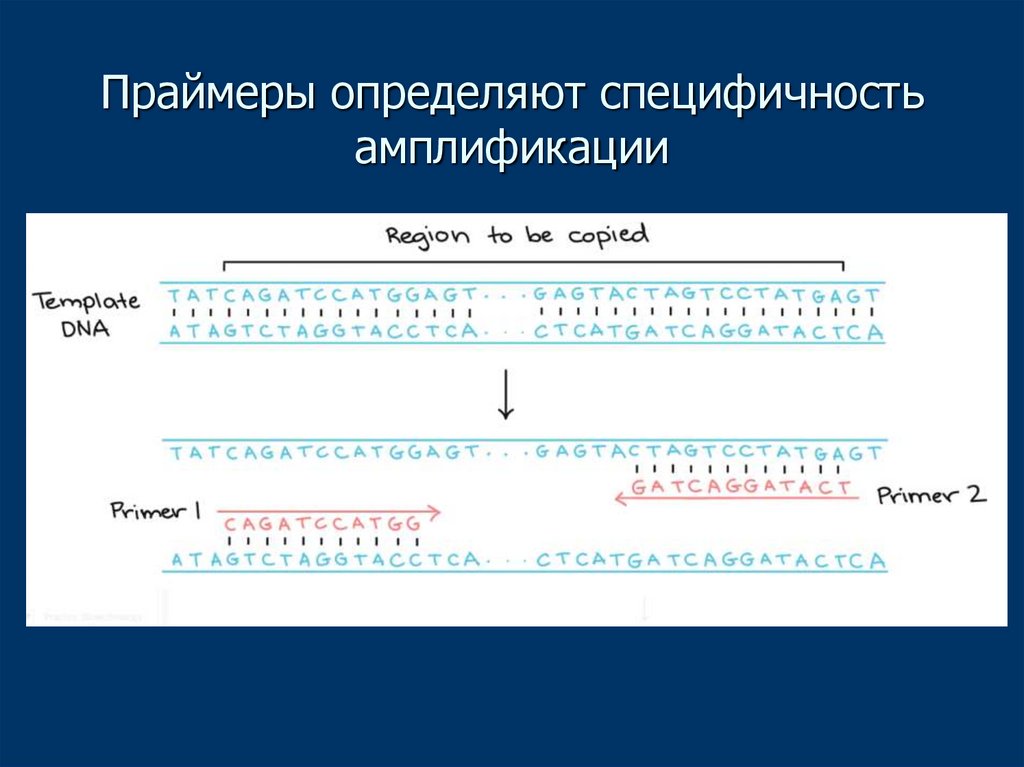
17. Праймеры определяют специфичность амплификации
18. Полимеразная цепная реакция
После завершения амплификациипроизводится детекция образовавшихся
в ходе ПЦР ампликонов.
Эта задача решается методом
электрофореза продуктов ПЦР в
агарозном геле либо измерением уровня
флюоресценции в зависимости от
используемой разновидности ПЦР.
19. Регистрация результатов ПЦР
Электрофоретическая детекция. Метод основан навыявлении амплифицированных фрагментов ДНК при
помощи электрофореза в агарозном геле, содержащем
бромистый этидий.
Бромистый этидий образует с фрагментами ДНК комплекс,
который светится в виде полос при облучении геля УФлучами.
Для приготовления геля расплавляют смесь агарозы, буфера
и воды, добавляют раствор бромистого этидия. Охлаждают
до 50-60 °С, заливают в специальные формы и в еще не
застывший гель помещают специальные гребенки, которые
проделывают в нем отверстия. После того как гель застывает
гребенки извлекают.
20. Регистрация результатов ПЦР
В лунки помещают исследуемые иконтрольные образцы и проводят
электрофорез в течение 15-20 мин.
После процедуры электрофореза гель
помещают на трансиллюминатор (прибор
излучающий ультрафиолет) и выявляют
фрагменты ДНК в виде светящихся полос.
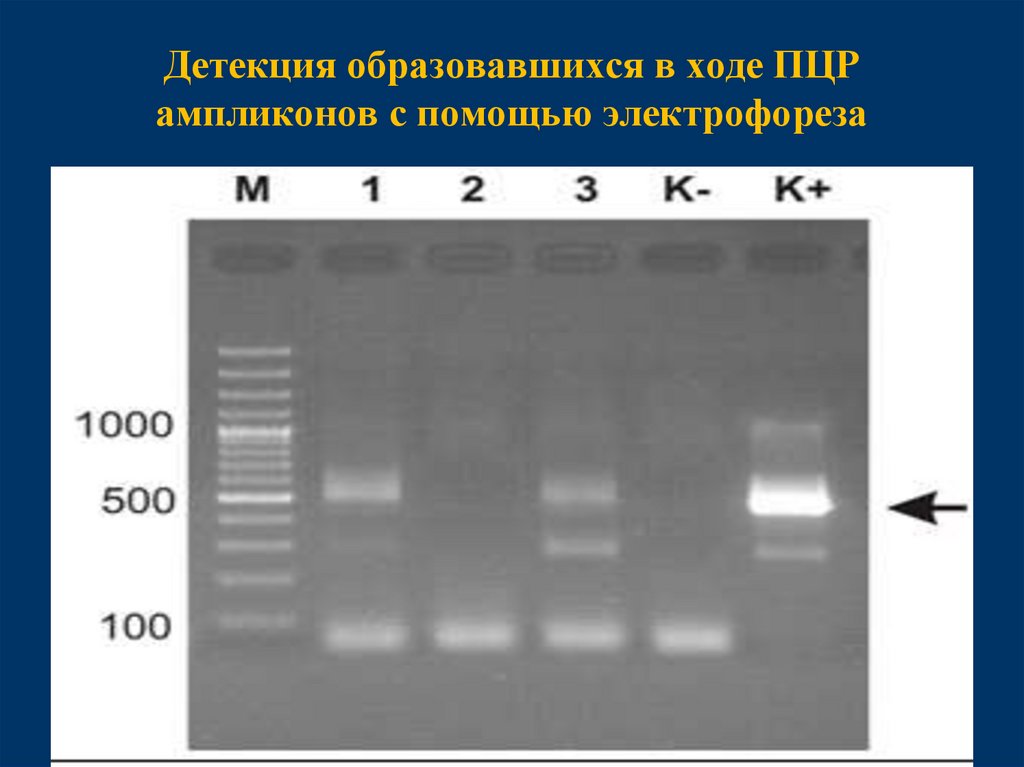
21. Детекция образовавшихся в ходе ПЦР ампликонов с помощью электрофореза
22. Электрофоретическая детекция
Существенным недостатком электрофоретическойдетекции, является высокий риск контаминации
исследуемых образцов продуктами амплификации
вследствие необходимости открытия пробирок и
субъективизм учета результатов.
В связи с этим для электрофореза необходимо
отдельное помещение и сотрудники, не
участвующие в проведении этапов выделения
нуклеиновых кислот и амплификации.
23. Полимеразная цепная реакция
На сегодняшний день разработаныразличные вариации ПЦР
(например, ПЦР в реальном
времени), позволяющие не только
выявить наличие микроорганизма
но и измерить его количество.
24. ПЦР в реальном времени (или количественная ПЦР)
Real-time PCR включает в себяодновременно детекцию и
количественное определение
специфической последовательности
ДНК в образце.
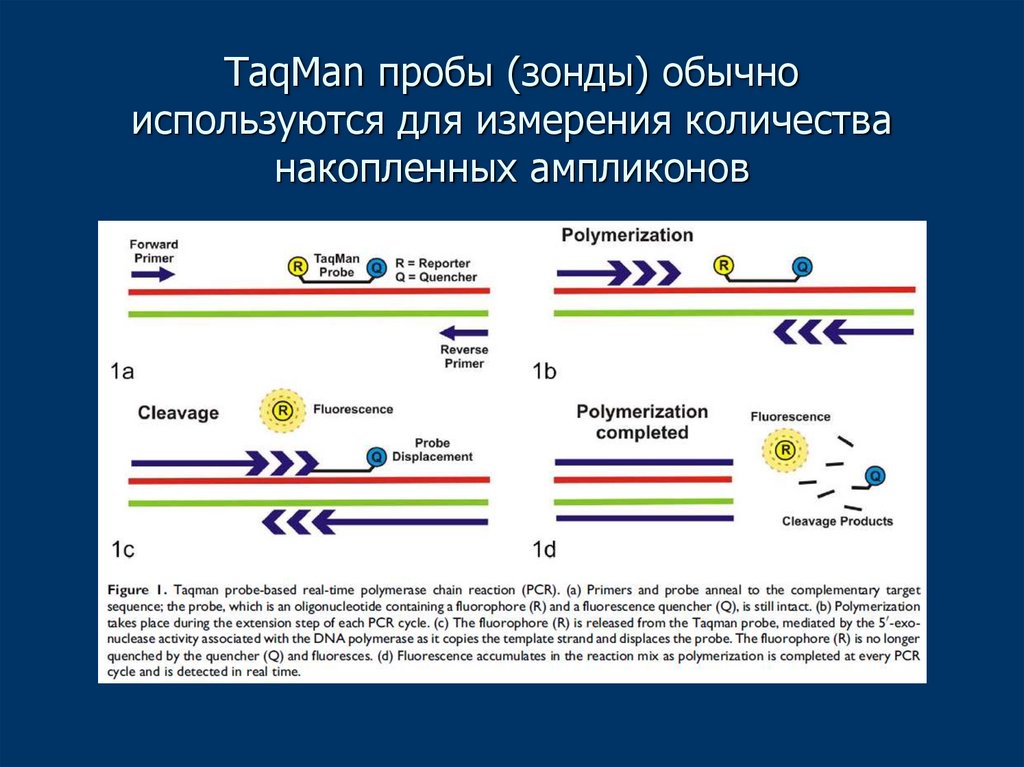
25. TaqMan пробы (зонды) обычно используются для измерения количества накопленных ампликонов
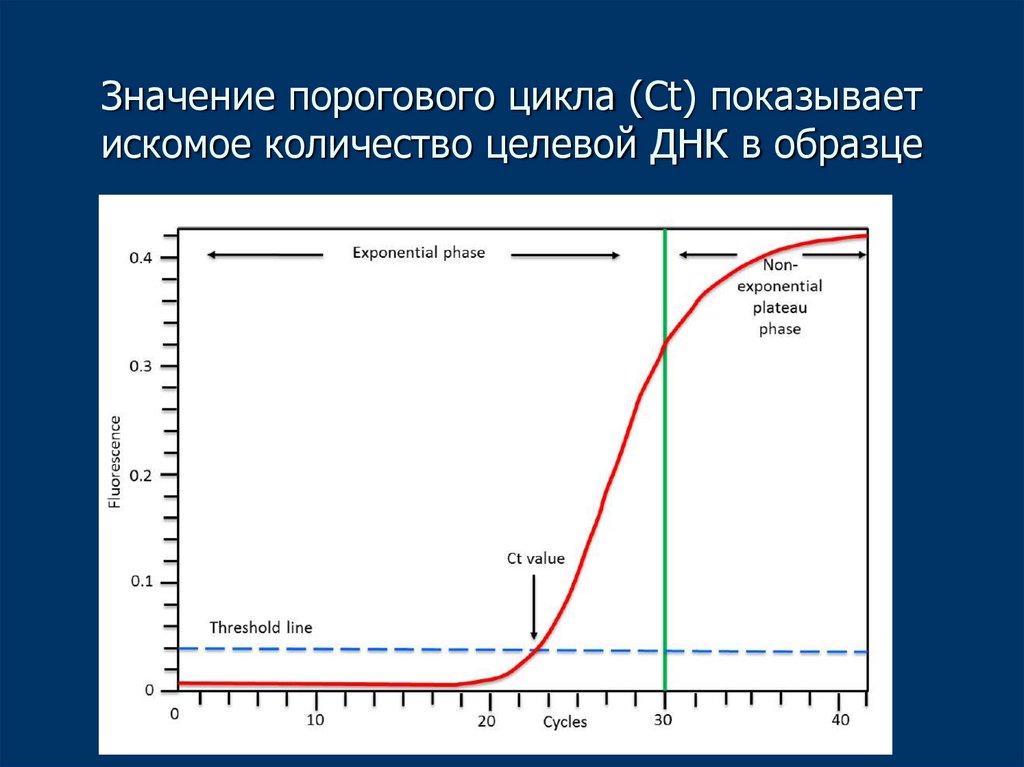
26. Значение порогового цикла (Ct) показывает искомое количество целевой ДНК в образце
27.
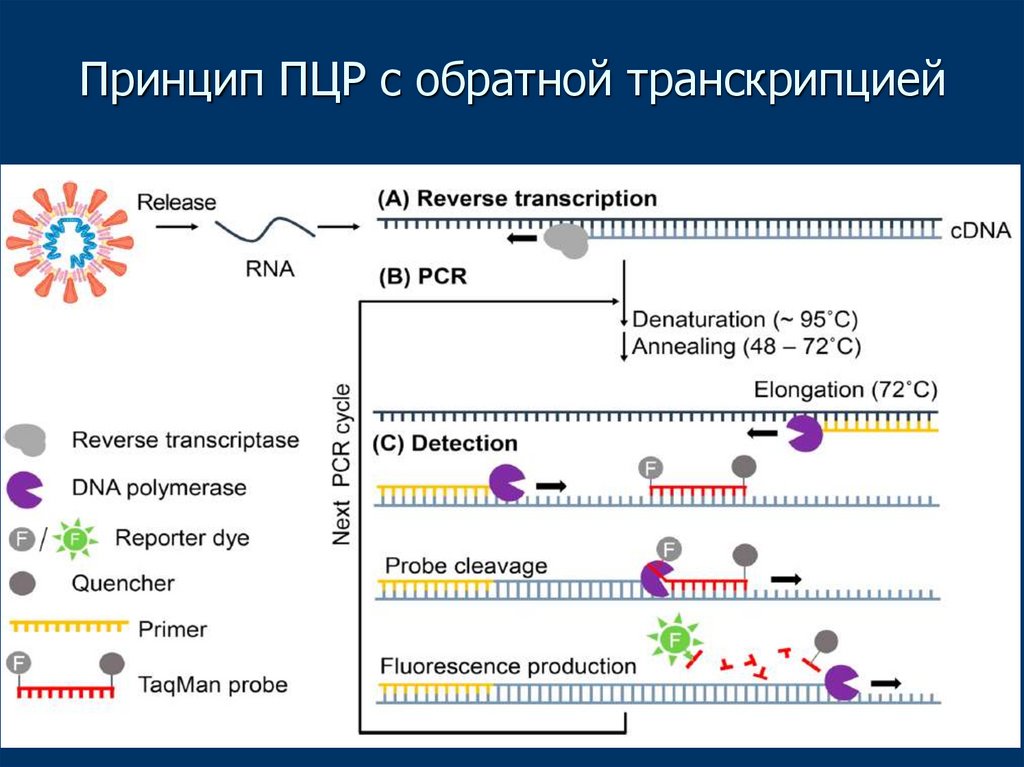
ПЦР с обратной транскрипцией• Очевидная проблема: ПЦР амплифицирует
только ДНК, но многие вирусы имеют РНК
геномы
• Решение: проведение перед ПЦР обратной
транскрипции – процесса синтеза
комплементарной ДНК (кДНК),
использующего РНК как матрицу и
обратную транскриптазу как катализатор
28. Принцип ПЦР с обратной транскрипцией
29.
30.
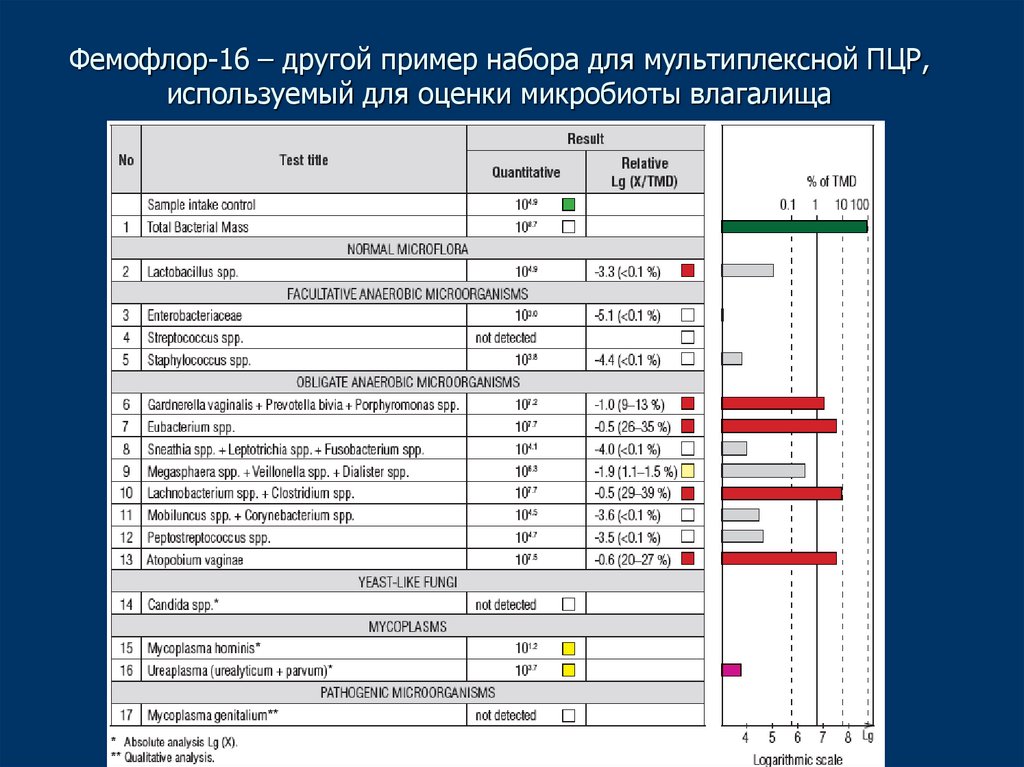
Наборы для мультиплексной ПЦР• Позволяют тестировать образец сразу на
несколько инфекций
31. Фемофлор-16 – другой пример набора для мультиплексной ПЦР, используемый для оценки микробиоты влагалища
32. Достоинства ПЦР
Прямое обнаружение возбудителя. Выявлениеспецифического фрагмента ДНК при помощи ПЦР говорит о
наличии возбудителя в исследуемом материале.
Высокая чувствительность. ПЦР-анализ выявляет наличие
возбудителя даже в тех случаях, когда другими методами это
сделать невозможно.
Высокая чувствительность, позволяет выявить ДНК/РНК
возбудителя на ранних стадиях, когда другие методы
неэффективны.
Высокая специфичность. Специфичность метода определяется
подбором специфических праймеров, способных связаться
только с фрагментом ДНК искомого микроорганизма. То есть
позволяет выявить ДНК инфекционного агента в присутствии
ДНК других микроорганизмов и ДНК клеток организма
хозяина.
Универсальность постановки ПЦР. Сходство химической
структуры нуклеиновых кисло позволят унифицировать
методику и определить в одной пробе несколько
возбудителей.
33. Достоинства ПЦР
Быстрота постановки и высокая скорость получениярезультата. Очень важное преимущество ПЦР – отсутствие
культуральной микробиологической работы. ПЦР-анализ
максимально облегчен и во многом автоматизирован.
Простота и удобство постановки ПЦР делает возможным
получение результата через 2-3 часа.
Высокая эффективность ПЦР. ПЦР помогает избежать
известных сложностей, возникающих при выращивании
трудно культивируемых, некультивируемых или
персистирующих форм микроорганизмов для диагностики
латентных и хронических инфекций.
Разнообразие исследуемого материала. В качестве образца
для ПЦР-исследования может выступать не только материал
от больного, но также многие другие субстраты, в которых
могут быть идентифицированы молекулы ДНК. К ним
относятся вода, почва, продукты питания, смывы, что
позволяет широко использовать ПЦР в санитарной
микробиологии.
34. Ограничения ПЦР
Основным ограничением использованияметода ПЦР является высокая
изменчивость патогенных микроорганизмов.
Отдельные штаммы и генотипы могут
мутировать в амплифицируемом участке
генома и становиться неуловимыми для
данной тест-системы.
Еще одним недостатком ПЦР является
выявление нуклеиновых кислот как живого,
так и неживого микроорганизма, что
осложняет контроль проводимой терапии.
35. Преимущества и недостатки молекулярно-генетических методов
• Преимущества– Высокая чувствительность
– Высокая специфичность
– Универсальность метода (подходит для любых микробов, включая
трудно и некультивируемых)
– Быстрое получение результатов (6-8 часов для ПЦР)
– Простые требования для транспортировки и хранения образцов
• Недостатки
– Рутинные методики не позволяют дифференцировать живых и
мертвых микроорганизмов
• Например, могут давать ложноположительные результаты в
течение нескольких недель после успешного лечения или
выздоровления
– В большинстве случаев не позволяют определить чувствительность
тестируемого микроба к антимикробным препаратам
36.
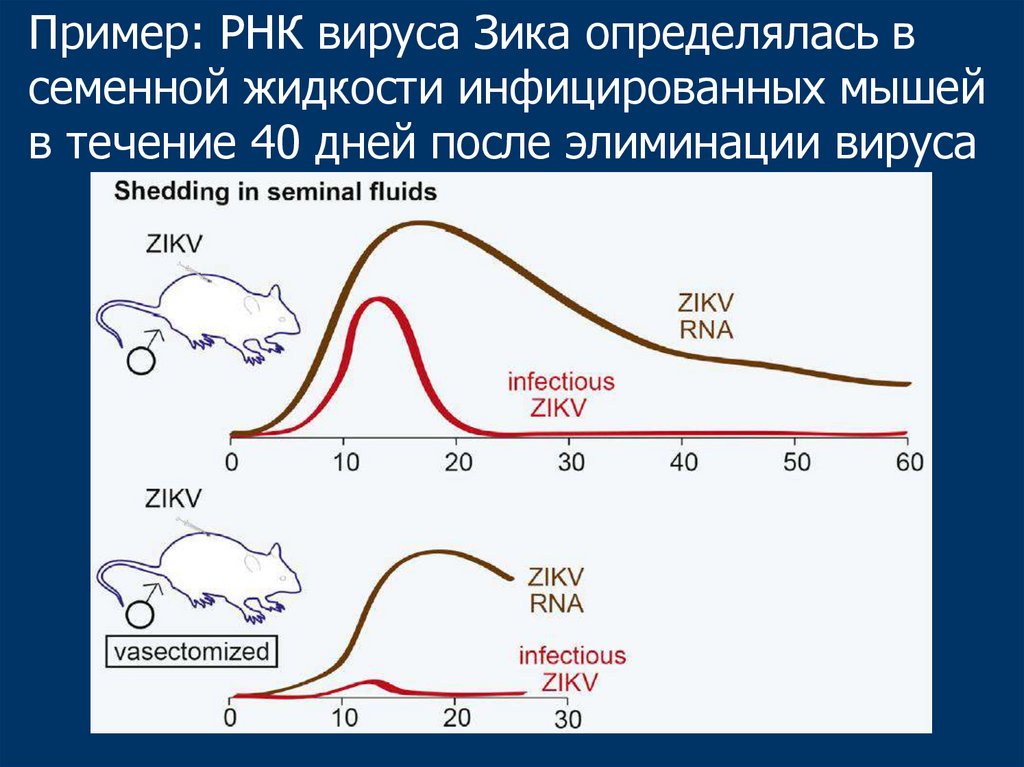
Пример: РНК вируса Зика определялась всеменной жидкости инфицированных мышей
в течение 40 дней после элиминации вируса
37.
Иммунологические методы38.
Иммунологические маркеры инфекции• Микробные антигены
– Прямое доказательство инфекции
• Антитела к микробным антигенам
– Косвенное доказательство инфекции
– Две основных трудности интерпретации
• Серонегативный период
• Наличие анамнестических антител
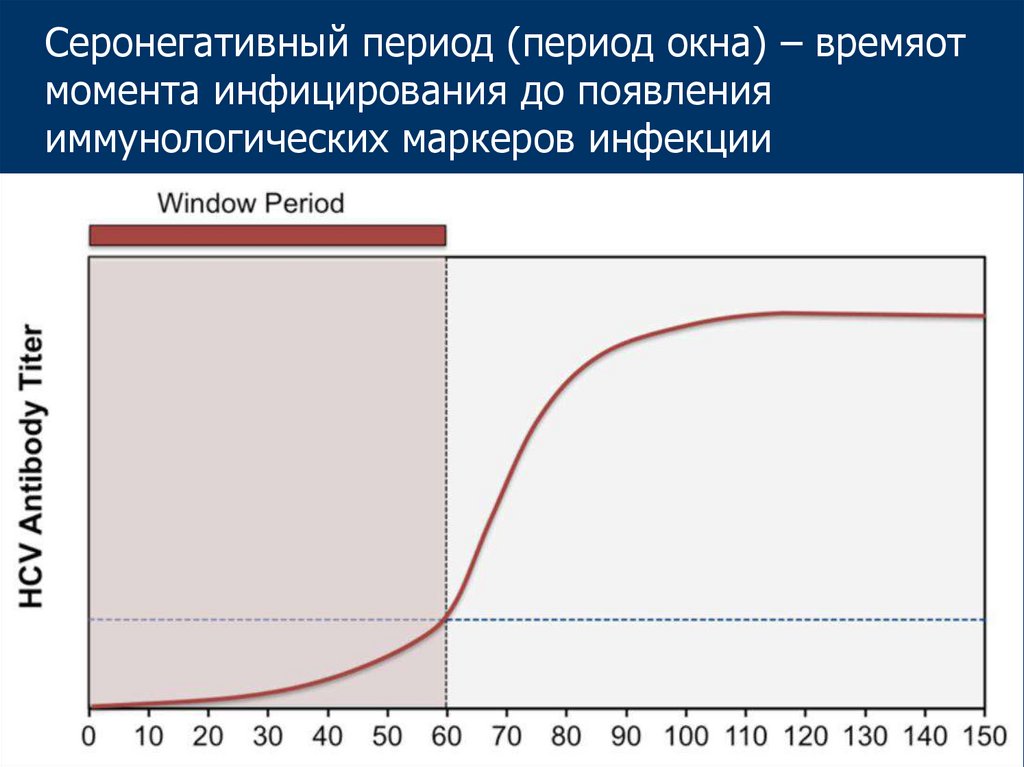
39.
Серонегативный период (период окна) – времяотмомента инфицирования до появления
иммунологических маркеров инфекции
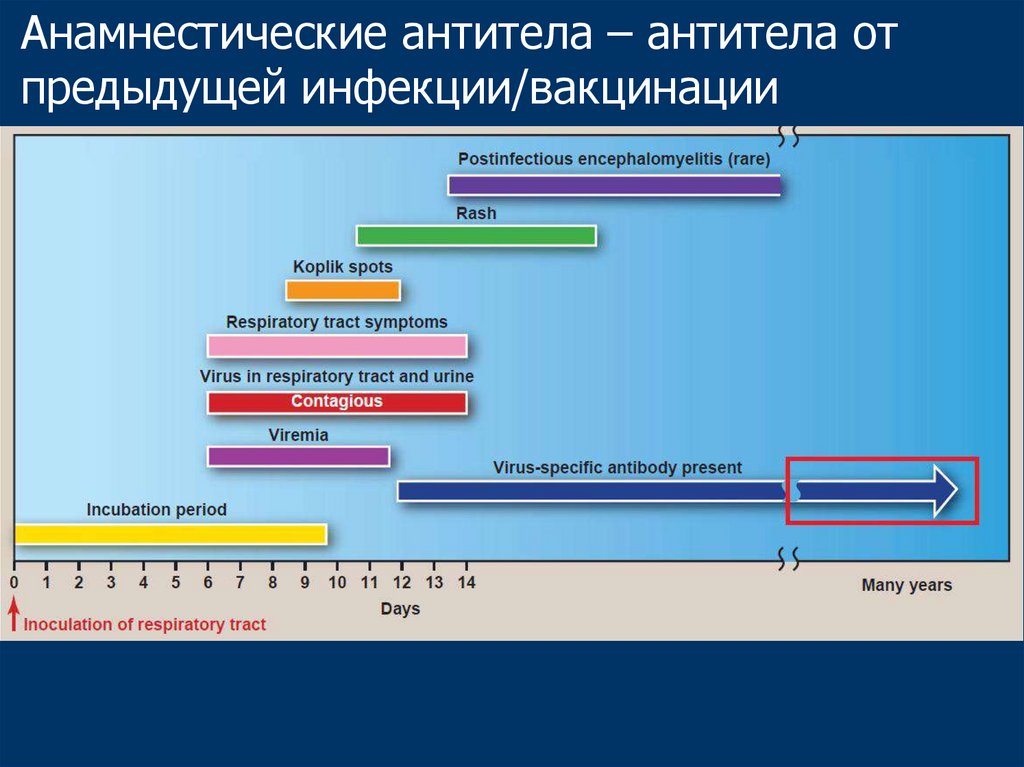
40.
Анамнестические антитела – антитела отпредыдущей инфекции/вакцинации
41.
Иммуноферментный анализИФА
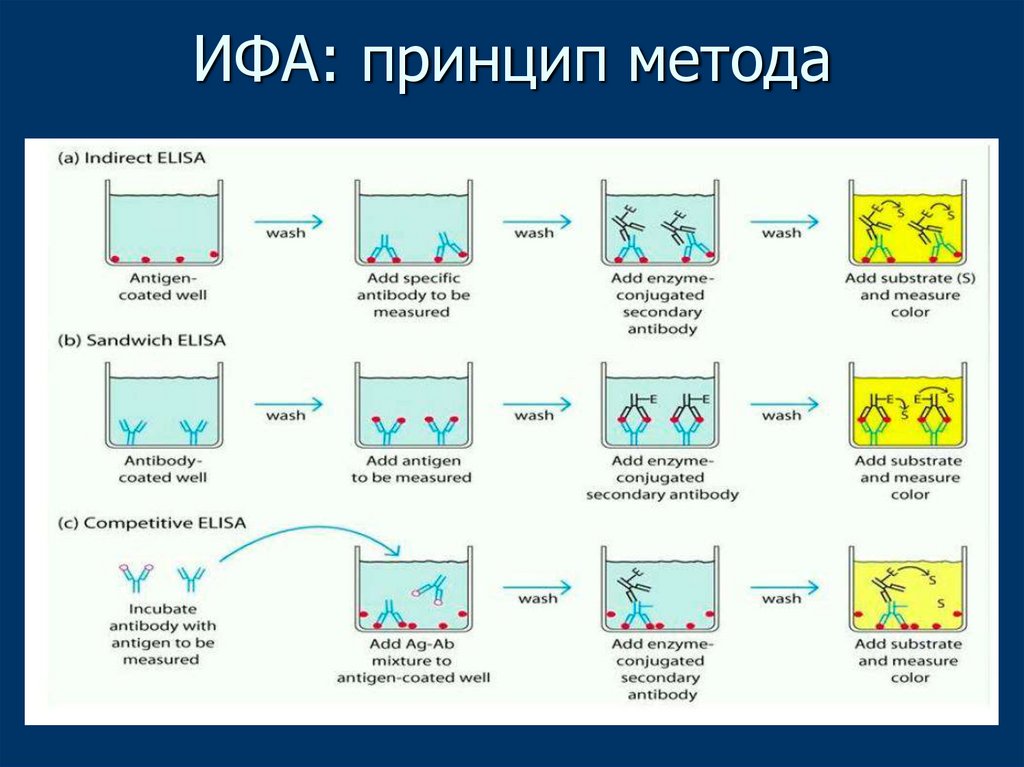
42. Иммуноферментный анализ
ИФА — лабораторный иммунологическийметод качественного или количественного
определения различных соединений,
макромолекул, вирусов, в основе которого
лежит реакция АГ+АТ.
Выявление образовавшегося комплекса
проводят с использованием фермента в
качестве метки для регистрации сигнала.
43. Компоненты
АГАТ
Конъюгат - иммуноглобулин, к искомому
компоненту реакции, меченный ферментом
(пероксидазой)
Субстрат для выявления активности
пероксидазы (О-фенилендиамин)
44.
45. ИФА
46. ИФА: принцип метода
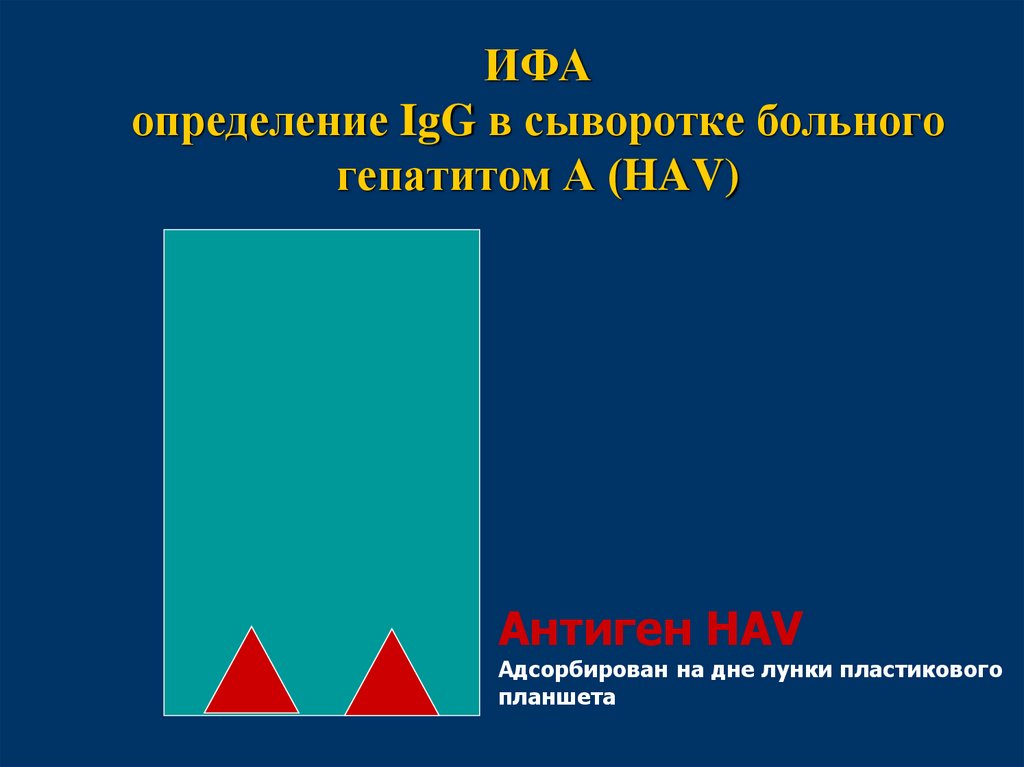
47. ИФА определение IgG в сыворотке больного гепатитом А (HAV)
Антиген HAVАдсорбирован на дне лунки пластикового
планшета
48. ИФА определение IgG в сыворотке больного гепатитом А (HAV)
Сыворотка кровибольного (АТ+)
Антиген HAV
49. ИФА определение IgG в сыворотке больного HAV
Субстрат+хромогенКонъюгат
Кроличьи АТ против IgG человека,
меченные пероксидазой
Сыворотка крови
больного (АТ+)
Антиген HAV
50. ИФА определение IgG в сыворотке больного HAV
Положительныйрезультат ИФА –
окрашивание
раствора
IgG в
сыворотке
больного HAV
обнаружены
51. ИФА Чем больше искомых антигенов/антител присутствовало в образце, тем интенсивнее финальная окраска
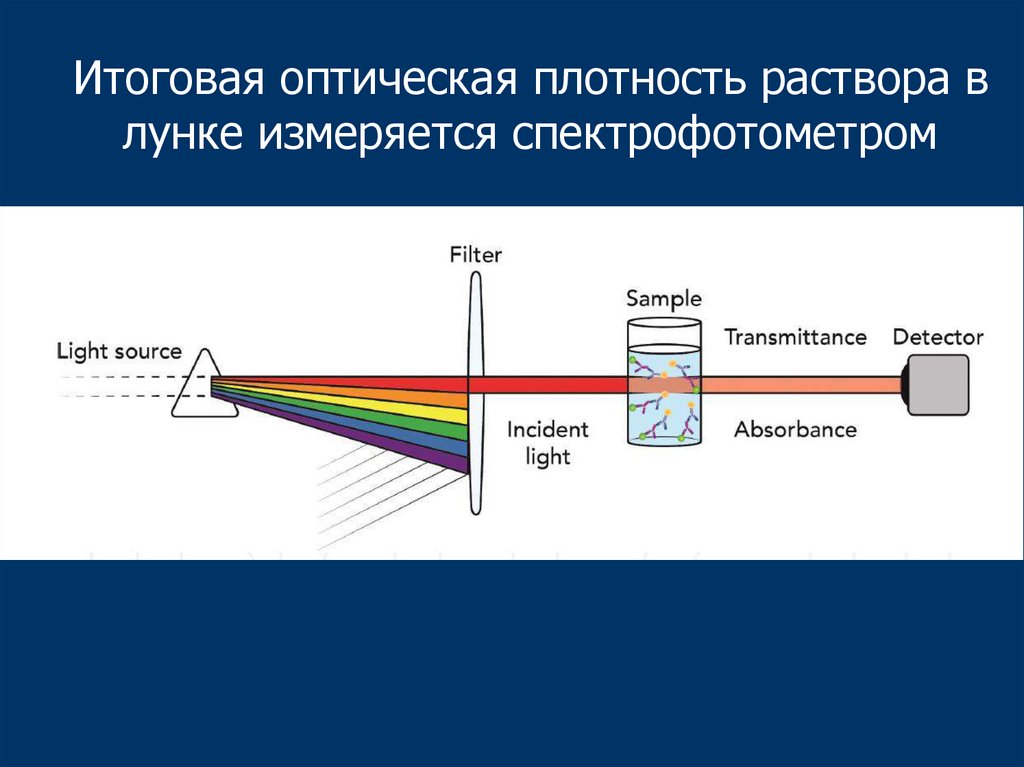
52.
Итоговая оптическая плотность раствора влунке измеряется спектрофотометром
53. ИФА
ИФА бывает качественным и количественным.В первом случае подразумевается
однозначный ответ: искомое вещество найдено, или
не найдено в образце.
Количественный анализ дает возможность оценить
концентрацию антител в крови человека, что в
сравнении с результатами предыдущих тестов
даст ответ на вопрос о том, как развивается
инфекционный процесс.
54. ИФА
Преимущества, которыми располагает ИФА по сравнению с другимисерологическими методами:
высокая чувствительность, составляющая 90%;
быстрота и удобство проведения диагностической реакции;
возможность использовать минимальные объемы исследуемого
материала;
возможность автоматизации всех этапов проведения реакции;
возможность ранней диагностики инфекции;
пригодность для массовых обследований;
отслеживание динамики развития процесса инфекционного
заболевания.
Недостаток - относясь к непрямым методам диагностики, он позволяет
определить иммунный ответ организма на возбудителя, а не самого
возбудителя.
55. ИФА
Анализируемые показатели определения классов Ig :IgM — наличие этого класса иммуноглобулинов говорит об
остром инфекционном процессе в организме. Отсутствие IgM
может говорить как об отсутствии конкретного возбудителя
в организме, так и о переходе инфекции в хроническую
стадию.
IgA при отрицательном результате теста на IgM чаще всего
свидетельствует о хронической или скрыто протекающей
инфекции.
IgM и IgA (совместное присутствие) — два положительных
результата говорят о разгаре острой фазы заболевания.
IgG говорит либо о хронизации заболевания либо о
выздоровлении и выработке иммунитета к инфекционному
агенту.
56.
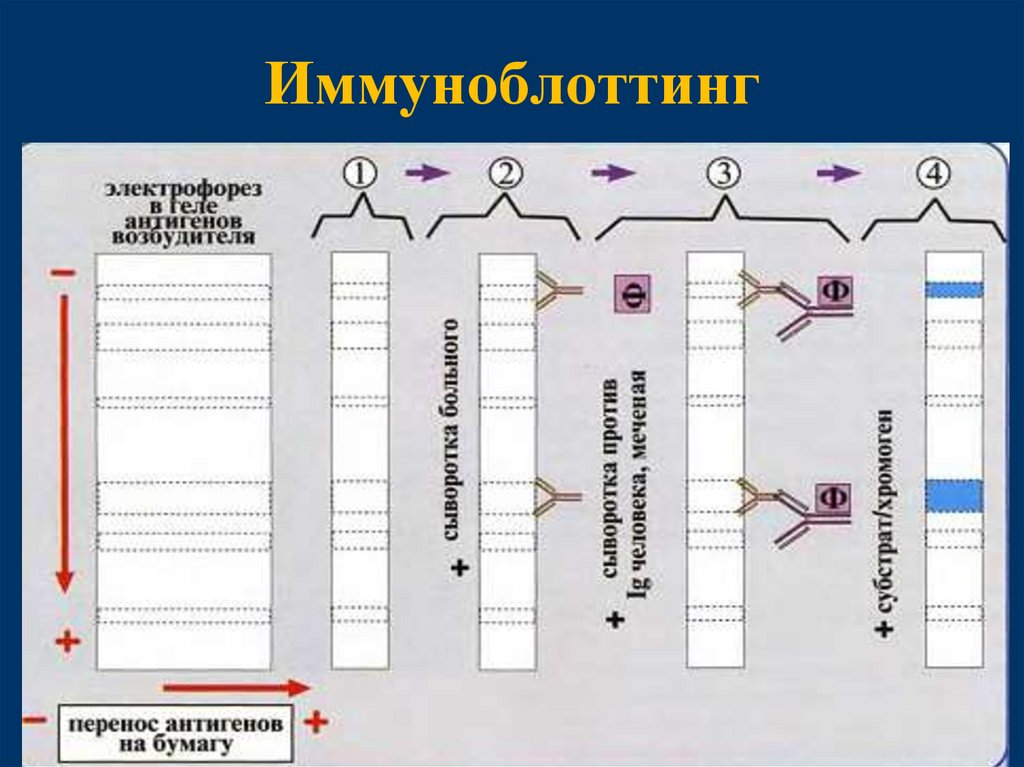
Вестернблот (иммуноблот)57. Иммуноблоттинг
Антигены возбудителя разделяют спомощью электрофореза в
полиакриламидном геле, затем
переносят их (блоттинг - от англ,
blot, пятно) из геля на
нитроцеллюлозную мембрану и
проявляют с помощью ИФА.
58. Иммуноблоттинг
На эти полоски наносят сыворотку больного.После инкубации, отмывают от несвязавшихся
антител больного и наносят сыворотку против
иммуноглобулинов человека, меченную
ферментом.
Образовавшийся на полоске комплекс [антиген +
антитело больного + антитело против Ig человека]
выявляют добавлением хромогенного субстрата,
изменяющего окраску под действием фермента.
59. Иммуноблоттинг
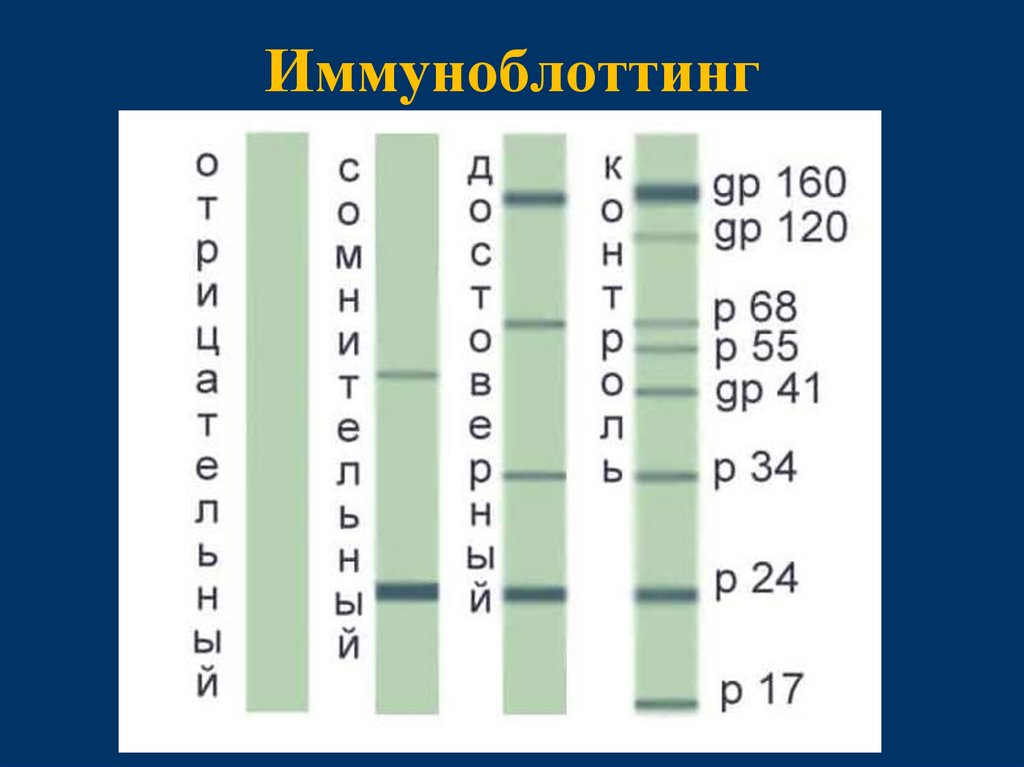
60. Иммуноблоттинг
61.
Основное применение вестернблота вмедицине
• Подтверждение положительных
результатов ИФА
– Вестернблот демонстрирует бо́ льшую
специфичность и положительное
прогностическое значение чем ИФА
• Примеры инфекций
– ВИЧ (в некоторых странах)
– Болезнь Лайма (в некоторых странах)
62.
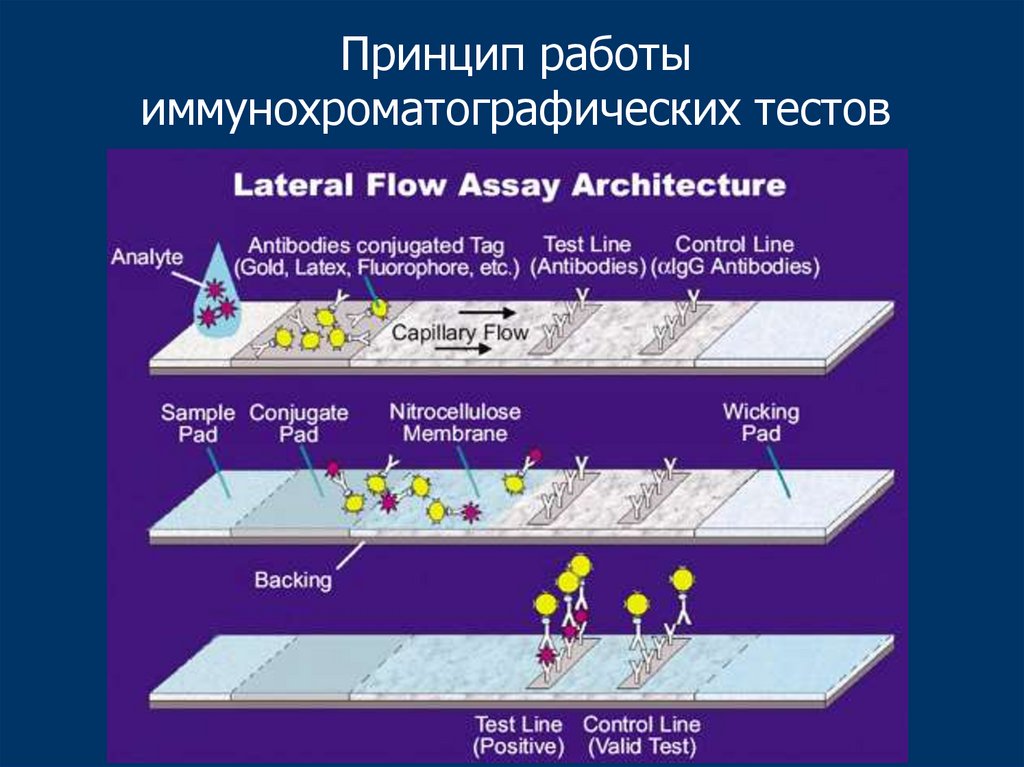
Принцип работыиммунохроматографических тестов
63.
Преимущества и недостаткииммунологических методов
• Преимущества
– Средняя-высокая чувствительность
– Средняя-высокая специфичность
– Быстрое получение результатов (4-6 часов)
– Простые требования для транспортировки и хранения
образцов
• Недостатки
– Сложность интерпретации непрямых тестов
– Непрямые тесты неприменимы для диагностики
заболеваний, вызванных условно-патогенными
микроорганизмами
– Могут давать ложноотрицательные результаты на ранних
стадиях инфекции/заболевания (особенно непрямые
тесты)
– Не позволяют определить чувствительность к
антимикробным препаратам
64.
Interferon-gamma releaseassays (IGRAs)
65.
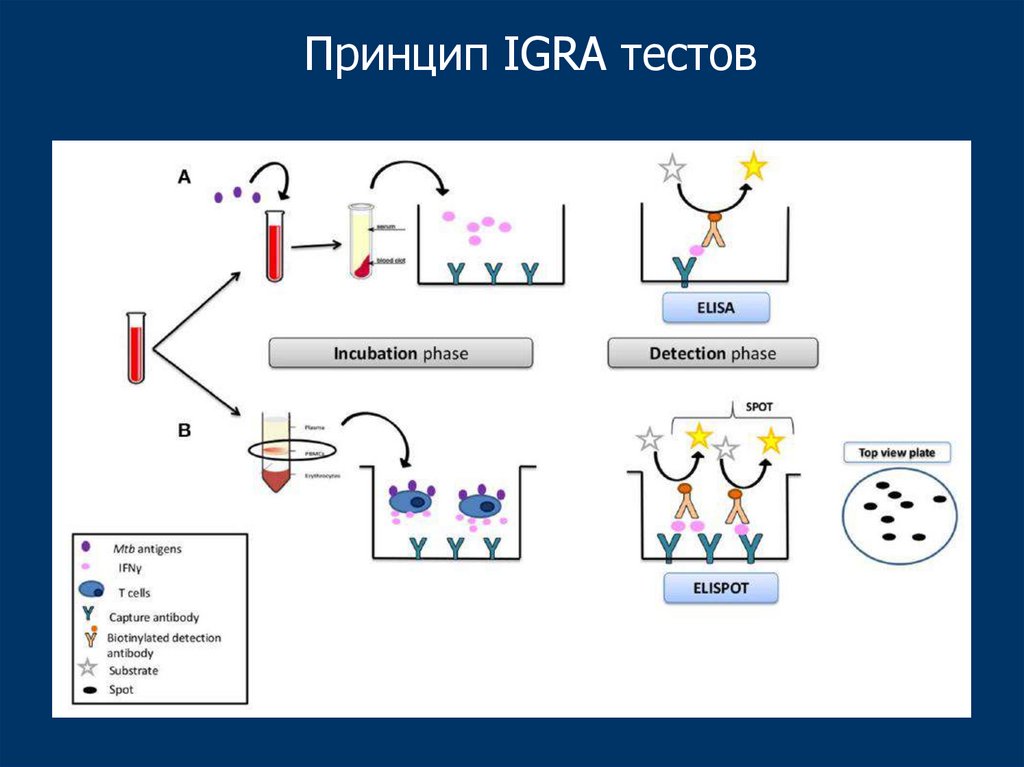
Принцип IGRA тестов66.
Основное применение IGRA тестов• Диагностика туберкулеза
– У пациентов, аллергичных к используемым в
кожных тестах белкам
– У пациентов, не желающих применять кожные
тесты
• Основное ограничение – не позволяют
дифференцировать активный и латентный
туберкулез
• Редко применяются на территории
Российской Федерации из-за наличия более
дешевого теста со схожей аккуратностью –
Диаскин-теста
67. Дома
Иммунопрофилактика и иммунотерапияинфекционных заболеваний
68.
ВакциныТипы вакцин: аттенуированные, инактивированные, субъединичные,
анатоксины, генно-инженерные, векторные, мРНК
Особенности иммунного ответа при введении различных типов вакцин;
иммуногенность и реактивность различных типов вакцин
Примеры и роль адъювантов в составе вакцин
Возможные поствакцинальные реакции и осложнения после введения
вакцины
Критерии напряженности поствакцинального иммунитета и бустерная
вакцинация
Популяционный иммунитет
Иммунные сыворотки и моноклональные антитела
Получение поликлональных лошадиных иммунных сывороток для лечения
и постконтактной профилактики инфекционных заболеваний
Получение донорских иммуноглобулинов для лечения и постконтактной
профилактики инфекционных заболеваний
Получение моноклональных антител для лечения и постконтактной
профилактики инфекционных заболеваний
Возможные осложнения после введения лечебно-профилактических
иммунных сывороток и моноклональных антител











































 Медицина
Медицина








