Похожие презентации:
Векторы бактерий
1.
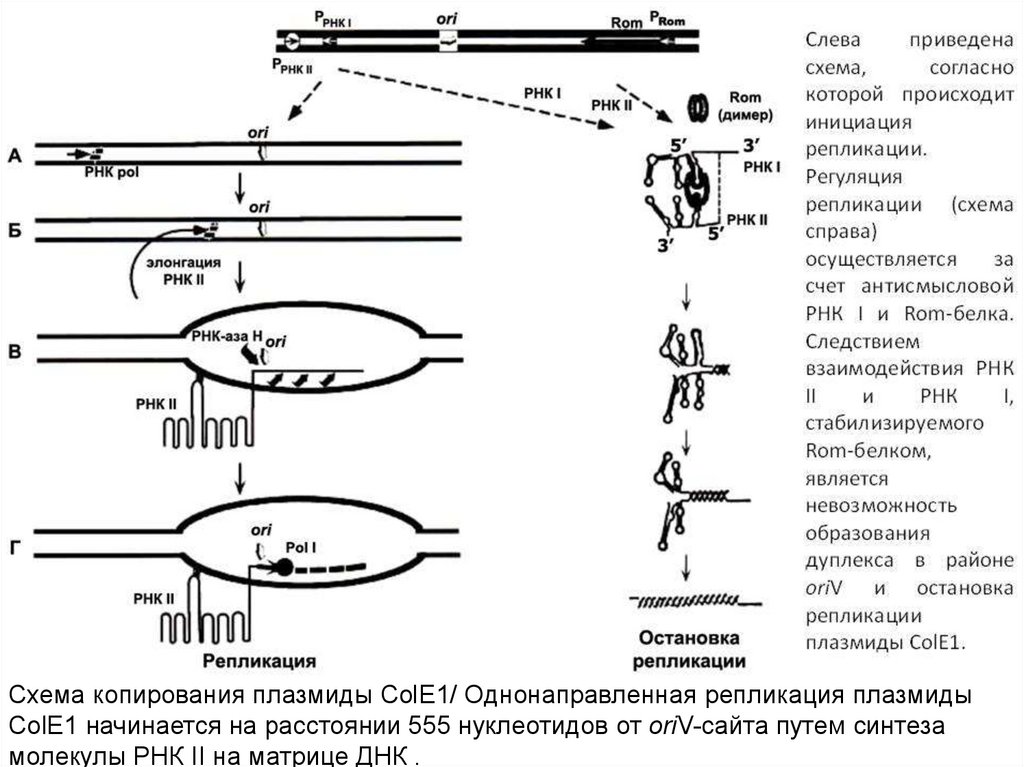
Схема копирования плазмиды ColE1/ Однонаправленная репликация плазмидыColE1 начинается на расстоянии 555 нуклеотидов от oriV-сайта путем синтеза
молекулы РНК II на матрице ДНК .
2.
Наличиедвух
генов
резистентности (AmpR и
TcR), в каждом из которых
присутствуют уникальные
сайты
рестрикции,
позволяет вести отбор
гибридных конструкций
среди
трансформантов,
отобранных на среде с
одним антибиотиком, по
их чувствительности ко
второму антибиотику.
Плазмида pBR322, созданная Боливаром и Родригесом (в названнии буквы BR обозначают
фамилии авторов: B –Боливар, R – Родригес, а номер взят из их исследовательских
протоколов) – один из первых векторов.
Этот вектор размером 4 361 п.н. содержит фрагмент ДНК природных колициногенных
плазмид размером около 1200 п.н., включающий
1. репликатор (oriV-сайт и прилегающая к нему область, с которой считывается РНКII);
2. Ген rom-ген (встречается название rop – регулирует копийность в количестве 20 копий);
3.Сайт oriT (может мобилизоваться на конъюгационный перенос).
4. Ген устойчивости к тетрациклину (TcR – из плазмиды pSC101);
5. Ген устойчивости к ампициллину (AmpR – это транспозон Tn3 из плазмиды R1).
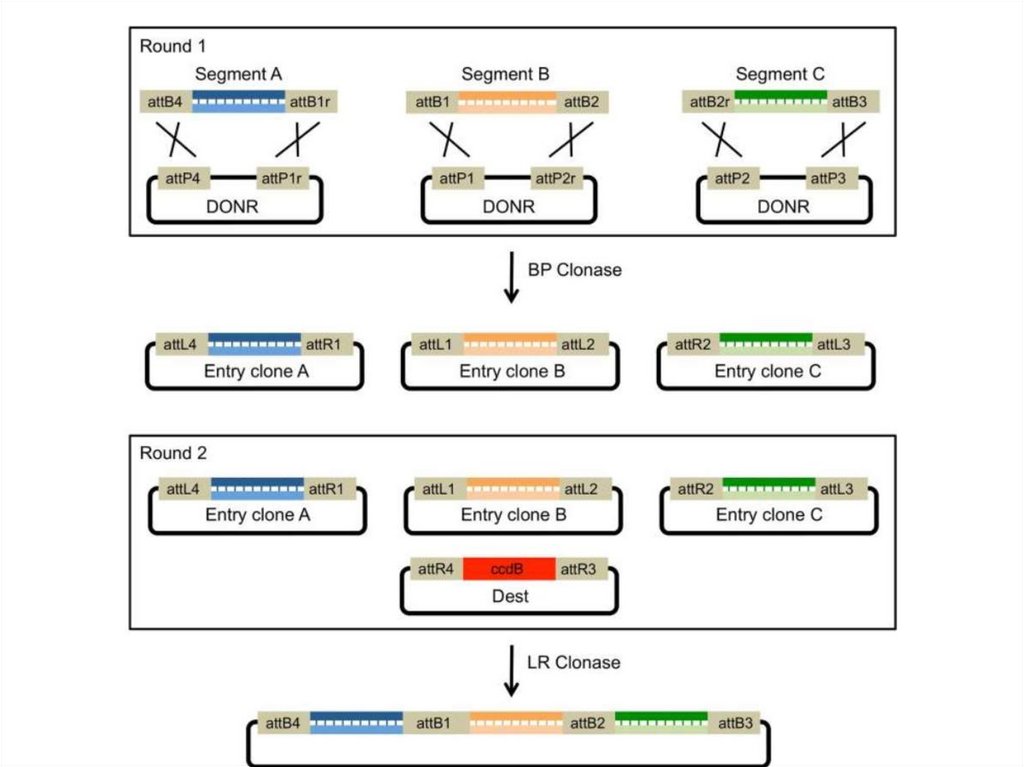
3.
Например, если встроить чужеродную ДНК в уникальныйсайт локализованный в гене, определяющим устойчивость
к ампициллину, произойдет его инактивация (он будет
разорван чужеродной ДНК). Тогда лигирующую смесь
(разрезанный по уникальному сайту вектор и вставка)
можно ввести трансформацией (электропорацией) в
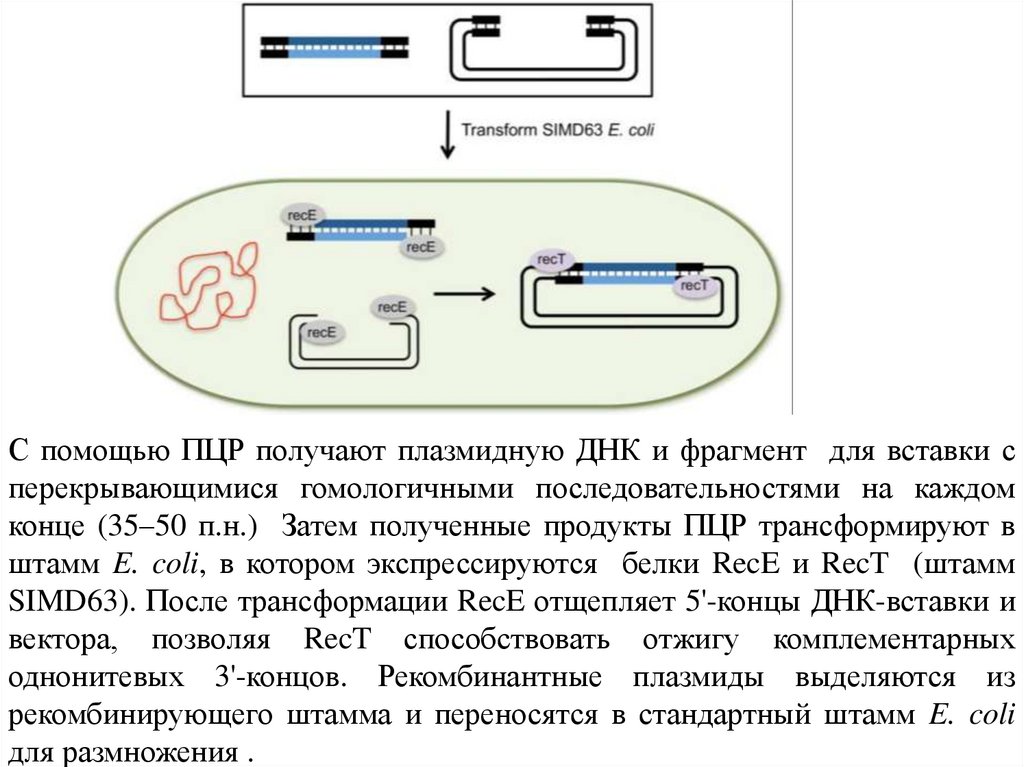
клетки E. coli и отбирать плазмидсодержащие бактерии на
среде
с
тетрациклином.
Затем
среди
тетрациклинустойчивых
бактерий
отбирать
чувствительных к ампициллину (пересевом или методом
реплик). И, наоборот, при встраивании ДНК в уникальный
сайт, локализованный в гене, определяющем устойчивость
к тетрациклину, среди ампициллинрезистентных бактерий
можно отобрать трансформанты чувствительные к
тетрациклину.
4.
При встраивании чужой ДНК в ген, определяющийампициллинрезистентность (AmpR) разработан метод
прямой селекции ампициллинчувствительных клеток
(AmpS). Он основан на том, что β-лактамаза,
кодируемая этим геном, превращает пенициллин в
пеницилловую
кислоту,
которая
способна
связывать йод. Трансформанты отбирают на среде,
содержащей тетрациклин и крахмал. Затем выросшие
клоны опрыскивают раствором йода, при этом АmpRколонии обесцвечивают индикаторную среду, а
АmpS – не обесцвечивают и будут иметь синию
окраску.
5.
Наличие сайтов клонирования в промоторе гена TcR.Внедрение
чужеродной
ДНК
в
HindIII-сайт
инактивирует промотор и делает трансформанты
чувствительными к тетрациклину. Это используют для
поиска фрагментов ДНК, содержащих промоторы.
Трансформанты с клонированными промоторами
сохраняют устойчивость к тетрациклину.
Плазмида
pBR322
достаточно
стабильна.
Культивирование клеток E. coli, содержащих эту
плазмиду, в отсутствии антибиотика в течение 30
генераций не приводит к ее значительной потере. Это
дает возможность использовать ее в прикладных
целях, поскольку масштабные ферментации обычно не
превышают 30 клеточных генераций.
6.
Широкое распространение получили векторы серии pUC,сконструированные в лаборатории Мессинга в 1985 году.
Данные вектора содержат только oriV и прилегающую к
нему область плазмиды ColE1. Отсутствие rom-гена,
регулирующего инициацию репликации, обеспечивает
увеличение копийности (в клетках присутствует до 500
копий плазмиды). Данные вектора предназначены не
только для встраивания чужеродной ДНК, но и для
экспрессии генов (содержат промотор и оператор
лактозного оперона). Кроме того, можно использовать
прямую
селекцию
для
отбора
трансформантов,
содержащих гибридные конструкции. Это возможно за
счет наличия экспрессионной кассеты, обеспечивающей
транскрипцию клонированных генов.
7.
В экспрессионную кассету входят:1. Промотор lac-оперона;
2. Оператор lac-оперона;
3. Начальная часть гена lacZ, кодирующая α-пептид βгалактозидазы, состоящий из 145 аминокислот (впервые
экспрессионная кассета была сконструирована в векторе
на основе фага М13). Данный пептид способен
комплементировать in vivo дефектный бактериальный
белок
β-галактозидазы,
у
которой
отсутствует
аминокислоты с 11 по 41 в N-коцевой части (делеция
lacZΔM15).
В результате трансформации плазмидой pUC мутантных
бактерий (генотип lacZΔM15) приводит к изменению их
фенотипа от Lac– к Lac+ (эффект α-комплементации).
8.
В гене lacZ методом направленного мутагенеза в 5 кодоне гуанин(G) был заменен на аденин (А), в результате чего появился EcoRIсайт. В результате в α-пептиде β-галактозидазы аспартат был
заменен на аспарагин. Эта замена не изменила его функциональной
активности и по-прежнему происходила комплементация дефектной
β-галактозидазы бактерий-хозяев. В образовавшийся EcoRI-сайт
была введена последовательность с числом нуклеотидов кратным
трем, содержащая с учетом шизомеров 20 уникальных сайтов
рестрикции (полилинкер). При этом комплементационная
активность α-пептида сохранялась на прежнем уровне, поскольку не
происходило сдвига рамки считывания при трансляции.
9.
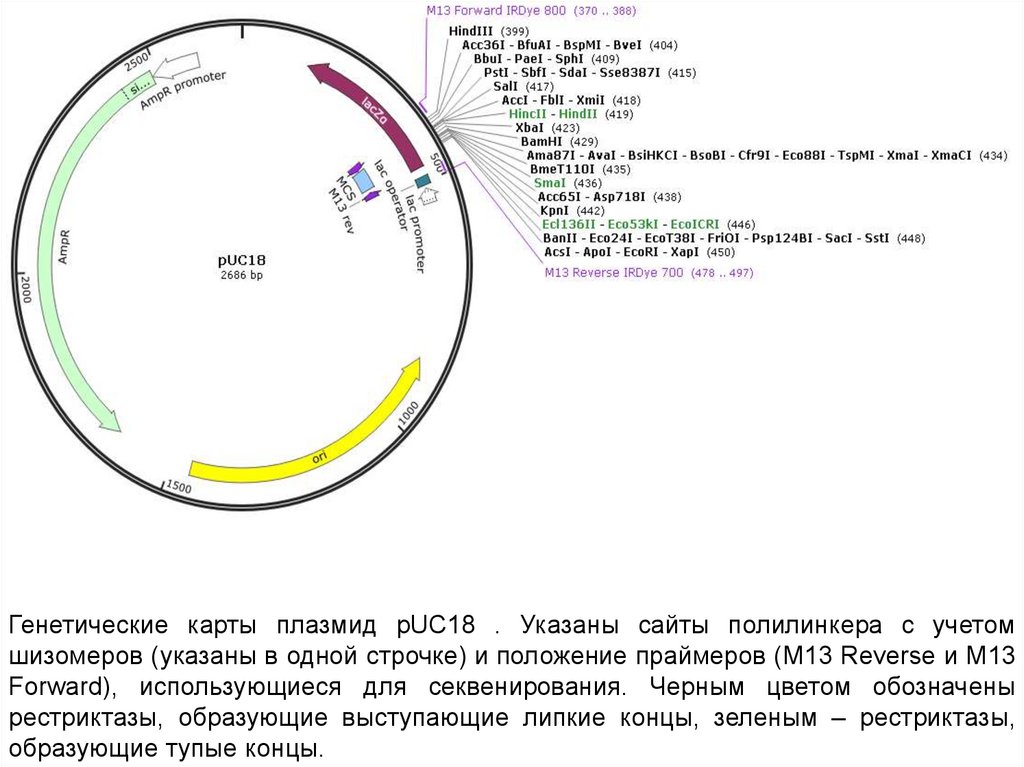
Генетические карты плазмид pUC18 . Указаны сайты полилинкера c учетомшизомеров (указаны в одной строчке) и положение праймеров (М13 Reverse и М13
Forward), использующиеся для секвенирования. Черным цветом обозначены
рестриктазы, образующие выступающие липкие концы, зеленым – рестриктазы,
образующие тупые концы.
10.
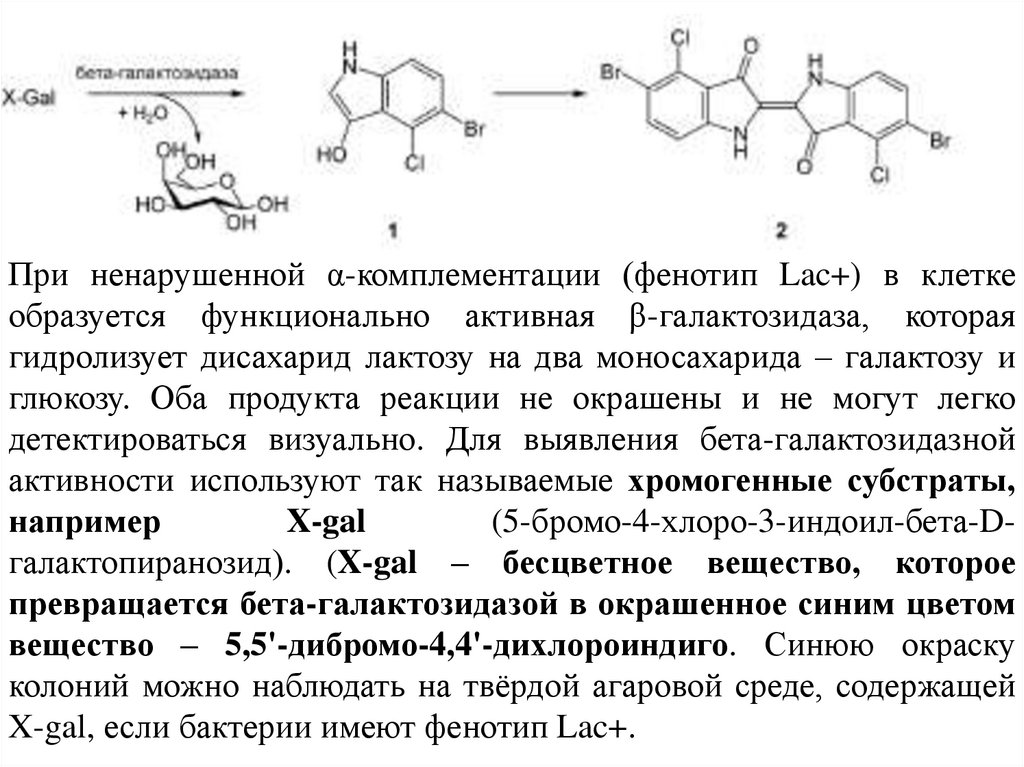
При ненарушенной α-комплементации (фенотип Lac+) в клеткеобразуется функционально активная β-галактозидаза, которая
гидролизует дисахарид лактозу на два моносахарида – галактозу и
глюкозу. Оба продукта реакции не окрашены и не могут легко
детектироваться визуально. Для выявления бета-галактозидазной
активности используют так называемые хромогенные субстраты,
например
X-gal
(5-бромо-4-хлоро-3-индоил-бета-Dгалактопиранозид). (X-gal – бесцветное вещество, которое
превращается бета-галактозидазой в окрашенное синим цветом
вещество – 5,5'-дибромо-4,4'-дихлороиндиго. Синюю окраску
колоний можно наблюдать на твёрдой агаровой среде, содержащей
X-gal, если бактерии имеют фенотип Lac+.
11.
Если в lacZ-ген вектора pUC встроить чужеродную ДНК,нарушиться синтез α-пептида и бактерии, содержащие
гибридную плазмиду не будут окрашены в синий цвет
(белые колонии) на среде с X-gal.
Поскольку в плазмиде pUC для транскрипции гена lacZ
используется промотор и оператор lac-оперона, РНКполимераза может присоединиться к данному промотору
и начать синтез мРНК только при отсутствии репрессора
(продукт
хромосомного
гена
lacI,
который
экспрессируется конститутивно). Снятие репрессора с
оператора происходит в присутствии лактозы или IPTG
(изопропил-β-D-тиогалактозида), обладающего такой же
функциональной активностью.
12.
Для отбора бактерий, содержащих плазмиды pUCсо встроенной чужеродную ДНК, используется
бело-голубой
тест
(blue-white
тест).
Трансформанты высевают на полноценную среду
с ампициллином (селективный маркер для отбора
бактерий, содержащих pUC), в которую добавляют
IPTG и X-Gal в концентрации 0,5 mM и 50
мкг/мл соответственно.
Такой же диагностической средой может являться
минимальный агар с ампициллином и X-Gal с
добавлением в качестве источника углерода
лактозы.
13.
Вектор pACYC184 содержитр15
репликон,
гены
устойчивости к тетрациклину
(ТсR)
и
хлорамфениколу
(CmR).
Отбор
вектора
pACYC184 со встроенной
чужеродной
ДНК
осуществляют по такому же
принципу, как и для pBR322.
К ColE1 репликонам относится плазмида р15. Она организована сходным
образом, однако совместима с плазмидами серии pUC. Это послужило причиной
создания на основе репликонов р15 векторов, которые можно вводит в клетки,
содержащие плазмиды серии pUC. Системы двух векторов используются для
изучения регуляции экспрессии клонированных генов, поскольку позволяют
расположить структурные и регуляторные гены (или последовательности) на
разных плазмидах, объединенных в одной клетке.
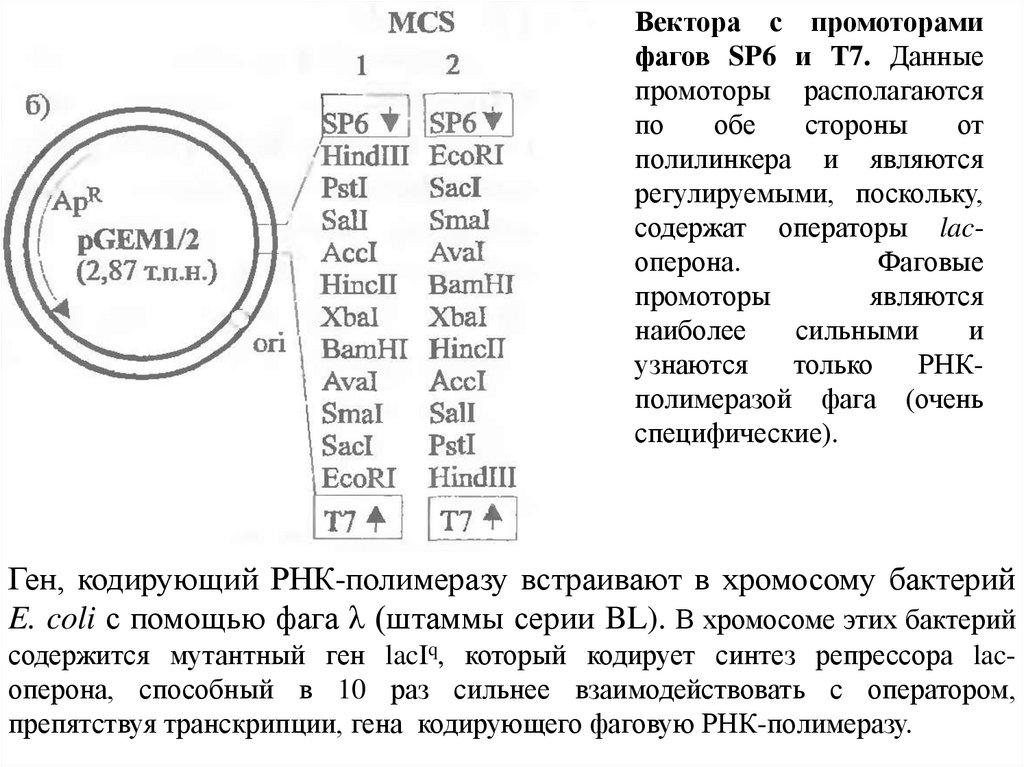
14.
Вектора с промоторамифагов SP6 и Т7. Данные
промоторы располагаются
по
обе
стороны
от
полилинкера и являются
регулируемыми, поскольку,
содержат операторы lacоперона.
Фаговые
промоторы
являются
наиболее
сильными
и
узнаются
только
РНКполимеразой фага (очень
специфические).
Ген, кодирующий РНК-полимеразу встраивают в хромосому бактерий
E. coli с помощью фага λ (штаммы серии BL). В хромосоме этих бактерий
содержится мутантный ген lacIq, который кодирует синтез репрессора lacоперона, способный в 10 раз сильнее взаимодействовать с оператором,
препятствуя транскрипции, гена кодирующего фаговую РНК-полимеразу.
15.
Вектор pTZ57R/Tсодержит ген,определяющий устойчивость к
ампицилину (ApR) и oriV-сайт
плазмиды pUC. Вокруг места
встраивания чужеродной ДНК
находятся сайты полилинкера.
Вектор содержит регулируемый
промотор (промотор фага Т7 и
оператор lac-оперона), а также
область фага f1, которая
позволяет получить продукт
амплификации
в
виде
одноцепочечной ДНК
При использовании в ПЦР реакции Taq-полимеразы образуются продукты
(ампликоны), содержащие на 3′-концах без матрицы присоединенный
аденин (конец 3′-A). Для встраивания таких ампликотонов используются,
так называемые Т-вектора. Это линейные молукулы, содержащие на 5'концах выступающий тимин (Т). Для получения гибридных конструкций
необходимо смешать ДНК линейного Т-вектора с продуктом амлификаии,
добавить лигазу и буфер и лигирующей смесью трансформировать
бактерии E. Coli.
16.
При использовании в реакции ПЦР ДНК-полимераз Pfu, Vent, Deep Vent продуктыамплификации будут иметь тупые концы. Для их встраивания используют
линейные вектора с тупыми концами. При этом разрезают такие гены (например,
фаговый ген eco47IR), которые детерминируют синтез продуктов, летальных
для бактериальной клетки. При встраивании продукта амплификации в такой ген,
его активность остается нарушенной и можно отобрать бактерии, содержащие
гибридные конструкции. Если при лигировании продукт амплификации не
встроился в этот ген, он восстановит свою активность и при попадании в
бактериальную клетку приведет ее к гибели (трансформанты не образуются).
Таким образом, наличие трансформантов на среде с антибиотиком, устойчивость
к которому кодируется вектором, свидетельствует о присутствии в клетках
гибридных плазмид.
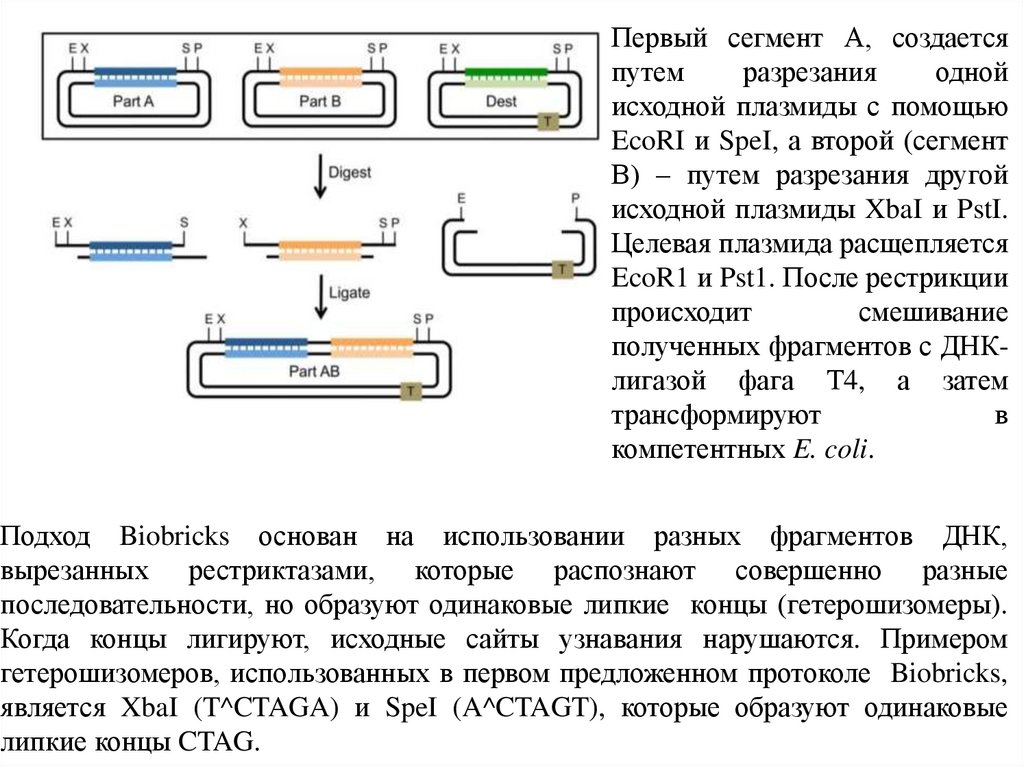
17.
Первый сегмент А, создаетсяпутем
разрезания
одной
исходной плазмиды с помощью
EcoRI и SpeI, а второй (сегмент
В) – путем разрезания другой
исходной плазмиды XbaI и PstI.
Целевая плазмида расщепляется
EcoR1 и Pst1. После рестрикции
происходит
смешивание
полученных фрагментов с ДНКлигазой фага Т4, а затем
трансформируют
в
компетентных E. coli.
Подход Biobricks основан на использовании разных фрагментов ДНК,
вырезанных рестриктазами, которые распознают совершенно разные
последовательности, но образуют одинаковые липкие концы (гетерошизомеры).
Когда концы лигируют, исходные сайты узнавания нарушаются. Примером
гетерошизомеров, использованных в первом предложенном протоколе Biobricks,
является XbaI (T^CTAGA) и SpeI (A^CTAGT), которые образуют одинаковые
липкие концы CTAG.
18.
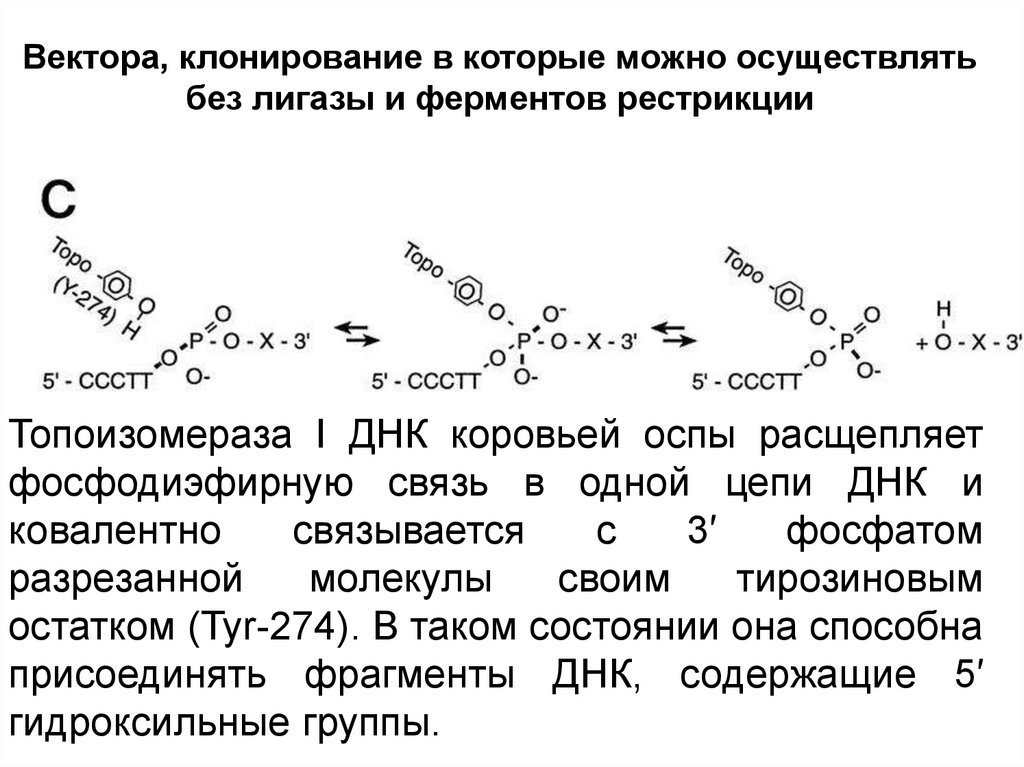
Вектора, клонирование в которые можно осуществлятьбез лигазы и ферментов рестрикции
Топоизомераза I ДНК коровьей оспы расщепляет
фосфодиэфирную связь в одной цепи ДНК и
ковалентно
связывается
с
3′
фосфатом
разрезанной
молекулы
своим
тирозиновым
остатком (Tyr-274). В таком состоянии она способна
присоединять фрагменты ДНК, содержащие 5′
гидроксильные группы.
19.
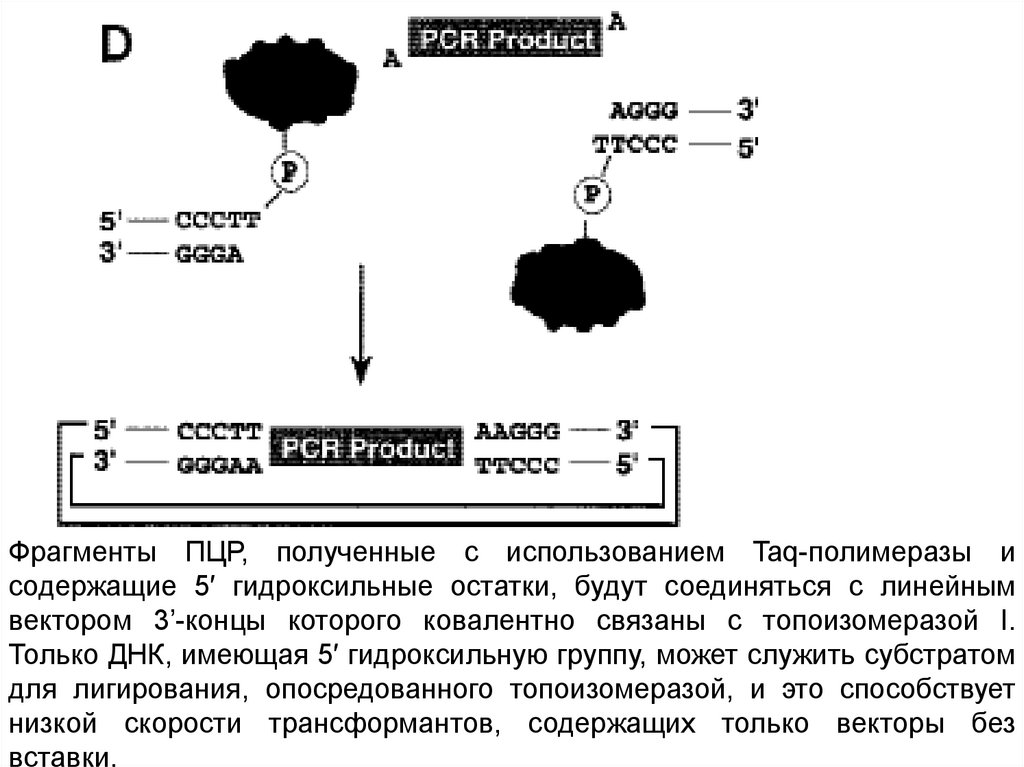
Фрагменты ПЦР, полученные с использованием Taq-полимеразы исодержащие 5′ гидроксильные остатки, будут соединяться с линейным
вектором 3’-концы которого ковалентно связаны с топоизомеразой I.
Только ДНК, имеющая 5′ гидроксильную группу, может служить субстратом
для лигирования, опосредованного топоизомеразой, и это способствует
низкой скорости трансформантов, содержащих только векторы без
вставки.
20.
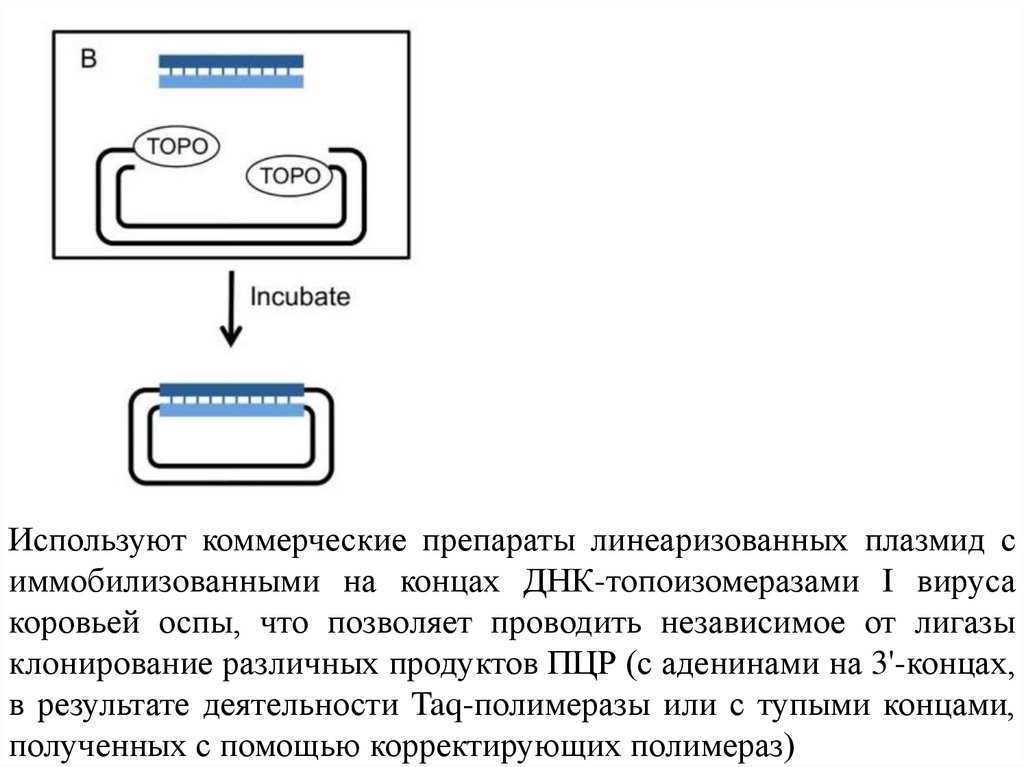
Используют коммерческие препараты линеаризованных плазмид симмобилизованными на концах ДНК-топоизомеразами I вируса
коровьей оспы, что позволяет проводить независимое от лигазы
клонирование различных продуктов ПЦР (с аденинами на 3'-концах,
в результате деятельности Taq-полимеразы или с тупыми концами,
полученных с помощью корректирующих полимераз)
21.
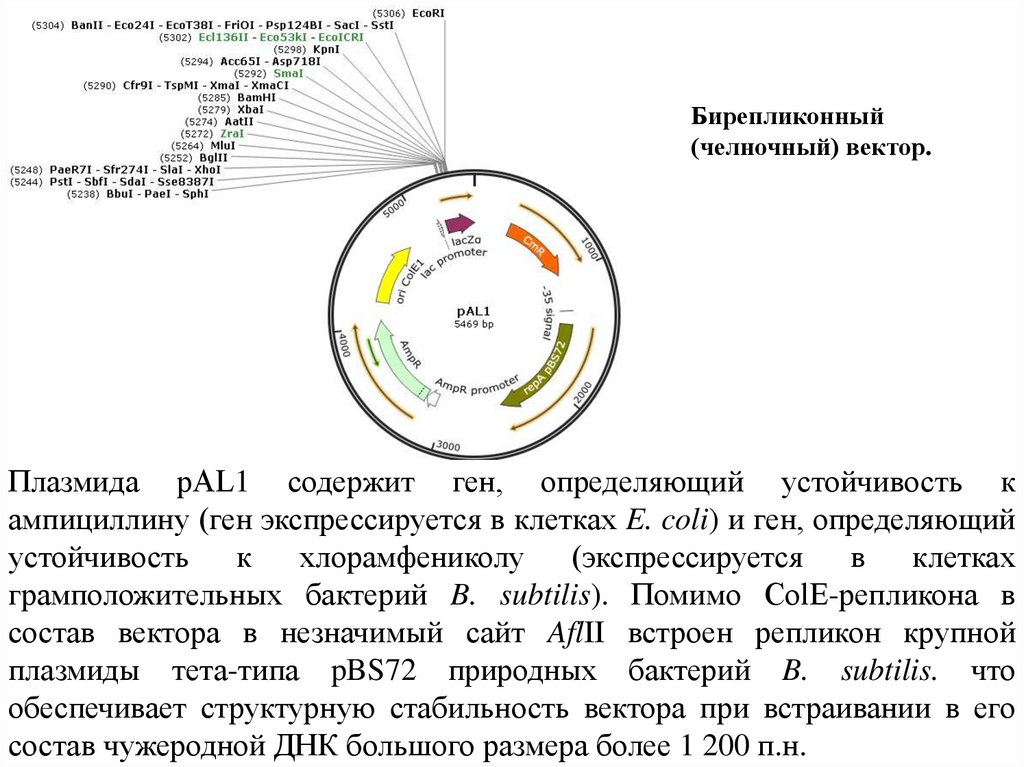
Бирепликонный(челночный) вектор.
Плазмида рАL1 содержит ген, определяющий устойчивость к
ампициллину (ген экспрессируется в клетках E. coli) и ген, определяющий
устойчивость
к
хлорамфениколу
(экспрессируется
в
клетках
грамположительных бактерий B. subtilis). Помимо ColЕ-репликона в
состав вектора в незначимый сайт AflII встроен репликон крупной
плазмиды тета-типа pBS72 природных бактерий B. subtilis. что
обеспечивает структурную стабильность вектора при встраивании в его
состав чужеродной ДНК большого размера более 1 200 п.н.
22.
PspacTer
MCS
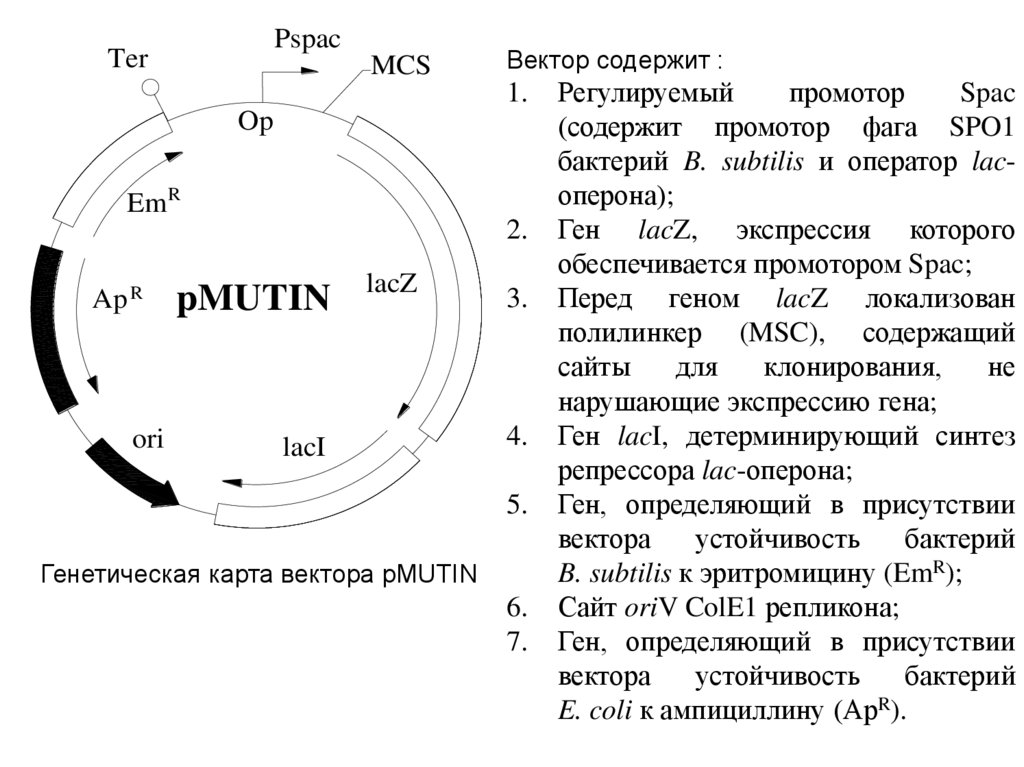
Вектор содержит :
1.
Op
Em R
2.
Ap R
ori
pMUTIN
lacZ
lacI
3.
4.
5.
Генетическая карта вектора рMUTIN
6.
7.
Регулируемый
промотор
Spac
(содержит промотор фага SPO1
бактерий B. subtilis и оператор lacоперона);
Ген lacZ, экспрессия которого
обеспечивается промотором Spac;
Перед геном lacZ локализован
полилинкер (MSC), содержащий
сайты
для
клонирования,
не
нарушающие экспрессию гена;
Ген lacI, детерминирующий синтез
репрессора lac-оперона;
Ген, определяющий в присутствии
вектора
устойчивость
бактерий
B. subtilis к эритромицину (EmR);
Сайт oriV ColE1 репликона;
Ген, определяющий в присутствии
вектора
устойчивость
бактерий
E. coli к ампициллину (АрR).
23.
orilacI
Ap R
EmR
lacZ
Pspac
orf 1
orf 2
lacZ
orf 3
lacI
ori
orf 1
Ap
?orf 2
R
R Em
Pspac
orf 3
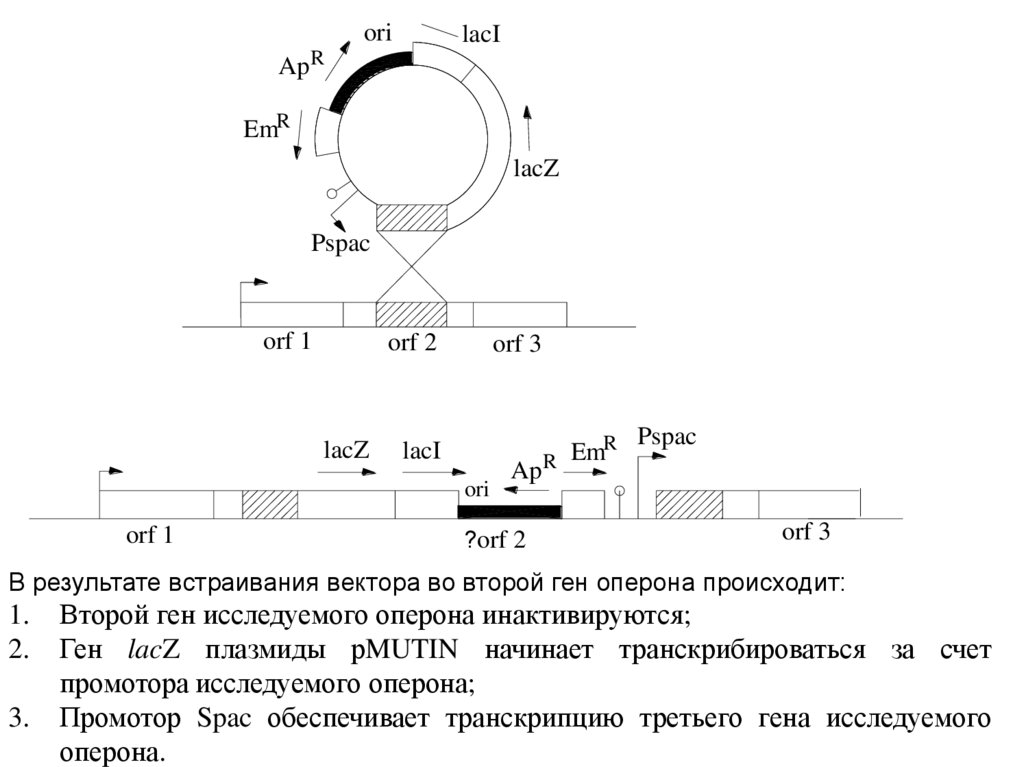
В результате встраивания вектора во второй ген оперона происходит:
1.
2.
3.
Второй ген исследуемого оперона инактивируются;
Ген lacZ плазмиды рMUTIN начинает транскрибироваться за счет
промотора исследуемого оперона;
Промотор Spac обеспечивает транскрипцию третьего гена исследуемого
оперона.
24.
В результате направленной вставки плазмиды в хромосому можноизучить:
1. Роль инактивированного гена (при встраивании определенных
фрагментов разных генов оперона в состав вектора рMUTIN,
можно изучить их функциональную роль в каком-либо
процессе, либо в жизнедеятельности клетки в целом);
2. Изучить регуляцию оперона (при добавлении каких-либо
метаболитов, либо меняя условия культивирования),
поскольку можно количественно оценить эффективность
транскрипции исследуемого оперона по экспрессии гена lacZ
(как указывалось ранее добавление X-gal в среду
культивирования бактерий позволяет оценить эффективность
синтеза β-галактозидазы);
3. Изучить активность ненарушенных генов исследуемого
оперона (расположенных за местом вставки плазмиды) за счет
их транскрипции с промотора Spac.
25.
Вектора серии pET для экспрессии чужеродных генов содержат:1.
2.
3.
4.
5.
6.
СоlE1 репликон (oriV-сайт и rom-ген, смотри вначале), что уменьшает
копийность вектора;
Маркер антибиотикорезистентности (могут быть разными и обеспечивать
устойчивость к разным антибиотикам);
Регулируемый промотор, состоящий из промоторной области фага Т7 («-35»
и «-10») и оператора lac-оперона;
Терминатор фага Т7;
Ген lacI, детерминирующий синтез репрессора;
Может входить сайт инициации репликации фага f1, что позоляет наработать
встроенный фрагмент в виде одноцепочечной ДНК (используется для
секвенирования, в качестве гибридизационных зондов и направленного
введения мутаций).
26.
Между промотором и сайтом встраивания чужероднойДНК (либо сайтом встраивания чужеродной ДНК и
терминатором) обычно присутствуют три элемента,
которые входят в состав первоначально образованного
полипептида (белок гибридный). Эти вспомогательные
последовательности могут располагаться либо на N-конце,
либо на С-конце гибридного полипептида. Они состоят из
определенных аминокислотных последовательностей,
которые обеспечивают:
а) очистку белка,
б) маркирование белка
в) отщепление целевого белка от вспомогательной части.
Всеми этими характеристиками обладает полипептид
ХpressTM, являющийся частью продукта гена 10 фага Т7.
27.
Очистка белкаВ состав полипептида полипептид ХpressTM входит
последовательность из шести расположенных подряд
гистидиновых аминокислотных остатков (His6),
которые
обладают
свойством
специфически
связываться с дивалентными катионами. Присутствие
His обеспечивает «вылавливание» синтезированного
белка на агарозном носителе, заряженном ионами Ni2+.
Другими
словами
культуральную
жидкость,
полученную в результате ферментации бактерий E. coli,
содержащих плазмиду с клонированным геном,
пропускают через колонку с Ni-агарозой, что позволяет
связать, а затем элюировать только целевой белок.
28.
Маркирование белка.Выделенный гибридный белок включает :
эпитоп (Ерi) (последовательность, состоящую из
аминокислот: Аsp-Leu-Tyr-Asp-Asp-Asp-Asp-Lys),
которые являются эпитопом, для которого имеются
коммерческие
антитела,
что
позволяет
диагностировать наличие целевого белка после его
выделения и очистки.
Отщепление целевого белка от
вспомогательной части.
Часть эпитопа Asp-Asp-Asp-Asp-Lys (сайт ЕК)
распознается и расщепляется энтерокиназой, что
позволяет отделить целевой белок от гибридного.
29.
рЕТ-вектора содержат уникальный сайт NdeI, разрезаниекоторого обеспечивает образование старт-кодона ATG.
Клонирование гена в этот сайт обеспечивает после всех
манипуляций (выделение, очистка) образование только
целевого белка. Для клонирования гена в один из сайтов
полилинкера, используется три плазмиды (а, b и с), и только в
одной из них в последовательности клонированного гена не
нарушается рамка считывания и образуется белок, содержащий
дополнительные аминокислоты либо на N-, либо на С-конце
белковой молекулы. Многие из таких гибридных белков
сохраняют функциональную активность.
30.
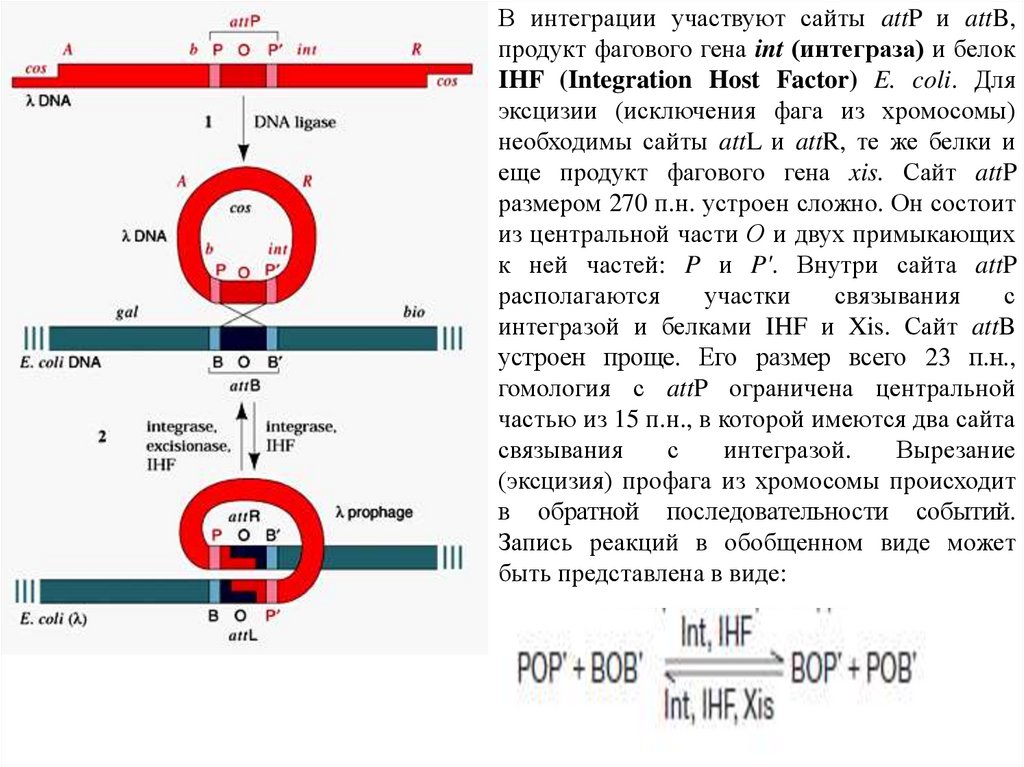
В интеграции участвуют сайты attP и attB,продукт фагового гена int (интеграза) и белок
IHF (Integration Host Factor) E. coli. Для
эксцизии (исключения фага из хромосомы)
необходимы сайты attL и attR, те же белки и
еще продукт фагового гена xis. Сайт attP
размером 270 п.н. устроен сложно. Он состоит
из центральной части О и двух примыкающих
к ней частей: P и P'. Внутри сайта attP
располагаются
участки
связывания
с
интегразой и белками IHF и Xis. Сайт attB
устроен проще. Его размер всего 23 п.н.,
гомология с attP ограничена центральной
частью из 15 п.н., в которой имеются два сайта
связывания
с
интегразой.
Вырезание
(эксцизия) профага из хромосомы происходит
в обратной последовательности событий.
Запись реакций в обобщенном виде может
быть представлена в виде:
31.
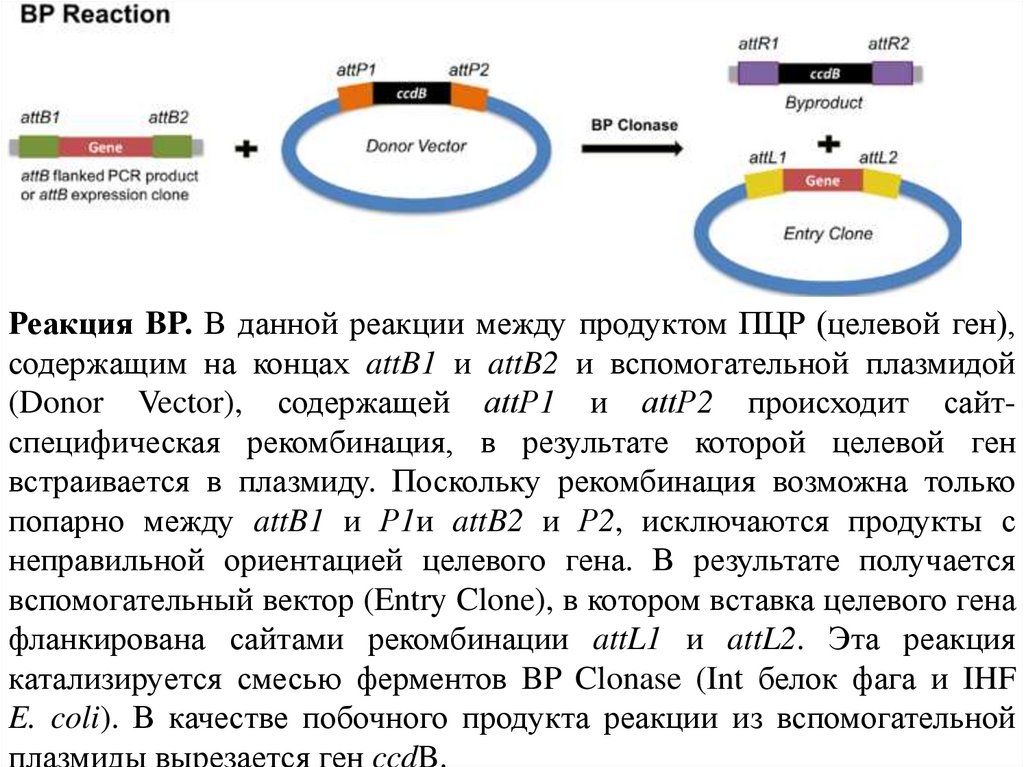
Реакция BP. В данной реакции между продуктом ПЦР (целевой ген),содержащим на концах attB1 и attB2 и вспомогательной плазмидой
(Donor Vector), содержащей attР1 и attР2 происходит сайтспецифическая рекомбинация, в результате которой целевой ген
встраивается в плазмиду. Поскольку рекомбинация возможна только
попарно между attB1 и Р1и attB2 и Р2, исключаются продукты с
неправильной ориентацией целевого гена. В результате получается
вспомогательный вектор (Entry Clone), в котором вставка целевого гена
фланкирована сайтами рекомбинации attL1 и attL2. Эта реакция
катализируется смесью ферментов BP Clonase (Int белок фага и IHF
E. coli). В качестве побочного продукта реакции из вспомогательной
плазмиды вырезается ген ccdB.
32.
Вспомогательная плазмида (Donor Vector) содержит селективныймаркер (ген устойчивости к антибиотику) и ген ссdB,
детерминирующий синтез белка, летального для клеток E. coli
(например, E. coli DH5α). Для размножения плазмид, содержащих
ген ссdB, используется специальный штамм с измененным геном,
детерминирующим синтез ДНК-гиразы (например, штамм E. coli
DB3.1 устойчивый к токсическому эффекту CcdB, поскольку
содержит мутацию в гене ДНК-гиразы (gyrA462)). На следующем
этапе вспомогательный вектор (Entry Clone), в котором целевой ген
фланкирован сайтами рекомбинации attL1 и attL2, вводят в клетки
E. coli, чуствительные к токсическому действию белка CcdB
(например, E. coli DH5α). Это обеспечивает отбор только бактерий,
содержащих вспомогательный вектор с целевым геном (Entry
Clone).
33.
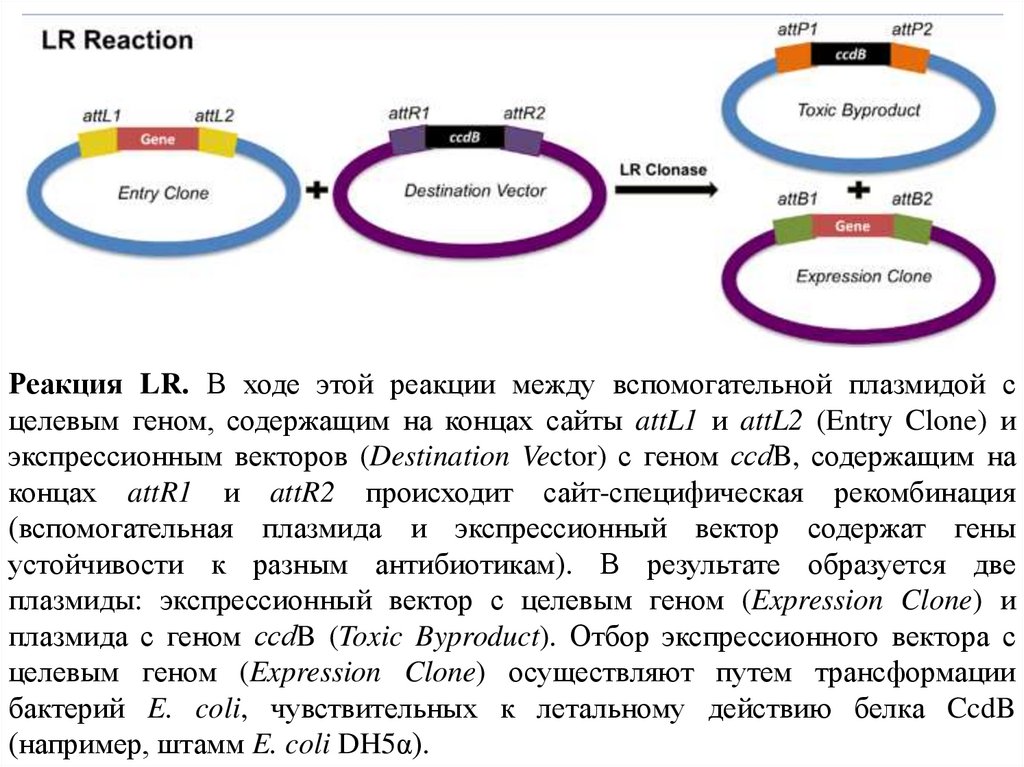
Реакция LR. В ходе этой реакции между вспомогательной плазмидой сцелевым геном, содержащим на концах сайты attL1 и attL2 (Entry Clone) и
экспрессионным векторов (Destination Vector) с геном ссdB, содержащим на
концах attR1 и attR2 происходит сайт-специфическая рекомбинация
(вспомогательная плазмида и экспрессионный вектор содержат гены
устойчивости к разным антибиотикам). В результате образуется две
плазмиды: экспрессионный вектор с целевым геном (Expression Clone) и
плазмида с геном ссdB (Toxic Byproduct). Отбор экспрессионного вектора с
целевым геном (Expression Clone) осуществляют путем трансформации
бактерий E. coli, чувствительных к летальному действию белка CcdB
(например, штамм E. coli DH5α).
34.
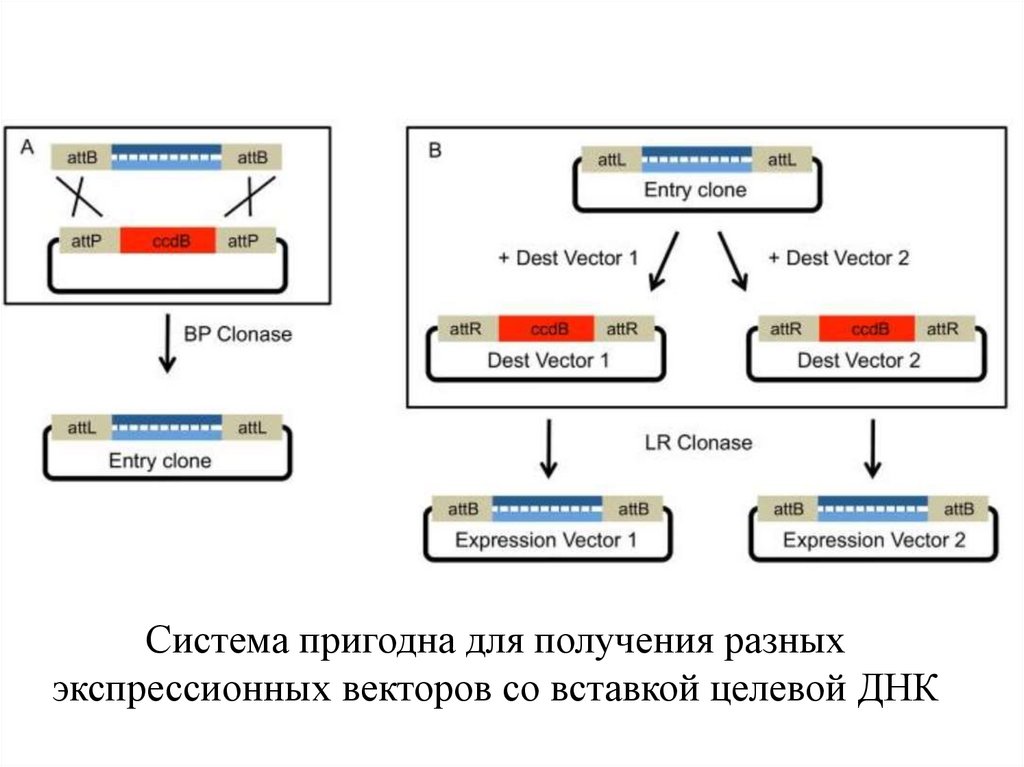
Система пригодна для получения разныхэкспрессионных векторов со вставкой целевой ДНК
35.
36.
Существует два механизма рекомбинации, которыеобеспечиваются продуктами генов бактериофагов.
Система Red включает три белка:
1. Gam
ингибирует белки RecBCD (разрушают
линейную двухцепочечную ДНК);
2. Exo является 5'-3'-экзонуклеазой, разрезающей
двуцепочечную ДНК с образованием свободных
3'-концов;
3. Beta
связывается
с
образованными
одноцепочечными концами и способствует
рекомбинации.
37.
Система RecETвключает два белка, кодируемых профагом Rac,находящимся в геноме E. coli K-12.
RecE, представляет собой 5'-3'-экзонуклеазу, аналогичную Exo;
RecT представляет собой рекомбиногенный белок,
связывающий одноцепочечную ДНК, аналогичный Beta.
Данные белки действуют на двухцепочечные концы ДНК до
того, как RecBCD сможет их разрушить, и превращают их в
рекомбиногенные 3'-выступающие одноцепочечные концы,
покрытые белком RecT.
38.
С помощью ПЦР получают плазмидную ДНК и фрагмент для вставки сперекрывающимися гомологичными последовательностями на каждом
конце (35–50 п.н.) Затем полученные продукты ПЦР трансформируют в
штамм E. coli, в котором экспрессируются белки RecE и RecT (штамм
SIMD63). После трансформации RecE отщепляет 5'-концы ДНК-вставки и
вектора, позволяя RecT способствовать отжигу комплементарных
однонитевых 3'-концов. Рекомбинантные плазмиды выделяются из
рекомбинирующего штамма и переносятся в стандартный штамм E. coli
для размножения .





















 Биология
Биология