Похожие презентации:
Тепловой эффект химической реакции, понятие о термохимии
1.
Ильина И.В., руководитель ЦДОШ, учитель химииМБОУ «Средняя общеобразовательная школа №27
имени А.А. Дейнеки» г. Курска
E-mail мой: ilina.irina71@mail.ru
2.
Тепловой эффект химическойреакции, понятие о
термохимии. Экзо- и
эндотермические реакции.
Ильина И.В., учитель химии МБОУ «Средняя общеобразовательная школа
№ 27 имени А.А. Дейнеки» города Курска
E-mail мой: ilina.irina71@mail.ru
3.
Цель и задачи урокаЦель: сформировать знания о тепловом эффекте
химической реакции
Задачи:
1. Познакомить с понятием “тепловой эффект химических
реакций”, классификацией химических реакций (явлений)
по тепловому эффекту.
2. Уметь составлять термохимические уравнения и
производить расчеты теплоты по уравнению реакции.
3. Владеть понятиями “теплота”, “энергия”, “экзо- и
эндотермические
реакции”,
“тепловой
эффект”,
“термохимическое уравнение”, выделение и поглощение
энергии.
4.
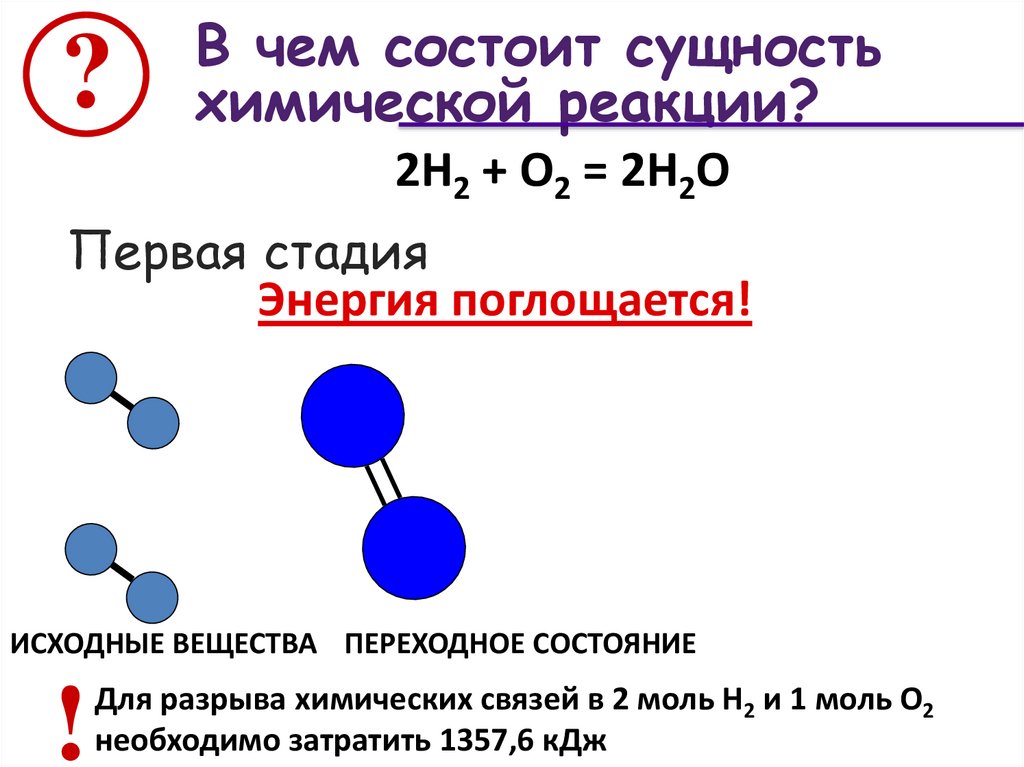
?В чем состоит сущность
химической реакции?
2Н2 + О2 = 2Н2О
Первая стадия
Энергия поглощается!
ИСХОДНЫЕ ВЕЩЕСТВА ПЕРЕХОДНОЕ СОСТОЯНИЕ
!
Для разрыва химических связей в 2 моль Н2 и 1 моль О2
необходимо затратить 1357,6 кДж
5.
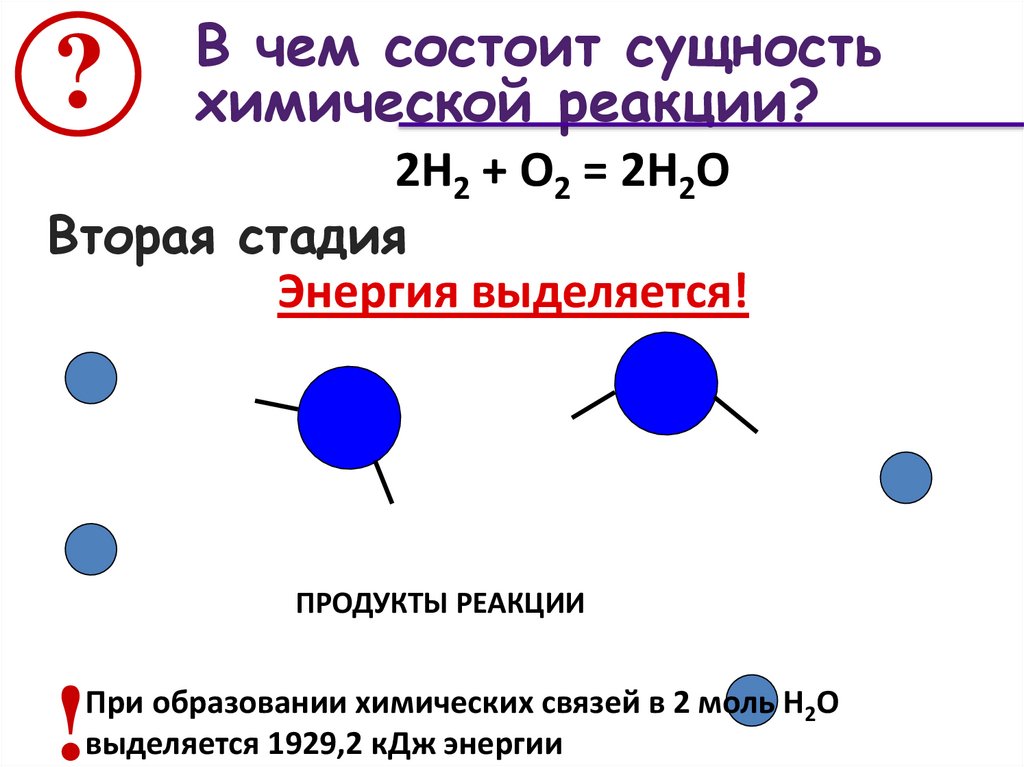
?В чем состоит сущность
химической реакции?
2Н2 + О2 = 2Н2О
Вторая стадия
Энергия выделяется!
ПРОДУКТЫ РЕАКЦИИ
!
При образовании химических связей в 2 моль Н2О
выделяется 1929,2 кДж энергии
6.
Герман Иванович Гесс-Российский академик
-Основоположник термохимии
Термохимия —
раздел химии, в задачу
которого
входит
определение
и
изучение тепловых эффектов реакции
7.
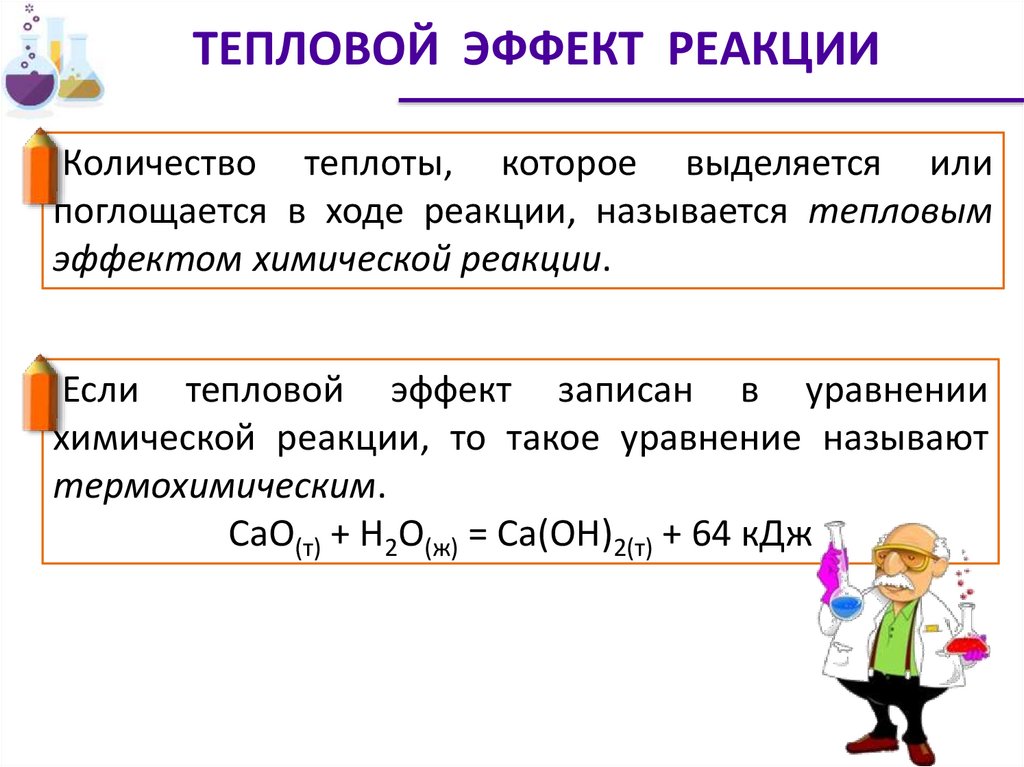
ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИКоличество теплоты, которое выделяется или
поглощается в ходе реакции, называется тепловым
эффектом химической реакции.
Если тепловой эффект записан в уравнении
химической реакции, то такое уравнение называют
термохимическим.
СаО(т) + Н2О(ж) = Са(ОН)2(т) + 64 кДж
8.
ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИВ термохимических уравнениях тепловой эффект
указан на количества веществ, соответствующих
коэффициентам перед их формулами.
В
термохимических
уравнениях
указываются
агрегатные состояния веществ.
2H2(г) + О2(г) = 2Н2O(г) + 484 кДж
2H2(г) + О2(г) = 2Н2O(ж) + 572 кДж
9.
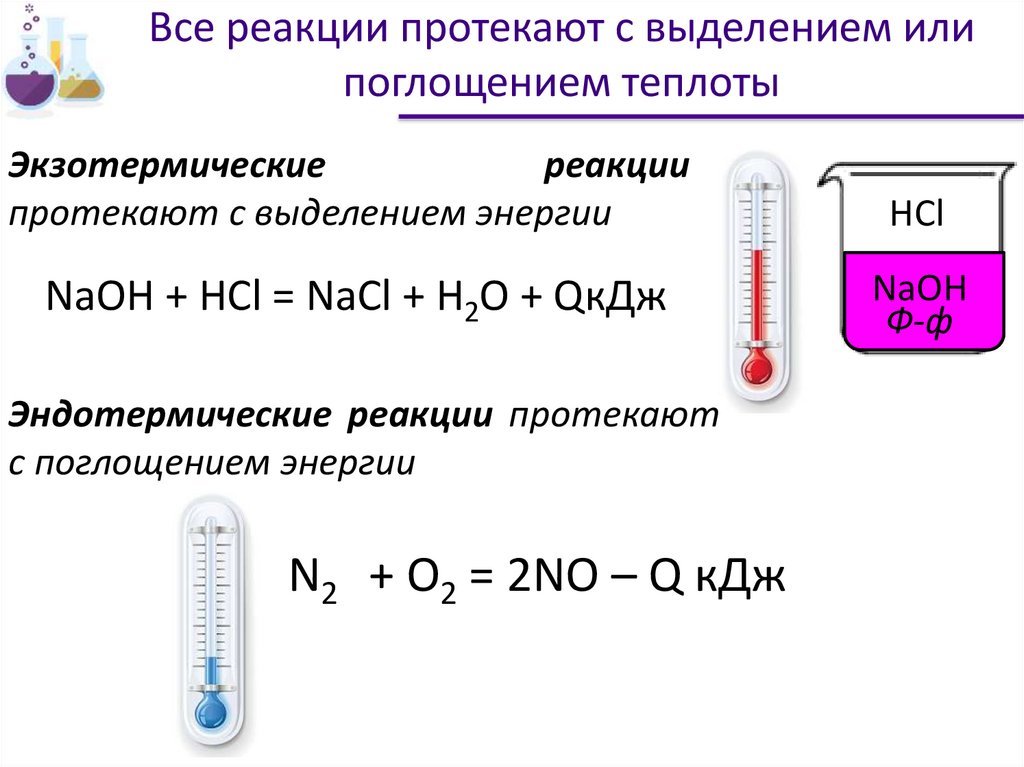
Все реакции протекают с выделением илипоглощением теплоты
Экзотермические
реакции
протекают с выделением энергии
HCl
NaOH + HCl = NaCl + H2O + QкДж
NaOH
Ф-ф
Эндотермические реакции протекают
с поглощением энергии
N2 + O2 = 2NO – Q кДж
10.
ЗАДАЧА № 1При протекании реакции термохимическое уравнение которой
Fe2O3(тв) + 3C(тв) = 2Fe(тв) + 3CO(г) – 490,6 кДж, поглотилось
2943,6 кДж теплоты. Какой объём угарного газа (н.у.) при
этом образовался?
Дано:
Q= 2943,6 кДж Fe O
Решение:
Х л 2943,6 кДж
2 3(тв) + 3C(тв) = 2Fe(тв) + 3CO(г) – 490,6 кДж
3 моль
V- ?
Vm=22,4 л/моль
1) Находим объём СО по формуле V = n × Vm
V(СО) = 3 моль × 22,4 л/моль = 67,2 л
2) Установим пропорциональные отношения:
По условию
Х л СО ---------- 2943,6 кДж
По уравнению 67,2 л СО ---------- 490,6 кДж
Ответ: V = 403,2 л
Х = 403,2 л
11.
ЗАДАЧА №25. В результате горения 48 г метана выделилось 2406 кДж
теплоты. Составьте термохимическое уравнение этой
реакции.
CH
+
2O
=
CO
+2H
O
+
802
кДж
4
2
2
2
Ответ:________________________________________________
Дано:
m(СН4) = 48 г
Q1 = 2406 кДж
Q -?
Решение:
48 г
2406кДж
CH4 + 2О2 CO2 + 2H2О + Q
1 моль
1. Определим количество метана n = m : M
М(СН4)=16 г/моль n(CH ) = 48 г : 16 г/моль = 3 моль
4
2. Составляем пропорцию:
По условию
3 моль CH4 - 2406 кДж
По уравнению
1 моль CH4 - Q
Q = 802 кДж
12.
ЗАДАЧА №3Синтез
аммиака
протекает
в
соответствии
с
термохимическим уравнением реакции N2 + 3H2 2NH3 + 92
кДж. Определите количество теплоты, которое выделится в
результате образования 560 мл (н.у.) газообразного аммиака.
Дано:
V=560 мл =
= 0,56 л
Q-?
Vm =22,4 л/моль
Решение:
0,56 л
Х кДж
N2 + 3H2 2NH3 + 92 кДж
2 моль
1) Находим количество аммиака по формуле
n= V : Vm
V(NH3) = 0,56 л : 22,4 л/моль = 0,025 моль
2) Установим пропорциональные отношения:
По условию
0,025 моль NH3---------- Х кДж
Х = 1,15 кДж
По уравнению 2 моль NH3 ---------- 92 кДж
Ответ: Q = 1,15 кДж
13.
КОРОТКО О ГЛАВНОМУравнение реакции, в котором приводится тепловой
эффект, называют термохимическим уравнением.
Реакции, протекающие с выделением теплоты (Q>0),
называются экзотермическими.
Реакции, протекающие с поглощением теплоты
(Q<0), называются эндотермическими.
Тепловой
эффект
реакции
прямо
пропорционален количеству вещества.
14.
Домашнее задание1. Повторить параграф 13
2. Задачи №1 и №2 (из презентации)
3. Тест (из презентации)
Пишите в электронный журнал или на мою почту.
E-mail мой: ilina.irina71@mail.ru
Дополнительно (по желанию)
15.
Домашнее заданиеЗадача №1. В соответствии с термохимическим
уравнением
C6H12О6 + 6О2 6CO2 + 6H2О + 2816 кДж
выделится 7040 кДж теплоты, если в реакции
участвует глюкоза массой (в граммах):
Задача 2. Составьте термохимическое уравнение
реакции горения кальция, если известно, что при
сгорании кальция массой 14 г выделилось количество
теплоты 307,2 кДж.
16.
ТЕСТ1. Реакции, протекающие с выделением теплоты и
света называются реакциями …..
а) разложения;
б) эндотермические;
в) экзотермические
г)замещения
2. Какие схемы можно назвать термохимическими
уравнениями реакций?
а) 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
б) 2 H2 + O2 = 2 H2О + 572 кДж
в) 2 H2(г) + O2(г) = 2 H2О(ж)
17.
ТЕСТ3. Какая запись, соответствует эндотермической реакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж
б) СаСO3 = СO2 + СаО – 310 кДж
г) Н2 + I2 = 2HI – 52 кДж
д) 3Fe + O2 = Fe3O4 + 118 кДж
4. Определите тип, к которому относятся данные реакции:
1. С+О2 = СО2 + 402,24кДж
2. 2HgO = 2Hg + О2 -180кДж
А) обе реакции экзотермические
Б) обе реакции эндотермические
В) А – эндотермическая, а Б – экзотермическая
Г) А – экзотермическая, а Б – эндотермическая
18.
Дополнительно (по желанию)1. При нейтрализации 49 г неизвестной кислоты раствором
щёлочи при определённых условиях выделяется 48 кДж
теплоты. Вычислите количество теплоты, выделяющееся
при нейтрализации 9,8 г данной кислоты в тех же условиях.
Дано:
m1 = 49 г
Q 1= 48 кДж
m2 = 9,8 г
Q2 - ?
Решение:
1) Установим пропорциональные отношения:
49 г ---------- 48 кДж
9,8 г ---------- Х кДж
Х = 9,6 кДж
Ответ: Q2 = 9,6 кДж
19.
Дополнительно (по желанию)2. В соответствии с термохимическим уравнением
2C2H2 + 5О2 4CO2 + 2H2О + 2610 кДж
выделится 652,5 кДж теплоты, если в реакции участвует
ацетилен массой (в граммах):
Ответ:_________г (Запишите число с точностью до целых)
Дано:
Q=652,5 кДж
Решение:
Хг
652,5 кДж
2C2H2 + 5О2 4CO2 + 2H2О + 2610 кДж
2 моль
m(С2Н2)-?
1) Установим пропорциональные отношения:
По условию
х моль
---------- 652,5 кДж
М(С2Н2) =26 г/моль По уравнению 2 моль C H ---------- 2610 кДж
2 2
Х = 0,5 моль (С2Н2)
2) Определяем массу ацетилена по формуле m= n · M
m(С2Н2) = 0,5 моль · 26 г/моль = 13 г.
20.
Дополнительно (по желанию)3. В результате реакции, термохимическое уравнение которой
H+ + ОН- H2О + 57 кДж,
выделилось 171 кДж теплоты. Вычислите массу гидроксида
натрия, который был нейтрализован соляной кислотой.
Ответ:_________г (Запишите число с точностью до целых)
Дано:
Q= 171 кДж
m(NaOH)-?
М(NaOH)=40 г/моль
Решение:
Хг
171 кДж
H+ + ОН- H2О + 57 кДж
1 моль
1) Определяем количество вещества
n = 171 кДж : 57 кДж = 3 моль
2) Определяем кол-во вещества и массу NaOH:
n(OH-) = n(NaOH) = 3моль
m(NaOH) = n · M = 3 моль · 40 г/моль = 120 г
21.
Дополнительно (по желанию)4. В соответствии с термохимическим уравнением
C2H5ОН + 3О2 2CO2 + 3H2О + 1374 кДж
При сгорании 110,4 г спирта выделится теплота в количестве
3297,6
Ответ:_______кДж
Дано:
m(C2H5OH)=110,4г
Q -?
Решение:
C2H5ОН+3О2 2CO2+3H2О+1374 кДж
5. Термохимическое уравнение сгорания аммиака имеет вид:
4NН3(г) + 3О2(г) 2N2(г) + 6H2О(ж) + 1528 кДж
При образовании 11,2 л (н.у.) азота выделяется
382
Ответ:_______кДж
(Запишите число с точностью до целых)

















 Химия
Химия








