Похожие презентации:
Растворы. Растворимость веществ
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙУНИВЕРСИТЕТ
Кафедра химии
Растворы.
Растворимость веществ
1. Классификация растворов.
2. Термодинамика образования растворов.
3. Растворимость веществ.
4. Законы Генри, Дальтона, Сеченова.
Лектор: доктор биологических наук, профессор, зав. кафедрой
химии Ирина Петровна Степанова
2.
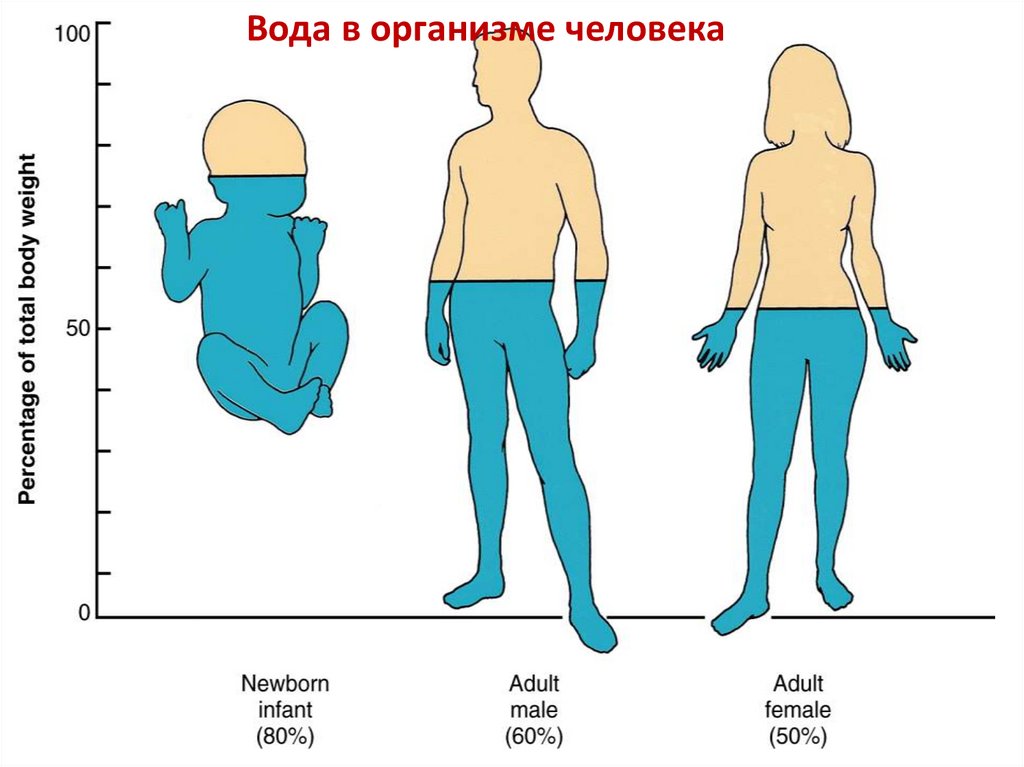
Медико-биологическое значение темыРастворы играют большую роль в процессах
жизнедеятельности. Важнейшие физиологические
жидкости – кровь, лимфа, желудочное и кишечное
содержимое, моча, слюна – являются растворами.
3.
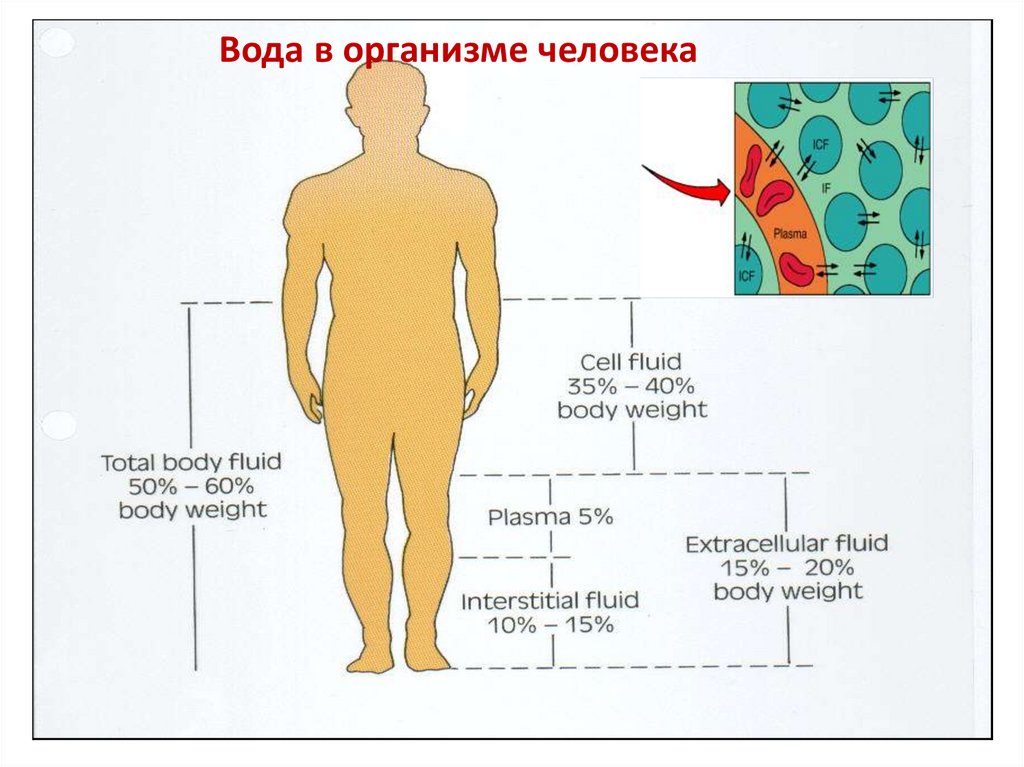
Вода в организме человека4.
Вода в организме человека5.
Медико-биологическое значение темыПроцессы
усвоения
пищи,
действие
ферментов, лекарственных
препаратов и др. реакции в
организме
обычно
протекают в растворах.
6.
РастворыРаствор
–
физико-химическая
система, состоящая из двух или
большего числа веществ и имеющая
переменный
состав в некотором
интервале соотношения компонентов.
7.
РастворыРастворы занимают промежуточное положение
между механическими смесями веществ и
химическими соединениями.
С механическими смесями растворы сближает
переменность по составу, а с химическими
соединениями
тепловые
эффекты,
сопровождающие растворение
большинства
веществ.
8.
Компоненты раствораРастворитель
Среда
Растворенное вещество
Вещество,
равномерно
распределяемое
в
растворителе
в
виде
молекул и ионов.
9.
РастворыРастворитель
=A
Раствор
=A
=B
С термодинамической
точки зрения
растворителем считается
тот компонент, который в
чистом виде существует в
том же агрегатном
состоянии, что и раствор в
целом.
Если же до растворения все компоненты
находились в одинаковом агрегатном состоянии,
(например: спирт – вода), то растворителем
считается компонент, находящийся в большем
количестве.
10.
РастворыВ растворах электролитов независимо от
концентрации электролит рассматривается как
растворенное вещество.
Например, в 70%-ном растворе
азотной кислоты
растворенным веществом
является HNO3, хотя HNO3
находится в большем
количестве (70% по массе), а
растворителем – вода.
11.
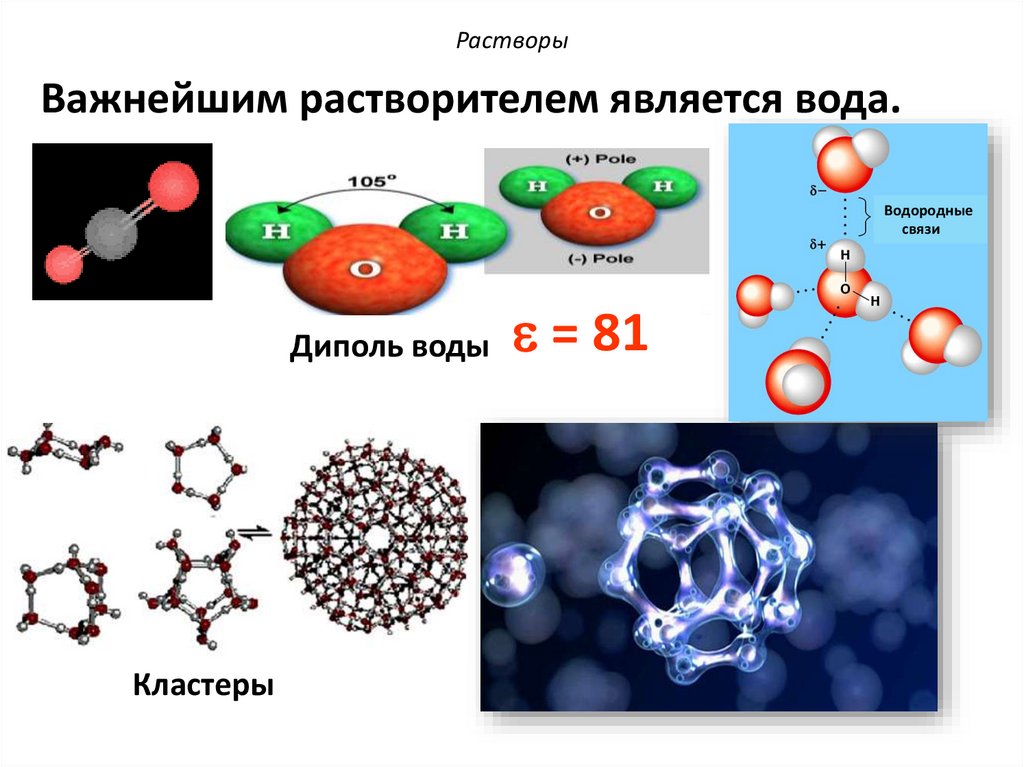
РастворыВажнейшим растворителем является вода.
Водородные
связи
Диполь воды
Кластеры
= 81
12.
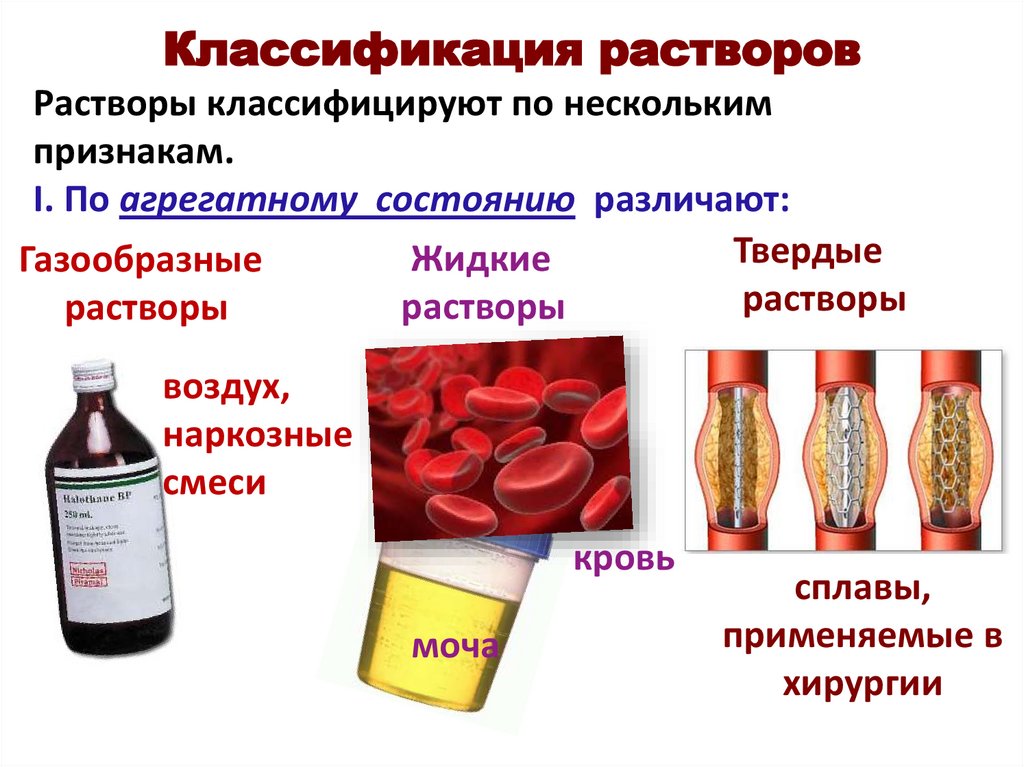
Классификация растворовРастворы классифицируют по нескольким
признакам.
I. По агрегатному состоянию различают:
Твердые
Жидкие
Газообразные
растворы
растворы
растворы
воздух,
наркозные
смеси
кровь
моча
сплавы,
применяемые в
хирургии
13.
Классификация растворовII. По молярной массе растворенного вещества
различают:
растворы НМВ
М(Х) < 5000 г/моль
растворы ВМВ
М(Х)> 5000 г/моль
Главной особенностью
растворов ВМВ является
существенное различие в
размерах между
макромолекулами
полимеров и молекулами
низкомолекулярного
растворителя.
14.
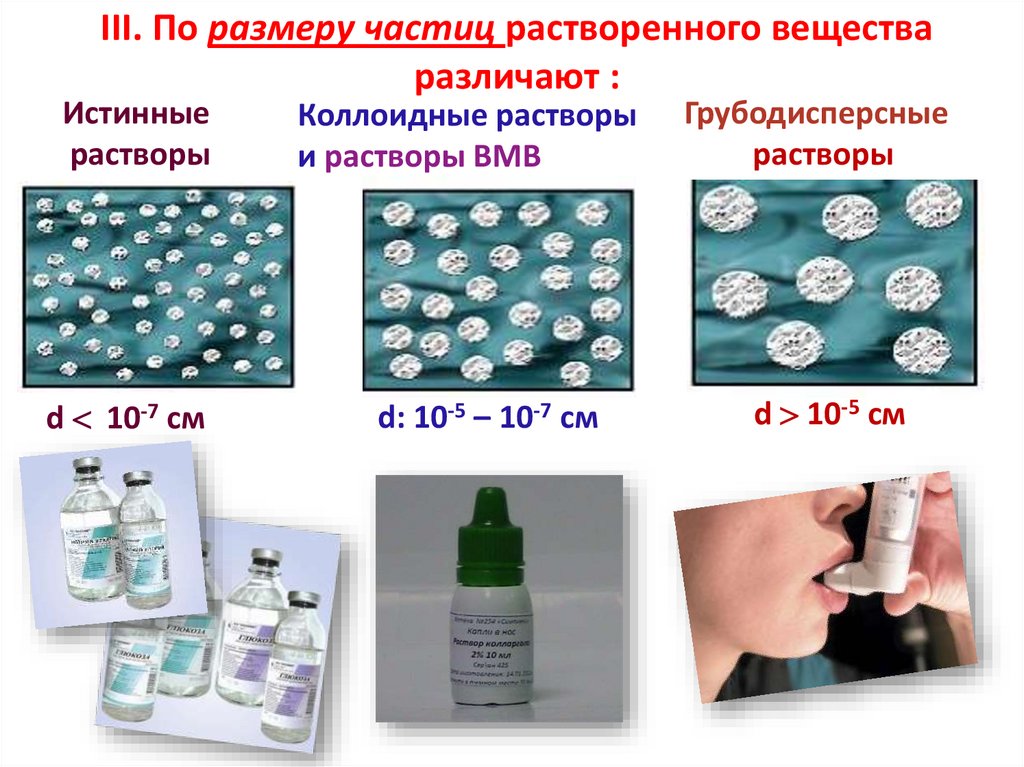
III. По размеру частиц растворенного веществаразличают :
Истинные
растворы
Коллоидные растворы
и растворы ВМВ
Грубодисперсные
растворы
d 10-7 см
d: 10-5 – 10-7 см
d 10-5 см
15.
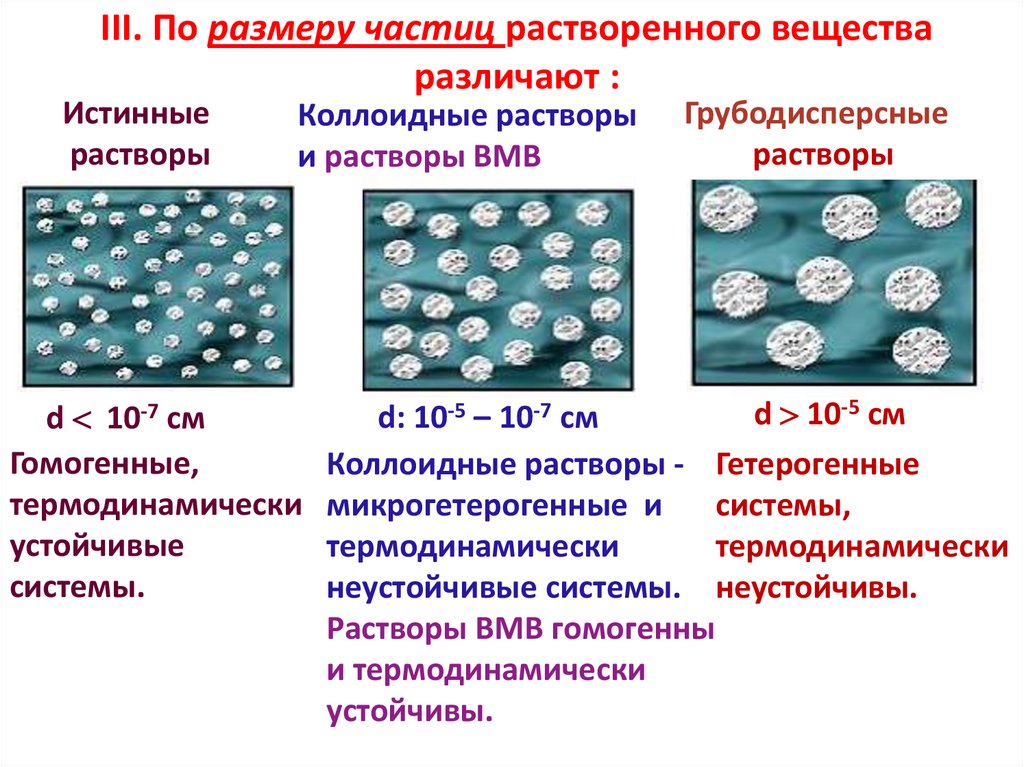
III. По размеру частиц растворенного веществаразличают :
Истинные
растворы
Коллоидные растворы
и растворы ВМВ
Грубодисперсные
растворы
d 10-5 см
d: 10-5 – 10-7 см
d 10-7 см
Гомогенные,
Коллоидные растворы - Гетерогенные
термодинамически микрогетерогенные и
системы,
устойчивые
термодинамически
термодинамически
системы.
неустойчивые системы. неустойчивы.
Растворы ВМВ гомогенны
и термодинамически
устойчивы.
16.
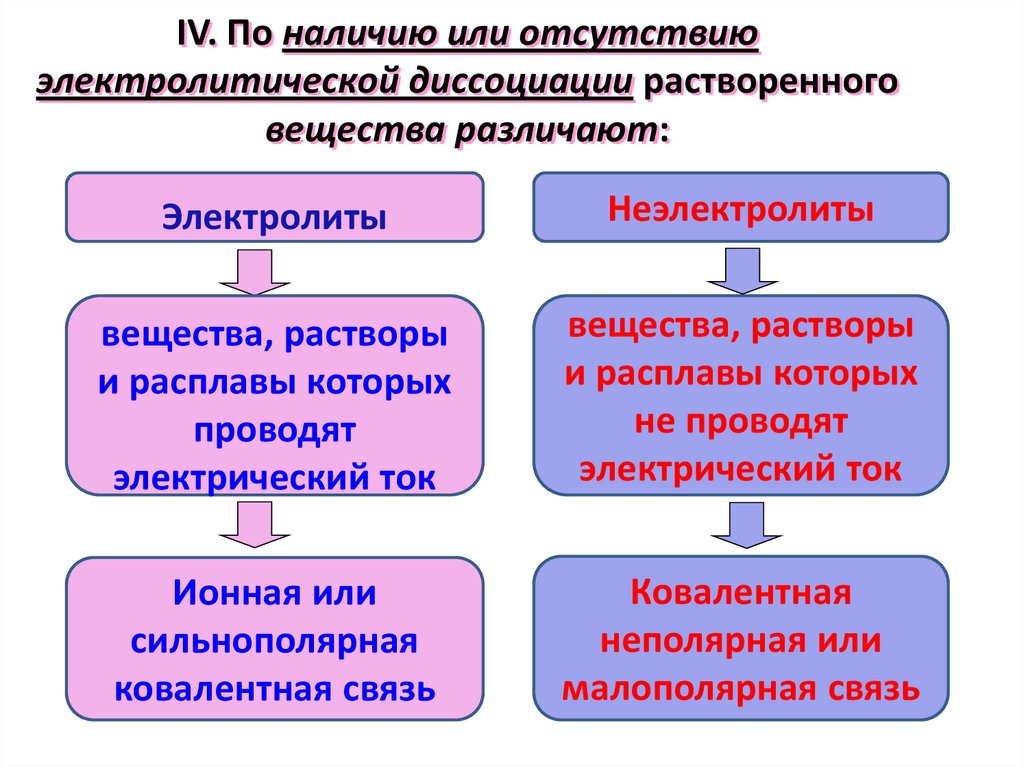
IV. По наличию или отсутствиюэлектролитической диссоциации растворенного
вещества различают:
Электролиты
Неэлектролиты
вещества, растворы
и расплавы которых
проводят
электрический ток
вещества, растворы
и расплавы которых
не проводят
электрический ток
Ионная или
сильнополярная
ковалентная связь
Ковалентная
неполярная или
малополярная связь
17.
IV. По наличию или отсутствиюэлектролитической диссоциации растворенного
вещества различают:
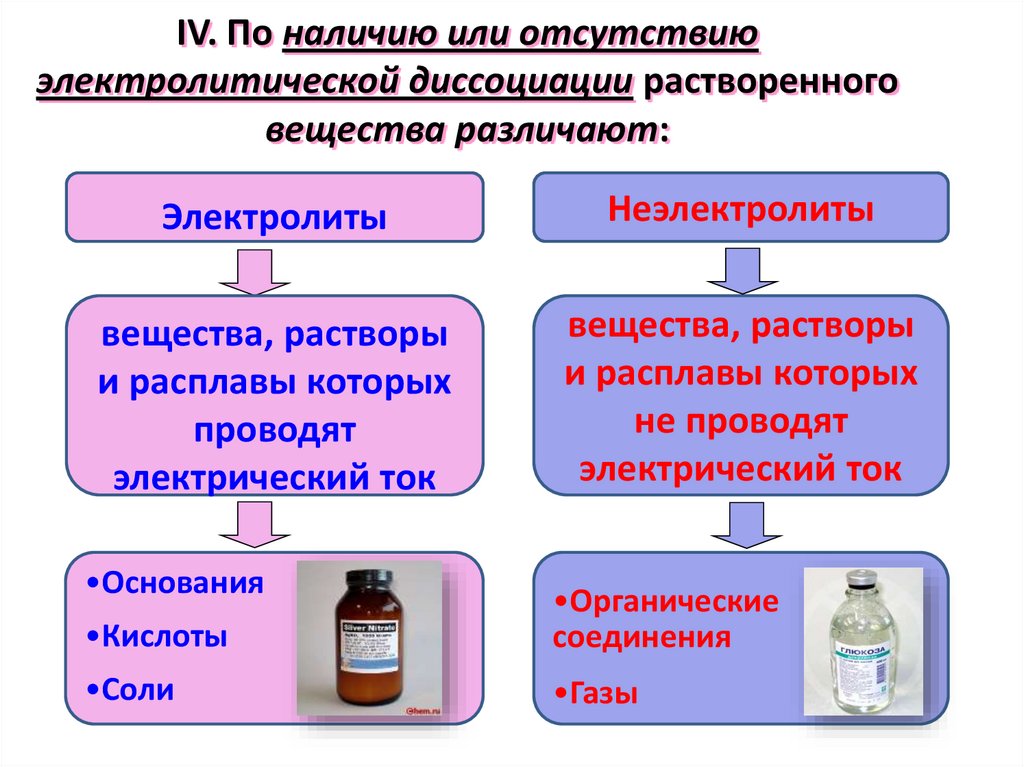
Электролиты
Неэлектролиты
вещества, растворы
и расплавы которых
проводят
электрический ток
вещества, растворы
и расплавы которых
не проводят
электрический ток
•Основания
•Кислоты
•Органические
соединения
•Соли
•Газы
18.
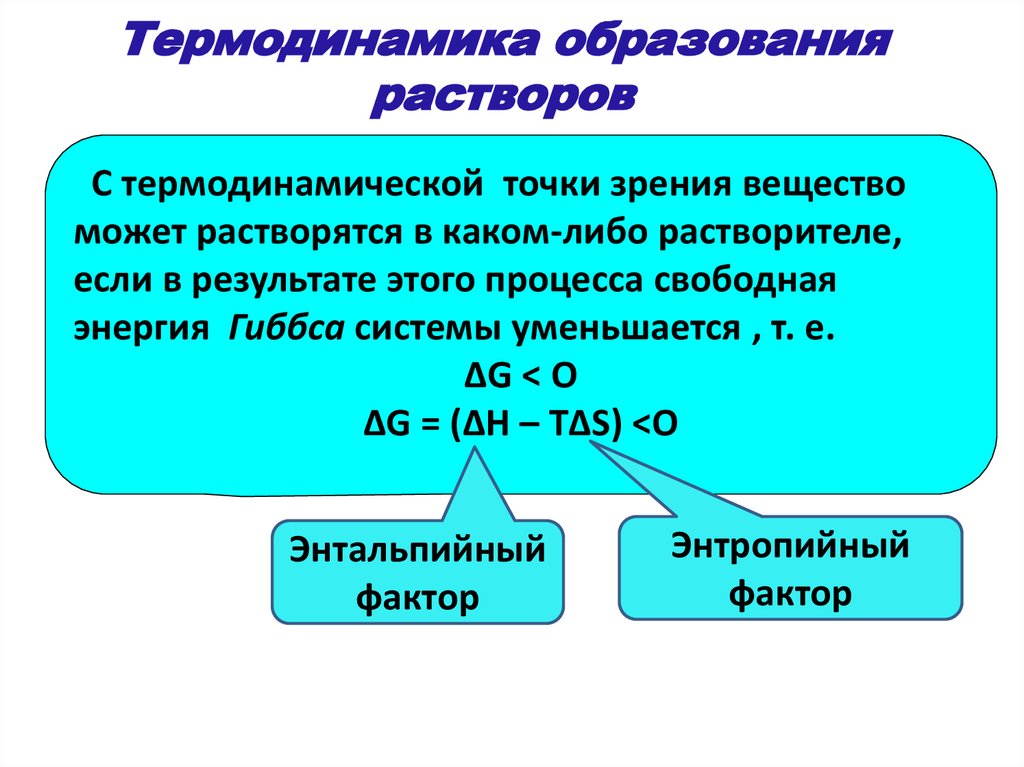
Термодинамика образованиярастворов
С термодинамической точки зрения вещество
может растворятся в каком-либо растворителе,
если в результате этого процесса свободная
энергия Гиббса системы уменьшается , т. е.
ΔG < O
ΔG = (ΔH – TΔS) <O
Энтальпийный
фактор
Энтропийный
фактор
19.
Термодинамика образования растворов1. Влияние энтальпийного фактора
Как известно, ΔH зависит от изменения объема
системы: ΔH = ΔU + pΔV.
При растворении твердых и жидких веществ
объем системы практически не изменяется
(ΔV=0), следовательно ΔH=ΔU, тогда ΔG=ΔU-TΔS.
Таким образом, при растворении твердых и
жидких веществ фактором, влияющим на величину
величину ΔG, будет изменение внутренней энергии
системы ΔU.
20.
Термодинамика образования растворовТеплота, выделяемая или поглощаемая при
растворении 1 моль вещества, называется
теплотой растворения Qраств. или
энтальпией растворения ΔHраств. [кДж· моль-1].
21.
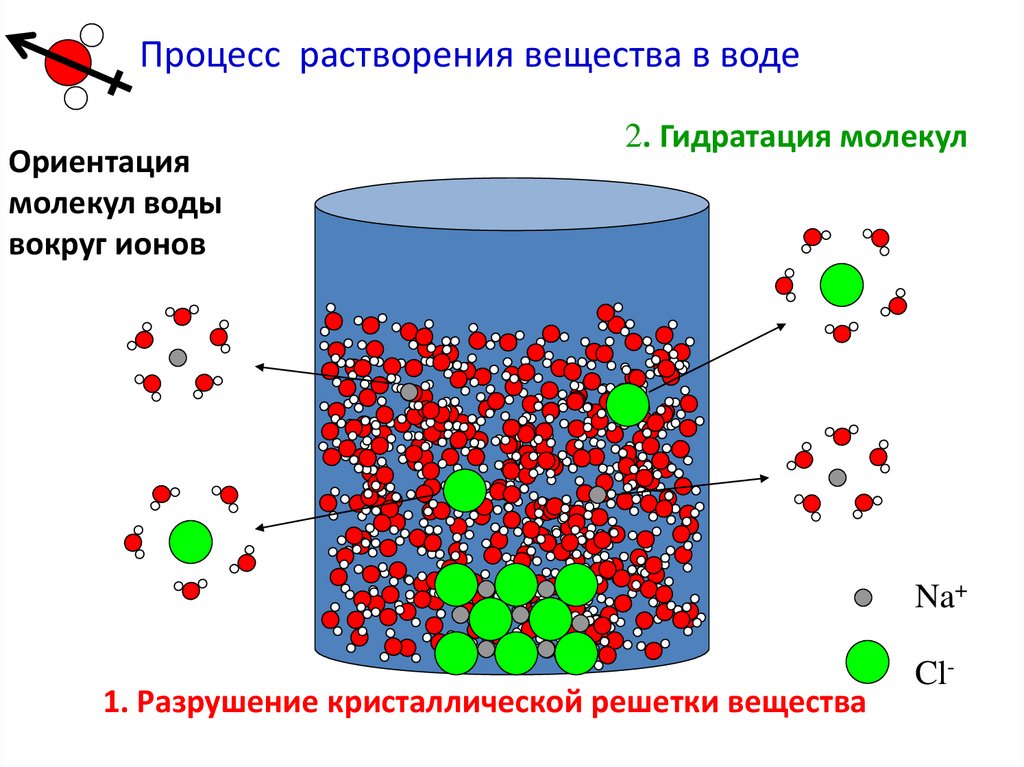
Термодинамика образования растворовПроцесс растворения вещества складывается из
нескольких стадий:
1.
Разрушение
кристаллической
структуры
растворяемого
вещества, т.е. фазовый переход,
является эндотермическим процессом: ΔHф.п. > 0.
2.
Сольватация
(гидратация)
процесс
взаимодействия частиц растворенного вещества с
молекулами растворителя – это экзотермический
процесс: ΔHсол. < 0.
22.
Процесс растворения вещества в водеОриентация
молекул воды
вокруг ионов
2. Гидратация молекул
Na+
1. Разрушение кристаллической решетки вещества
Cl-
23.
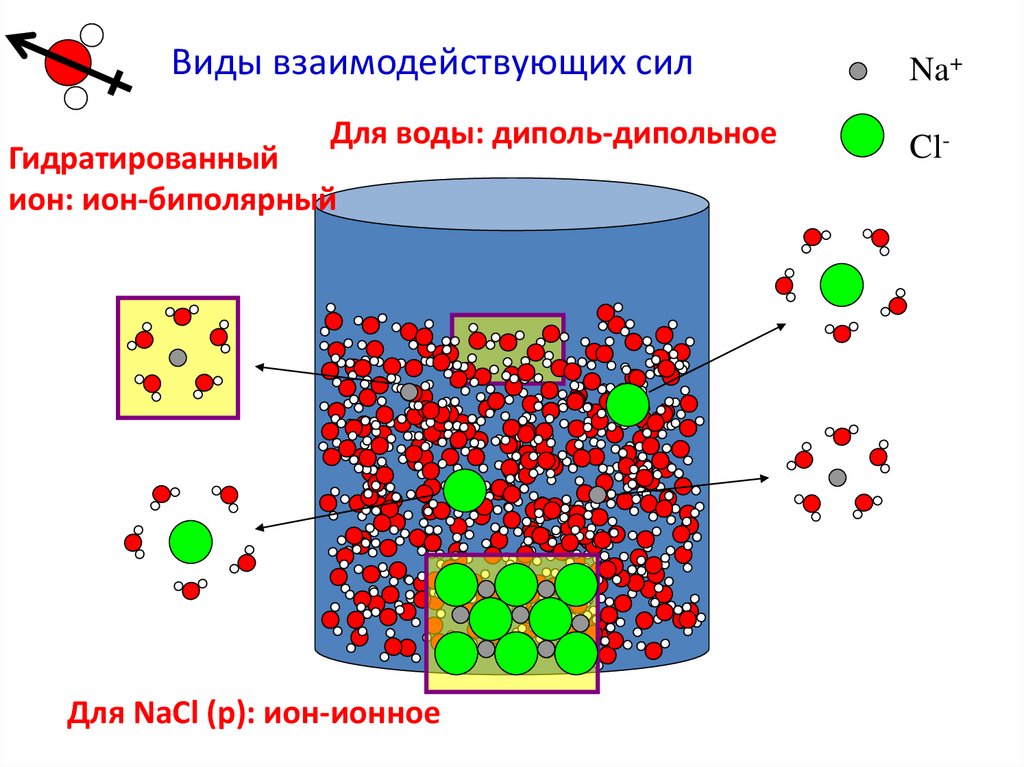
Виды взаимодействующих силДля воды: диполь-дипольное
Гидратированный
ион: ион-биполярный
Для NaCl (р): ион-ионное
Na+
Cl-
24.
Термодинамика образования растворовΔHраств. = ΔHф.п. + ΔHсол.
Если Hф.п. > Нсол. – то процесс
эндотермический,
Если Hф.п. < Нсол. – то процесс
экзотермический.
25.
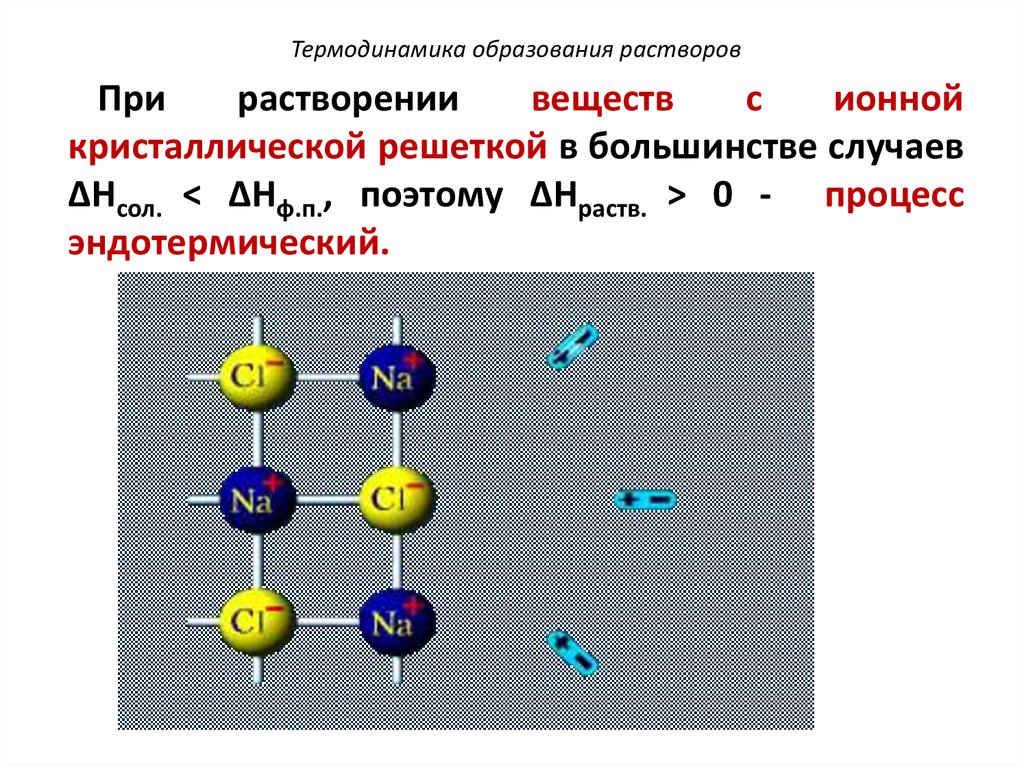
Термодинамика образования растворовПри
растворении
веществ
с
ионной
кристаллической решеткой в большинстве случаев
ΔHсол. < ΔHф.п., поэтому ΔHраств. > 0 - процесс
эндотермический.
26.
Термодинамика образования растворовПри растворении жидкостей с молекулярной
кристаллической решеткой ΔHсол. > ΔHф.п. ,
следовательно ΔHраств. < 0 – т.е. их растворение
является экзотермическим процессом.
При растворении газообразных веществ ΔHф.п. = 0,
поэтому энтальпия растворения ΔHраств. = ΔHсол.,
следовательно ΔHраств. < 0, т.е. растворение газов
является экзотермическим процессом.
27.
Термодинамика образования растворов2. Влияние энтропийного фактора
При переходе вещества из упорядоченного
твердого или жидкого состояния в растворы в системе
возрастает беспорядок, поэтому энтропия системы
увеличивается, ΔSраств. > О.
Это
способствует
протеканию
процесса
растворения, т. к. ΔG понижается, и вклад
энтропийного фактора будет особенно заметен при
повышенных температурах.
28.
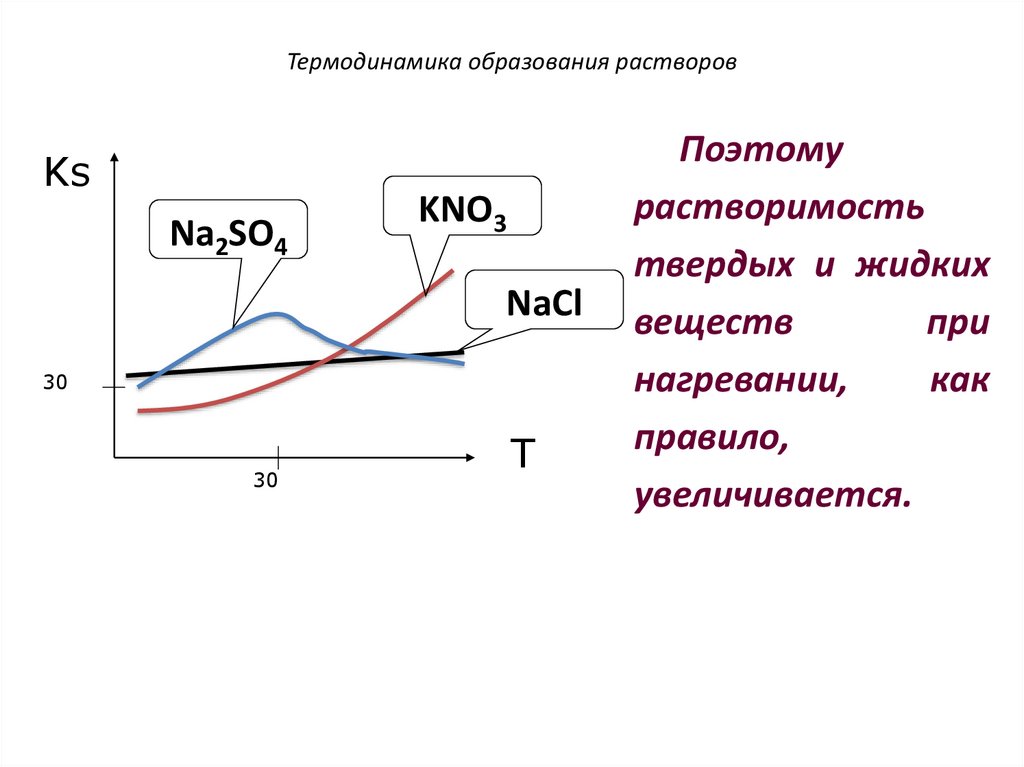
Термодинамика образования растворовKs
Na2SO4
KNO3
NaCl
30
30
T
Поэтому
растворимость
твердых и жидких
веществ
при
нагревании,
как
правило,
увеличивается.
29.
Термодинамика образования растворовПри переходе из газообразного состояния в
растворенное в системе наблюдается возрастания
упорядоченности из-за сольватации (гидратации)
молекул, поэтому энтропия системы уменьшается
ΔSраств. < О.
Влияние энтропийного фактора на величину ΔG
является минимальным при низких температурах.
Поэтому
растворимость
газов
при
охлаждении увеличивается, а с повышением
температуры уменьшается.
30.
Растворимость веществРастворимость
свойство
данного
вещества растворяться в
том
или
ином
растворителе.
.
31.
Растворимость веществПроцесс
растворения
протекает
самопроизвольно до тех пор, пока в системе не
установится состояние равновесия (ΔG=0),
такой раствор называется насыщенным.
Насыщенным
называется
раствор,
находящийся в динамическом равновесии с
избытком растворенного вещества.
32.
Растворимость веществКоличественно
растворимость
характеризуют
концентрацией
насыщенного раствора при определенной
температуре и давлении (коэффициент
растворимости); выражают
в граммах
вещества на 100 г растворителя.
K
200 C
- коэффициент растворимости
H 2O
33.
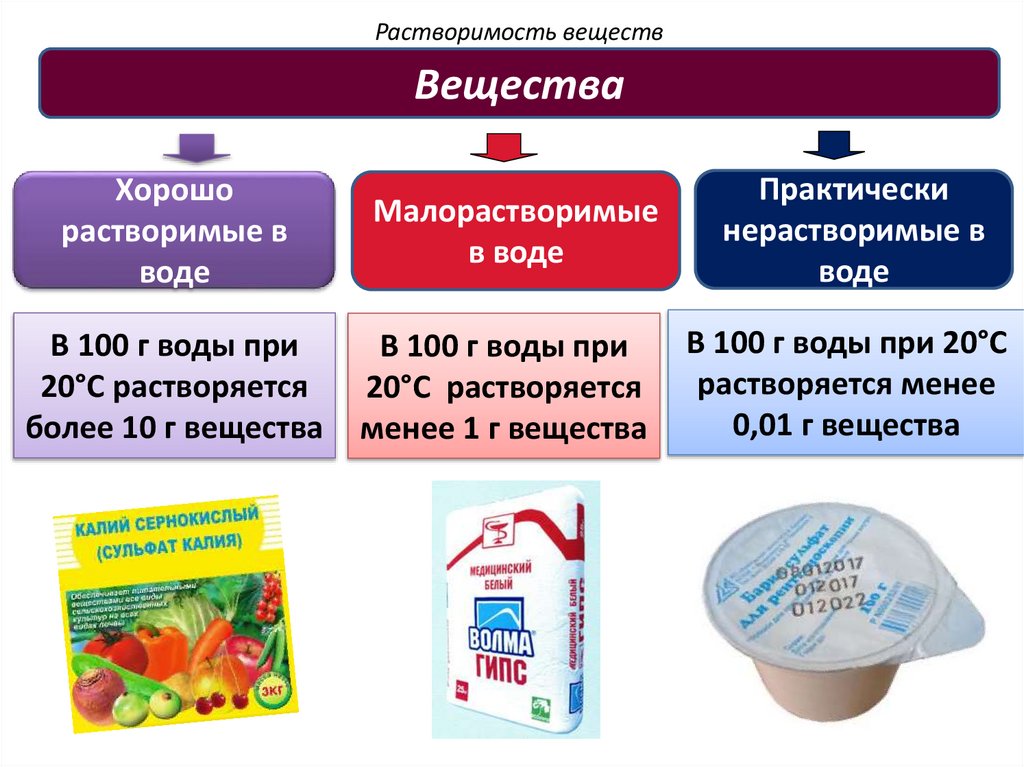
Растворимость веществВещества
Хорошо
растворимые в
воде
Малорастворимые
в воде
Практически
нерастворимые в
воде
В 100 г воды при
20°C растворяется
более 10 г вещества
В 100 г воды при
20°C растворяется
менее 1 г вещества
В 100 г воды при 20°C
растворяется менее
0,01 г вещества
34.
Растворимость веществ35.
Растворимость веществРастворимость вещества зависит от ряда
факторов.
1. Влияние на растворимость природы
компонентов.
Природа вещества определяется типом
химической связи. Вещества с полярным
ковалентным
(HCl)
и
ионным
(гетерополярным) типом связи (NaCl) лучше
растворяются в полярных растворителях
(например Н2О), а с неполярной связью (O2, N2,
С6Н6 и др.) – в неполярных растворителях.
36.
Растворимость веществНа растворимость органических соединений в воде
оказывает влияние наличие в их молекулах
гидрофильных полярных групп.
Гидрофильность полярных групп в молекулах
органических соединений убывает в следующем
порядке:
карбоксильная группа -СООН;
гидроксильная группа -ОН;
альдегидная группа
-СНО;
аминогруппа
-NН2;
тиогруппа
-SН.
Хорошая растворимость в воде многих белков
обусловлена наличием в их молекулах большого
количества гидрофильных полярных групп.
37.
Растворимость веществ2. Влияние на растворимость внешних
условий (давления, температуры)
Так как при образовании насыщенного
раствора устанавливается истинное равновесие
(ΔG=0), то для определения влияние температуры
и давления на растворимость пользуются
принципом Ле Шателье.
Для этого нужно учитывать знаки изменения
энтальпии (ΔН) и объёма (ΔV) системы при
растворении. Знак (ΔН) будет определять характер
действия температуры, а знак (ΔV) – характер
действия давления.
38.
Растворимость веществБольшое значение
имеет
влияние
давления
и
температуры
на
растворимость газов в
физиологических
жидкостях организма.
39.
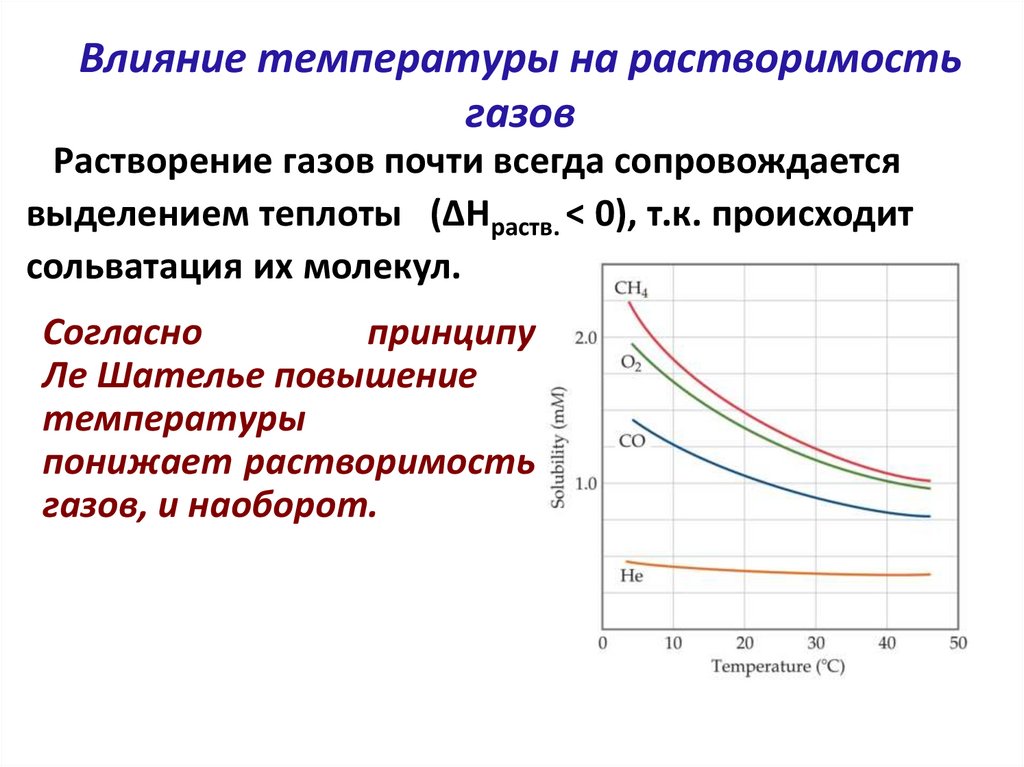
Влияние температуры на растворимостьгазов
Растворение газов почти всегда сопровождается
выделением теплоты (ΔHраств. < 0), т.к. происходит
сольватация их молекул.
Согласно
принципу
Ле Шателье повышение
температуры
понижает растворимость
газов, и наоборот.
40.
Влияние давления на растворимость газовнизкое P
высокое P
низкая c
высокая c
Т.к. при растворении
газов в жидкости
объём
системы
уменьшается
(ΔV < 0), увеличение
давления повышает
растворимость газов,
и наоборот.
41.
Законом Генри (1803 г.)(для малорастворимых газов)
Количество
газа,
растворенное
при
данной температуре в
определенном объеме
жидкости,
при
равновесии
прямо
пропорционально
давлению
газа
над
раствором.
William Henry
(1774-1836)
42.
Растворимость веществаМатематическое выражение закона Генри:
С(Х)=Кг·p(X), где:
С(Х) - концентрация газа Х в насыщенном растворе,
моль· дм-3;
Кг - константа Генри, моль· дм -3 ·Па-1, зависит от
природы газа, растворителя и температуры;
p(Х) - давление газа X над раствором, Па.
43.
Закон Д. ДальтонаJohn Dalton
(1766 -1844)
При растворении в жидкости
смеси газов растворимость
каждого
из
них
пропорциональна
его
парциальному давлению.
Парциальным давлением называется часть общего
давления, которая приходится на долю каждого газа
в газовой смеси, т. е. общее давление газовой смеси
складывается из суммы парциальных давлений
газов, входящих в состав данной смеси.
Pобщее= P1+ P2+ P3+…+
P
44.
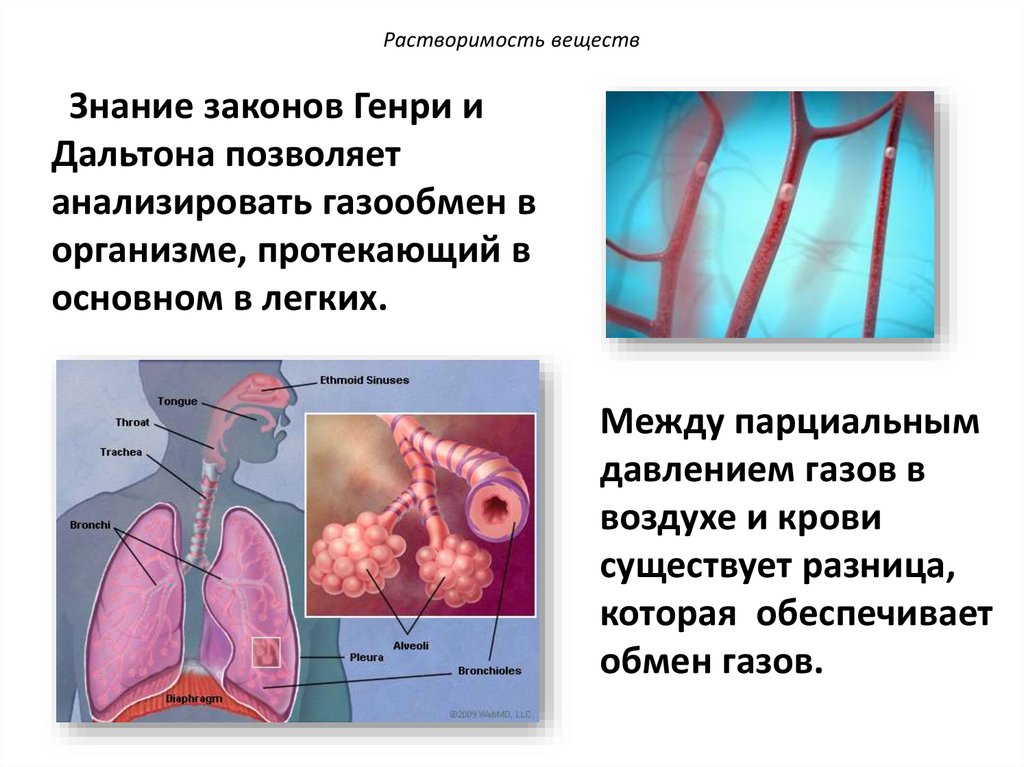
Растворимость веществЗнание законов Генри и
Дальтона позволяет
анализировать газообмен в
организме, протекающий в
основном в легких.
Между парциальным
давлением газов в
воздухе и крови
существует разница,
которая обеспечивает
обмен газов.
45.
Растворимость веществЗаконы
ГенриДальтона позволяют
объяснить патологию
организма, связанную
с работой человека
либо
в
условиях
высокогорья
(40005000 м над уровнем
моря),
либо на
больших глубинах под
водой (≈ 40 м под
водой).
46.
Растворимость веществВ первом случае развивается
горная болезнь в
следствие гипоксии, т.к. на больших высотах
парциальное
давление
кислорода
в
воздухе
уменьшается, а вместе с этим уменьшается и его
содержание в крови.
47.
Растворимость веществВо
втором
случае
наблюдается
декомпрессионная
или
кессонная
болезнь.
На
глубине ≈ 40 м под водой
резко повышается давление
вдыхаемой газовой смеси,
поэтому растворимость газов
в
крови
увеличивается.
Например,
растворимость
азота повышается от 4 до 9
раз.
48.
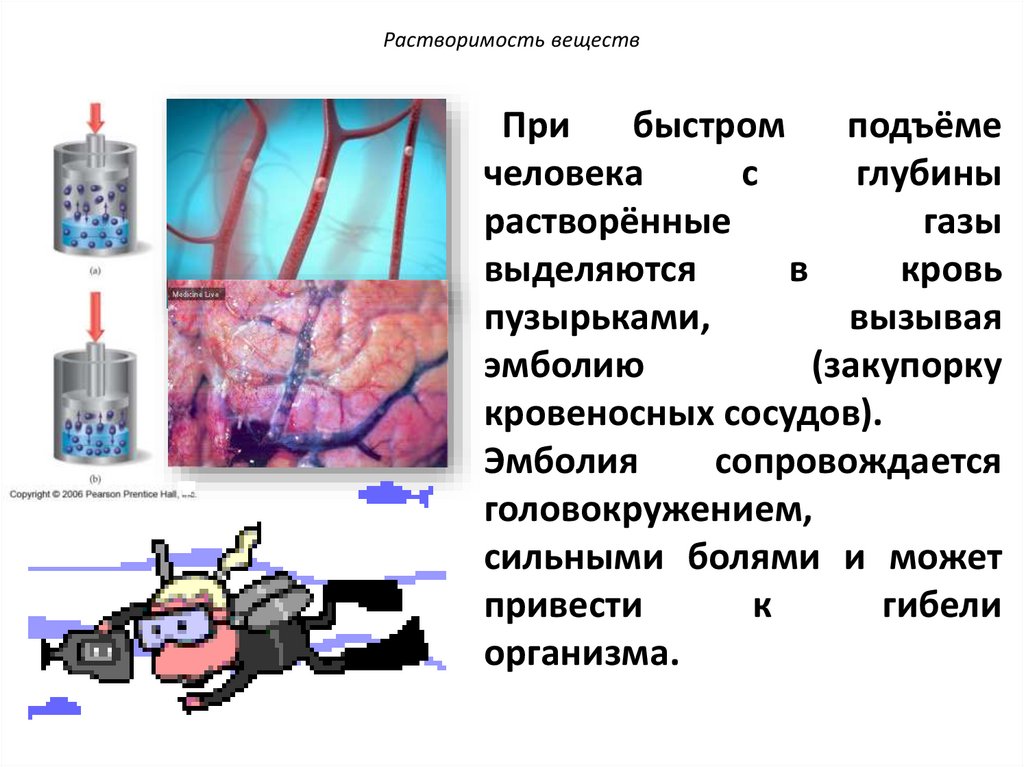
Растворимость веществПри
быстром
подъёме
человека
с
глубины
растворённые
газы
выделяются
в
кровь
пузырьками,
вызывая
эмболию
(закупорку
кровеносных сосудов).
Эмболия
сопровождается
головокружением,
сильными болями и может
привести
к
гибели
организма.
49.
Растворимость веществОксигенобаротерапию применяют для лечения
кессонной болезни, некоторых видов анемии,
газовой гангрены и других заболеваний.
50.
3. Влияние электролитов нарастворимость газов
Закон И.М. Сеченова
Растворимость газов в
растворах
электролитов
меньше, чем в чистых
растворителях.
И.М. Сеченов,
1829-1905
51.
Растворимость веществМатематическое выражение закона Сеченова:
C ( X ) C0 ( X ) e
K c CЭ
,
С(Х) - растворимость газа Х в растворе электролита,
моль ·дм-3;
С0(Х) - растворимость газа Х в чистом растворителе,
моль ·дм-3;
е - основание натурального логарифма (е=2,7183);
Кс - константа Сеченова , зависит от природы газа,
электролита и температуры;
Сэ - концентрация электролита, моль ·дм-3.
52.
Растворимость веществВ крови, желудочном содержимом,
моче
и
других
физиологических
жидкостях
содержаться
такие
электролиты, как NaCl, NaHCO3, NaH2PO4,
KCl, CaCl2 и др. Благодаря присутствию
электролитов, растворенные газы – O2,
CO2, N2 и др. – легко удаляются из
физиологических жидкостей, что имеет
огромное значение в процессах дыхания и
обмена веществ.
53.
СПАСИБО ЗАВАШЕ
ВНИМАНИЕ!




































 Химия
Химия








