Похожие презентации:
Кинетическое химическое равновесие
1. Кинетическое химическое равновесие
12.
Все химические реакции можно классифицировать кака.необратимые
б. обратимые
Необратимые реакции протекают до конца – до
полного израсходования одного из реагирующих веществ
(протекают в одном направлении).
Обратимые реакции— реакции, протекающие
одновременно
в
двух
противоположных
направлениях
(прямом
и
обратном)
при
одинаковых условиях, например:
3H2 + N2 ↔ 2 NH3
1 k1 C ( H 2 ) C ( N 2 )
3
2 k 2 C ( NH 3 )
2
2
3.
Когда скорости прямой и обратной реакций становятсяодинаковыми, наступает химическое равновесие.
1 2
k1 [ H 2 ] [ N 2 ] =
3
NH 3
k1
k 2 H 2 3 N 2
2
k 2 [NH 3 ]2
k1
NH 3
K p Kp
;
3
k2
H 2 N 2
2
Зная константу равновесия реакции, можно рассчитать
равновесный состав реагирующей смеси, предельный выход
продуктов, определить направление протекания реакции.
3
4.
При Kp >> 1 выход реакции велик.При K<< 1 выход реакции мал.
Величина константы равновесия зависит от:
а. Природы реагирующих веществ
б. температуры
Если известны значения двух констант равновесия
(K1 и K2) при температурах Т1 и Т2 , то из уравнения
K1 H T2 T1
ln
K2
R T2 T1
можно рассчитать тепловой эффект химической
реакции
4
5.
Константа равновесия НЕ ЗАВИСИТ от:а. концентрации
б. катализатора
Смещение равновесия подчиняется принципу Ле
Шателье — Брауна (1884 г.):
если на систему, находящуюся в устойчивом
равновесии,
воздействовать
извне,
изменяя
какое-либо из условий равновесия (температура,
давление,
концентрация),
то
в
системе
усиливаются
процессы,
направленные
на
компенсацию внешнего воздействия.
Влияние температуры.
Влияние температуры зависит от знака теплового
эффекта реакции. При повышении температуры
химическое равновесие смещается в направлении
эндотермической
реакции
при
понижении
температуры — в направлении экзотермической
5
реакции.
6.
Влияние давления.При повышении давления равновесие сдвигается в
направлении, в котором уменьшается суммарное
количество молей газов и наоборот.
Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется
следующим правилам:
при повышении концентрации одного из исходных веществ
равновесие
сдвигается в направлении образования продуктов
реакции;
при повышении концентрации одного из продуктов реакции
равновесие cдвигается в направлении образования исходных веществ.
6
7.
Стандартное изменение энергии Гиббса реакции связано с константойравновесия реакции уравнением:
G RT ln K p
G 2,3RT lg K p
Это уравнение называют уравнением изотермы химической
реакции. Оно позволяет рассчитать изменение энергии Гиббса при
протекании процесса и определить направление протекания
реакции:
Если Кр > 1, то ∆G < 0 – реакция идёт в прямом
направлении, слева направо;
Если Кр = 1, то ∆G = 0 – реакция достигла
равновесного состояния;
Если Кр < 1, то ∆G > 0 – реакция идёт в обратном
направлении.
7
8. РАСТВОРЫ СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ И ЭЛЕКТРОЛИТОВ
89.
Растворы – гомогенные системы, состоящие какминимум из двух компонентов (растворенное вещество и
растворитель), соотношения которых могут меняться в
широких пределах и продуктов их взаимодействия.
Повсеместность растворов объясняется тем что процесс растворения
самопроизволен , т.е. сопровождается уменьшением ∆G.
Различают истинные и коллоидные растворы.
По агрегатному состоянию растворы бывают:
газообразные ( воздух);
жидкие ( растворы различных солей и газов воде);
твердые (раствор водорода в платине, воды в
цеолитах); многие металлические сплавы из-за их
однородности
относятся
к
твердым
растворам.
Например, латунь (Zn в Cu).
9
10.
Процессрастворения
не
является
просто
механическим распределением одного вещества в
другом, а характеризуется разрушением растворенного
вещества
с
последующим
взаимодействием
растворенных частиц с растворителем.
C позиции термодинамики вещество может растворяться в
жидкости самопроизвольно при Р,Т =const, если в результате
этого процесса энергия Гиббса уменьшается, т.е. ΔGраств < 0.
Изменение энергии Гиббса в процессе растворения вещества равно:
G раств H раств T S раств
Количество
теплоты,
поглощающейся
или
выделяющейся при растворении 1 моль вещества,
называется теплотой растворения.
10
10
11.
В процессе растворения вещества в воде энтальпия системыможет как увеличиваться (ΔHраств > 0, эндотермический
процесс), так и уменьшаться (ΔHраств < 0, экзотермический
процесс).
Изменение энтальпии системы при растворении вещества
складывается из двух факторов: изменение ее в результате
разрушения структуры вещества (ΔHструкт.) (фазовый переход) и
за счет сольватации его частиц растворителем (ΔHсольв.)
H раств H структ H сольв
Процесс
сольватации
молекул
или
ионов
всегда
экзотермический (ΔHсольв.< 0), т.к. сопровождается образованием
связей.
Процесс
разрушения
структуры
эндотермический (ΔH структ. >0).
вещества
–
11
12.
Прирастворении
твердых
веществ
с
молекулярной
кристаллической
решеткой
или
жидкостей,
где
межмолекулярные связи не очень прочные, обычно
│ΔH структ. │< │ΔHсольв │.
Поэтому
растворение
таких
веществ
экзотермическим
процессом (ΔHраств < 0).
является
Растворение твердых веществ с │ионной кристаллической решеткой
может быть:
- экзотермическим процессом когда │ΔHструкт.│ < │ΔHсольв│
-эндотермическим процессом, когда │ΔH структ│ > │ΔHсольв │
При растворении газов ΔHструкт = 0, поэтому процесс растворения почти
всегда экзотермический.
12
13.
Влияние энтропийного фактора на процессрастворения.
При растворении жидких и твердых веществ
обычно происходит их переход из более
упорядоченного
в
менее
упорядоченное
состояние, т.е. энтропия системы возрастает
(∆Sраств >0).
Следовательно, энтропийный фактор, особенно при
повышенных температурах, будет способствовать
растворению.
Растворы,
в
процессе
образования
которых
тепловые и объемные эффекты отсутствуют,
называются идеальными растворами.
13
14.
Растворимость – способность вещества растворяться втом или ином растворителе.
Мерой растворимости вещества при данных условиях является
концентрация его насыщенного раствора.
Насыщенный раствор – раствор, находящийся в равновесии с
растворяющимся веществом (∆G=0).
Зависимость растворимости от температуры.
Растворимость большинства твердых веществ в
воде сопровождается поглощением теплоты.
Поэтому, как правило, с увеличением температуры
растворимость твердых веществ увеличивается.
14
15.
Растворимость газов в водеэкзотермический процесс.
представляет
Поэтому
растворимость
газов
температуры уменьшается
с
собой
повышением
Особенности воды:
1.Обладает аномально высокой теплоемкостью (75.3
Дж/моль К) и большой теплотой испарения (40,8
кДж/моль), что обеспечивает термостатирование
нашего организма.
2.Необычно высока диэлектрическая проницаемость
воды
(ε=78,5) способствует растворению солей,
кислот, оснований и их диссоциации на ионы.
Вода – самый распространенный и универсальный
растворитель. Она проявляет как протонодонорные и
протоноакцепторные свойства, так и электронодонорные
и электроноакцепторные свойства. Вода – амфолит:
2H2O ↔ H3O+ + –OH
15
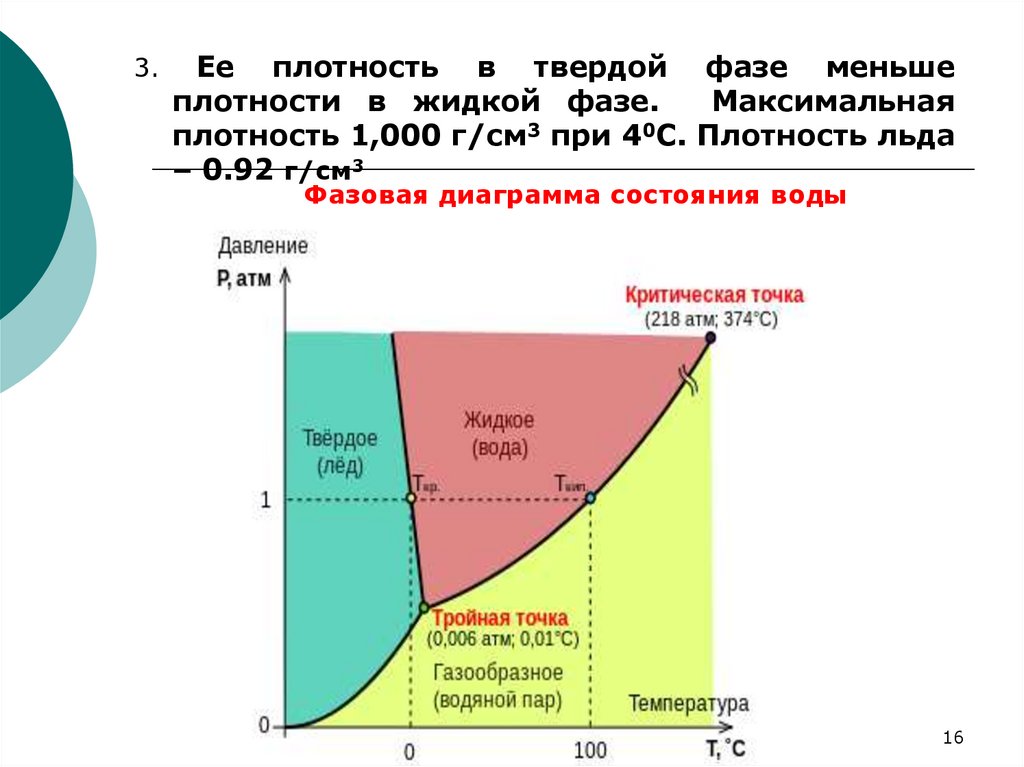
16.
3.Ее плотность в твердой фазе меньше
плотности в жидкой фазе.
Максимальная
плотность 1,000 г/см3 при 40С. Плотность льда
– 0.92 г/см3
Фазовая диаграмма состояния воды
16















 Химия
Химия








