Похожие презентации:
Серосодержащие кислоты
1.
Вычислите массу соли, полученной при взаимодействии 95 г оксида натрияс раствором серной кислоты, содержащим 140 г вещества.
2. Серосодержащие кислоты
3.
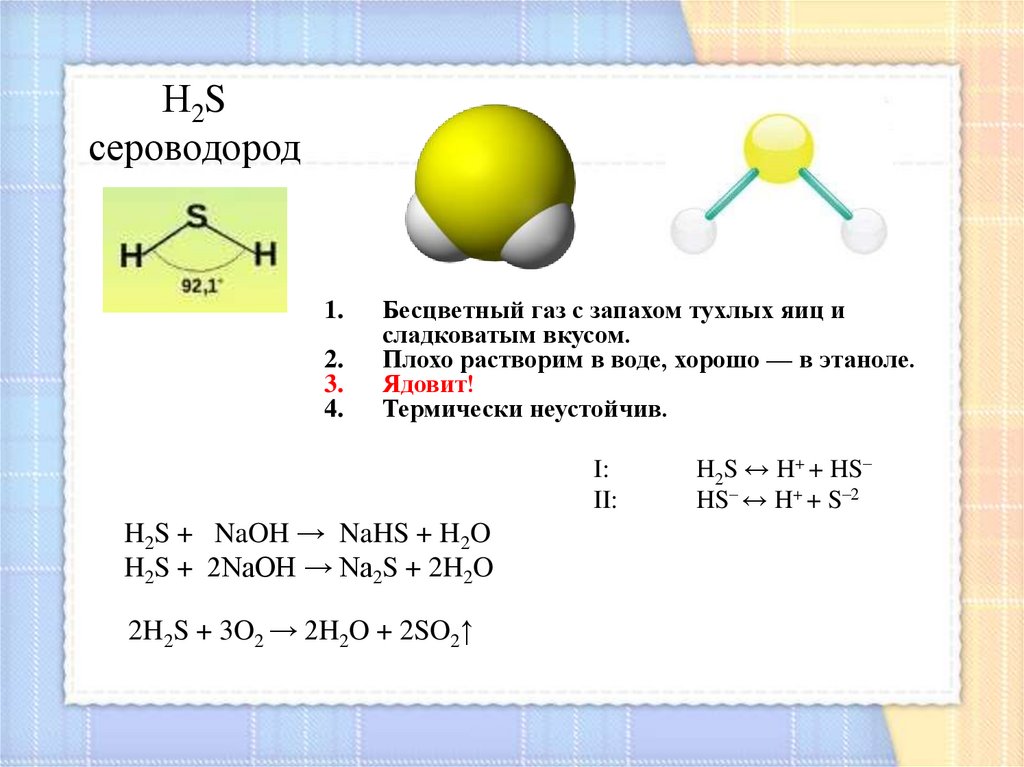
Н2Sсероводород
1.
2.
3.
4.
Бесцветный газ с запахом тухлых яиц и
сладковатым вкусом.
Плохо растворим в воде, хорошо — в этаноле.
Ядовит!
Термически неустойчив.
I:
II:
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
2H2S + 3O2 → 2H2O + 2SO2↑
H2S ↔ H+ + HS–
HS– ↔ H+ + S–2
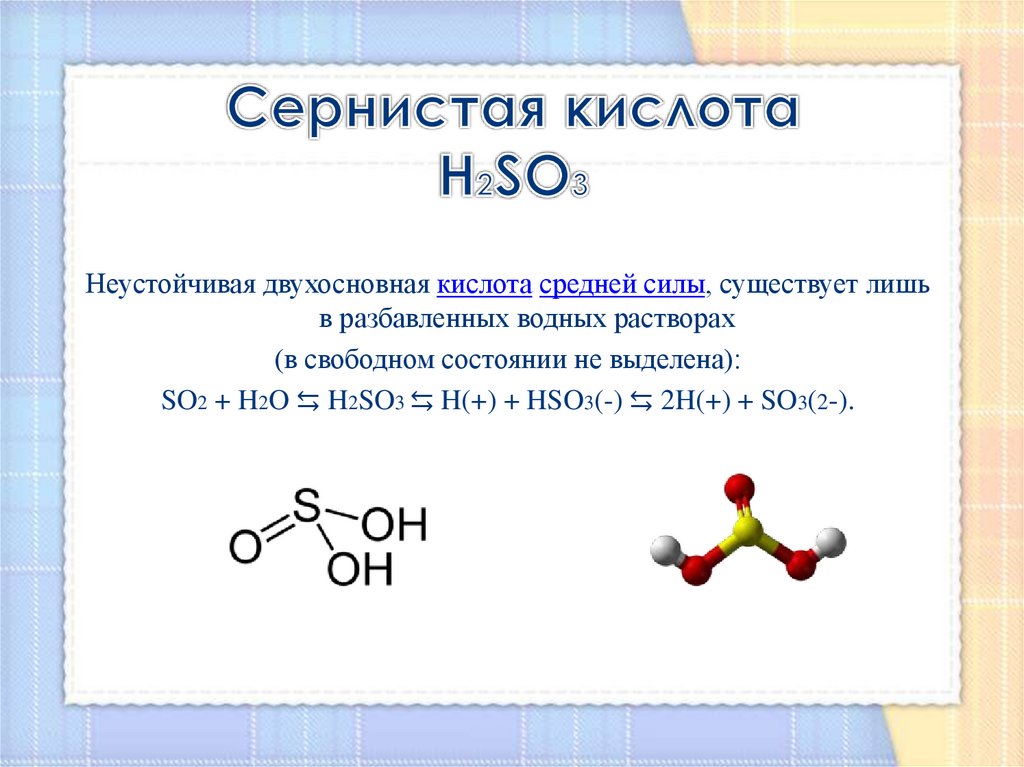
4. Сернистая кислота H2SO3
Неустойчивая двухосновная кислота средней силы, существует лишьв разбавленных водных растворах
(в свободном состоянии не выделена):
SO2 + H2O ⇆ H2SO3 ⇆ H(+) + HSO3(-) ⇆ 2H(+) + SO3(2-).
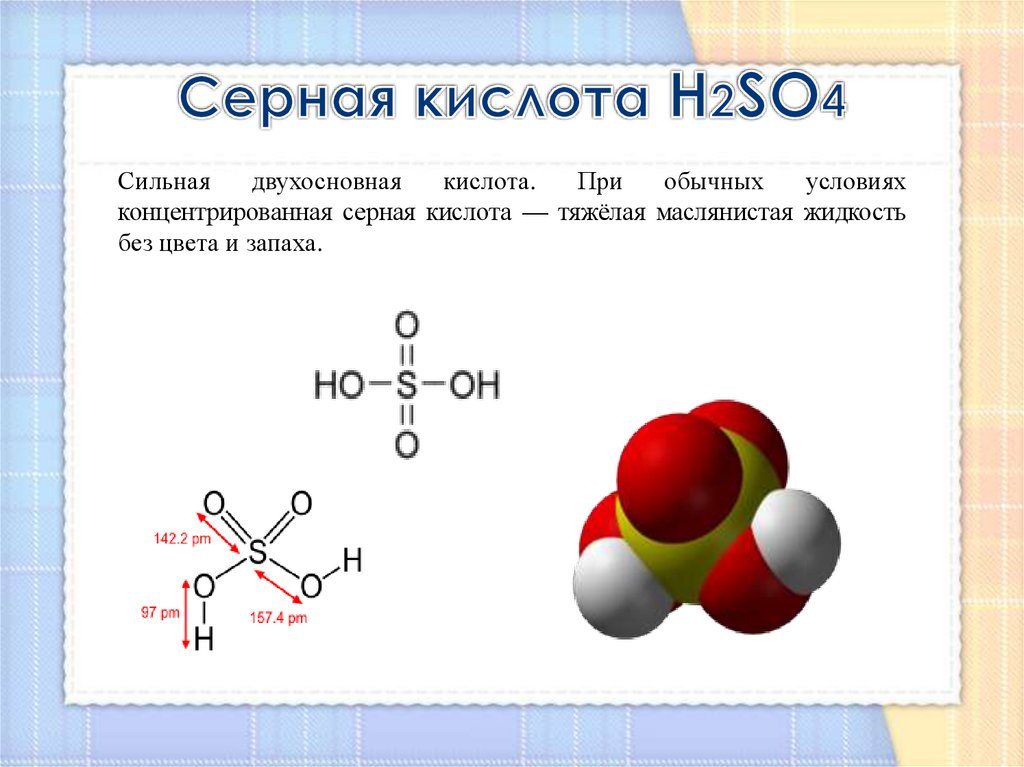
5. Серная кислота Н2SO4
Сильнаядвухосновная
кислота.
При
обычных
условиях
концентрированная серная кислота — тяжёлая маслянистая жидкость
без цвета и запаха.
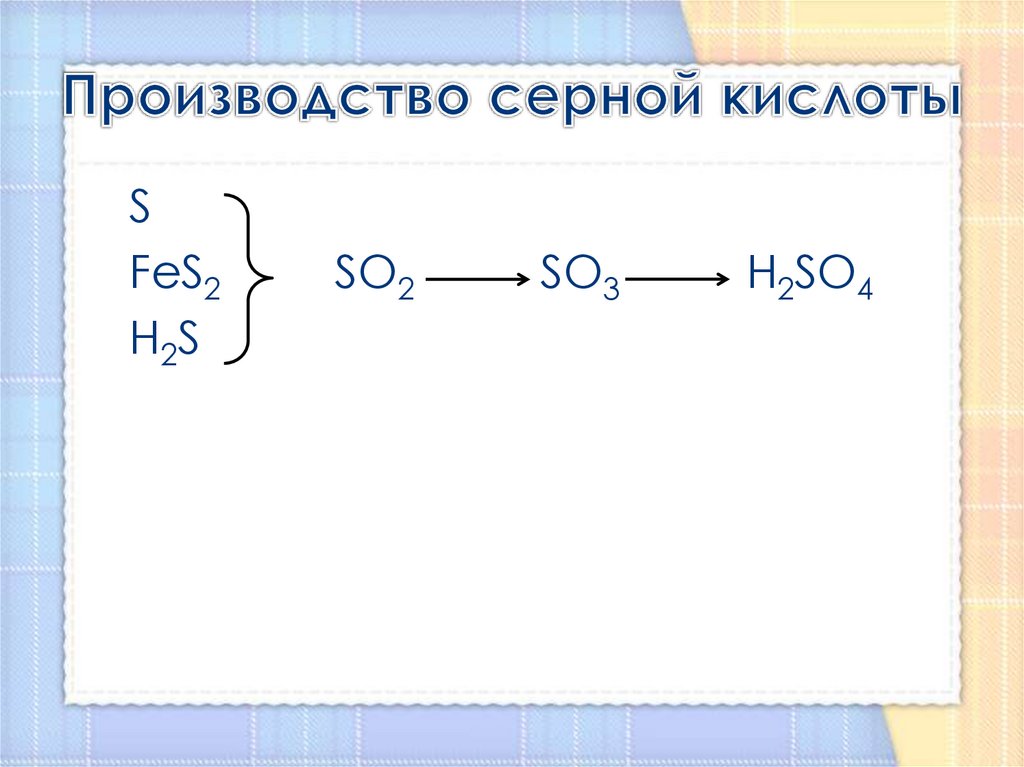
6. Производство серной кислоты
SFeS2
H2S
SO2
SO3
H2SO4
7. Химические свойства
Сернистая кислотаСерная кислота
8. К 50 г хлорида бария прилили раствор серной кислоты. Вычислите массу образовавшегося осадка, если выход продукта реакции
составил 80%.9. Домашнее задание
Решите задачи:1) Вычислите массу соли, полученной при взаимодействии
оксида цинка с раствором серной кислоты массой вещества
40г, если выход продукта реакции составил 75,8%.
2) Какая масса соли образуется, если для реакции раствора
серной кислоты потребуется карбонат магния массой 16,8 г ?
Выход продукта реакции составил 92%.





 Химия
Химия








