Похожие презентации:
Серная кислота H2SO4
1.
СЕРНАЯКИСЛОТА
Лицей при КТУ имени Исхака Раззакова
Презентация к уроку химии
Карпенко Наталья Анатольевна
2.
Серная кислота H2SO4 —сильная двухосновная кислота,
отвечающая высшей степени
окисления серы (+6). При
обычных условиях
концентрированная серная
кислота — тяжёлая
маслянистая жидкость без цвета
и запаха, с кислым «медным»
вкусом.
3.
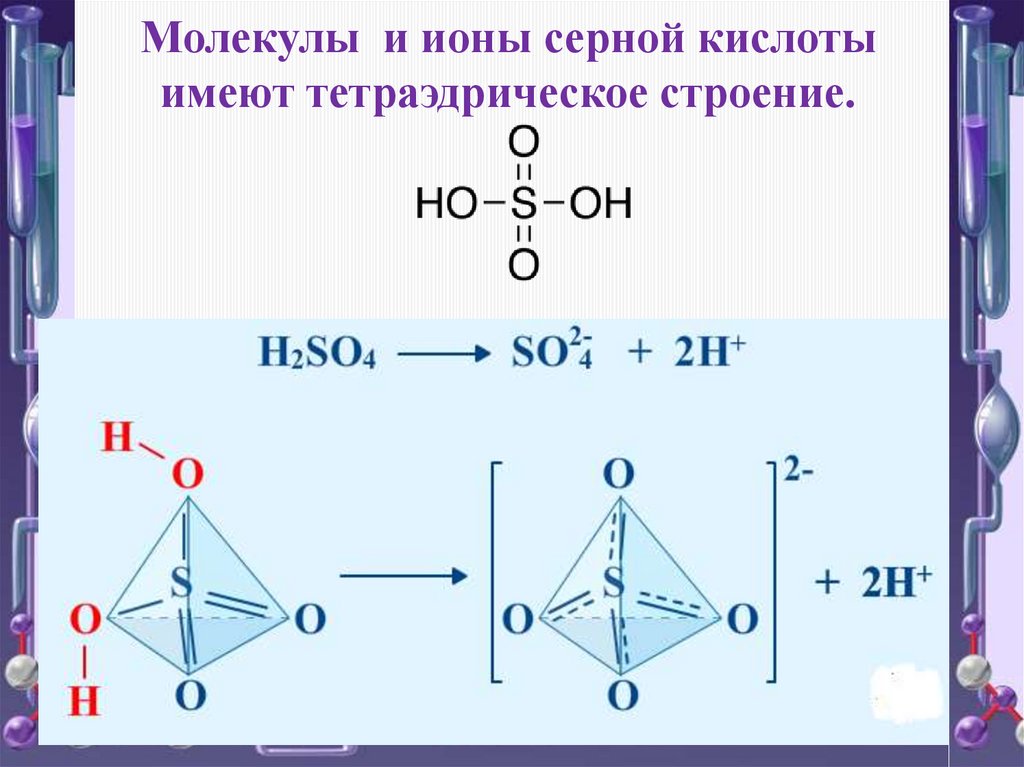
Молекулы и ионы серной кислотыимеют тетраэдрическое строение.
4.
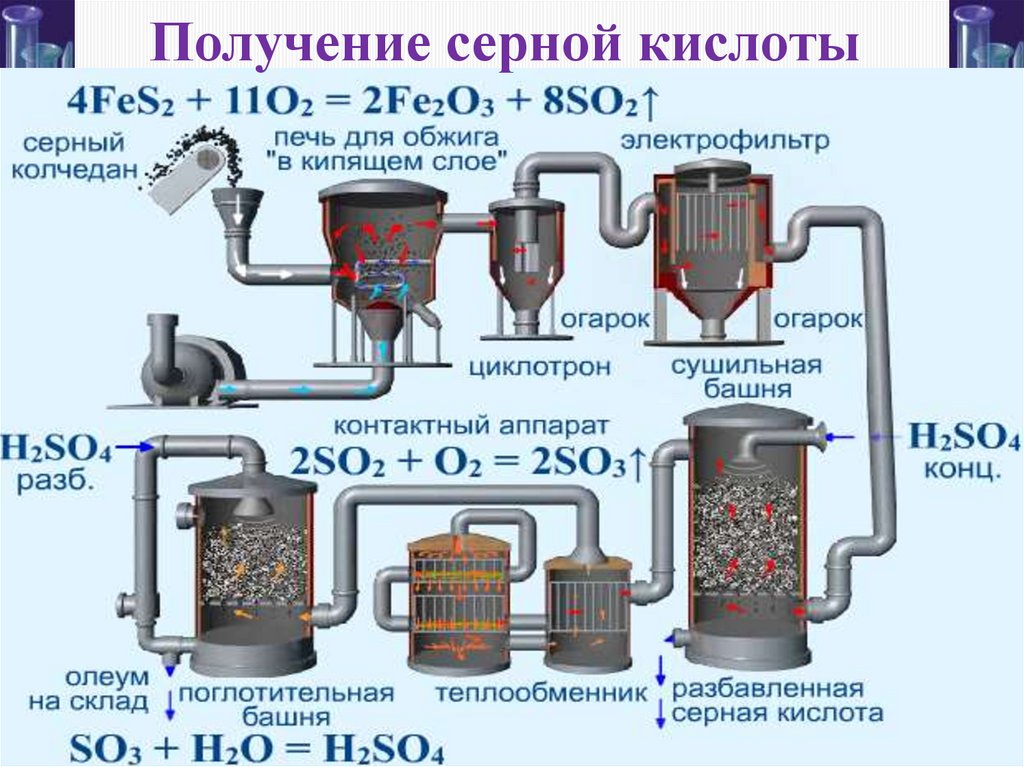
Получение серной кислотыFeS2
S
H2S
SO2 → SO3 → H2SO4
Пирит
Серный колчедан
5.
Получение серной кислоты6.
7.
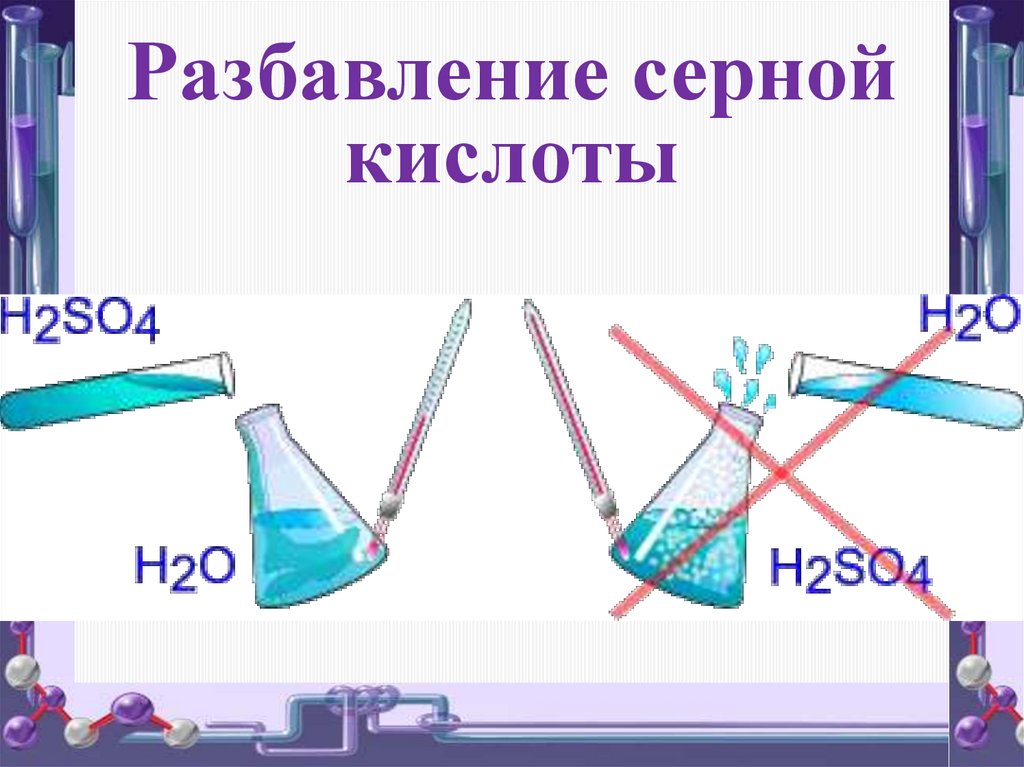
Разбавление сернойкислоты
8.
Химические свойстваразбавленной серной
кислоты
9.
1. Диссоциация:H2SO4 ↔ H+ + HSO4HSO4- ↔ H+ + SO42-
10.
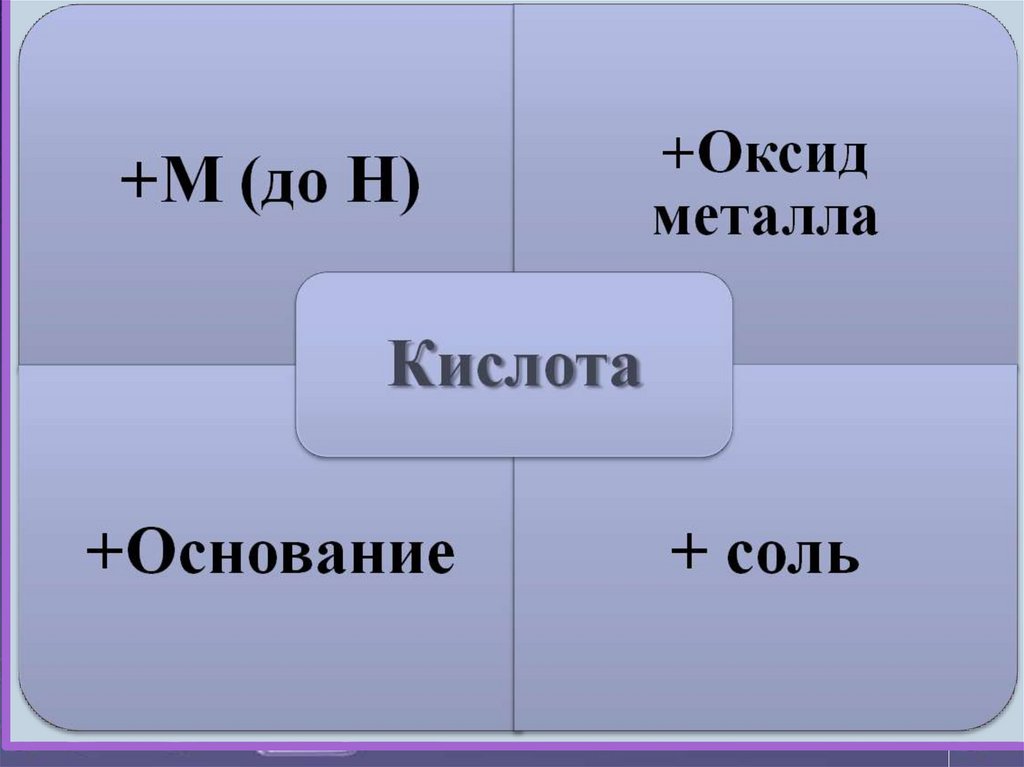
2. Взаимодействие с металлами( до Н )
Zn + H2SO4 → ZnSO4 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
Cu + H2SO4 →
11.
3. Взаимодействие с оcновными иамфотерными оксидами
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+ + H2O
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2H+ → Zn2+ + H2O
12.
4. Взаимодействие с основаниямии амфотерными гидроксидами
2NaOH + H2SO4 → Na2SO4 +2 H2O
H+ + ОН- → H2O
NaOH + H2SO4 → NaHSO4 +H2O
Кислая соль
гидросульфат натрия
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Zn(OH)2 + 2H+ → Zn2+ +2H2O
13.
5.Взаимодействие с солямиH2SO4+BaCI2 = BaSO4 ↓ + 2HCI
Ba2++SO42- = BaSO4 ↓
K2CO3 + H2SO4 = K2SO4 + CO2↑+ Н2O
2H++ CO32- = CO2 ↑+ H2O
14.
Качественная реакцияH2SO4+BaCI2 = BaSO4 ↓ + 2HCI
Ba2+ + SO42- = BaSO4↓
15.
Серная кислотавытесняет более летучие
кислоты
NaCI + H2SO4 → NaHSO4 + HCI
16.
Химическиесвойства
концентрированной
серной кислоты
17.
Органические веществаобугливаются !!!
C12H22O11
(сахароза)
→
12С
(уголь)
+ H2O
18.
1. Концентрированная сернаякислота окисляет неметаллы
неМе + H2SO4(конц.) = H2O + SO2 +
кислородсодержащая кислота неМе,
C + 2H2SO4 = 2H2O + CO2 + 2SO2
S + 2H2SO4 = 3SO2 + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
19.
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co
→Ni→Sn→Pb→H →
→Sb→Cu→Hg→Ag→Pd→Pt→Au
20.
2. Концентрированная сернаякислота окисляет металлы
Концентрированная H2SO4 –
сильный окислитель; Реагирует с
металлами.
При взаимодействии с металлами
Au, Pt, Рd не реагирует.
Пассивирует алюминий, железо,
хром. Но при нагревании реагирует
и с ними.
21.
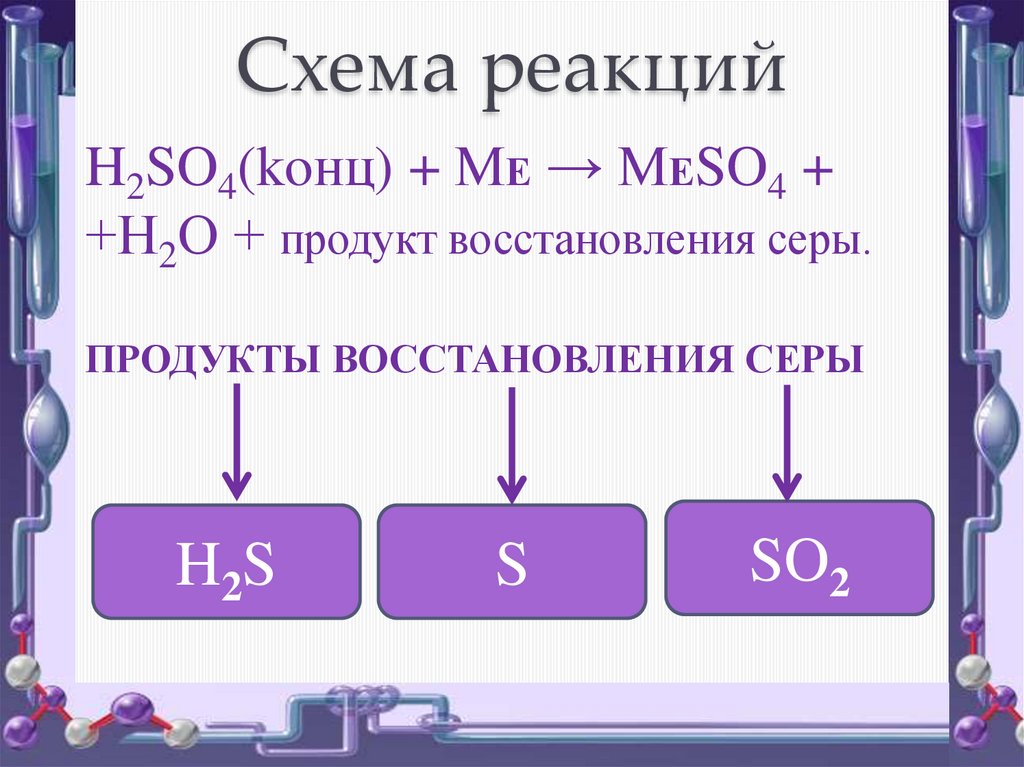
Схема реакцийH2SO4(koнц) + МЕ → МЕSO4 +
+Н2О + продукт восстановления серы.
ПРОДУКТЫ ВОССТАНОВЛЕНИЯ СЕРЫ
H2S
S
SO2
22.
H2SO4(koнц) + МЕ → МЕSO4 + Н2О+
H2S
Активные металлы (до алюминия
включительно) восстанавливают
серную кислоту до сероводорода.,
С алюминием реакция протекает
только при нагревании.
23.
H2SO4(koнц) + МЕ → МЕSO4 +Н2О +
S
Металлы, расположенные в ряду
напряжений от алюминия до
железа - до свободной серы.,
24.
Правее железаМеталлы с меньшей активностью
- до сернистого газа.
H2SO4(koнц) + МЕ → МЕSO4 +
Н2О +
SO2
25.
Задание1. Вычислите объём газа (н.у.), который
образуется при взаимодействии 15% ного раствора серной кислоты массой
900 г с цинком?
2. Вычислите объём газа (н.у.), который
образуется при взаимодействии
концентрированной серной кислоты
массой 900 г с оловом?
26.
Без нагревания не реагируюттакже Fe, Al, Cr - пассивируются
Пассива́ция мета́ллов — переход
поверхности металла в
неактивное, пассивное состояние,
связанное с образованием тонких
поверхностных слоёв соединений,
препятствующих коррозии или
приводящих к созданию оксидной
плёнки.
27.
Домашнее задание1. Выучить лекцию
2. Составить кластер
«Применение серной кислоты»
3. Написать и защитить
реферат на тему:
«Получение серной кислоты»
28.
Упражнения• Страница 31 упражнения 1-4
• Задачи 1, 2 страница 32























 Химия
Химия








