Похожие презентации:
Кислород, его характеристика, получение и свойства
1.
В чем горят дрова и газ,Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без …
2.
«Кислород – это та ось, вокругкоторой вращается химия»
А.Берцелиус
3.
План урока1. Нахождение кислорода в природе.
2. История открытия кислорода.
3. Кислород, как элемент
4. Озон как простое вещество
5. Свойства кислорода.
6. Получение кислорода в лаборатории.
7. Применение кислорода.
8. Домашнее задание
4.
1. Нахождение кислородав природе
5.
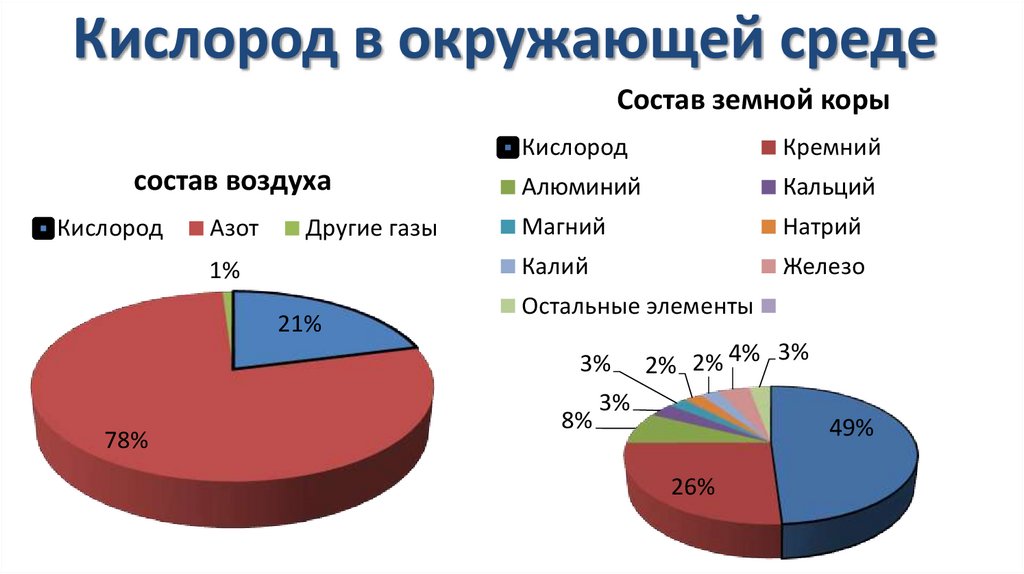
Кислород в окружающей средеСостав земной коры
состав воздуха
Кислород
Азот
Другие газы
1%
21%
78%
Кислород
Кремний
Алюминий
Кальций
Магний
Натрий
Калий
Железо
Остальные элементы
3% 2% 2% 4% 3%
3%
8%
49%
26%
6.
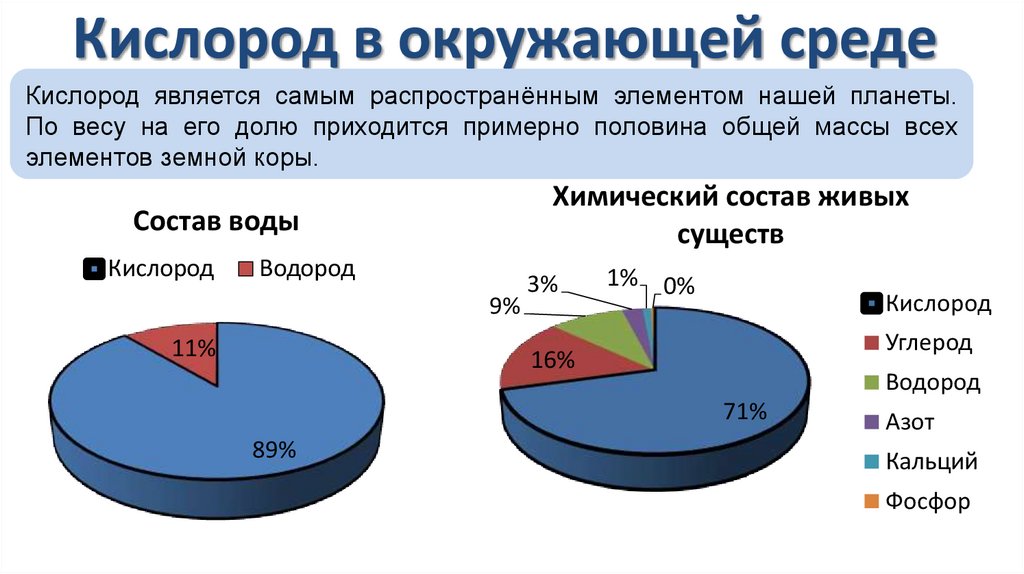
Кислород в окружающей средеКислород является самым распространённым элементом нашей планеты.
По весу на его долю приходится примерно половина общей массы всех
элементов земной коры.
Химический состав живых
существ
Состав воды
Кислород
Водород
9%
11%
3%
1% 0%
Кислород
Углерод
16%
Водород
71%
89%
Азот
Кальций
Фосфор
7.
2. История открытиякислорода.
8.
Английский ученый.В 1774 году разложением
oксида ртути ( II )
получил кислород и
изучил его свойства
2HgO = 2Hg + O2↑р. разложения
1733 - 1804
9.
С целью проверки опытов Шееле и Пристлив 1774 году получил кислород, установил его
природу и изучил его способность соединяться
с фосфором и серой при горении и металлами
при обжиге. Изучил состав атмосферного воздуха.
Создал кислородную теорию горения. Совместно с
Ж. Менье установил сложный состав воды и получил
воду из кислорода и водорода.
2H2 + O2 = 2H2O р. соединения
Лавуазье показал, что процесс дыхания
подобен процессу горения.
1743 - 1794
Название кислороду Oxygenium дал А. Лавуазье
10.
Голландский алхимик и технолог. Получил кислородпримерно за 150 лет до Пристли при нагревании
нитрата калия: 2КNO3 = 2KNO2 + O2 ↑ р. разлож.
Его открытие было засекречено, т.к. использование
полученного газа предполагалось для дыхания
людей на подводных лодках
1572 - 1633
11.
3. Кислород, какэлемент
12.
Кислород как элемент.1.
В какой группе, подгруппе и периоде
находится элемент кислород?
2.
Какой он имеет порядковый номер?
3.
Какая атомная масса кислорода?
4.
Какая валентность?
5.
В состав каких веществ
и соединений входит кислород?
13.
Кислород как элемент.1.
2.
3.
Элемент кислород находится в VI группе, главной
подгруппе, II периоде, порядковый номер №8, Ar(O) = 16.
валентность II
Входит в состав оксидов, оснований, солей, кислот,
органических веществ, в том числе живых организмовдо 65% по массе.
14.
Аллотропная модификация кислорода Озон O3Озон образуется в воздухе во время грозы и при окислении смолы хвойных деревьев.
В верхних слоях атмосферы образование озона происходит под действием
ультрафиолетового излучения Солнца.
Физические свойства озона: газ голубоватого цвета с запахом свежести
Рис. 1. Молния
15.
В больших концентрациях озон опасен для многих живых организмов. Он
губительно действует на бактерии, поэтому находит применение для
обеззараживания воздуха и питьевой воды.
В воздушной оболочке Земли на высоте 25–30 км существует озоновый слой.
Содержащийся в нём озон образуется из кислорода под действием
солнечного излучения. Озоновый экран защищает все живые организмы,
обитающие на Земле, от разрушительного действия ультрафиолетовых
лучей. Если бы не было озонового слоя, то жизнь на Земле была бы
невозможна.
16.
4. Свойства кислорода.17.
Физические свойстваГаз - без цвета, вкуса и запаха; в 100V H2O растворяется 3V O2 (н.у.);
При давлении 760 мм. рт.ст. и температуре
–183 С кислород сжижается
3
2
Сосуд Дьюара
18.
Химические свойстваВзаимодействие веществ с кислородом называется окислением.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar.
С неметаллами
C + O2 CO2 р. соед.
S + O2 SO2 р. соед.
2H2 + O2 2H2O р. соед.
Со сложными веществами
4FeS2 + 11O2 2Fe2O3 + 8SO2 р. горения
2H2S + 3O2 2SO2 + 2H2O р. горения
CH4 + 2O2 CO2 + 2H2Oр. горения
С металлами
2Mg + O2 2MgO р. соед.
2Cu + O2 –t 2CuO р. соед.
19.
5. Получениекислорода в
лаборатории.
20.
Способы получения кислорода1) разложение перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2↑
21.
2) разложение пероксида водорода2H2O2 = 2H2O + O2↑
Катализаторы – это вещества, которые ускоряют ход химической реакции, но сами
при этом не расходуются.
Пример: MnO2 ускоряет процесс разложения перекиси водорода.
22.
3) разложение хлората калия2KClO3 = 2KCl + 3O2↑
4) разложение оксида ртути (II)
2HgO = 2Hg + O2↑
5)электролиз воды
2H2O = 2H2↑ + O2↑
23.
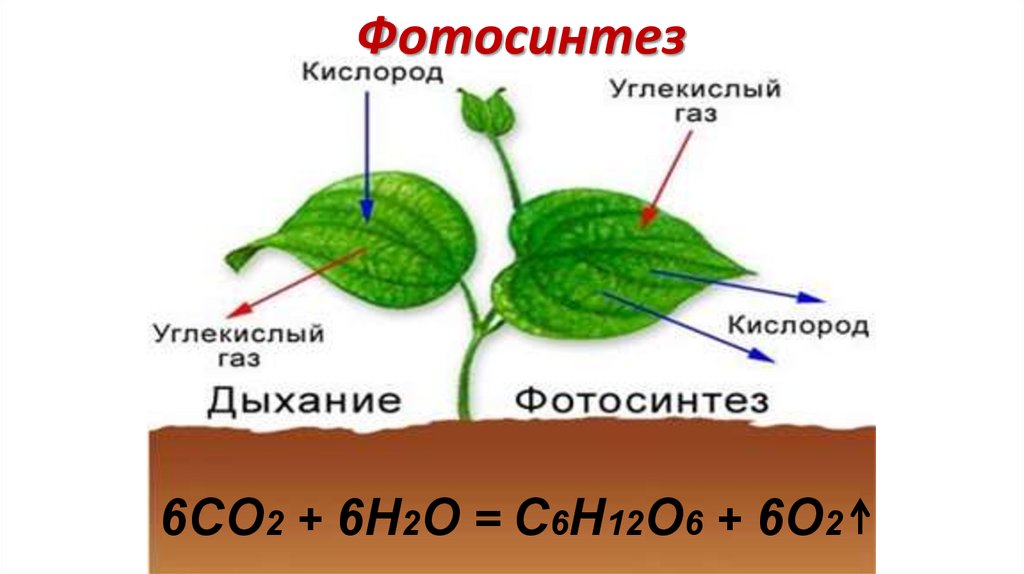
Фотосинтез6CO2 + 6H2O = C6H12O6 + 6O2
24.
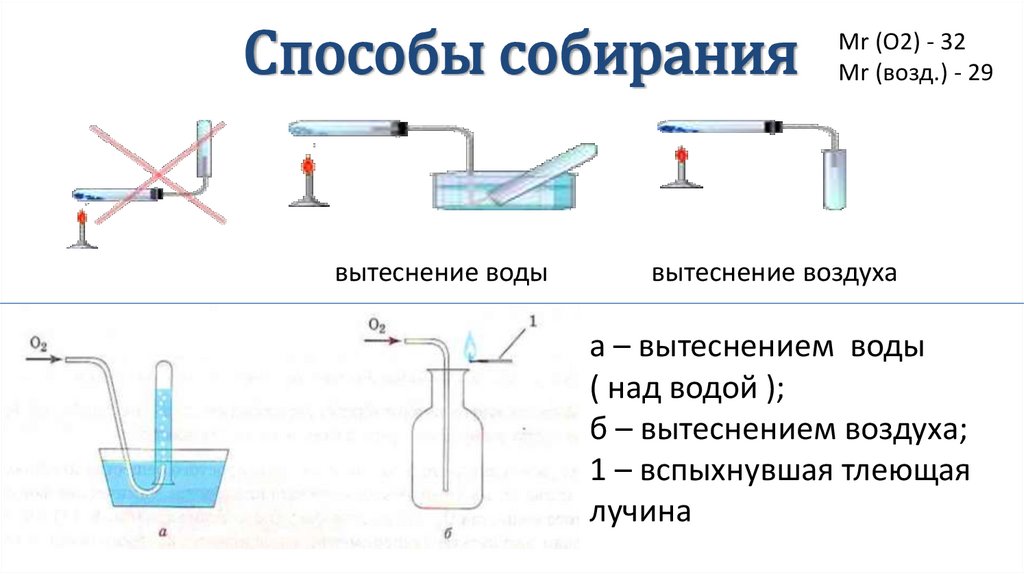
Способы собираниявытеснение воды
Mr (O2) - 32
Mr (возд.) - 29
вытеснение воздуха
а – вытеснением воды
( над водой );
б – вытеснением воздуха;
1 – вспыхнувшая тлеющая
лучина
25.
6. Применениекислорода.
26.
Применение кислорода:Металлургия
Химическая промышленность
Находит широкое применение в
медицине
Газовая сварка и резка металла, даже под
водой
Окислитель ракетного топлива
космических кораблей
Для жизнеобеспечения на орбитальных
станциях, подводных лодках,
авиационной технике
Горение рыхлого горючего материала,
пропитанного жидким кислородом,
сопровождается взрывом, что даёт
возможность применять кислород при
взрывных работах.
27.
Домашнее задание:параграф 13, записать
конспект презентации,
рис.47 в тетрадь, стр. 67
№6,7 письменно























 Химия
Химия








