Похожие презентации:
Электрохимические процессы
1.
ЭЛЕКТРОХИМИЧЕСКИЕПРОЦЕССЫ
1
2.
ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬРАСТВОРОВ
2
3.
Жизнедеятельность любых живых организмов обязательновключает
наряду
с
химическими
различные
электрохимические явления, которые лежат в основе
важнейших биохимических процессов:
• возникновения биопотенциалов и переноса вещества через
мембраны;
• передачи нервных импульсов;
• превращения химической энергии питательных веществ в
электрическую, которая используется для синтеза молекул
АТФ – аккумуляторов энергии в организме.
Электрохимия изучает свойства систем, содержащих
подвижные
ионы
(растворов,
расплавов,
твердых
электролитов) и явления, возникающие на границе раздела
фаз вследствие переноса заряженных частиц.
3
4.
Электрохимия рассматривает , с одной стороны , влияниеэлектрического поля на движение заряженных частиц и
протекание химических реакций в таких системах. В этом
случае электрическая энергия превращается в химическую.
С другой стороны – возникновение на границе раздела фаз
электрического поля в результате движения через нее
заряженных частиц или протекания на ней ОВР. В этом
случае химическая энергия переходит в электрическую.
Для организма важную роль играет перемещение ионов в
электрическом поле , обуславливающее электрическую
проводимость растворов электролитов, биологических
жидкостей и тканей организма.
4
5.
Электропроводность растворов электролитовЭЛЕКТРОПРОВОДНОСТЬ - это способность растворов
электролитов проводить электрический ток за счет
движения ионов, на которые распадается электролит при
диссоциации.
+ и - - скорость движения катиона и аниона (приведены в
справочниках).
Скорость направленного движения ионов, т.е.
путь, пройденный ионами в растворе под действием
электрического поля в направлении к электроду за
единицу времени,
зависит от напряженности
электрического поля:
E u
-скорость движения ионов;
Е- напряженность поля, В/м;
u – коэффициент напряженности, называемый электрической проводимостью
иона или просто подвижностью иона, м2/(В . с)
5
6.
Подвижность иона характеризует его способностьпреодолевать сопротивление среды при направленном
движении в электрическом поле.
Рассмотрим факторы, влияющие на подвижность
иона в водном растворе при наличии электрического
поля.
1. Заряд и радиус иона, т.е. его природа.
Влияние этих характеристик взаимосвязано. Чем
больше заряд
и чем меньше радиус иона, тем
сильнее гидратируется ион, тем толще его гидратная
оболочка и, следовательно, тем ниже подвижность
иона в растворе.
6
7.
2. Природы растворителя, его диэлектрическаяпроницаемость и вязкость.
Чем полярнее
растворитель, тем лучше сольватируется ион, тем
больше
размеры
гидратированного
иона
и,
следовательно, меньше его подвижность.
Чем больше вязкость растворителя, тем меньше
подвижность иона.
3. Температура раствора растворителя. При
повышении
температуры
уменьшаются
вязкость
растворителя и толщина сольватных оболочек ионов,
снижается межионное взаимодействие. Все это
приводит к увеличению подвижности ионов.
4. Ионная сила раствора. Чем больше ионная сила
раствора, тем сильнее межионное электростатическое
взаимодействие, тем меньше подвижность ионов.
7
8.
5. Концентрация ионов. Чем выше концентрацияионов в растворе, тем сильнее электростатическое
взаимодействие ионов что понижает их подвижность.
Концентрация ионов зависит от силы электролита и
его количества в растворе. При разбавлении растворов
сильных электролитов подвижность ионов растет.
В растворах слабых электролитов
подвижность
ионов практически не зависит от разбавления.
Для характеристики свойств ионов
используются
значения предельной электрической подвижности
ионов (uo) в данном растворителе при данной
температуре.
8
9.
Предельной подвижностью иона (uo , м2/(В . с)называется средняя скорость его направленного
движения,
приобретаемая
им
в
бесконечно
разбавленном растворе в однородном электрическом
поле напряженностью 1 В/м
Предельная подвижность иона в данном растворителе
зависит только от природы иона и температуры. У
большинства ионов предельные подвижности очень
малы: 3-8 .10-8 м2/(В . с).
Значительно больше подвижность ионов Н+ и ОН-.
Для них характерен «эстафетный» механизм перемещения.
9
10.
Под действием электрического поля ион гидроксонияпередает протон по водородной связи молекуле воды
ближайшего ассоциата. В результате ассоциат приобретает
избыточный положительный заряд, который он передает
соседнему ассоциату, отдавая протон от ближайшей к нему
молекулы воды вдоль линий электрического поля.
_
H
+
-H+
O
H
H
+
H
+
H
(H2O)n
-H+
(H2O)n
H
-H+
...
H
+
O
H
Т.о., за счет перескока протона от ассоциата к ассоциату по
водородной связи происходит быстрое перемещение иона
гидроксония к отрицательному полюсу.
10
11.
Аналогично происходит перемещение ОН- в водной среде кположительному полюсу путем отщепления им протона от
молекулы воды ближайшего ассоциата.
Однако подвижность ОН- меньше, чем иона Н3О+ , т.к.
протон в ионе гидроксония связан менее прочно, чем в
молекуле воды.
В неводных растворителях эти ионы не имеют аномально
большие скорости движения.
Количественной характеристикой способности раствора
проводить ток служит электрическая проводимость.
Электрическая проводимость (G) – физическая величина,
обратная электрическому сопротивлению проводника: G =
1/R
11
12.
Единицей электрической проводимости в СИ является сименс(См), 1См = 1 Ом-1 .
Электрическое сопротивление однородного проводника
прямо пропорционально его длине (l) и обратно
пропорционально площади поперечного сечения (s):
характеризующее
l ρ = удельное сопротивление,
природу проводника ( Ом . м).
R
s
Отсюда
s
1 s
s
G
l l
l
χ – удельная электрическая проводимость, См/м;
s – площадь плоских электродов, между которыми
заключен раствор, м2 ;
l – расстояние между электродами, м.
12
13.
Удельнаяэлектрическая
проводимость
(æ)
характеризует
свойства проводящей среды –
раствора электролита.
это электрическая проводимость столбика раствора,
помещенного
между
двумя
электродами,
расположенными на расстоянии 1 м, и площадью 1 м2 ,
æ æ 1м3 раствора.
т.е.это электрическая проводимость
Удельная электрическая проводимость
раствора
электролита равна количеству электричества, переносимому
содержащимися в нем ионами через поперечное сечение
раствора площадью 1 м2 в однородном электрическом поле
напряженностью 1В/м за 1 секунду.
В аналитической практике УЭП часто выражается в
См/см; 1 См/см = 102 См/м
13
14.
Факторы, влияющие на величину удельной электрическойпроводимости.
1. природа электролита
связана с разной скоростью
движения ионов и степенью диссоциации. С увеличением
подвижности (υ) ионов, УЭП .
2. природа растворителя влияет на скорость движения
ионов, что связано с вязкостью растворителя и его
сольватирующей
способностью
(диэлектрической
проницаемостью).
3. температура: с повышением температуры вязкость
растворителя уменьшается, а подвижность ионов
увеличивается и, следовательно, УЭП .
4. концентрация
14
15.
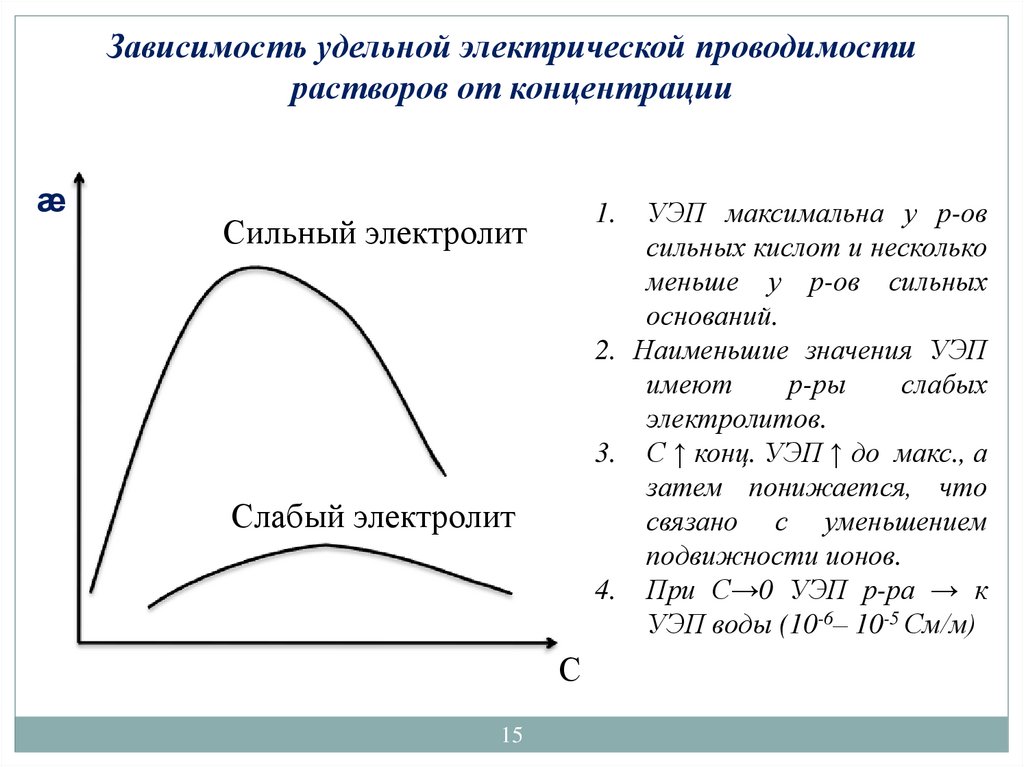
Зависимость удельной электрической проводимостирастворов от концентрации
æ
УЭП максимальна у р-ов
сильных кислот и несколько
меньше у р-ов сильных
оснований.
2. Наименьшие значения УЭП
имеют
р-ры
слабых
электролитов.
3. С ↑ конц. УЭП ↑ до макс., а
затем понижается, что
связано с уменьшением
подвижности ионов.
4. При С→0 УЭП р-ра → к
УЭП воды (10-6– 10-5 См/м)
1.
Сильный электролит
Слабый электролит
С
15
16.
Для объяснения процессов, происходящих в растворах, вместоУЭП
часто
используют
молярную
электрическую
проводность ( )
- удельная электрическая проводимость раствора электролита
с концентрацией (С’) 1 моль/м3 .
Между УЭП и МЭП существует соотношение:
C
'
Cм м 2
моль
Поскольку в аналитической практике молярная концентрация
(C) моль/л (1л = 103моль/м3), то
1000 C
16
17.
0Величина МЭП четко зависит от концентрации. Для
любого электролита при разбавлении раствора (при С→0)
МЭП увеличивается до постоянной и специфической для
каждого электролита величине, которая называется
0
предельной молярной электрической проводимостью,
ПМЭП
называется значение МЭП его бесконечно
разбавленного раствора.
МЭП при данном разбавлении всегда меньше значения
ПМЭП.
Отношение МЭП к ПМЭП характеризует:
для слабого электролита – степень его
диссоциации при данной концентрации
раствора;
17
0
18.
для сильного электролита – коэффициент электрическойпроводимости при данной концентрации (fэл ), который
характеризует межионые и ион-дипольные взаимодействия в
растворе.
ЗАКОН НЕЗАВИСИМОГО ДВИЖЕНИЯ ИОНОВ
В РАЗБАВЛЕННЫХ РАСТВОРАХ
(ЗАКОН КОЛЬРАУША)
При бесконечном разбавлении каждый вид ионов,
присутствующих в растворе, переносит электричество
независимо от других ионов и вносит в суммарную
электрическую проводимость раствора определенный вклад,
пропорционально заряду, подвижности и концентрации
ионов.
В соответствии с этим вводится понятие о предельной
молярной электрической проводимости ионов – катионов и
анионов.
18
19.
ПМЭП иона называется количество электричества,переносимое 1 моль ионов данного вида в бесконечно
разбавленном растворе в однородном электрическом поле
напряженностью 1 В/м через поперечное сечение
раствора площадью 1 м2 за 1 секунду.
ПМЭП иона рассчитывают по формуле:
0
,
где:
u
F
0
,
u
0
,
zF u
0
,
z96500
- предельная подвижность иона м2/(В . с)
- число Фарадея (96500 Кл/моль)
Значения ПМЭП ионов позволяют рассчитать ПМЭП
данного электролита на основании закона Кольрауша.
19
20.
Предельная молярная электрическая проводимостьданного раствора электролита равна сумме предельных
молярных проводимостей ионов, входящих в его состав.
В
общем
виде
для
диссоциирующего по схеме
электролита
тип
m
n
Kt n Anm nKt
mAn
Закон Кольрауша записывается
0 ( Ktn Anm ) n 0 ( Kt m ) m 0 ( An n )
( Kt ) и ( An ) - ПИЭП катиона и аниона.
0
m
0
n
20
KtnAnm
21.
На основе экспериментально определенной величины МЭП ( )для исследуемого раствора и величины ПМЭП
0
( ), вычисленной для соответствующего электролита по закону
Кольрауша, можно рассчитать:
1. Степень диссоциации слабого электролита в растворе
0
2. Константу его диссоциации
С 2
2
Kд
С ( 0 ) /(1 0 )
1
21
22.
Зависимость электрической проводимости от природыэлектролита и его концентрации позволяет использовать это
свойство для:
а. изучения поведения электролитов в растворах;
б. исследования механизмов реакций, протекающих с
участием электролитов;
в. количественного определения ряда веществ.
Введение электродов в анализируемые системы позволяет
вести непрерывный контроль за ходом многих процессов, в
том числе и биохимических.
Метод
анализа,
основанный
на
определении
электрической проводимости жидких сред, называют
КОНДУКТОМЕТРИЕЙ.
22
23.
Кондуктометрия является одним из наиболее точныхметодов
определения
констант
диссоциации
физиологически важных слабых электролитов,
изоэлектрических точек аминокислот, пептидов и белков.
Кондуктометрия применяется, например,
для
определения
суммарного
содержания
электролитов в различных биологических средах (в
плазме и сыворотке крови, желудочном соке, моче,
тканевой жидкости),
- для контроля качества минеральных вод и
различных напитков,
- чистоты фармацевтических препаратов,
- степени очистки воды, ионитов и т.п.
23
24.
- для изучения проницаемости биологическихмембран,
- для сравнения объема клеток и межклеточного
пространства, например объема эритроцитов в крови.
В
основе
кондуктометрии
лежит
измерение
электрического сопротивления исследуемых объектов.
Во всех случаях сопротивление образца сравнивается со
стандартной величиной, отклонение позволяет судить о
качестве продукта.
24
25.
Преимущества КД-метрии:• определение как в прозрачных, так и в
окрашенных или мутных растворах, а также в
присутствии окислителей и восстановителей;
• определение разнообразных органических и
неорганических веществ;
• возможность анализа концентрированных и
разбавленных растворов;
• исследование водных, неводных и смешанных
растворов;
• использование разнообразных типов реакций;
• легкая автоматизация;
• простота и точность определения;
25
26.
Наиболее часто используют КД титрование.Линейная
зависимость
между
концентрацией
разбавленных
растворов
электролитов
и
их
электрической
проводимостью
дает
возможность
использовать
кондуктометрию
при
титровании
анализируемого раствора для определения
точки
эквивалентности.
Кондуктометрическое титрование
- титриметрический метод анализа, в котором точка
эквивалентности
определяется
по
изменению
электрической проводимости раствора в ходе титрования
26
27.
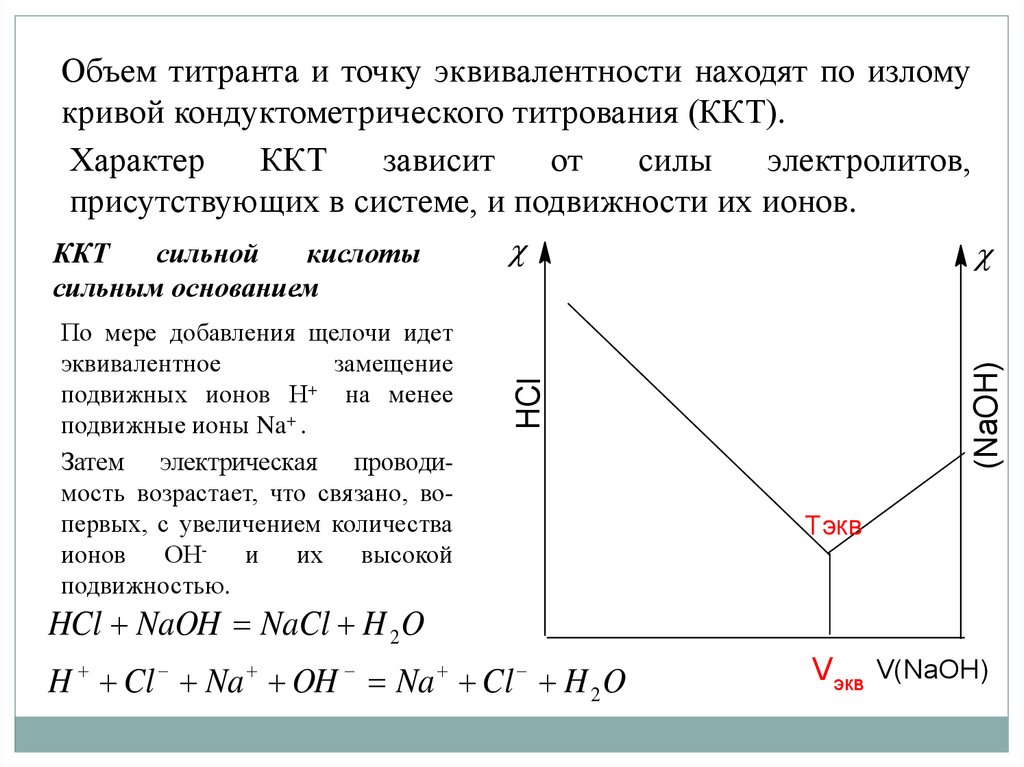
Объем титранта и точку эквивалентности находят по изломукривой кондуктометрического титрования (ККТ).
Характер
ККТ
зависит
от
силы
электролитов,
присутствующих в системе, и подвижности их ионов.
ККТ
сильной
кислоты
HCl
По мере добавления щелочи идет
эквивалентное
замещение
подвижных ионов Н+ на менее
подвижные ионы Na+ .
Затем электрическая проводимость возрастает, что связано, вопервых, с увеличением количества
ионов ОН- и их высокой
подвижностью.
(NaOH)
сильным основанием
Tэкв
HCl NaOH NaCl H 2 O
H Cl Na OH Na Cl H 2 O
Vэкв V(NaOH)
28.
сильнымДо Тэкв. электрическая проводимо-сть
возрастает, т.к. молекулы слабодиссоциирующей кислоты замеща-ются
эквивалентным количеством соли –
сильного электролита.
За т.экв. проводимость увеличива-ется
, но более резко, что объясняется
появлением избытка щелочи.
Tэкв
(NaOH)
кислоты
(CH3COOH)
ККТ слабой
основанием
Vэкв V(NaOH)
CH 3COOH NaOH CH 3COONa H 2 O
CH 3COOH Na OH CH 3COO Na H 2 O
28
29.
ККТ смеси кислот: сильной (HCl)и слабой (CH3COOH) раствором
сильного основания.
1. По мере добавления щелочи идет
эквивалентное замещение подвижных ионов
Н+ на менее подвижные ионы Na+.
2. Электропроводимость незначительно
повышается, т.к. кроме ионов соли NaCl в
растворе появляются ионы другой соли –
CH3COONa . В Тэкв две соли.
3.
Дальнейшее
добавление
титранта
приводит к появлению подвижных ионов
ОН- и электропроводимость увеличива-ется
1
3
Tэкв
Tэкв
2
Vэкв
1.
HCl NaOH NaCl H 2 O
2.
H Cl Na OH Na Cl H 2 O
CH 3COOH NaOH CH 3COONa H 2 O
Vэкв V(NaOH)
CH 3COOH Na OH CH 3COO Na H 2 O
30.
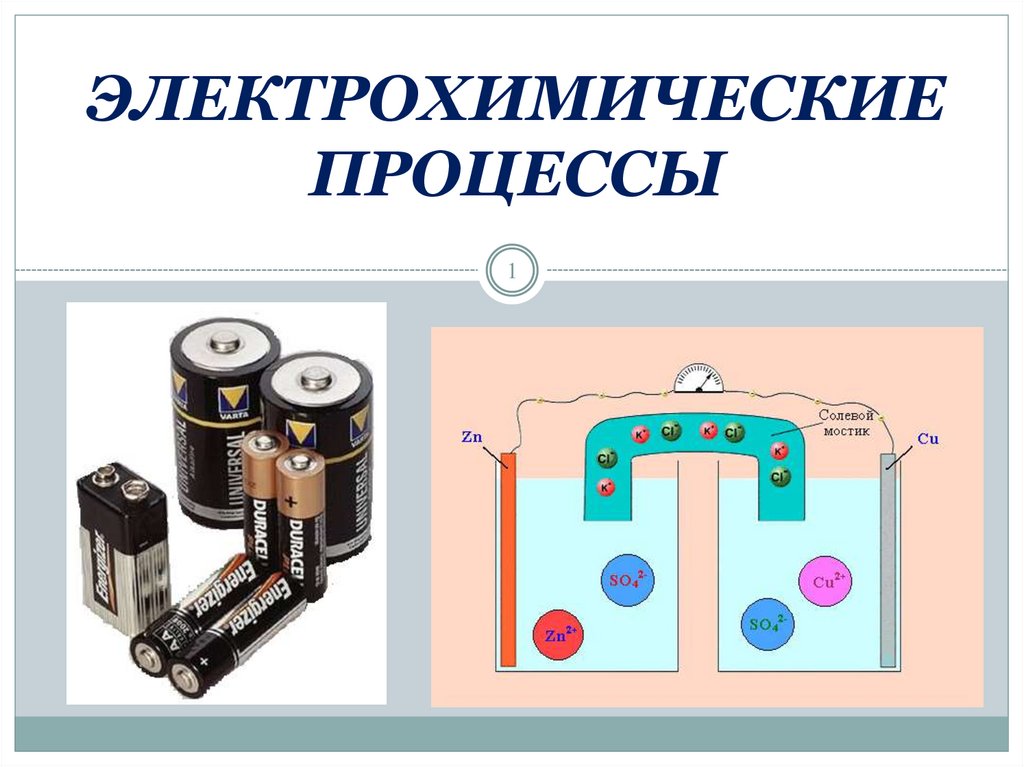
II. Химическиеисточники
тока
30
31.
Возникновение скачка потенциалана границе фаз
Двойной электрический слой на границах:
а) металл / металл;
б) металл / раствор;
31
в) раствор / раствор.
32.
Механизм возникновения электродныхпотенциалов
Ме0 - nē → Mеn+
Mеn+ + nē → Ме0
Ме
Zn2+
Zn2+
Zn2+
При погружении металла в
раствор, содержащий ионы этого
же металла, на поверхности
раздела фаз образуется двойной
электрический слой и возникает
скачок равновесного
потенциала, который называют
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
ДЭС
электродным
потенциалом.
Раствор
32
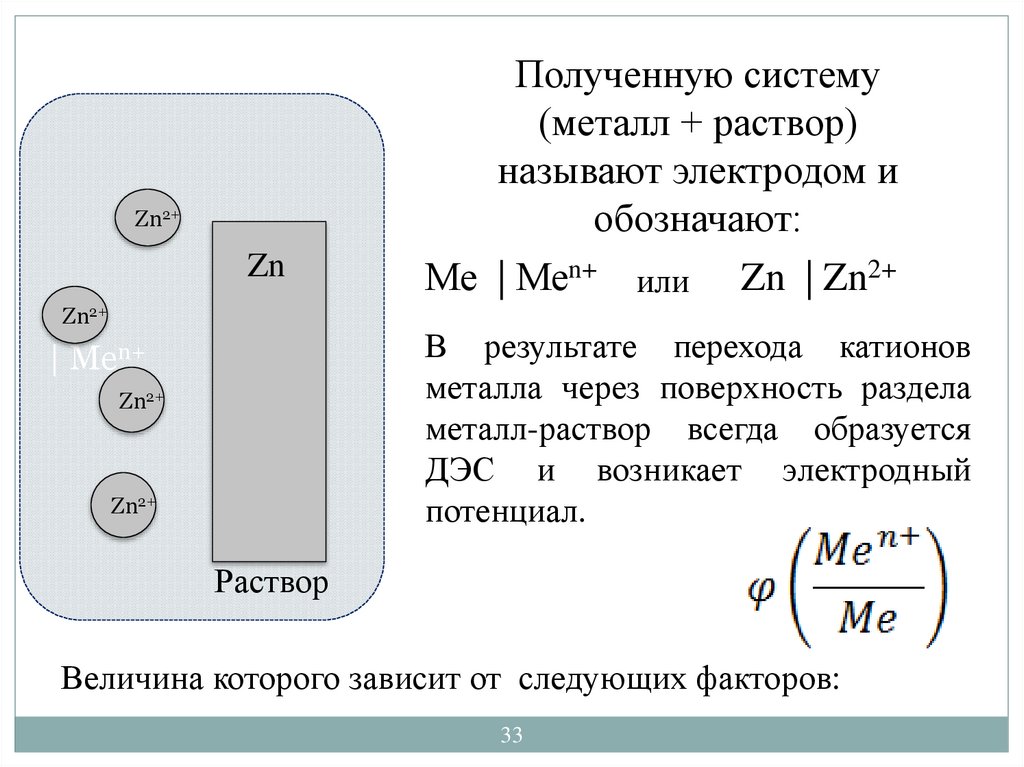
33.
Zn2+Zn
Zn2+
Полученную систему
(металл + раствор)
называют электродом и
обозначают:
Ме | Меn+ или Zn | Zn2+
В результате перехода катионов
металла через поверхность раздела
металл-раствор всегда образуется
ДЭС и возникает электродный
потенциал.
| Men+
Zn2+
Zn2+
Раствор
Величина которого зависит от следующих факторов:
33
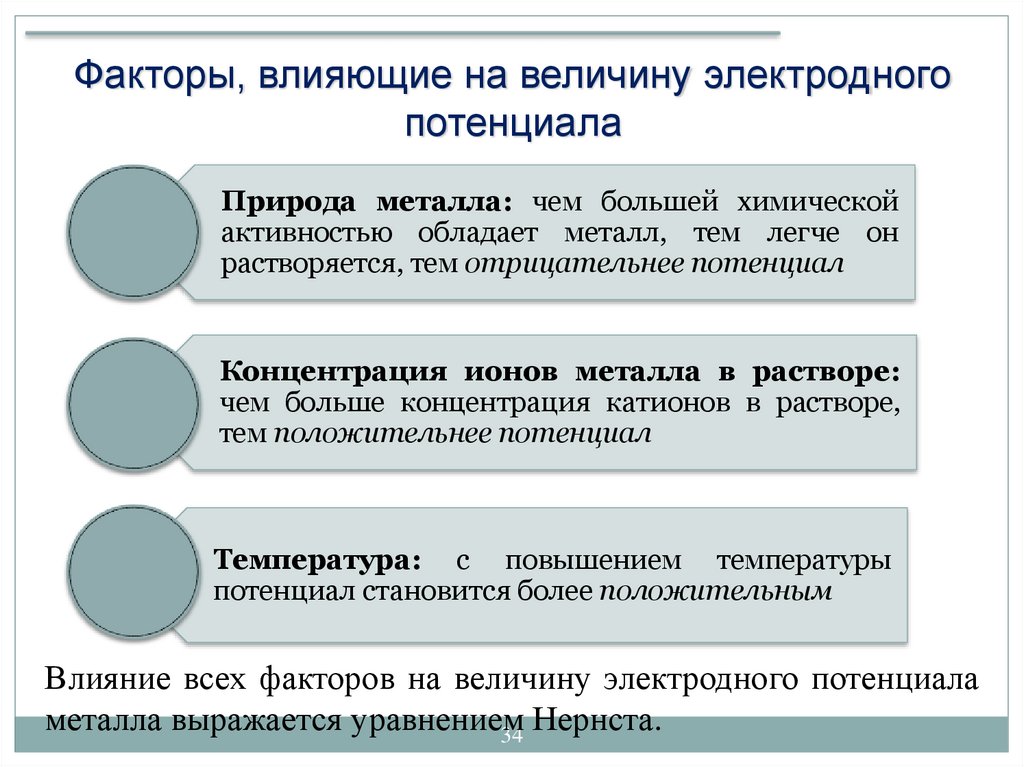
34.
Факторы, влияющие на величину электродногопотенциала
Природа металла: чем большей химической
активностью обладает металл, тем легче он
растворяется, тем отрицательнее потенциал
Концентрация ионов металла в растворе:
чем больше концентрация катионов в растворе,
тем положительнее потенциал
Температура: с повышением температуры
потенциал становится более положительным
Влияние всех факторов на величину электродного потенциала
металла выражается уравнением
Нернста.
34
35.
Уравнение НЕРНСТАRT
n n
ln aMen
Me |Me
Me |Me
nF
o
φ (Men+/Me) – электродный потенциал металла Me в растворе,
содержащем катионы Men+, Вольт
φo (Men+/ Me) – стандартный электродный потенциал, Вольт
R – универсальная газовая постоянная, Дж\моль∙К
Т – абсолютная температура, К
n – число электронов, участвующих в электродном процессе,
F – постоянная Фарадея,
a – активность ионов металла в растворе (для разбавленных растворов ее
заменяют на концентрацию с), моль/дм3
35
36.
Уравнение НЕРНСТАСтандартный электродный потенциал φº
- это
потенциал электрода, возникающий на границе раздела
металл-раствор при
активности всех потенциалопределяющих ионов в растворе 1 моль/л и температуре 298 К;
Абсолютное значение стандартного электродного потенциала
отдельно
взятого электрода измерить или рассчитать
невозможно, но можно определить его значение относительно
какого-либо другого электрода стандарт (эталон).
36
37.
Таким эталоном служит стандартный водородный электрод– платиновая пластинка, покрытая платиновой чернью и опущенная в
раствор серной кислоты, в которой активность ионов водорода равна
1 моль/л и через который все время пропускается чистый водород
под давлением 1 атм.
Условная запись электрода:
(Pt) H2 | 2H+ или (Pt) H2 | H2SO4
Токообразующая реакция:
2Н+ ↔ H2 - 2ē
aH 1
РH2 1атм
Потенциал
стандартного
водородного электрода условно
принят за нуль при любой
температуре.
37
38.
Уравнение Нернста для водородного электрода:=
Для определения электродного потенциала какого-либо
электрода
относительно стандартного водородного
составляют
гальваническую
цепь
из
двух
полуэлементов: исследуемого электрода и стандартного
водородного.
38
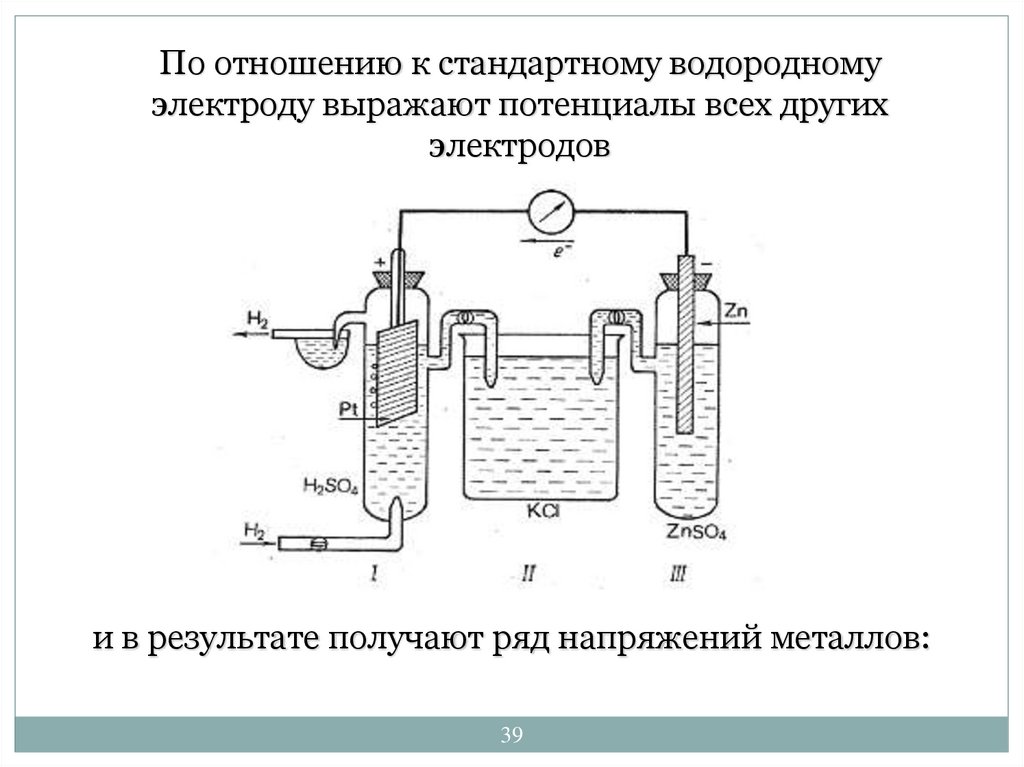
39.
По отношению к стандартному водородномуэлектроду выражают потенциалы всех других
электродов
и в результате получают ряд напряжений металлов:
39
40.
Электрохимический ряд напряжений металловАктивные
Средней активности
Благород
ные
Уменьшение химической активности металла
Увеличение потенциала
Усиление окислительных свойств
40
41.
Типыэлектродов
Электроды I рода
Электроды II рода
Окислительновосстановительные
электроды
41
42.
Электрод I родапредставляет собой металл, погруженный в
раствор соли, содержащей ионы этого же металла:
Zn
Условная запись:
Zn │ Zn2+
Электродная реакция:
Zn2++ 2ē ↔Zno
Уравнение Нернста:
ZnSO4
=
42
43.
Электрод II родасистема,
в
которой
металл
покрыт
слоем
труднорастворимой соли и погружен в раствор,
содержащий анионы этой соли: хлорсеребряный и
каломельный электроды.
Аg
AgCl
Хлорсеребряный и каломельный электроды
применяют в качестве электродов сравнения
при составлении различных гальванических
элементов.
Хлорсеребряный электрод
KCl
Условная запись:
Ag, AgCl│КCl или Ag, AgCl│Cl43
44.
представляет собой серебряную проволоку, покрытуюслоем AgCl, опущенную в насыщенный раствор KCl,
находящийся в сосуде с микрощелью для контакта с
исследуемым растворов
Электродная реакция:
AgCl↓+ ē ↔Ago + Cl• Уравнение Нернста:
Ag , AgCl / Cl
0
Ag , AgCl / Cl
0,059 lg C (Cl )
45.
В насыщенном растворе KCl при температуре 25оСпотенциал хлорсеребряного электрода φ = 0,22 В
Каломельный электрод:
Условная запись: (Pt)Hg,Hg2Cl2 | KCl или (Pt)Hg,Hg2Cl2| Cl• Электродная реакция : Hg2Cl2 + 2e → 2Hg + 2Cl-
Hg , Hg Cl / Cl
2
2
0
Hg , Hg 2Cl 2 / Cl
0,059 lg C (Cl )
В насыщенном растворе KCl при температуре 25оС
потенциал каломельного электрода φ = 0,242 В
45
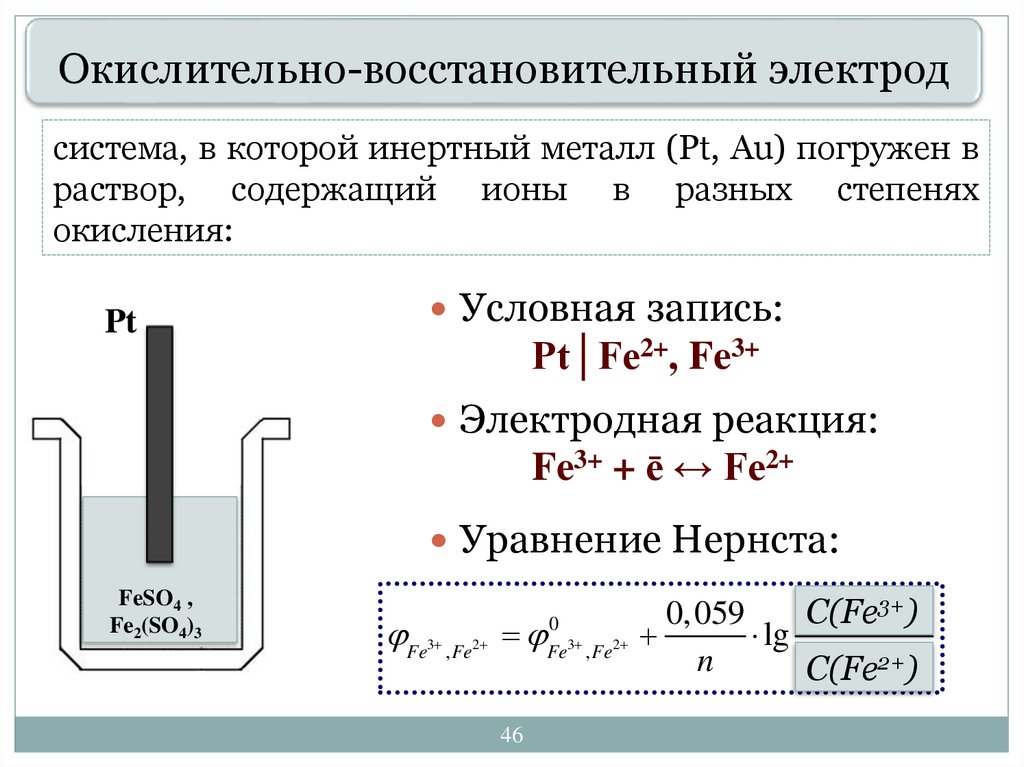
46.
Окислительно-восстановительный электродсистема, в которой инертный металл (Pt, Au) погружен в
раствор, содержащий ионы в разных степенях
окисления:
Pt
Условная запись:
Pt│Fe2+, Fe3+
Электродная реакция:
Fe3+ + ē ↔ Fe2+
Уравнение Нернста:
FeSO4 ,
Fe2(SO4)3
Fe , Fe
3
2
46
0
Fe3 , Fe2
3+).
cC(Fe
окисл
0, 059
lg
2+).
n
сC(Fe
восст
47.
Гальванические элементыГальванический
элемент
это
электрохимическая система, состоящая из
двух электродов любого типа и в которой
самопроизвольно протекает окислительновосстановительная реакция, энергия которой
преобразуется в электрическую энергию.
Гальванические элементы - химические
источники тока!
47
48.
Гальванические элементы (ГЭ):электрохимические - источником
электрической энергии является
химическая реакция.
концентрационные - источником
электрической энергии служат
процессы выравнивания
концентраций растворов.
48
49.
ПРАВИЛО ЗАПИСИ ГЭ:Слева всегда пишется электрод с меньшим стандартным
потенциалом, этот электрод называется АНОДОМ (А) и на
нем происходит процесс окисления (-е).
Справа пишется электрод с большим стандартным
потенциалом, этот электрод называется КАТОДОМ (К) и
на нем происходит процесс восстановления (+е).
Например: Привести схему ГЭ, составленного из двух
электродов I рода: цинкового и медного.
Zn │ZnSO4;
φ0 = -0,76 В
АНОД
Cu │CuSO4;
φ0 = 0,34 В
КАТОД
49
50.
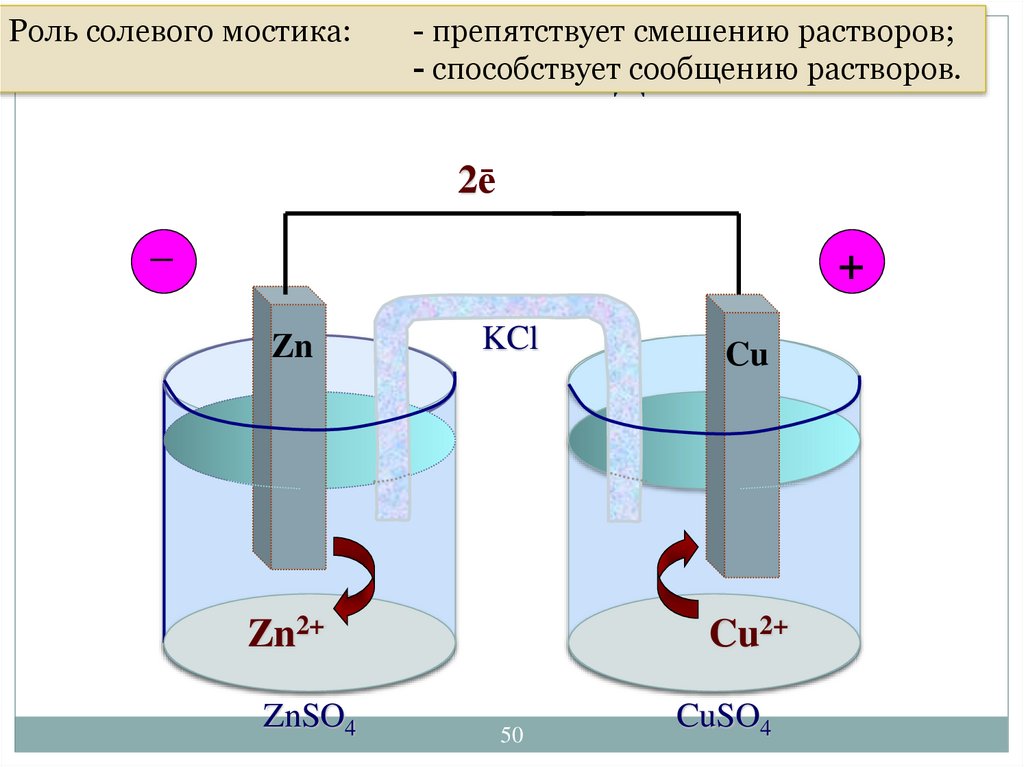
Роль солевого мостика:- препятствует смешению
Электрохимические
ГЭ растворов;
способствуетДаниэля-Якоби
сообщению растворов.
Гальванический- элемент
2ē
_
+
Zn
KCl
Zn2+
ZnSO4
Cu
Cu2+
50
CuSO4
51.
Расчет ЭДС гальванического элементаЭлектродвижущая сила (ЭДС) –
это разность электродных потенциалов катода и
анода в разомкнутом ГЭ
Е = φ(+) – φ(-)
51
52.
Расчет ЭДС гальванического элементаможно выполнить 2-мя путями:
1. Рассчитать по уравнению Нернста электродные
потенциалы каждого электрода, входящего в ГЭ.
Затем вычислить ЭДС по формуле: Е = φ(+) – φ(-)
2. Рассчитать ЭДС по уравнению Нернста для
суммарной
токообразующей
реакции,
протекающей при работе ГЭ.
52
53.
Уравнение Нернстадля расчета ЭДС гальванического элемента
Пусть в ГЭ протекает токообразующая реакция:
1А + 2В 3С + 4D
Уравнение Нернста для токообразующей реакции:
3
4
RT aC aD
0
Е Е
ln 1 2
nF a A aB
3
4
a
a
0,
059
Е Е0
lg C 1 D2
n
a A aB
где n – число электронов, участвующих в работе ГЭ
(наименьшее общее кратное электронов в электродных процессах).
Е0 – стандартная ЭДС гальванического элемента
o
o
Eo = φ
–
φ
(-)
53 (+)
54.
В гальваническом элементе за счет протекания химическойреакции совершается электрическая работа (Аэл). Для
обратимого процесса максимальная полезная работа
пропорциональна стандартной электрожвижущей силе (Е0).
Aэл nFE
0
Максимальная полезная работа в изобарно-изотермических
условиях равна убыли энергии Гиббса.
Aэл G ; G nFE
0
0
0
55.
Расчет константы равновесияокислительно-восстановительной реакции
G RT ln K c
nFE RT ln K c
0
nFE
ln K a
RT
0
n E
lg K a
0,059
o
o
или упрощенно:
K a 10
n E o
0 , 059
n – общее число электронов, участвующих в токообразующей
реакции,
Eo– стандартная ЭДС, Вольт
55
56.
Концентрационные ГЭ- это система из двух одинаковых электродов с
разными
активностями
(концентрациями)
растворов.
( – ) Ag AgNO3 AgNO3 Ag ( + )
ɑ1
ɑ2
a1 a2
ЭДС зависит от разности активностей растворов:
RT a2
E
ln
F
a1
т.к.
Е0 = 0
56
57.
ДИФФУЗНЫЙ ПОТЕНЦИАЛПротекание многих биологических процессов связано с
изменением концентраций ионов в клетках и тканях живых
организмов. Неравномерное распределение ионов в какойлибо жидкой среде обычно приводит к их направленному
движению и возникновению диффузного потенциала.
Диффузным потенциалом
называется потенциал,
возникающий на границе раздела двух растворов,
содержащих один и тот же электролит различной
концентрации, или двух растворов разных электролитов
вследствие различия в подвижности их катионов и анионов.
57
58.
МЕМБРАННЫЙ ПОТЕНЦИАЛДиффузный потенциал на границе двух растворов постепенно уменьшается в
результате выравнивания концентраций. Стабилизировать потенциал можно,
если соприкасающиеся растворы разделить полупроницаемой мембраной.
Мембранный потенциал – потенциал, возникающий между сторонами
мембраны с избирательной проницаемостью, разделяющей два
раствора различного состава.
Величину
мембранного
потенциала
определяют,
составив
гальваническую
Ø 2-3 мкм
цепь, в которой
два
электрода
сравнения
(внутренний и внешний)
KCl
опущены
в
растворы,
разделенные
мембраной.
клетка
(микроэлектродный
метод).
ЭДС
такой
ГЦ
характеризует
величину
мембранного потенциала.
Ø 0,1-0,5 мкм
58
59.
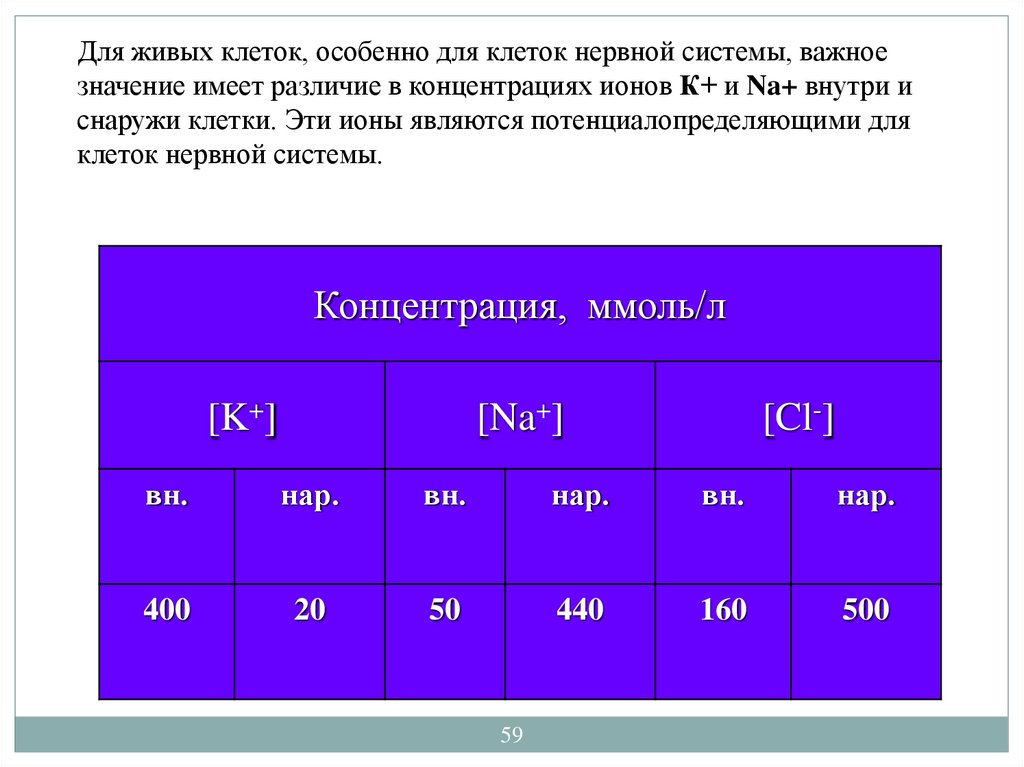
Для живых клеток, особенно для клеток нервной системы, важноезначение имеет различие в концентрациях ионов К+ и Na+ внутри и
снаружи клетки. Эти ионы являются потенциалопределяющими для
клеток нервной системы.
Концентрация, ммоль/л
[K+]
[Na+]
[Cl-]
вн.
нар.
вн.
нар.
вн.
нар.
400
20
50
440
160
500
59
60.
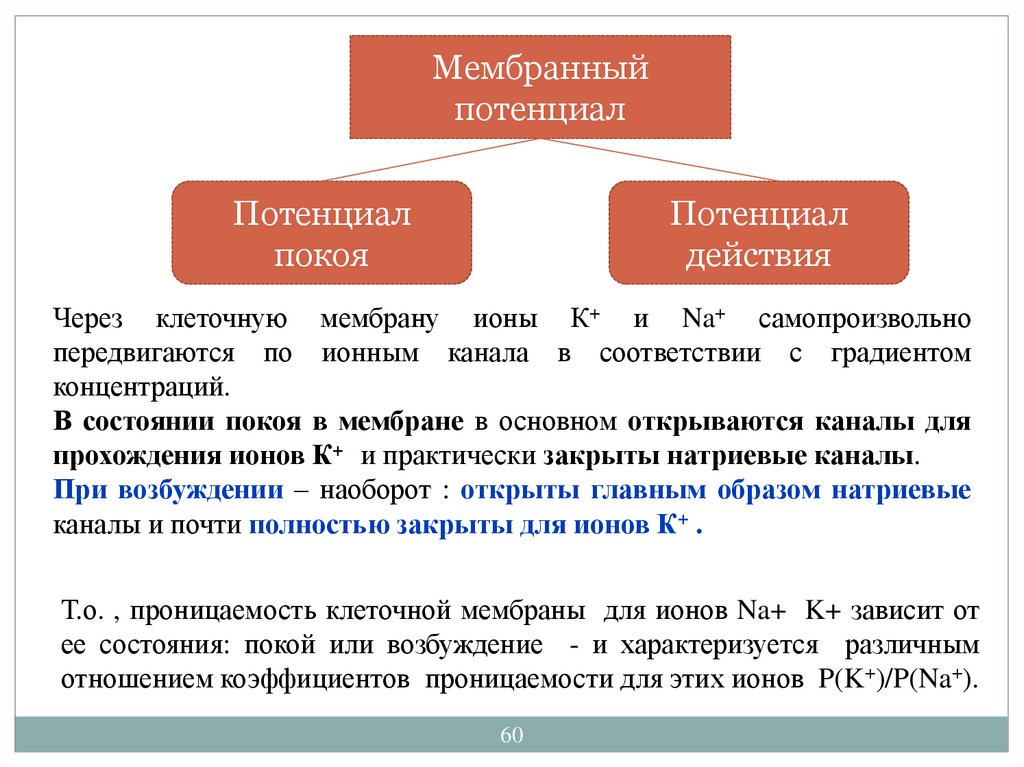
Мембранныйпотенциал
Потенциал
покоя
Потенциал
действия
Через клеточную мембрану ионы К+ и Na+ самопроизвольно
передвигаются по ионным канала в соответствии с градиентом
концентраций.
В состоянии покоя в мембране в основном открываются каналы для
прохождения ионов К+ и практически закрыты натриевые каналы.
При возбуждении – наоборот : открыты главным образом натриевые
каналы и почти полностью закрыты для ионов К+ .
Т.о. , проницаемость клеточной мембраны для ионов Na+ K+ зависит от
ее состояния: покой или возбуждение - и характеризуется различным
отношением коэффициентов проницаемости для этих ионов P(K+)/P(Na+).
60
61.
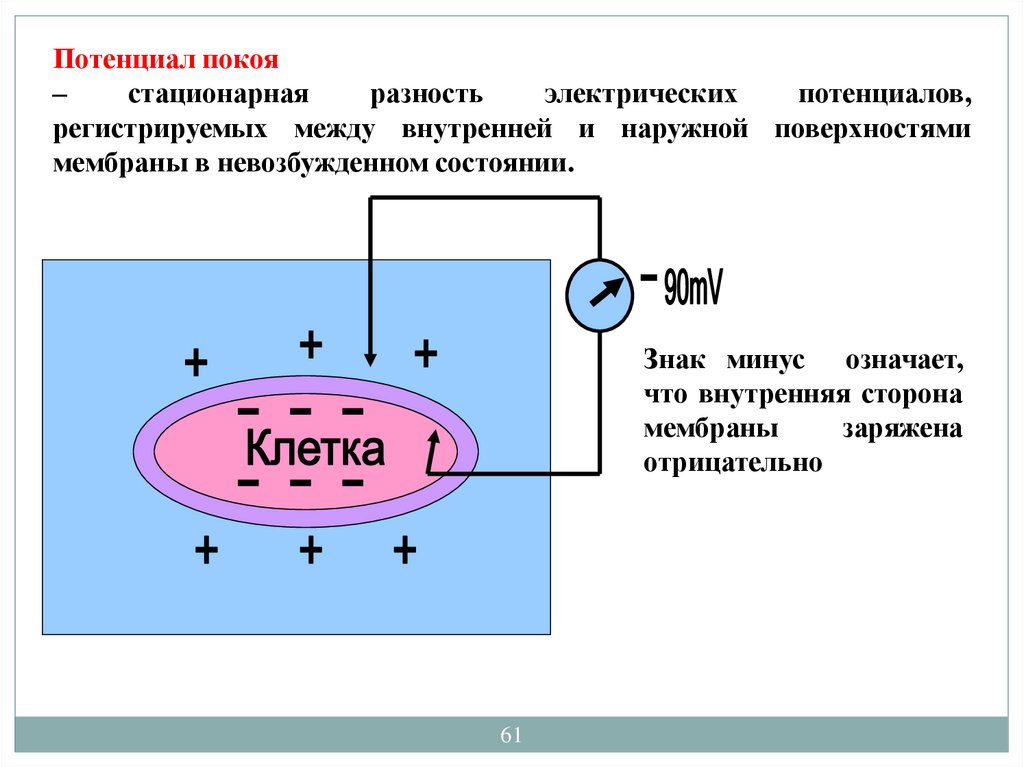
Потенциал покоя–
стационарная
разность
электрических
потенциалов,
регистрируемых между внутренней и наружной поверхностями
мембраны в невозбужденном состоянии.
Знак минус означает,
что внутренняя сторона
мембраны
заряжена
отрицательно
61
62.
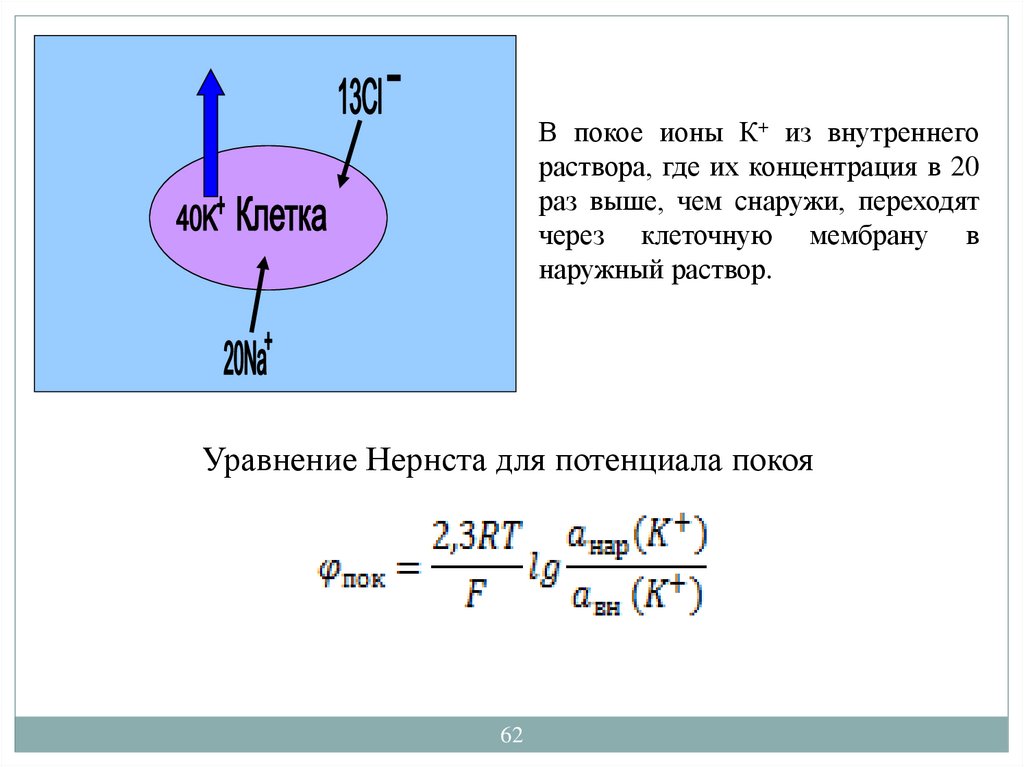
В покое ионы К+ из внутреннегораствора, где их концентрация в 20
раз выше, чем снаружи, переходят
через клеточную мембрану в
наружный раствор.
Уравнение Нернста для потенциала покоя
62
63.
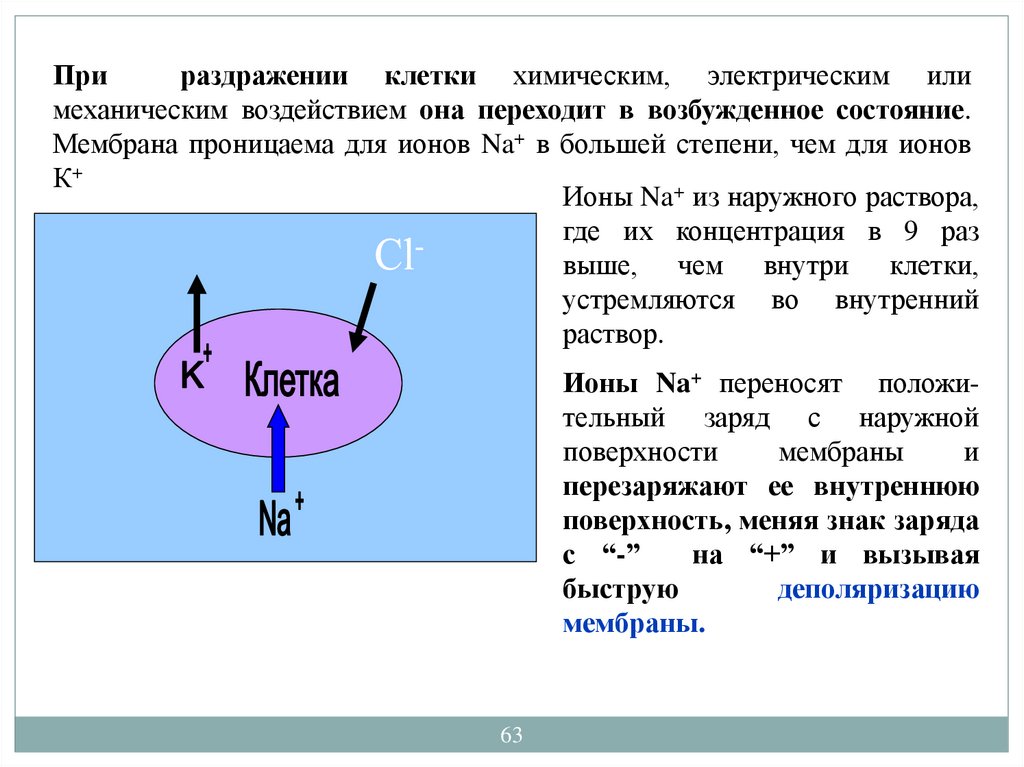
Прираздражении клетки химическим, электрическим или
механическим воздействием она переходит в возбужденное состояние.
Мембрана проницаема для ионов Na+ в большей степени, чем для ионов
К+
Ионы Na+ из наружного раствора,
где их концентрация в 9 раз
выше, чем внутри клетки,
устремляются во внутренний
раствор.
Ионы Na+ переносят положительный заряд с наружной
поверхности
мембраны
и
перезаряжают ее внутреннюю
поверхность, меняя знак заряда
с “-”
на “+” и вызывая
быструю
деполяризацию
мембраны.
63
64.
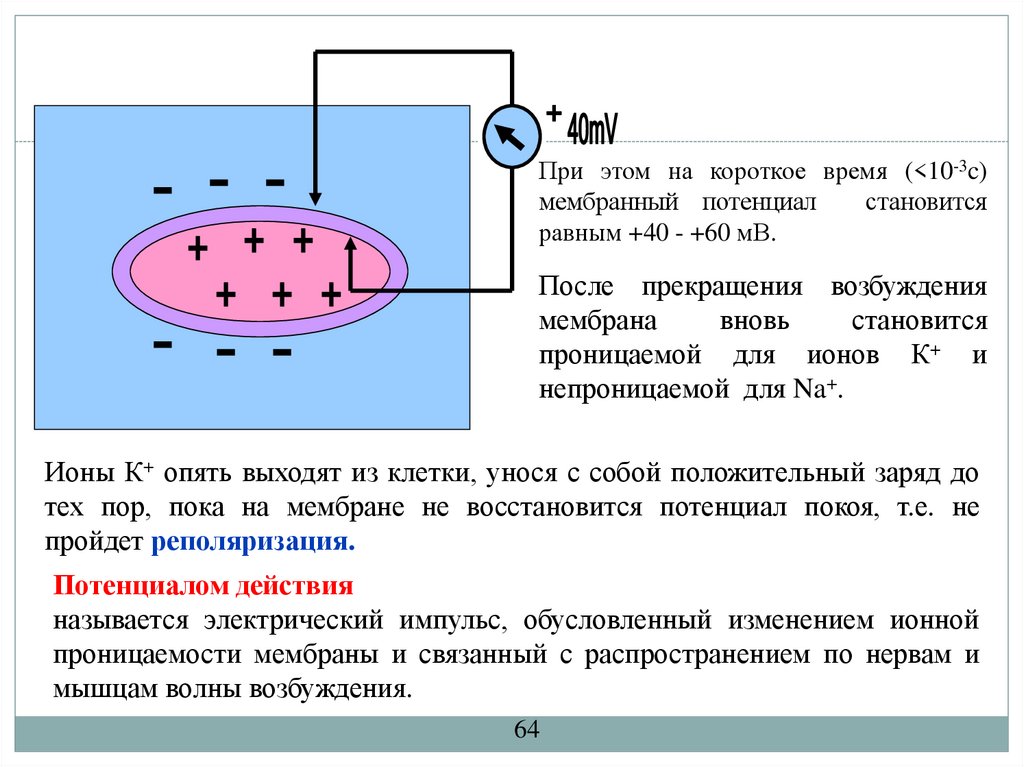
При этом на короткое время (<10-3c)мембранный потенциал
становится
равным +40 - +60 мВ.
После прекращения возбуждения
мембрана
вновь
становится
проницаемой для ионов К+ и
непроницаемой для Na+.
Ионы К+ опять выходят из клетки, унося с собой положительный заряд до
тех пор, пока на мембране не восстановится потенциал покоя, т.е. не
пройдет реполяризация.
Потенциалом действия
называется электрический импульс, обусловленный изменением ионной
проницаемости мембраны и связанный с распространением по нервам и
мышцам волны возбуждения.
64
65.
Уравнение Нернста для потенциала действияa снар ( Na )
2,3RT
Д
lg
F
a внутр ( Na )



















































 Химия
Химия