Похожие презентации:
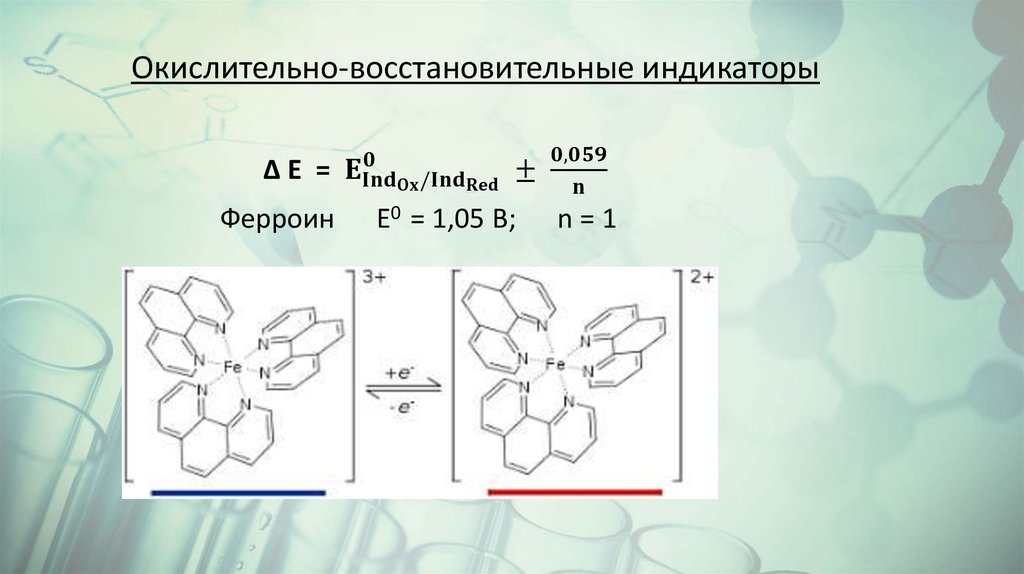
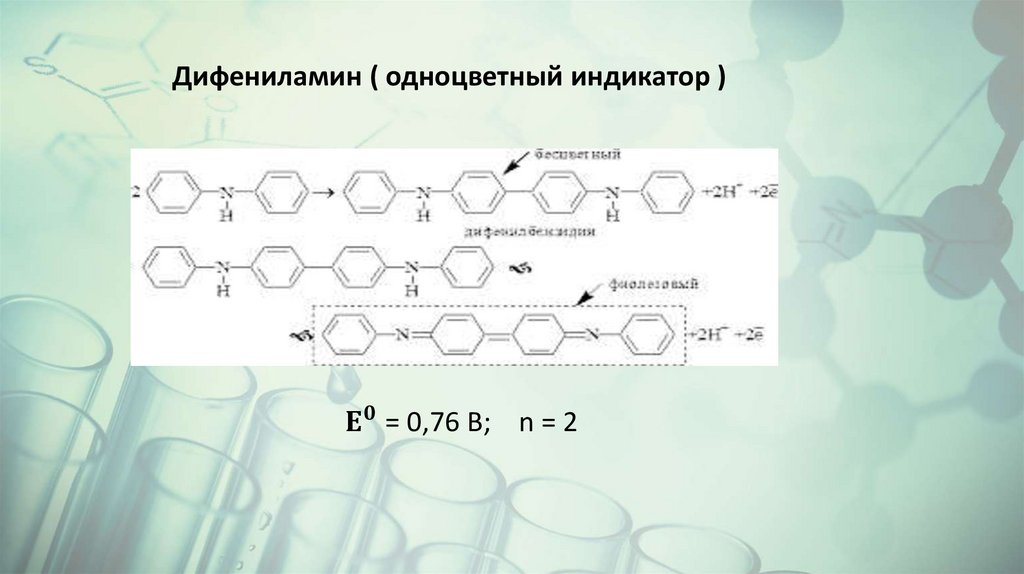
Кривая окислительно-восстановительного титрования
1.
Кривая окислительно-восстановительного титрованияДо начала титрования потенциал системы не рассчитывается.
До т.э. потенциал системы будет определяться о-в парой
титруемого вещества.
После т.э. потенциал системы определяется парой титранта.
2.
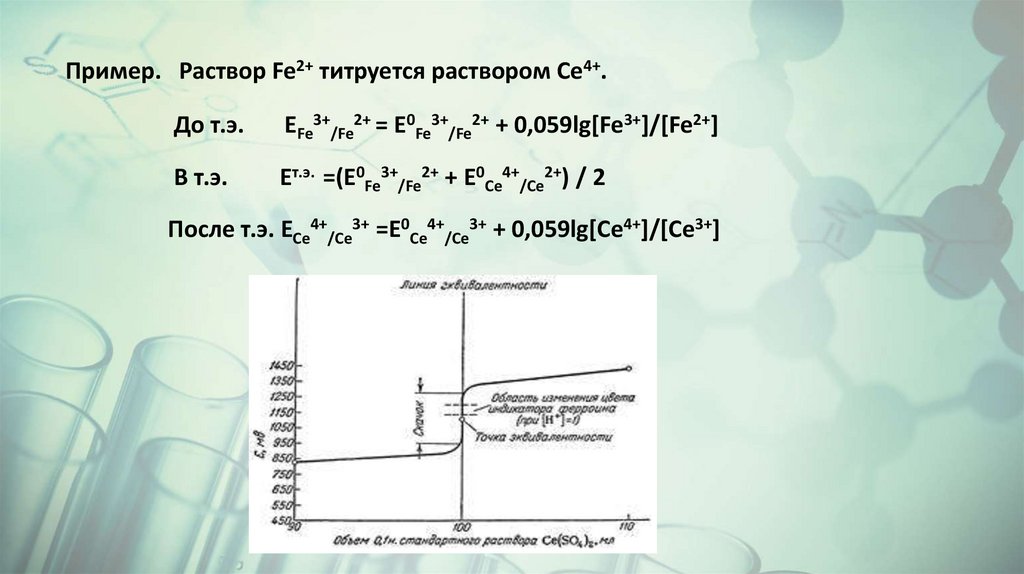
Пример. Раствор Fe2+ титруется раствором Се4+.До т.э.
EFe3+/Fe2+ = E0Fe3+/Fe2+ + 0,059lg[Fe3+]/[Fe2+]
В т.э.
Eт.э. =(E0Fe3+/Fe2+ + E0Ce4+/Ce2+) / 2
После т.э. ECe4+/Ce3+ =E0Ce4+/Ce3+ + 0,059lg[Ce4+]/[Ce3+]
3.
Положение точки эквивалентности относительно скачкатитрования зависит от соотношения количества
электронов, участвующих в реакции. Если n1 =n2, кривая
симметрична по отношению к т.э. Чем больше отличие n1
от n2, тем больше ассиметрия кривой.













 Химия
Химия








