Похожие презентации:
Расширение возможностей метода аналитических капельных реакций при производстве взрывотехнических экспертиз
1.
Министерство Внутренних ДелРоссийской Федерации
Экспертно-криминалистический центр
РАСШИРЕНИЕ ВОЗМОЖНОСТЕЙ
МЕТОДА АНАЛИТИЧЕСКИХ КАПЕЛЬНЫХ РЕАКЦИЙ
ПРИ ПРОИЗВОДСТВЕ
ВЗРЫВОТЕХНИЧЕСКИХ ЭКСПЕРТИЗ
(Старостин К.Д., Дьяконов А.В., Кузьмин В.В.)
125130, г.Москва, ул.З.и А.Космодемьянских д.5
kuzmin_vv@bk.ru
2.
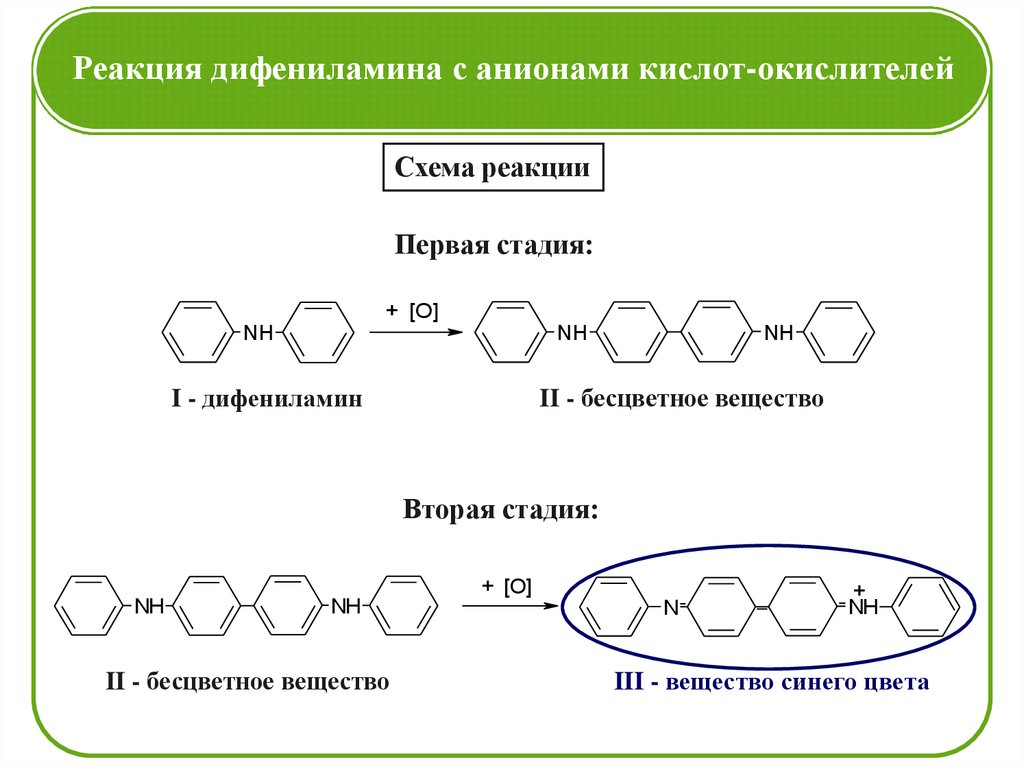
Реакция дифениламина с анионами кислот-окислителейСхема реакции
Первая стадия:
+ [O]
NH
NH
NH
II - бесцветное вещество
I - дифениламин
Вторая стадия:
+ [O]
NH
NH
II - бесцветное вещество
N
+
NH
III - вещество синего цвета
3.
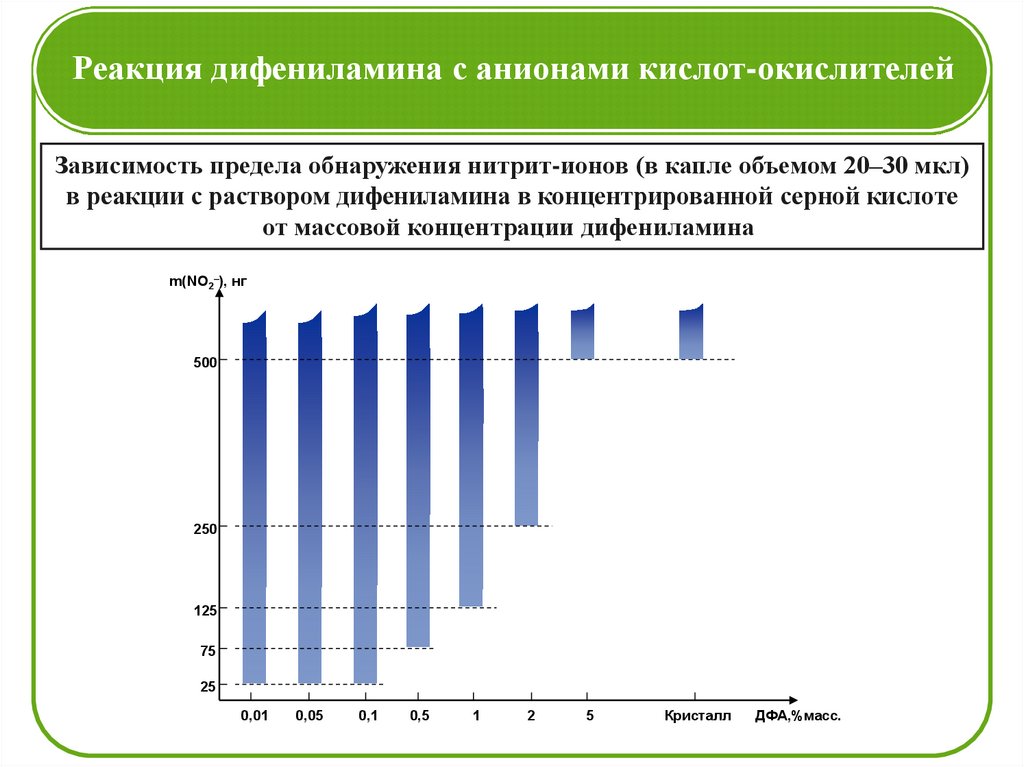
Реакция дифениламина с анионами кислот-окислителейЗависимость предела обнаружения нитрит-ионов (в капле объемом 20–30 мкл)
в реакции с раствором дифениламина в концентрированной серной кислоте
от массовой концентрации дифениламина
m(NO2–), нг
500
250
125
75
25
0,01
0,05
0,1
0,5
1
2
5
Кристалл
ДФА,%масс.
4.
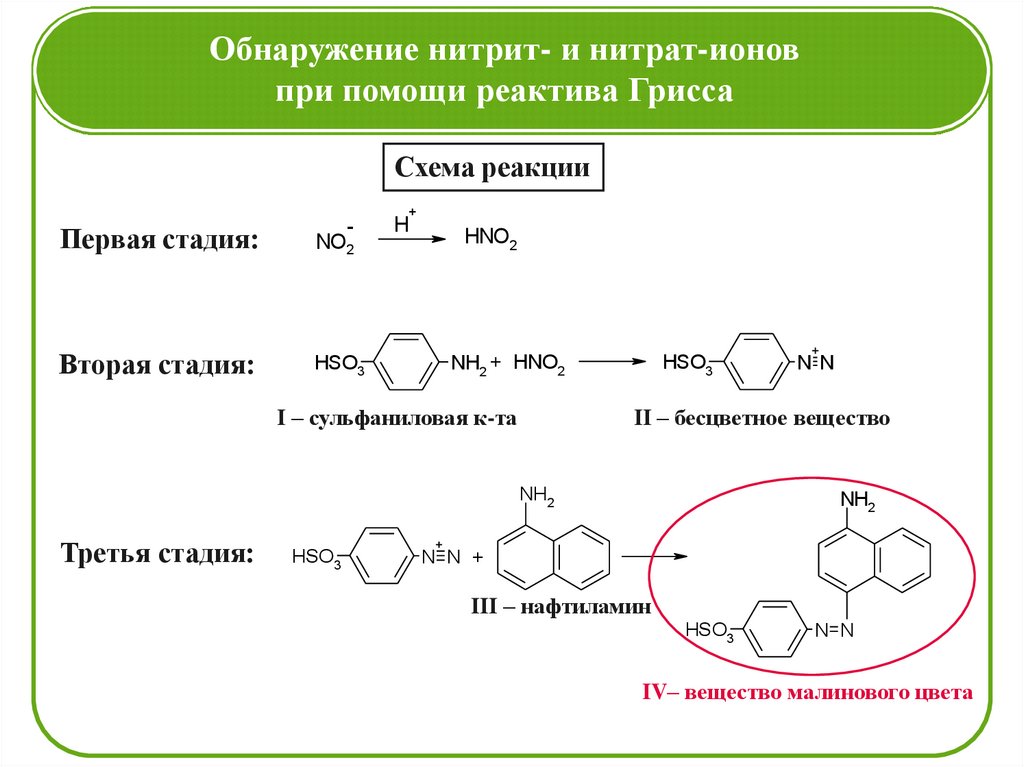
Обнаружение нитрит- и нитрат-ионовпри помощи реактива Грисса
Схема реакции
-
Первая стадия:
NO2
Вторая стадия:
HSO3
+
H
HNO2
NH2 + HNO2
I – сульфаниловая к-та
HSO3
II – бесцветное вещество
NH2
Третья стадия:
HSO3
+
N N
NH2
+
N N +
III – нафтиламин
HSO3
N N
IV– вещество малинового цвета
5.
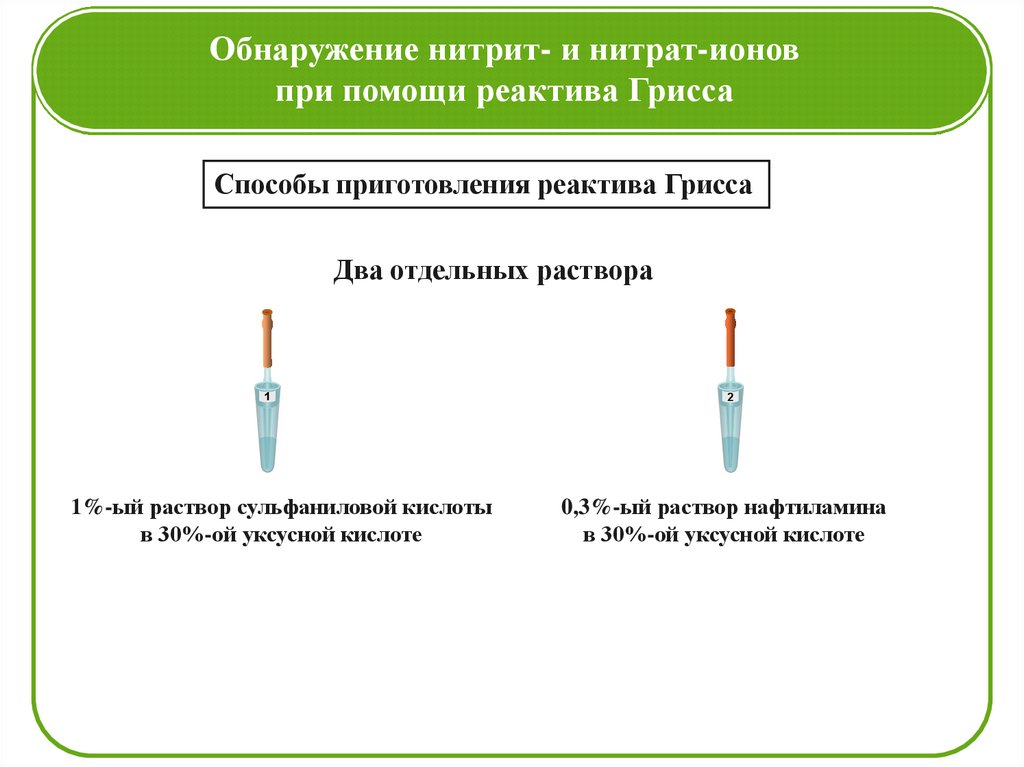
Обнаружение нитрит- и нитрат-ионовпри помощи реактива Грисса
Способы приготовления реактива Грисса
Два отдельных раствора
1
1%-ый раствор сульфаниловой кислоты
в 30%-ой уксусной кислоте
2
0,3%-ый раствор нафтиламина
в 30%-ой уксусной кислоте
6.
Обнаружение нитрит- и нитрат-ионовпри помощи реактива Грисса
Способы приготовления реактива Грисса
Сухой реактив Грисса
Сухой реактив Грисса выпускают по:
- ТУ 6-09-3569–74
- МРТУ 6-09-3085–66
Растворители для сухого реактива Грисса:
Состав сухого
реактива Грисса
30%-ая уксусная кислота
нафтиламин
1
сульфаниловая
кислота
10
100%-ая уксусная кислота
винная кислота
89
серная или другие сильные кислоты ( pH~0 )
50%-ый этанол
7.
Обнаружение нитрит- и нитрат-ионовпри помощи реактива Грисса
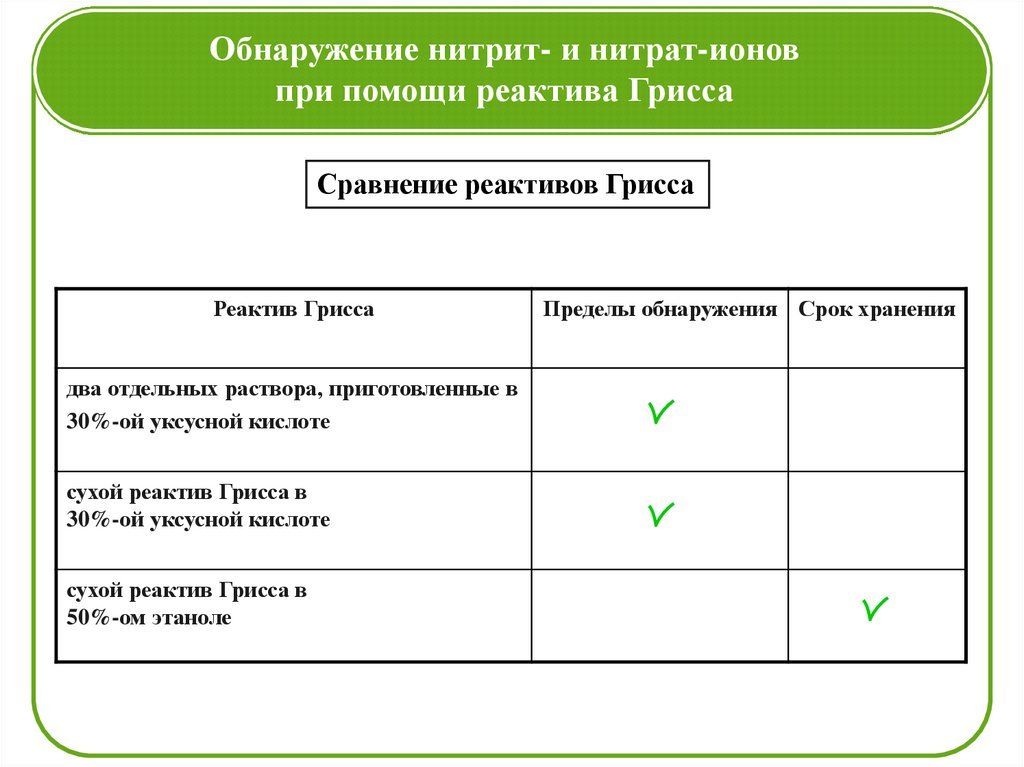
Сравнение реактивов Грисса
Реактив Грисса
два отдельных раствора, приготовленные в
30%-ой уксусной кислоте
сухой реактив Грисса в
30%-ой уксусной кислоте
сухой реактив Грисса в
50%-ом этаноле
Пределы обнаружения Срок хранения
8.
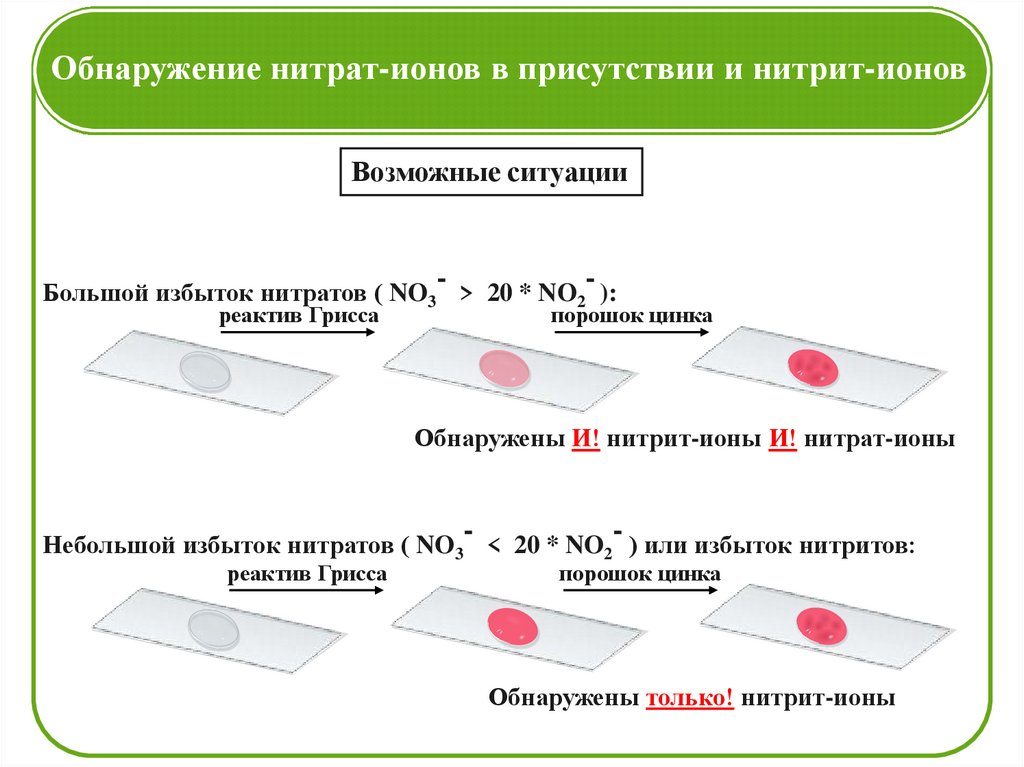
Обнаружение нитрат-ионов в присутствии и нитрит-ионовВозможные ситуации
-
-
Большой избыток нитратов ( NO3 > 20 * NO2 ):
реактив Грисса
порошок цинка
Обнаружены И! нитрит-ионы И! нитрат-ионы
-
-
Небольшой избыток нитратов ( NO3 < 20 * NO2 ) или избыток нитритов:
реактив Грисса
порошок цинка
Обнаружены только! нитрит-ионы
9.
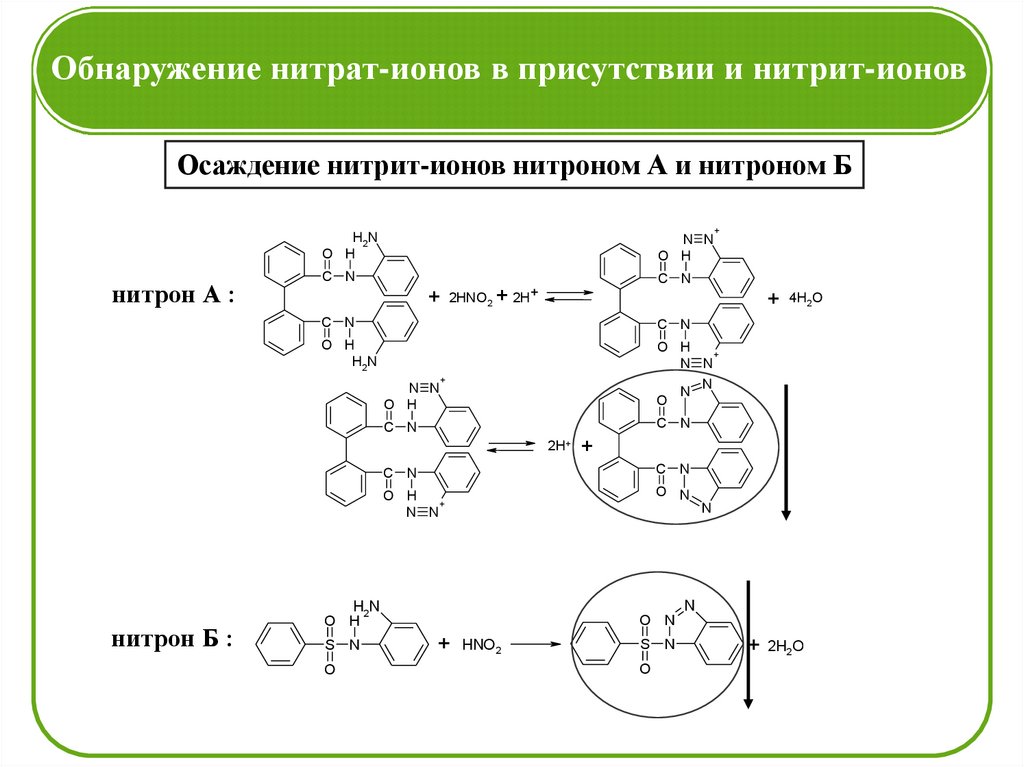
Обнаружение нитрат-ионов в присутствии и нитрит-ионовОсаждение нитрит-ионов нитроном А и нитроном Б
+
H2N
O H
нитрон А :
N N
O H
C N
C N
+ 2HNO2 + 2H+
+ 4H2O
C N
C N
O H
H2N
O H
+
N N
N
N
O
+
N N
O H
C N
C N
2H+
нитрон Б :
C N
C N
O H
+
N N
O N
O
N
N
H2N
O H
S N
+
O N
+ HNO2
S N
O
+ 2H2O
10.
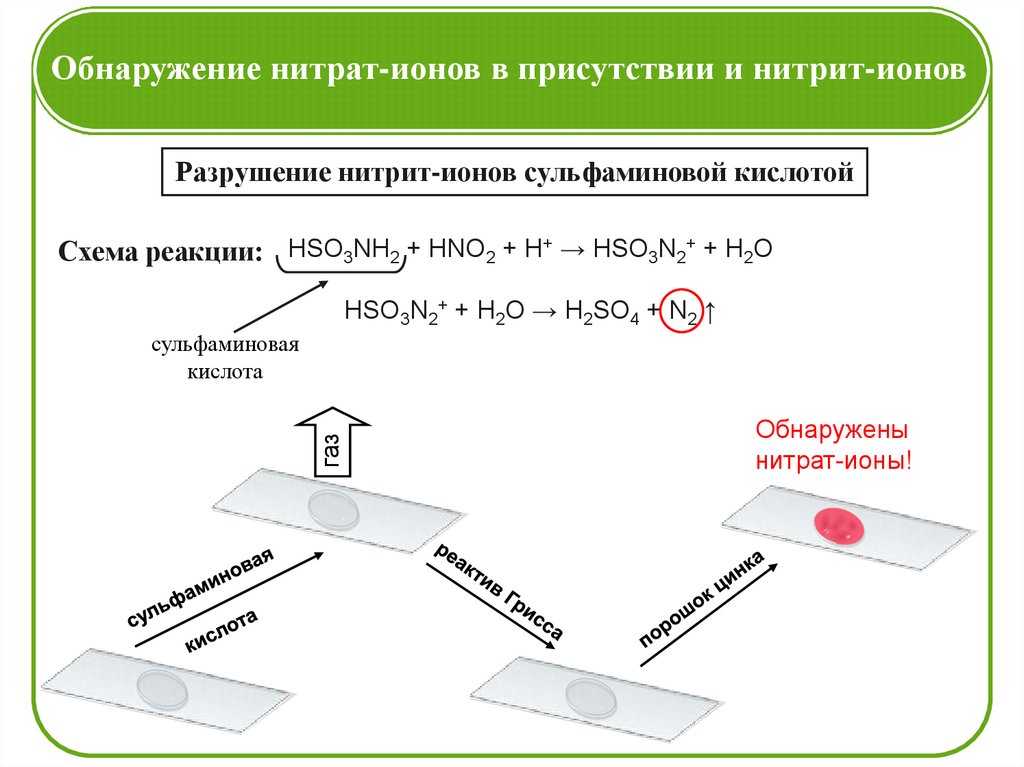
Обнаружение нитрат-ионов в присутствии и нитрит-ионовРазрушение нитрит-ионов сульфаминовой кислотой
Схема реакции: HSO3NH2 + HNO2 + H+ → HSO3N2+ + H2O
HSO3N2+ + H2O → H2SO4 + N2 ↑
газ
сульфаминовая
кислота
Обнаружены
нитрат-ионы!
11.
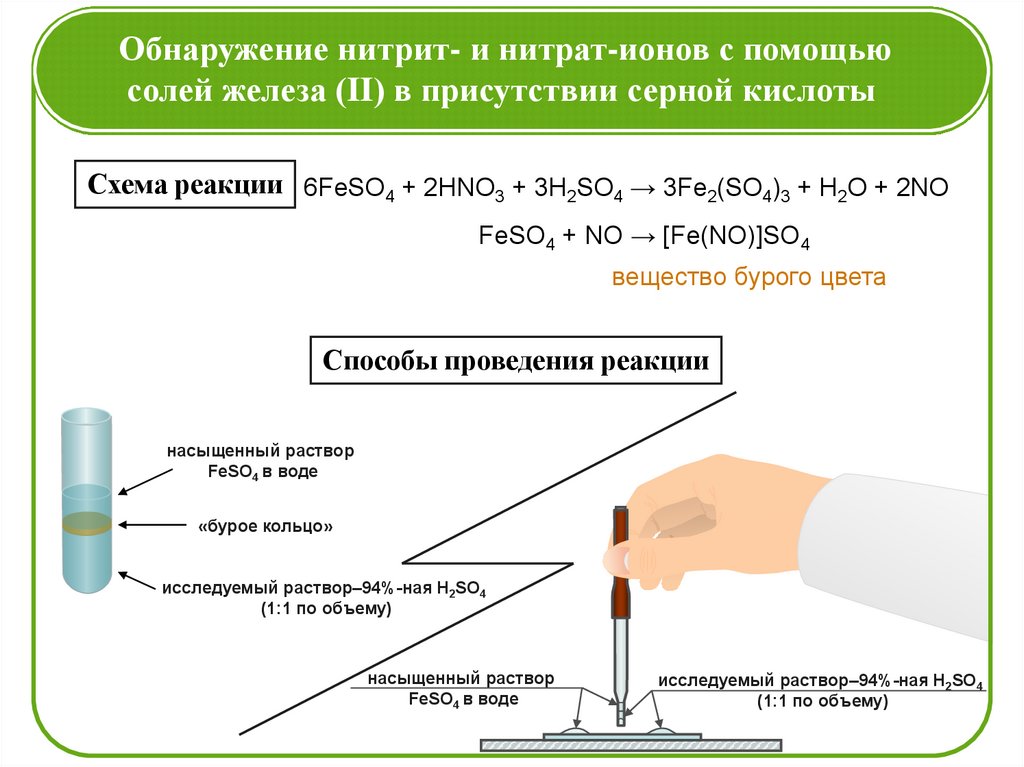
Обнаружение нитрит- и нитрат-ионов с помощьюсолей железа (II) в присутствии серной кислоты
Схема реакции 6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + H2O + 2NO
FeSO4 + NO → [Fe(NO)]SO4
вещество бурого цвета
Способы проведения реакции
насыщенный раствор
FeSO4 в воде
«бурое кольцо»
исследуемый раствор–94%-ная H2SO4
(1:1 по объему)
насыщенный раствор
FeSO4 в воде
исследуемый раствор–94%-ная H2SO4
(1:1 по объему)
12.
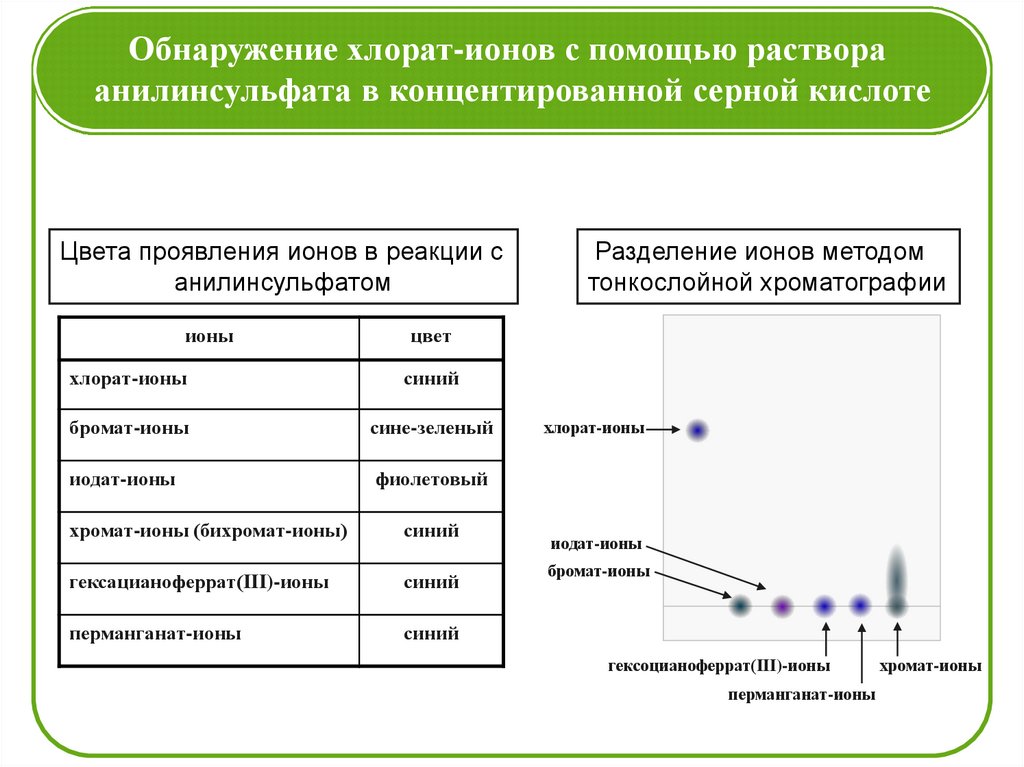
Обнаружение хлорат-ионов с помощью раствораанилинсульфата в концентированной серной кислоте
Цвета проявления ионов в реакции с
анилинсульфатом
ионы
Разделение ионов методом
тонкослойной хроматографии
цвет
хлорат-ионы
синий
бромат-ионы
сине-зеленый
иодат-ионы
фиолетовый
хромат-ионы (бихромат-ионы)
синий
гексацианоферрат(III)-ионы
синий
перманганат-ионы
синий
хлорат-ионы
иодат-ионы
бромат-ионы
гексоцианоферрат(III)-ионы
перманганат-ионы
хромат-ионы
13.
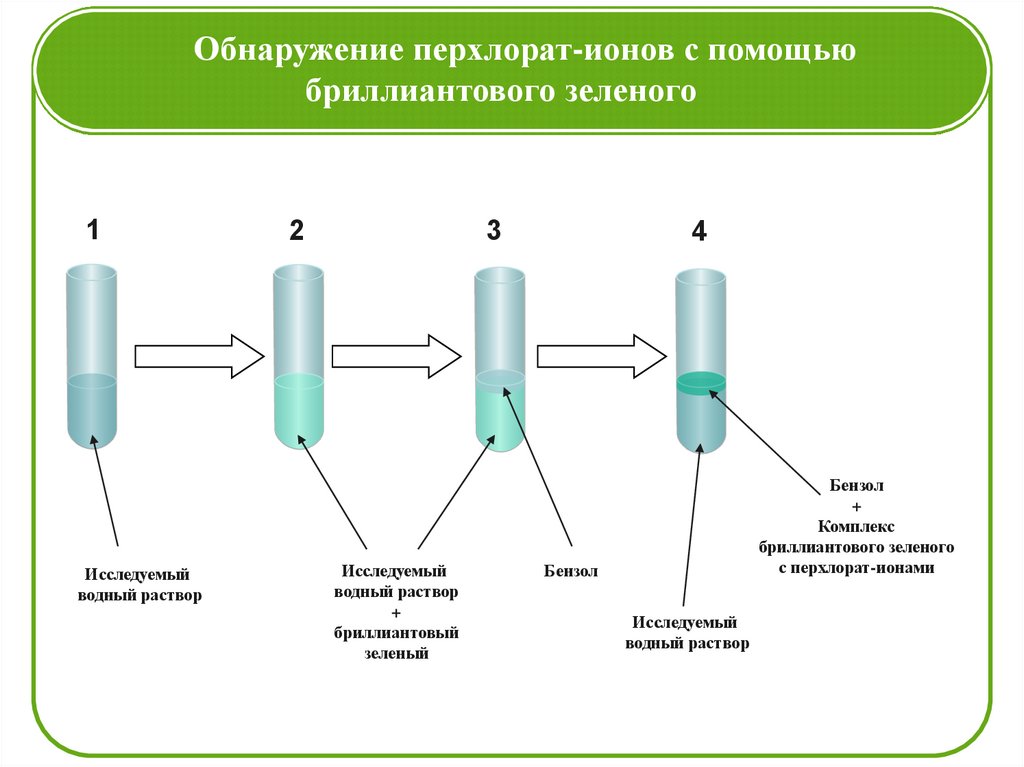
Обнаружение перхлорат-ионов с помощьюбриллиантового зеленого
1
Исследуемый
водный раствор
2
3
Исследуемый
водный раствор
+
бриллиантовый
зеленый
4
Бензол
+
Комплекс
бриллиантового зеленого
с перхлорат-ионами
Бензол
Исследуемый
водный раствор
14.
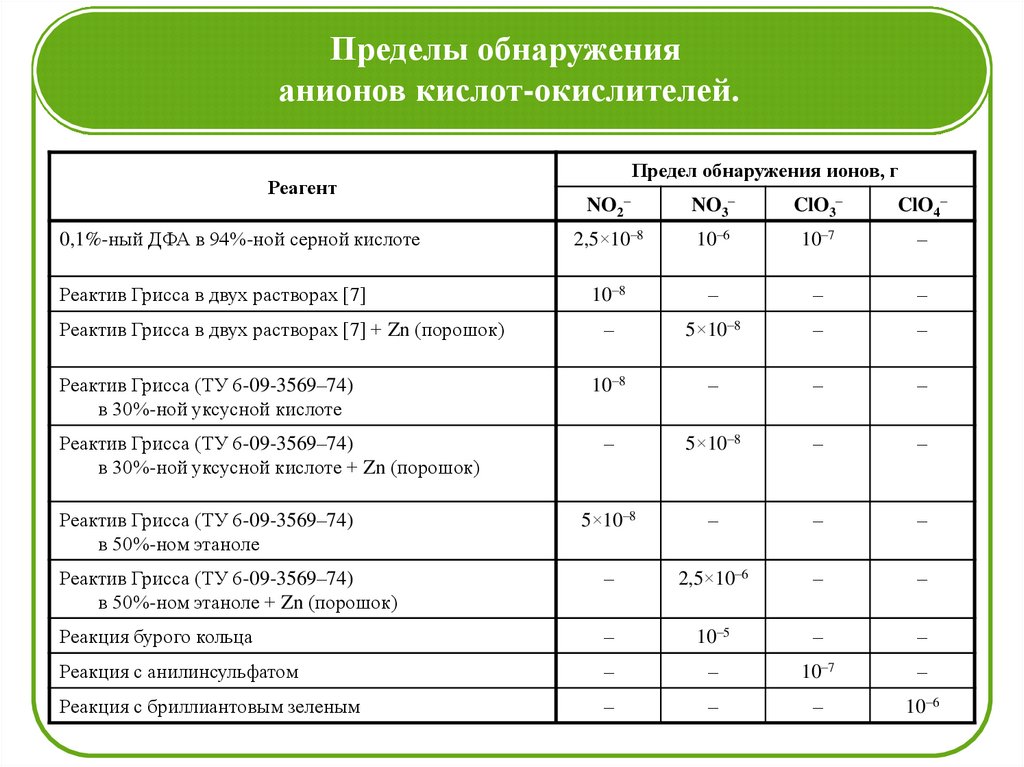
Пределы обнаруженияанионов кислот-окислителей.
Реагент
Предел обнаружения ионов, г
NO2–
NO3–
ClO3–
ClO4–
2,5×10–8
10–6
10–7
–
Реактив Грисса в двух растворах [7]
10–8
–
–
–
Реактив Грисса в двух растворах [7] + Zn (порошок)
–
5×10–8
–
–
Реактив Грисса (ТУ 6-09-3569–74)
в 30%-ной уксусной кислоте
10–8
–
–
–
Реактив Грисса (ТУ 6-09-3569–74)
в 30%-ной уксусной кислоте + Zn (порошок)
–
5×10–8
–
–
5×10–8
–
–
–
Реактив Грисса (ТУ 6-09-3569–74)
в 50%-ном этаноле + Zn (порошок)
–
2,5×10–6
–
–
Реакция бурого кольца
–
10–5
–
–
Реакция с анилинсульфатом
–
–
10–7
–
Реакция с бриллиантовым зеленым
–
–
–
10–6
0,1%-ный ДФА в 94%-ной серной кислоте
Реактив Грисса (ТУ 6-09-3569–74)
в 50%-ном этаноле
15.
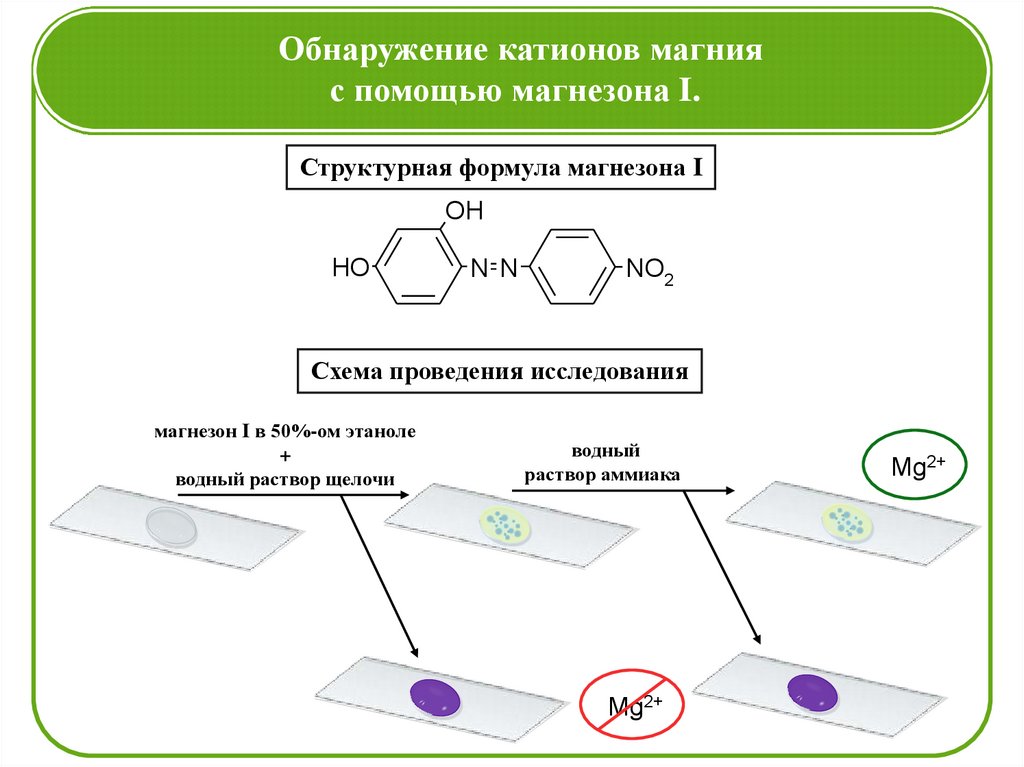
Обнаружение катионов магнияс помощью магнезона I.
Структурная формула магнезона I
OH
HO
N N
NO2
Схема проведения исследования
магнезон I в 50%-ом этаноле
+
водный раствор щелочи
водный
раствор аммиака
Mg2+
Mg2+
16.
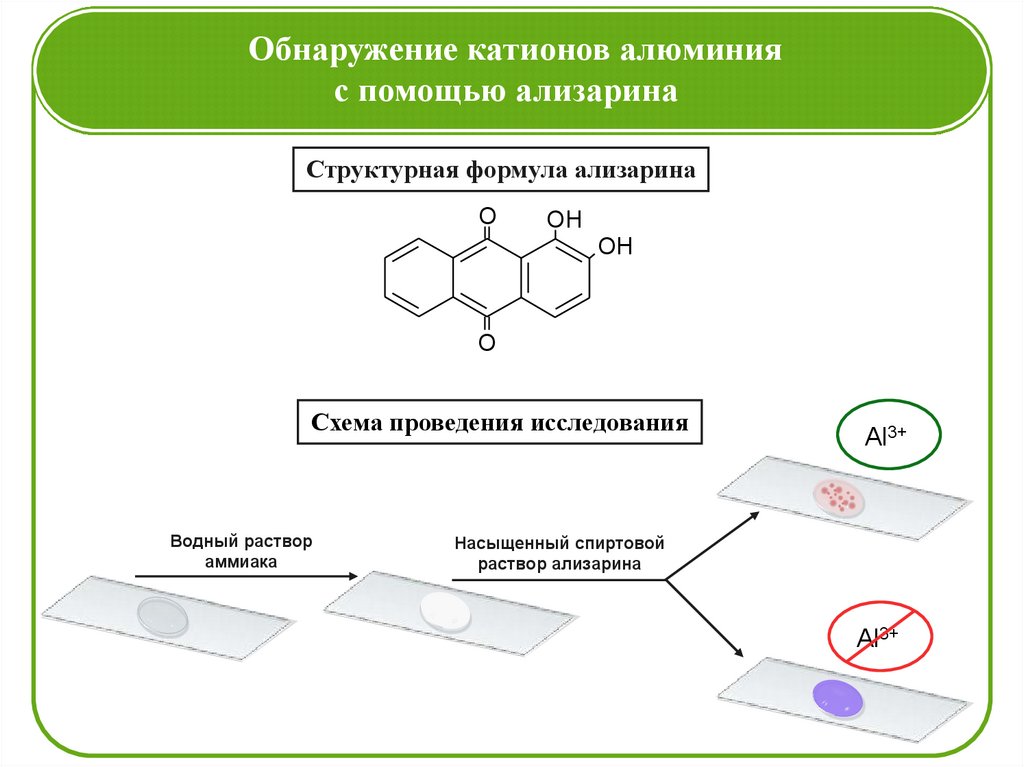
Обнаружение катионов алюминияс помощью ализарина
Структурная формула ализарина
O
OH
OH
O
Схема проведения исследования
Водный раствор
аммиака
Al3+
Насыщенный спиртовой
раствор ализарина
Al3+
17.
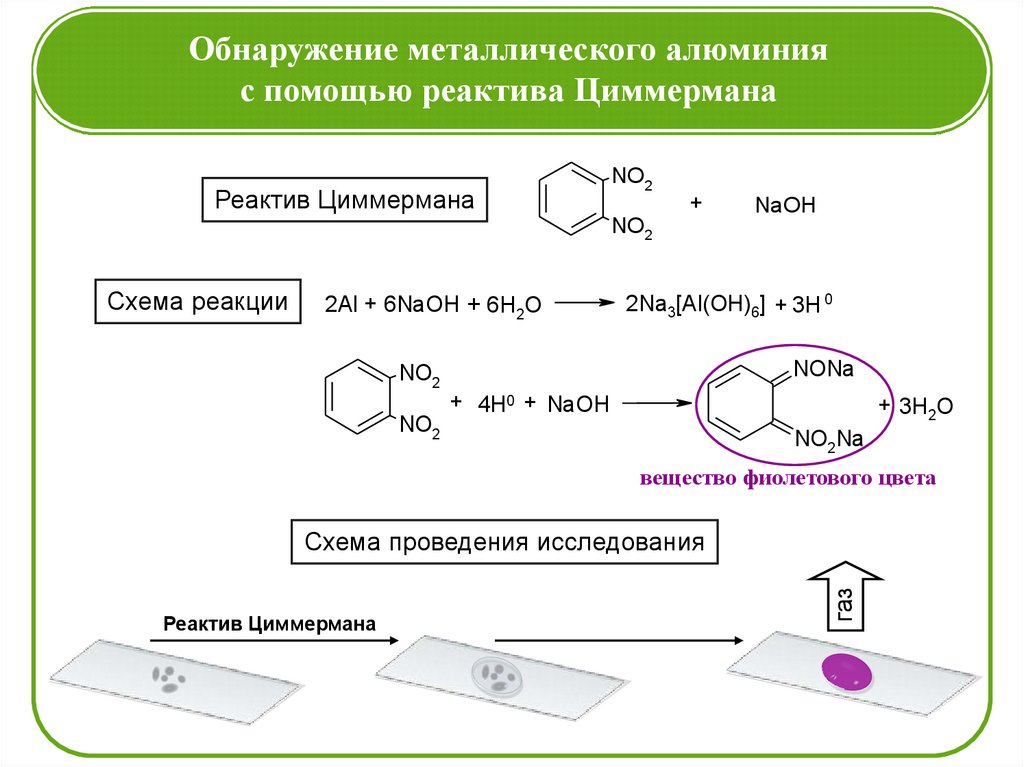
Обнаружение металлического алюминияс помощью реактива Циммермана
Реактив Циммермана
NO2
+
NaOH
NO2
Схема реакции
2Al + 6NaOH + 6H2O
2Na3[Al(OH)6] + 3H 0
NONa
NO2
NO2
+ 4H0 + NaOH
+ 3H2O
NO2Na
вещество фиолетового цвета
Реактив Циммермана
газ
Схема проведения исследования
18.
Обнаружение титанаПеревод металлического титана в ионную форму
Ti
Ti
3+
H2SO4 , t
воздух
3+
Ti
Ti
4+
19.
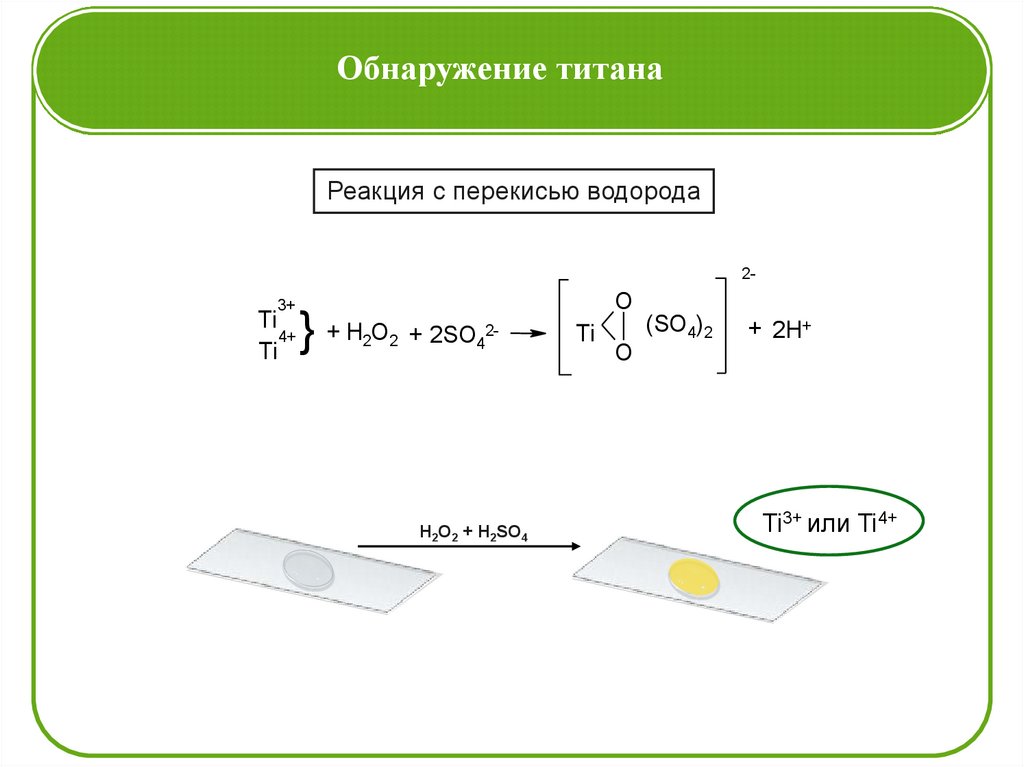
Обнаружение титанаРеакция с перекисью водорода
23+
Ti
4+
Ti
} + H O + 2SO
2
2
O
24
H2O2 + H2SO4
Ti
(SO4)2
+ 2H+
O
Ti3+ или Ti4+
20.
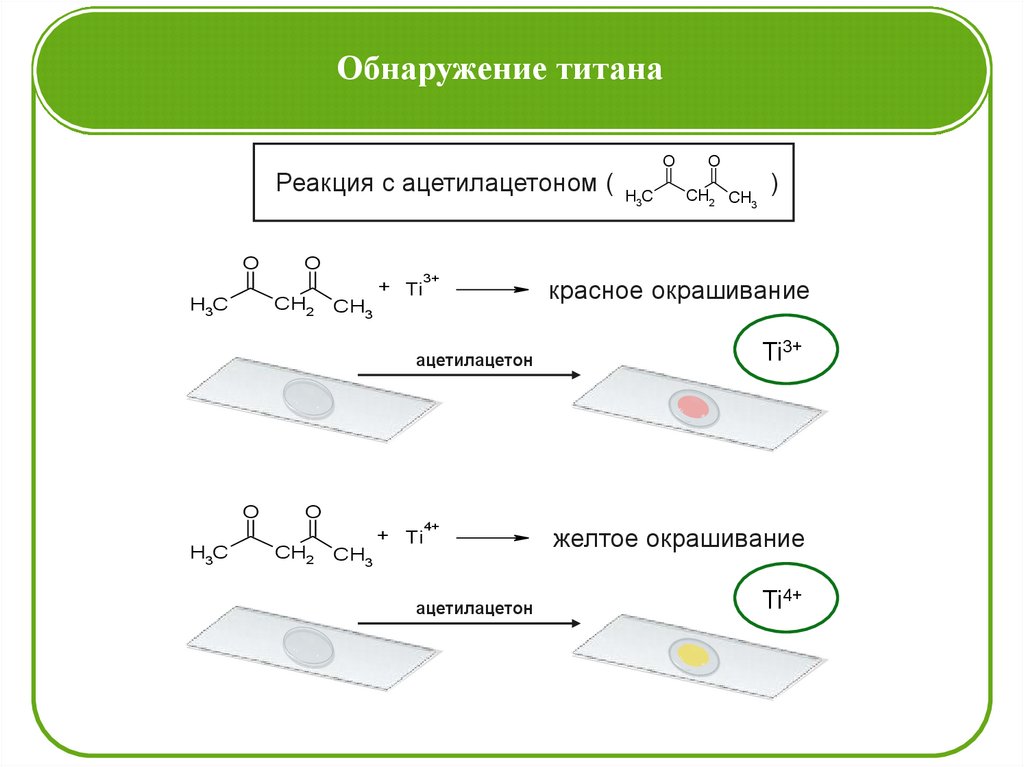
Обнаружение титанаРеакция с ацетилацетоном ( H C
3
O
+ Ti
3+
CH3
ацетилацетон
O
H3C
O
CH2 CH3
)
O
CH2
H3C
O
красное окрашивание
Ti3+
O
CH2
+ Ti
4+
CH3
ацетилацетон
желтое окрашивание
Ti4+
21.
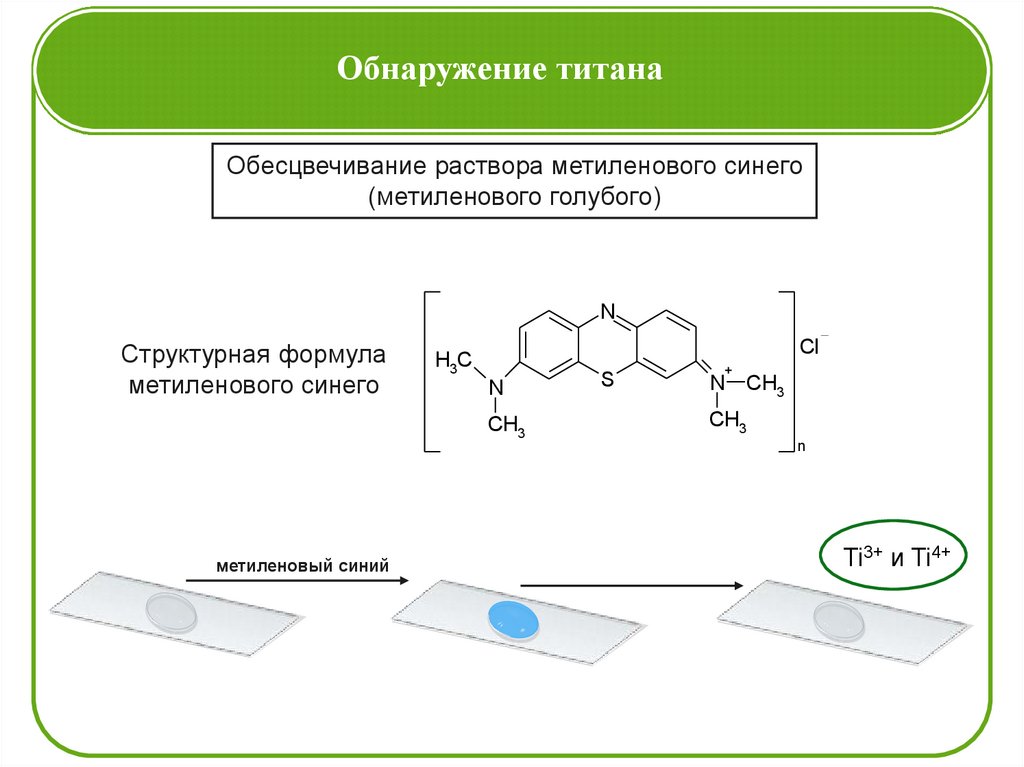
Обнаружение титанаОбесцвечивание раствора метиленового синего
(метиленового голубого)
N
Структурная формула
метиленового синего
Cl
H3C
N
CH3
метиленовый синий
S
+
N
CH3
CH3
n
Ti3+ и Ti4+
22.
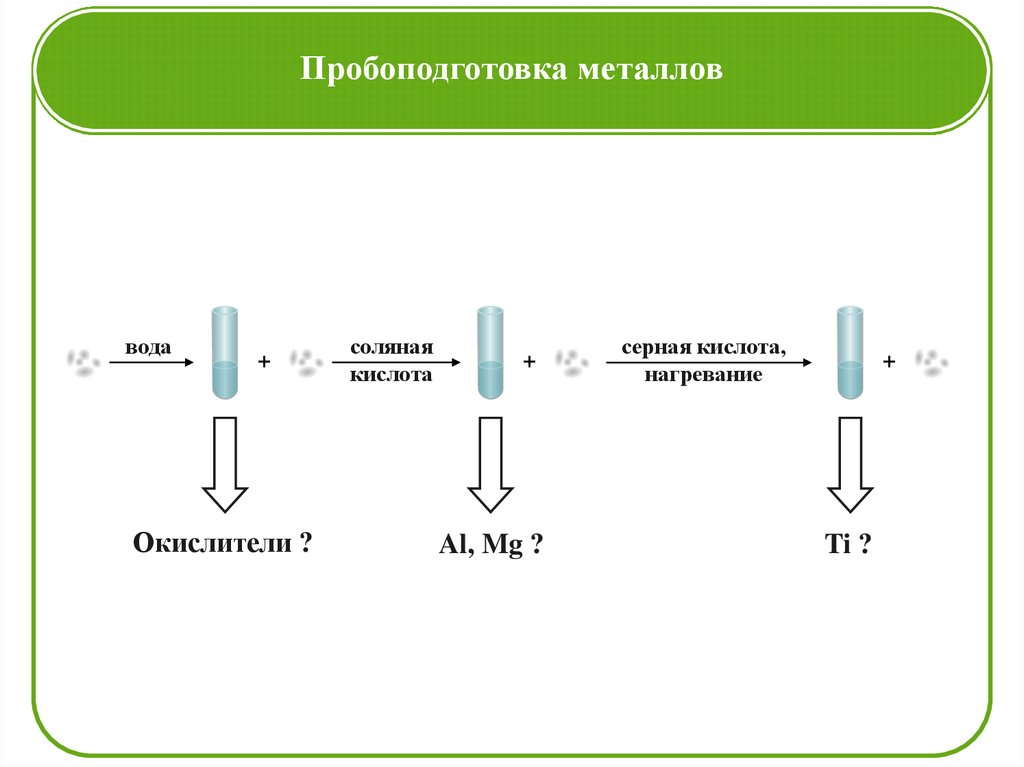
Пробоподготовка металловвода
+
Окислители ?
соляная
кислота
+
Al, Mg ?
серная кислота,
нагревание
+
Ti ?
23.
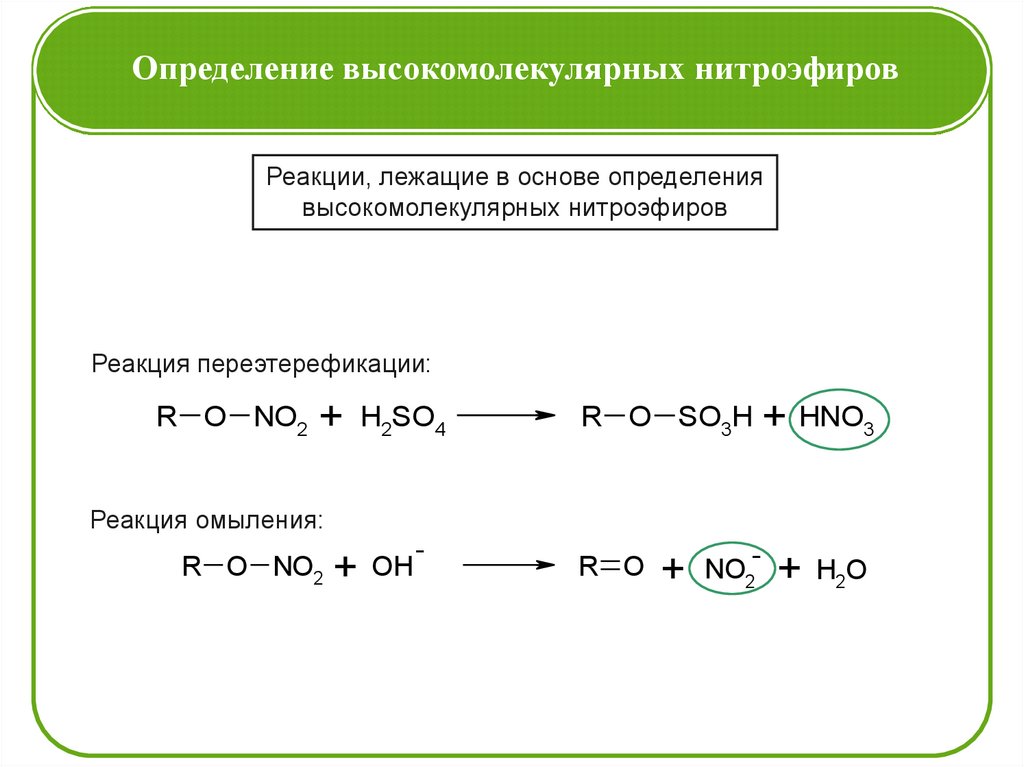
Определение высокомолекулярных нитроэфировРеакции, лежащие в основе определения
высокомолекулярных нитроэфиров
Реакция переэтерефикации:
R O NO2 + H2SO4
R O SO3H + HNO3
Реакция омыления:
R O NO2 + OH
-
R O + NO2- + H2O
24.
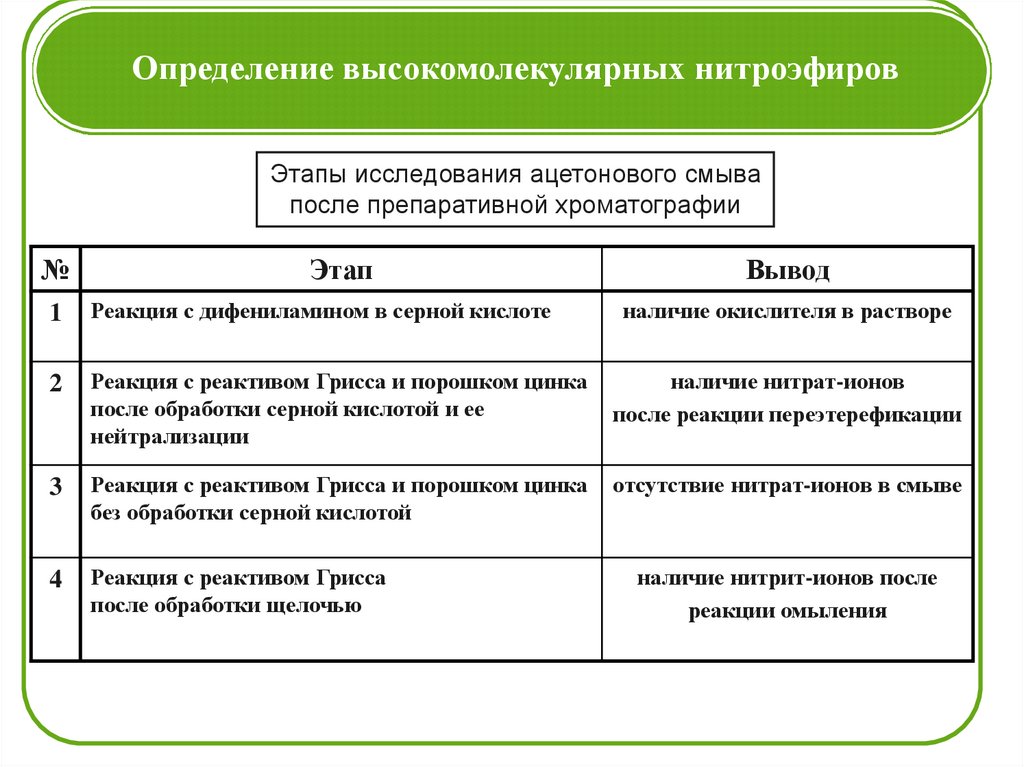
Определение высокомолекулярных нитроэфировЭтапы исследования ацетонового смыва
после препаративной хроматографии
№
Этап
Вывод
1
Реакция с дифениламином в серной кислоте
наличие окислителя в растворе
2
Реакция с реактивом Грисса и порошком цинка
после обработки серной кислотой и ее
нейтрализации
наличие нитрат-ионов
после реакции переэтерефикации
3
Реакция с реактивом Грисса и порошком цинка
без обработки серной кислотой
отсутствие нитрат-ионов в смыве
4
Реакция с реактивом Грисса
после обработки щелочью
наличие нитрит-ионов после
реакции омыления



 Химия
Химия








