Похожие презентации:
Кислород
1. Кислород
2. Кислород
• Кислород – самыйраспространенный элемент на
Земле 49,5%
• Кислород существует в
самородном виде (воздух) и
входит в состав воды, горных
пород и живых организмов.
• В атмосфере содержание
кислорода – 21%
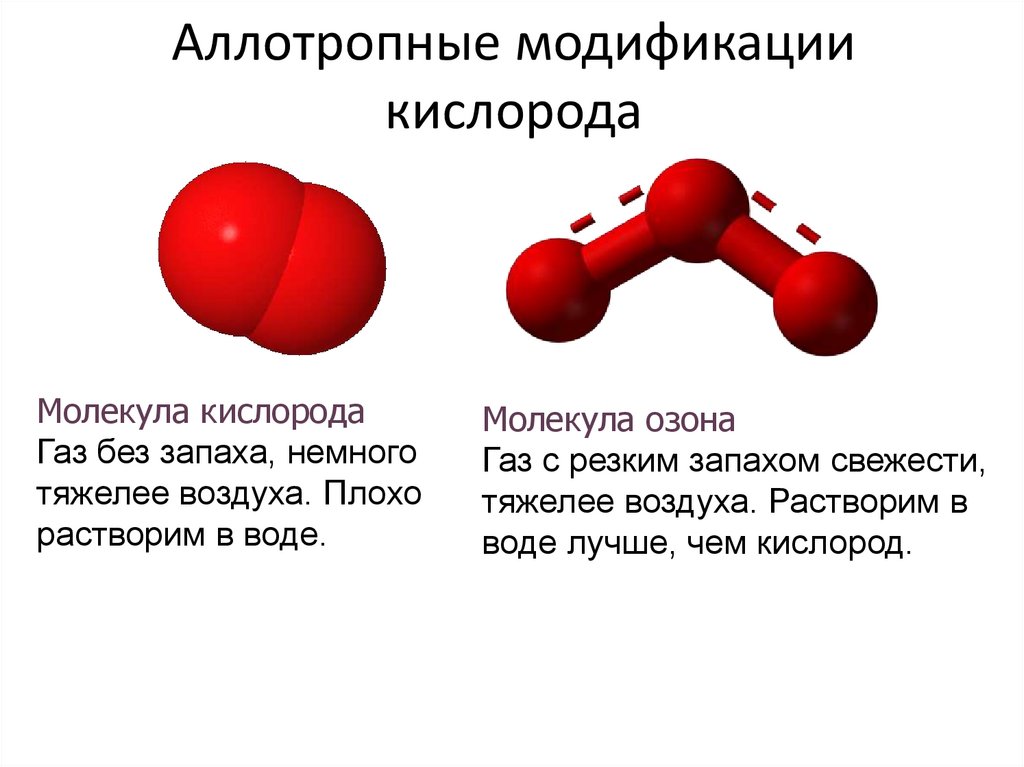
3. Аллотропные модификации кислорода
Молекула кислородаГаз без запаха, немного
тяжелее воздуха. Плохо
растворим в воде.
Молекула озона
Газ с резким запахом свежести,
тяжелее воздуха. Растворим в
воде лучше, чем кислород.
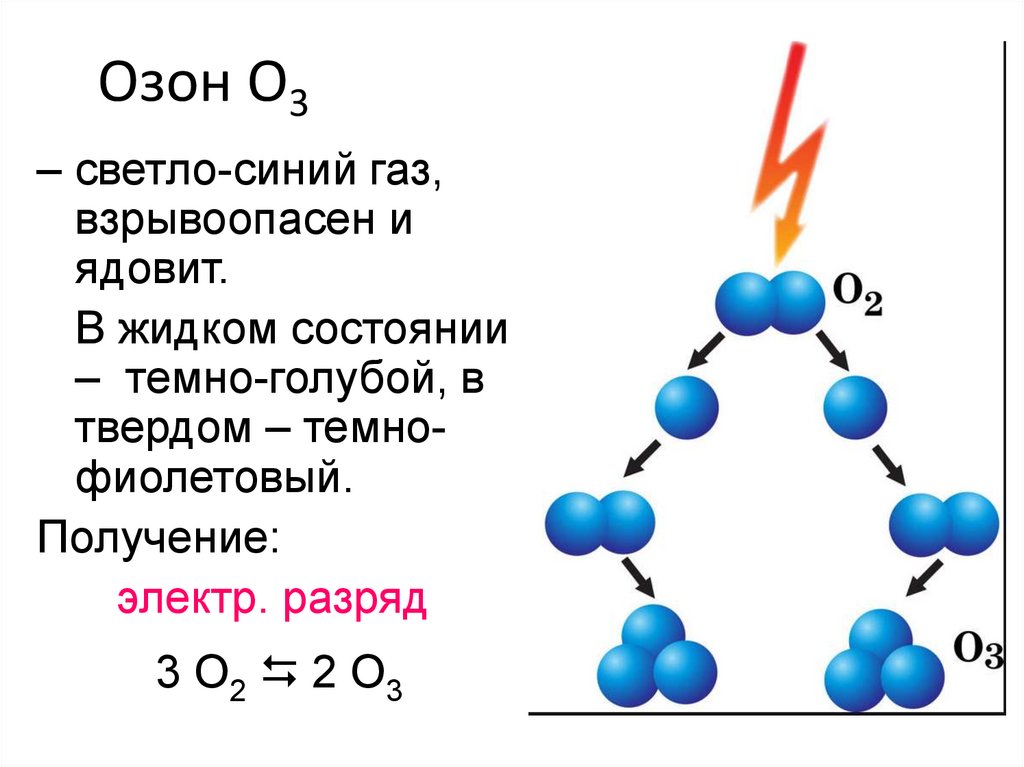
4. Озон O3
– светло-синий газ,взрывоопасен и
ядовит.
В жидком состоянии
– темно-голубой, в
твердом – темнофиолетовый.
Получение:
электр. разряд
3 O2 2 O3
5.
Химические свойства кислорода:не взаимодействует с галогенами,
благородными газами, золотом и
платиновыми металлами.
6. Получение кислорода
t2KMnO4 = K2MnO4 + MnO2 + O2↑
2H2O2 = 2H2O + O2↑
2KClO3 = 2KCl + 3O2↑
2HgO = 2Hg + O2↑
7.
Кислород активно взаимодействует сощелочными металлами даже без нагревания.
Металлы средней и низкой активности реагируют
с кислородом при нагревании.
4Li + O2 = 2Li2O
3Fe + 2O2 = Fe3O4
железная окалина
2Mg + O2 = 2MgO
8. Реакция горения
При взаимодействии металлов и неметаллов скислородом зачастую происходит выделение
большого количества тепла и даже
воспламенение
S + O2 = SO2
4P + 5O2 = 2P2O5
9.
Взаимодействие кислорода с азотом происходит толькопри нагревании свыше 2000 °C или же при электрическом
разряде.
N2 + O2 = 2NO - Q
10.
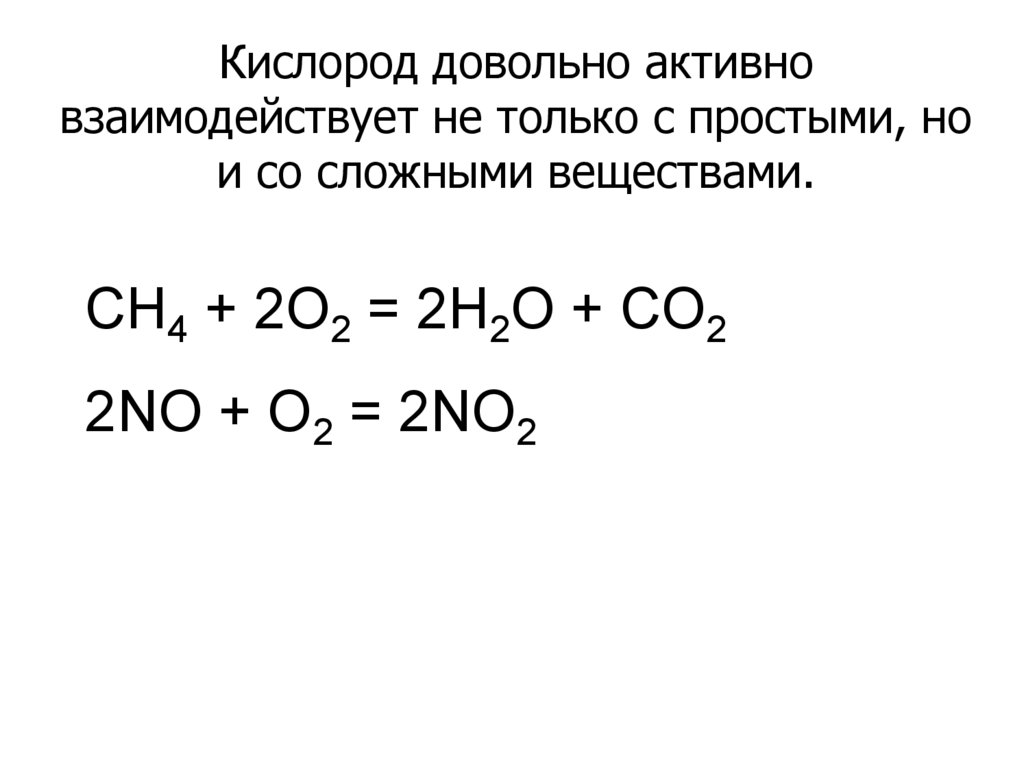
Кислород довольно активновзаимодействует не только с простыми, но
и со сложными веществами.
CH4 + 2O2 = 2H2O + CO2
2NO + O2 = 2NO2
11. Пероксид водорода H2O2
H2O2 – бесцветная вязкаяжидкость
В разбавленных растворах
пероксид водорода неустойчив и
самопроизвольно
диспропорционирует
2H2O2–1 = 2H2O–2 + O20







 Химия
Химия








