Похожие презентации:
Металлы. Подготовка у контрольной работе
1.
Обобщение по теме«Металлы»
Подготовка у контрольной работе
2.
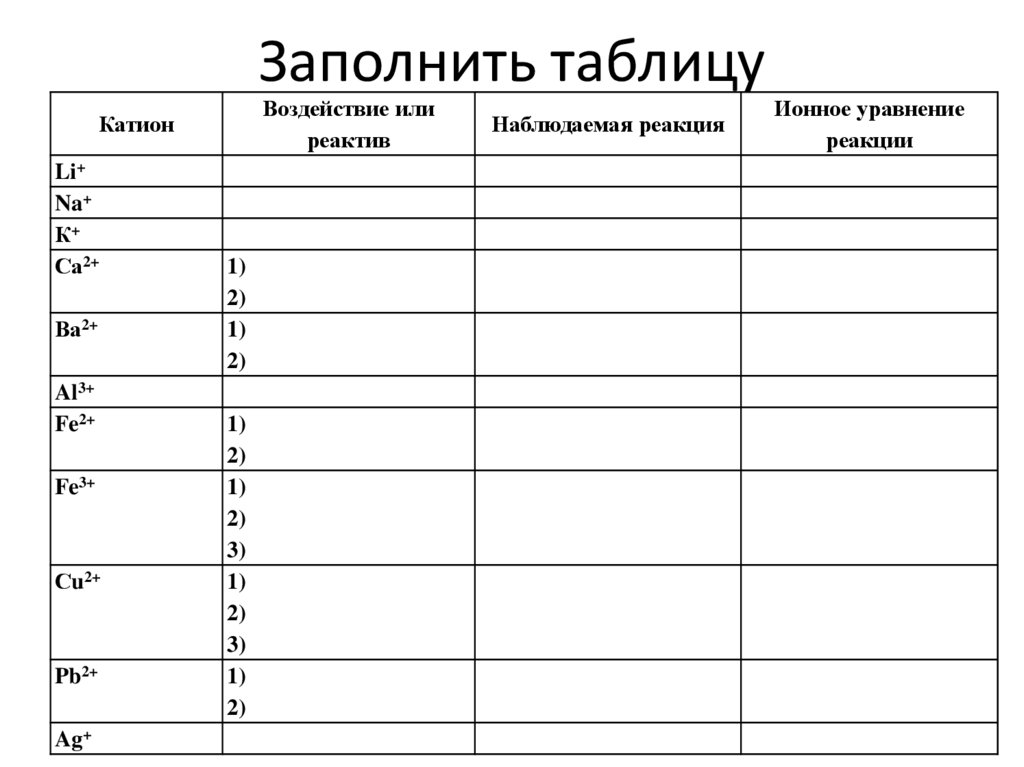
Заполнить таблицуВоздействие или
реактив
Катион
Li+
Na+
К+
Са2+
Ва2+
Al3+
Fe2+
Fe3+
Сu2+
Pb2+
Ag+
1)
2)
1)
2)
1)
2)
1)
2)
3)
1)
2)
3)
1)
2)
Наблюдаемая реакция
Ионное уравнение
реакции
3.
Задача № 1• В пронумерованных стаканчиках (с № 1 по
№ 5) даны кристаллические соли: хлорида
меди (II), хлорида бария, хлорида
алюминия, хлорида железа (III) и сульфата
железа (II). Распознайте предложенные
соли с помощью только одного реактива и
укажите, в каком стаканчике и какая соль
находится.
4.
Задача №2• Составьте уравнения реакций 1в. – натрия,
2 в. – кальция, 3 в. – алюминия по
отношению к кислороду, сере, воде,
соляной кислоте и гидроксиду натрия.
Реакции рассмотрите в свете ОВР и ТЭД.
Дайте названия и характеристику
полученным соединениям.
5.
Задания №3• Получите двумя способами из
Na NaOH,
Al AlCl3.
6.
Задание №4• Осуществите превращения, назовите полученные вещества:
• а) для металла, образующего растворимое
основание
Na Na2O2 Na2O NaOH Na2SO4
• б) для металла, образующего нерастворимое
основание
Fe FeCl2 Fe(OH)2 Fe(OH)3 Fe2O3
• в) для металла, образующего амфотерный
гидроксид
Be BeO Be(NO3)2 Be(OH)2 K2BeO2
BeSO4
7.
Задание №5• Почему на оцинкованном баке на месте
царапины цинк разрушается, а железо не
ржавеет? Напишите соответствующие
уравнения реакций.
8.
Задание №6• Охарактеризуйте магний по его положению
в ПС. Запишите уравнения,
характеризующие свойства магния, его
оксида и гидроксида.
9.
Задание №7• К раствору, содержащему 32 г сульфата
меди (II), прилили 21 г железных опилок.
Какая масса меди выделится при этом?
• Определите массу меди, которая может
быть получена из 16 кг оксида меди (II),
если выход продукта реакции составляет
70% от теоретически возможного.








 Химия
Химия








